24 червня, 2017
Хронический гастрит, рак желудка. Как предотвратить эту последовательность?
Открытие австралийских исследователей Робина Уоррена и Барри Маршала заставило мировую медицинскую общественность пересмотреть ряд положений, касающихся патологии гастродуоденальной зоны, и выделить целую группу Helicobacter pylori (Нр)-ассоциированных заболеваний. Инфекция Нр считается важнейшим этиопатогенетическим звеном развития хронического гастрита, язвенной болезни желудка и двенадцатиперстной кишки, МАLT-лимфомы (mucosa-associated lymphoidtissue lymphoma) и некардиального рака желудка (РЖ). Широкое проведение антихеликобактерной терапии (АХТ) с целью эрадикации инфекции в ряде стран Западной Европы, США, Японии и Австралии позволило существенно снизить уровень инфицированности и заболеваемости Нр-ассоциированными заболеваниями и предотвратить их опасные исходы (желудочно-кишечное кровотечение, перфорацию, аденокарциному желудка и др.).
Эрадикационная терапия неэффективна. Хронический гастрит – рак желудка
Аспекты диагностики и лечения вышеназванной группы заболеваний постоянно совершенствуются с позиций доказательной медицины, находя свое отражение в серии согласительных совещаний. Первая согласительная конференция прошла в голландском городе Маастрихт в 1996 году. С тех пор по традиции все совещания независимо от места проведения стали носить название Маастрихтских консенсусов. В дальнейшем были разработаны рекомендации Маастрихт II (2000), Маастрихт III (2005), Маастрихт IV (2010). И наконец, последний пересмотр – Маастрихт V – состоялся в 2015 году во Флоренции (Италия), где прошла очередная встреча 43 экспертов в области диагностики и лечения инфекции Нр из 24 стран Европы, Юго-Восточной Азии и Америки. Эти рекомендации имеют огромнейшее значение для охраны общественного здоровья, так как правильное назначение эрадикационной терапии останавливает неопластическое прогрессирование предраковых изменений в определенной подгруппе пациентов.
Еще в 2007 году, до Маастрихтского консенсуса IV, Американская коллегия гастроэнтерологов издала рекомендации по лечению инфекции Нр, в которых содержались следующие положения:
- резистентность к метронидазолу является относительной и преодолевается путем увеличения дозы и применения препаратов висмута;
- рекомендуется у всех пациентов выяснять факты применения макролидов в анамнезе;
- при предшествующем приеме макролидов предпочтение следует отдавать схемам с висмутом;
- частота нежелательных реакций при квадротерапии не превышает таковую при тройной терапии.
Последнее положение очень важно, так как свидетельствует об отсутствии более выраженных побочных эффектов при применении квадротерапии с препаратом висмута по сравнению с тройной терапией.
Этапы диагностики и лечения хронического гастрита как этапы канцерпревенции
Сегодня не вызывает сомнения ассоциация между Нр и РЖ. Еще в 1994 году Международное агентство по изучению рака (IARC-WHO), которое является структурным подразделением ВОЗ, признало эту инфекцию канцерогеном 1-го порядка из-за ее эпидемиологической связи с аденокарциномой желудка и МАLT-лимфомой желудка. По мнению Л.И. Аруина (2004), в результате длительного хронического воспаления, характерного исключительно для Нр-ассоциированного гастрита, нарушается система клеточного обновления в желудке (прогрессируют изменения процессов апоптоза и пролиферации с преобладанием последней). Как следствие этого, в слизистой оболочке желудка (СОЖ) появляются мишени для действия мутагенных и канцерогенных (внешнесредовых) факторов; эпителий желудка из-за атрофии замещается метапластичным, диспластичным и, наконец, неопластичным. Предложенный P. Correa около 15 лет назад гипотетический каскад последовательности событий, приводящих в конечном итоге к развитию аденокарциномы желудка, в настоящее время является общепризнанным. Согласно ему в течение 30 лет у 50% инфицированных Нр разовьется атрофия СОЖ, у 40% – кишечная метаплазия, у 8% – дисплазия и у 1-2% – аденокарцинома желудка.
Результаты проспективных исследований свидетельствуют о том, что у больных, инфицированных Нр, риск развития РЖ повышен в 3-6 раз. Риск развития РЖ повышается параллельно тяжести атрофического гастрита. В Маастрихтском консенсусе IV указано, что между РЖ и распространенностью и тяжестью гастрита, а также атрофией и кишечной метаплазией имеется положительная ассоциация. Риск развития РЖ увеличивается у пациентов с тяжелым атрофическим гастритом астрального отдела в 18 раз. Особенно высок риск развития РЖ при развитии атрофии как в антральном, так и в фундальном отделах желудка (панатрофия, мультифокальный атрофический гастрит), в этом случае он может увеличиваться в 90 раз. Наличие кишечной метаплазии увеличивает вероятность рака желудка в 10 раз. Тяжелый и распространенный атрофический гастрит, несомненно, является предиктором развития рака желудка. В настоящее время обнаружено, что наиболее распространенные и тяжелые случаи атрофического гастрита, выявленные по оценке пепсиногенового профиля, в сочетании с отсутствием антител к Нр (возможно, из-за их спонтанного исчезновения) были связаны с гораздо большей прогрессией дисплазии и рака. Значения относительного риска (ОР) для тяжелого атрофического Нр-негативного гастрита к менее выраженному Нр-позитивному гастриту: 8,2 (3,2-21,5) против 6 в исследовании H. Watabe и соавт., 131,98 (11,95-1457,36) против 2,77 в исследовании K. Yanaoka и соавт. и 61,85 (5,6-682,64) против 14,85 в работе H. Ohata и соавт. Y. Yamaji и соавт. также обнаружили повышенный уровень заболеваемости раком желудка для Нр-позитивных случаев с незначительно выраженной атрофией, который составил 0,37% случаев в год, и более высокий – до 0,53% случаев в год – при тяжелом Нр-негативном атрофическом гастрите.
Одним из актуальнейших вопросов в рамках канцерпревенции является возможность предотвращать и тормозить развитие пренеопластических изменений СОЖ (атрофия и кишечная метаплазия) путем эрадикации Нр. Эрадикация Нр предотвращает развитие пренеопластических изменений и является эффективным элементом канцерпревенции лишь в том случае, когда она назначается до их развития. В одном из положений Маастрихтского консенсуса IV сказано, что атрофия может подвергаться регрессии, но только в теле желудка, в антральном отделе регрессия не наблюдается; кишечная метаплазия является необратимой. В Маастрихтском консенсусе V (2015) утверждается, что эрадикация Нр приводит к обратному развитию атрофии желудка в отсутствие кишечной метаплазии, а также останавливает неопластическое прогрессирование предраковых изменений в определенной подгруппе пациентов. В ряде метаанализов было показано, что атрофия желудка может быть в той или иной степени обратимой как в антральном отделе, так и в теле желудка. Кишечная метаплазия необратима, хотя ее прогрессирование приостанавливается в большой подгруппе пациентов (Маастрихт V). Распространенные предраковые изменения (атрофия, кишечная метаплазия) требуют контроля путем эндоскопического стадирования. При отборе пациентов для наблюдения должны учитываться гистологические классификационные критерии OLGA/OLGIM.
Эрадикация Нр является экономически эффективной стратегией профилактики рака желудка и должна рассматриваться во всех популяциях. Стратегия screen-and-treat рекомендуется для популяций с высоким риском развития рака желудка, а также в популяциях среднего и низкого риска. Эндоскопический скрининг рассматривается в популяциях с высоким риском развития рака желудка, особенно у пациентов с прогрессирующими пренеопластическими изменениями, такими как атрофия / кишечная метаплазия (Маастрихт V).
Как повысить эффективность эрадикационной терапии. Обзор двух исследований
Вопрос выбора схемы антихеликобактерной терапии всегда был особенно актуальным. В соответствии с Маастрихтскими консенсусами IV и V акцент при выборе схемы должен делаться на данных о резистентности штаммов Нр к кларитромицину в регионе, так как рост резистентности штаммов Нр к кларитромицину связывают со снижением эффективности стандартных схем эрадикационной терапии. Резистентность к кларитромицину снижает эффективность стандартной тройной терапии до 35-60%. Повышение резистентности Нр к кларитромицину четко прослеживается в странах Европы. В 2012 году на симпозиуме, посвященном 30-летию открытия Нр, профессор Francis Megraud докладывал о результатах исследования чувствительности Нр в большинстве стран Европы, которое проводилось в 2008-2009 гг. Общий уровень резистентности к кларитромицину составил 17%. Если рассмотреть подробнее данные по странам, то можно видеть разброс между минимальным уровнем резистентности, составившим примерно 5% в Нидерландах, и максимальным (36%) в Австрии. Таким образом, в большинстве стран северных регионов Европы резистентность довольно низкая, тогда как в странах Южной, Восточной и Центральной Европы она выше – 15%. По данным Маастрихтского консенсуса V, резистентность к кларитромицину достигла 30% в Италии и Японии, 40% – в Турции, 50% – в Китае, в Швеции и Тайване – около 15%.
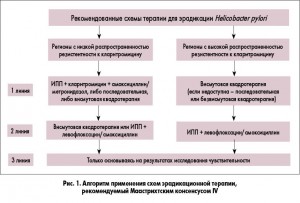
Результаты исследований показывают, что при повышении минимальной подавляющей концентрации (МПК) кларитромицина в отношении Нр выше 0,5 мг/л и особенно >2-4 мг/л происходит резкое снижение частоты эрадикации. Подобная закономерность выявлена и для фторхинолонов. Показано, что при повышении МПК левофлоксацина к Нр с <1 мг/мл до >1 мг/мл происходит снижение частоты эрадикации с 84,1 до 50%, а при изменении МПК с <8 мг/мл до >8 мг/мл частота эрадикации снижается с 82,3 до 0%. Несколько иная ситуация складывается с устойчивостью Нр к метронидазолу. Несмотря на достаточно широкое распространение устойчивых штаммов в популяции, столь драматического влияния на частоту эрадикации, как в случае макролидов и фторхинолонов, резистентность Нр к метронидазолу не оказывает. Поэтому в регионах с низкой резистентностью Нр к кларитромицину, в соответствии с консенсусом Маастрихт IV, в качестве эрадикационной терапии первой линии рекомендуется либо стандартная тройная терапия, либо квадротерапия с препаратом висмута (ИПП + висмута трикалия дицитрат + метронидазол + тетрациклин). В регионах же с высокой резистентностью Нр к кларитромицину (15-20%) в качестве эрадикационной терапии первой линии рекомендуется только квадротерапия с препаратом висмута. Однако стоит отметить, что в ряде стран, например во Франции, препараты висмута недоступны, поэтому как альтернативу первой линии терапии стоит рассматривать последовательную эрадикационную терапию (первые 5 дней – ИПП + амоксициллин, последующие 5 дней – ИПП + кларитромицин + тинидазол/метронидазол) или безвисмутовую квадротерапию (ИПП + кларитромицин + амоксициллин + метронидазол). В регионах с низкой резистентностью к кларитромицину в качестве терапии второй линии может использоваться квадротерапия на основе препаратов висмута (если она не использовалась как терапия первой линии) или как альтернатива тройная терапия с левофлоксацином (ИПП + амоксициллин + левофлоксацин). Что же касается регионов с высокой резистентностью штаммов Нр к кларитромицину, то, согласно консенсусу Маастрихт IV, терапией второй линии при неэффективности квадротерапии первой линии также является тройная терапия с левофлоксацином. Однако экспертный совет рекомендует учитывать растущий уровень резистентности к левофлоксацину, который в ближайшем будущем может поставить под угрозу эффективность данной схемы. Рекомендуемый Маастрихтским консенсусом IV алгоритм применения схем эрадикационной терапии представлен на рисунке 1.
Таким образом, четверную эрадикационную терапию с препаратом висмута можно использовать как терапию первой линии в странах и с высокой резистентностью к кларитромицину, и с низкой. При этом четверная схема с препаратом висмута в странах с низкой резистентностью к кларитромицину является терапией первой линии.
Кроме того, применение квадротерапии не только оказывает эрадикационный эффект, но и положительно влияет на течение постэрадикационного периода хронического гастрита и, что очень важно, является эффективной схемой канцерпревенции благодаря входящему в ее состав висмута субцитрату.
Реализация антибактериального эффекта препаратов висмута в отличие от антибиотиков происходит за счет местного антисептикоподобного действия. При контакте препаратов висмута с Нр происходит подавление синтеза аденозинтрифосфата, белков бактериальной клетки, нарушается бактериальная адгезия, синтез бактериальной протеазы, фосфолипазы и уреазы, повреждается внеклеточный бактериальный гликокаликс. Исследования последних лет показали, что одним из механизмов повреждения Нр является модификация метаболизма железа и никеля в бактериальной клетке. Можно предположить, что именно за счет различий в реализации антибактериального действия по сравнению с антибиотиками, а также воздействия на несколько мишеней резистентность Нр к препаратам висмута не развивается.
Применение висмута субцитрата коллоидного актуально не только в схемах классической квадротерапии, но также в качестве четвертого компонента в схемах стандартной тройной АХТ первой линии в целях оптимизации эффективности эрадикационного протокола. Недавнее исследование В. Ergul и соавт. (2013) показало существенное увеличение эффективности тройной схемы АХТ (до 90,7%) при включении висмута субцитрата. Висмута субцитрат коллоидный является важным компонентом клинических схем АХТ либо в составе традиционной квадротерапии, либо в качестве дополнительного компонента тройной терапии первой линии, что дает прирост эффективности эрадикации на 15-20%. В первую очередь, это обусловлено способностью висмута субцитрата преодолевать резистентность Нр к антибиотикам (особенно к кларитромицину). Интерес представляет также включение висмута субцитрата в схемы последовательной АХТ.
Исследования последних лет показали, что схемы терапии с висмута субцитратом обеспечивают высокий процент эрадикации Нр, выраженное уменьшение воспаления в СОЖ, а также, учитывая молекулярные механизмы действия висмута субцитрата коллоидного, обладают противоканцерогенным эффектом.
Маастрихтский консенсус V. Обзор рекомендаций
В 2016 году на 24-й Объединенной европейской гастроэнтерологической неделе в Вене в докладах была проанализирована эффективность применения метронидазола в Испании, Франции, Италии, Словении, Германии, которая составила от 83% до 89% в зависимости от ИПП и от 75% до 96% – от очередности (первая, вторая или третья линия терапии). Кроме того, были объявлены результаты применения терапии BOCA (висмут + эзомепразол + кларитромицин + амоксициллин), т.е. добавления висмута к стандартной тройной терапии, при применении которой был достигнут уровень эрадикации в Испании 96-97%, в России – 74-75%, в Украине – 90%.
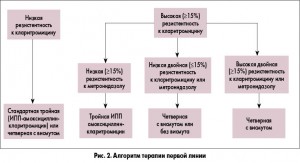
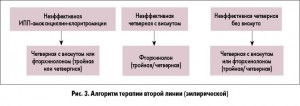
Далее представлен обзор раздела «Лечение» последнего Маастрихтского консенсуса V. Выбор схемы лечения определяется растущей резистентностью Нр к кларитромицину. Тройная терапия с кларитромицином не должна назначаться, если резистентность к кларитромицину в регионе больше 15%. В новых рекомендациях более строго подошли к разделению регионов на таковые с высокой и низкой резистентностью к кларитромицину. Ранее использовали показатель 20%, а сейчас предложили опираться в выборе на 15%. Согласно рекомендациям Европейского медицинского агентства по оценке медицинских препаратов для лечения бактериальных инфекций, выделяют три категории микроорганизмов в зависимости от их чувствительности к антибиотику: чувствительные (резистентность 0-10%), слабочувствительные (резистентность 10-50%), устойчивые (резистентность >50%). Нр попадает по чувствительности к кларитромицину во 2 категорию, исключая страны Северной Европы. Пороговым значением между высоким и низким уровнем резистентности к кларитромицину принято считать показатель в 15%. Кроме того, руководством к выбору схемы лечения должна служить индивидуальная чувствительность Нр к применяемым антибиотикам, которая зависит от употребления антибиотиков в прошлом данным индивидуумом. Поэтому у пациента, который раньше получал одну из основных схем антибиотикотерапии, должна определяться резистентность Нр к антибиотикам, несмотря на низкий уровень резистентности в данной популяции. Схемы первой и второй линии, предлагаемые Маастрихтским консенсусом V, представлены на рисунках 2 и 3.
В качестве терапии первой линии предлагается стандартная тройная терапия или висмутовая квадротерапия в странах с низкой резистентностью к кларитромицину. В странах с высокой резистентностью к кларитромицину выбор схемы определяется наличием резистентности к метронидазолу или двойной резистентности к метронидазолу и кларитромицину. В регионах с высокой резистентностью к кларитромицину предлагается назначать висмутсодержащую, безвисмутовую квадротерапию. Там, где высока двойная резистентность к кларитромицину и метронидазолу, схемой выбора является висмутсодержащая квадротерапия. Одновременная резистентность к кларитромицину и метронидазолу >15% снижает эффективность всех схем квадротерапии без препаратов висмута. Классическая квадротерапия с препаратом висмута показала высокую эффективность, несмотря на резистентность к метронидазолу в Европе. В отличие от кларитромицина, резистентность к метронидазолу может быть частично преодолена увеличением дозы, частотой и продолжительностью приема антибиотика. Так, последовательная терапия предлагает использовать метронидазол 5-7 дней, гибридная – 7 дней, сопутствующая – 10-14 дней. Однако последовательная терапия эффективнее 14-дневной трехкомпонентной схемы лишь в том случае, если уровень резистентности к метронидазолу меньше 40%. Также для преодоления резистентности рекомендуется увеличивать продолжительность лечения до 14 дней. В своем докладе на Европейской гастронеделе (2016) Р. Malfertheiner привел способы преодоления резистентности Нр к антибиотикам:
- основанная на препаратах висмута квадротерапия;
- ИПП плюс три антибиотика;
- увеличение продолжительности лечения;
- подбор терапии в зависимости от чувствительности Нр к антибиотикам;
- увеличение подавления кислотной продукции большими дозами ИПП.
Таким образом, большое внимание в Маастрихтском консенсусе V уделено квадротерапии на основе препаратов висмута. Если висмут в стране недоступен, в случае высокой двойной резистентности к кларитромицину и метронидазолу предлагается использовать левофлоксацин, рифабутин и двойную терапию с высокими дозами ИПП. Если недоступен тетрациклин, в регионах с высокой двойной резистентностью можно использовать висмутсодержащую квадротерапию, включающую фуразолидон и метронидазол, амоксициллин и метронидазол или применить тройную терапию с висмутом (препарат висмута плюс амоксициллин, кларитромицин или левофлоксацин). Резистентность к кларитромицину снижает эффективность тройной и последовательной терапии, резистентность к метронидазолу – последовательной терапии, двойная резистентность к кларитромицину и метронидазолу снижает эффективность последовательной, гибридной и сопутствующей терапии. Таким образом, еще раз подчеркивается эффективность висмутсодержащей квадротерапии.
После неудачи терапии первой линии (стандартная тройная терапия и фторхинолонсодержащая тройная или квадротерапия / висмутсодержащая квадротерапия) в качестве терапии второй линии используется висмутсодержащая квадротерапия или фторхинолонсодержащая тройная или квадротерапия. В случаях высокой резистентности Нр к фторхинолонам терапией выбора может быть комбинация висмута с другими антибиотиками или рифабутином. Висмут имеет синергический эффект с антибиотиками и преодолевает резистентность Нр к кларитромицину и левофлоксацину. Квадротерапия ИПП, амоксициллин, левофлоксацин плюс висмут показывает обнадеживающие результаты.
В случае неудачи терапии второй линии рекомендовано исследование чувствительности Нр к антибиотикам с помощью культурального метода или молекулярного определения резистентности генотипа для подбора индивидуальной терапии. Безвисмутовая квадротерапия значительно влияет на формирование двойной резистентности. Висмутсодержащая квадротерапия влияет на антибиотикорезистентность наименьшим образом. Резистентность Нр к тетрациклину очень редка и не развивается, несмотря на неудачи в лечении. При этом и резистентность к метронидазолу, если он применяеется в составе висмутсодержащей квадротерапии, не уменьшает процент эрадикации.
После неудачи терапии первой линии (с кларитромицином) и второй линии (висмутсодержащей квадротерапии) рекомендовано использование фторхинолонсодержащего режима. В регионах с известной высокой резистентностью к фторхинолонам может использоваться рифабутинсодержащая терапия спасения или комбинация висмута с различными антибиотиками. В случае неэффективности стандартной тройной терапии первой линии и фторхинолонсодержащего режима второй линии рекомендуется висмутсодержащая квадротерапия как режим третьей линии. При неудаче висмутсодержащей квадротерапии первой линии и фторхинолонсодержащей терапии второй линии рекомендована кларитромицинсодержащая тройная или квадротерапия. Другой опцией может быть комбинация висмута с различными антибиотиками.
В случае аллергии к антибиотикам пенициллинового ряда в качестве терапии первой линии может быть назначена схема ИПП + кларитромицин + метронидазол в регионах с низкой резистентностью к кларитромицину и квадротерапия в регионах с высокой резистентностью к кларитромицину. Фторхинолонсодержащий режим может использоваться как терапия второй линии в этом случае.
Статья печатается в сокращении.