21 жовтня, 2017
Тройной негативный парадокс

Чем совершеннее сила, тем сложнее ее остановить.
Фома Аквинский
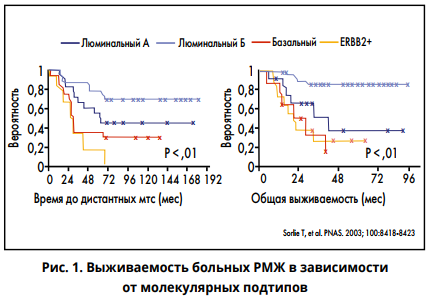
Рак молочной железы (РМЖ), в клетках которого нет экспрессии рецепторов эстрогена (ER), прогестерона (PR) и эпидермального фактора роста (HER2), называется тройным негативным (ТНРМЖ). Он составляет примерно 15-20% всех диагнозов РМЖ. Принято считать, что ТНРМЖ является биологически агрессивной опухолью с высоким риском рецидива даже при ранних стадиях и со сниженной выживаемостью –при метастатических (рис. 1), а в качестве современной стратегии при этом фенотипе используется эмпирическая химиотерапия.
Анализ выживаемости ранее проводился между молекулярными подтипами РМЖ, однако использование новых технологий молекулярной визуализации (секвенирование нового поколения) привело к пониманию того, что ТНРМЖ объединяет в себе большую группу заболеваний, различающихся прогнозом и возможностями терапии. На основании изучения интегративных кластеров была создана молекулярная классификация ТНРМЖ.
Эти исследования заложили фундамент для использования персонифицированных подходов к терапии ТНРМЖ, включая известные химиотерапевтические препараты, таргетные агенты и ингибиторы иммунных контрольных точек.
Биология тройного негативного РМЖ
В подавляющем большинстве случаев (95%) ТНРМЖ представлен инвазивной протоковой карциномой. На остальные морфологические подтипы приходится 5%, однако уже при гистологическом исследовании опухоль демонстрирует яркое разнообразие. В этой группе обычно встречаются опухоли с редким морфологическим подтипом: метапластическая карцинома с плоскоклеточной дифференциацией, веретеноклеточная карцинома, аденоидная цистокарцинома, секреторная карцинома, типичная медуллярная карцинома, атипичная медуллярная карцинома, апокринная карцинома.
Термин «тройной негативный» является иммуногистохимическим (ИГХ) определением, основанным на отсутствии выявления в клетках опухоли трех основных биомаркеров – ER, PG, HER2. Однако уже на этом этапе характеристики опухоли могут возникнуть затруднения. Например, только недавно было окончательно сформулировано понятие «эстроген-позитивный (ER+) рак» – сегодня таковым считают опухоли с эстроген-позитивной окраской >1% клеток. Хотя еще 10 лет назад к ER+ РМЖ относили опухоли с окраской >10% клеток. Таким образом, ранее опухоли с фенотипом HER2-, ER+ (5% клеток) причисляли к разряду не люминальных, а тройных негативных. HER2-позитивными (HER2+) считаются опухоли при наличии экспрессии соответствующего белка не менее +++ или амплификации гена HER2. В связи с этим опухоли с ИГХ характеристиками ER-, HER2(0), HER2+ и HER2++ по определению тоже относятся к тройным негативным, хотя имеют слабо выраженную экспрессию онкогена HER2.
Очевидно, что при такой характеристике понятие тройной негативности может смещаться.
Ацинус (структурная единица молочной железы) представлен большим клеточным разнообразием, однако опухоль может развиться либо из люминальных, либо из базальных/миоэпителиальных клеток. ТНРМЖ в 70-80% случаев представлен базальноподобным подтипом, включающим кластеры эпителиальных клеток с позитивной реакцией на кератины, интегрины и ламинин, а в 20-30% – люминальным подтипом, в котором сильно выражены гормональные андрогеновые регуляторы пролиферативных путей. Наблюдается строгая корреляция с апокринной сигнатурой, высокая экспрессия люминальных цитокератинов и мутации в PI3CA. Существует также более редкий подтип, называемый Claudin-low, который характеризуется низкой экспрессией маркеров люминальной дифференцировки, молекулярными признаками эпителиально-мезенхимального перехода, высоким уровнем активности генов иммунного ответа и сигнатурой стволовых клеток рака.
B. Lechman и соавт., проанализировав генетические нарушения у >500 больных ТНРМЖ, идентифицировали 6 уникальных подтипов этой опухоли:
1) базальноподобный 1;
2) базальноподобный 2 (иммуномодулирующий);
3) мезенхимальный;
4) мезенхимальный из стволовых клеток рака;
5) люминальный с экспрессией рецепторов андрогенов;
6) неклассифицируемый подтип.
Биология ТНРМЖ оказалась в центре внимания масштабного проекта The Cancer Genome Atlas. Недавно были опубликованы основные признаки этого рака: высокая частота мутаций ТР53 (80%), потеря генов-супрессоров RB1 и BRCA1, высокая активация пути PI3K, а также сильное сходство между базальноподобным РМЖ и серозным раком яичника, о чем свидетельствовали мутации АТМ и ТР53, высокая экспрессия АКТ3 и MYC, инактивация BRCA1 и BRCA2 и амплификация циклина E1. Полученные данные свидетельствуют о потенциальной чувствительности опухоли к препаратам платины.
Соли платины в лечении ТНРМЖ
Учитывая, что до недавнего времени возможности терапии ТНРМЖ были крайне ограниченны, потенциальная чувствительность клеток опухоли к препаратам платины имеет большое клиническое значение.
Выше было показано, что базальноподобный РМЖ относится к семейству злокачественных опухолей, ассоциированных с мутациями BRCA1, – так называемых BRCAness опухолей.
BRCA1 и BRCA2 – хорошо известные гены-супрессоры, которые участвуют в гомологичной рекомбинации двунитевых разрывов ДНК, возникающих при воздействии на спираль солей платины (так называемый платиновый аддукт). При мутации этих генов-супрессоров восстановления разрывов ДНК не происходит, и клетка погибает. В связи с этим опухоли с мутациями в генах BRCA1 и BRCA2 могут быть мишенью для препаратов платины и PARP-ингибиторов (феномен синтетической летальности).
В ряде клинических исследований была показана высокая эффективность препаратов платины в неоадъювантном режиме с достижением полного патологического ответа (pCR) у 90% больных. Использовались разные режимы и комбинации – как правило, карбоплатин применяли в сочетании с паклитакселом, антрациклинами, липосомальным доксорубицином, циклофосфамидом и бевацизумабом.
При паллиативном режиме во время метастатической прогрессии карбоплатин сочетали с доцетакселом, капецитабином, гемцитабином. Во всех случаях платиносодержащие комбинации превосходили компараторы по показателю «время до прогрессирования», хотя долгосрочная выживаемость не улучшалась. К тому же у большинства больных была зарегистрирована токсичность высокой степени.
Данных об эффективности солей платины в режиме адъювантной терапии при ТНРМЖ на сегодняшний день нет. По всей видимости, использование препаратов платины будет наиболее оправданным для достижения быстрого локорегионарного контроля заболевания и при необходимости хорошего клинического ответа (первично неоперабельная опухоль или воспалительная форма рака) – то есть в неоадъювантном режиме. Вторым показанием для неоадъювантного платиносодержащего режима является высокий риск рецидива у молодых пациенток с III стадией заболевания. При стадии II платина в неоадъюванте может назначаться исключительно при наличии подтвержденной мутации гена BRCA.
В режимах адъювантной и паллиативной химиотерапии токсичность препаратов на основе солей платины превосходит их клиническую эффективность. Как было отмечено выше, важным условием при назначении платины является наличие мутации BRCA1.
Другие химиотерапевтические агенты и таргетная терапия
Помимо известной схемы CMF, для терапии больных с ТНРМЖ могут быть использованы иринотекан, капецитабин и липосомальный доксорубицин. Известно, что метаболизм иринотекана связан с экспрессией топоизомеразы‑2, и анти-Top‑2 антитела связаны с SN‑38, активным метаболитом иринотекана.
Top‑2 экспрессируется у 80% больных с базальным подтипом РМЖ, что оправдывает назначение этого цитостатика при тройном негативном подтипе опухоли. Лечение иринотеканом улучшает показатель «время до прогрессирования» у больных, не повышая при этом токсичность.
Назначение капецитабина после неоадъювантной терапии оправданно у молодых пациентов, а также у больных с большой резидуальной опухолью после неоадъювантного лечения. Липосомальный доксорубицин в комбинации с бевацизумабом следует назначать при метапластическом (мезенхимальном) РМЖ, имеющем как эпителиальный, так и неэпителиальный компоненты с высокой продукцией VEGF/HIF1-α. Из-за частой активации PIK3CA (49%) у этих пациентов можно рассмотреть назначение mTOR-ингибиторов (эверолимус).
Другими потенциальными мишенями для противоопухолевой терапии в будущем могут быть амплификации/делеции в генах KRAS (32%), BRAF (30%) и EGFR (23%). При наличии протоонкогена HER2-Enriched (HER2-обогащенный), который встречается в 20-30% при люминальном ТНРМЖ, вариантом таргетной терапии может быть применение лапатиниба или цетуксимаба (зарегистрировано 6% положительных ответов продолжительностью >1 года).
При люминальном андроген-рецептор-позитивном типе (AR+) ТНРМЖ с апокринной сигнатурой и сильно выраженными гормональными регуляторами пролиферативных путей ингибицию стероидных андрогенных AR+ ER- рецепторов осуществляют гормональным препаратом энзалутамидом (аналог андрогенной блокады, применяемой при терапии больных раком предстательной железы).
Инфильтрация лимфоцитами
В отличие от ранее существовавшего мнения, сегодня доказано, что некоторые формы РМЖ иммуногенны. В реализации иммунного ответа участвуют многие клетки и цитокины. Иммуномодулирующий базальный тип встречается у 10-15% больных ТНРМЖ. Морфологически, как правило, выявляется медуллярная карцинома.
Баланс клеток в микроокружении опухоли (раковые клетки, фибробласты и лимфоциты) влияет на исход РМЖ. Опухоль-инфильтрирующие лимфоциты разделяют на интратуморальные (имеют прямой контакт с раковыми клетками) и стромальные (инфильтрируют строму, не соприкасаясь с раковыми клетками). Ткани опухоли при иммунном подтипе базальной карциномы обогащены иммунными клетками (лимфоцитами CD8/HPF). Степень иммунной инфильтрации может быть низкой, средней и высокой. Шкала инфильтрации опухоли лимфоцитами (CD8/144B) определяет количество лимфоцитов в поле зрения (мм2) от 0 до >70. Данная шкала, оценивающая степень иммунной инфильтрации, имеет прогностическое значение, а соотношение CD8/FoxP3/Treg является предиктором патологического ответа и долгосрочной выживаемости.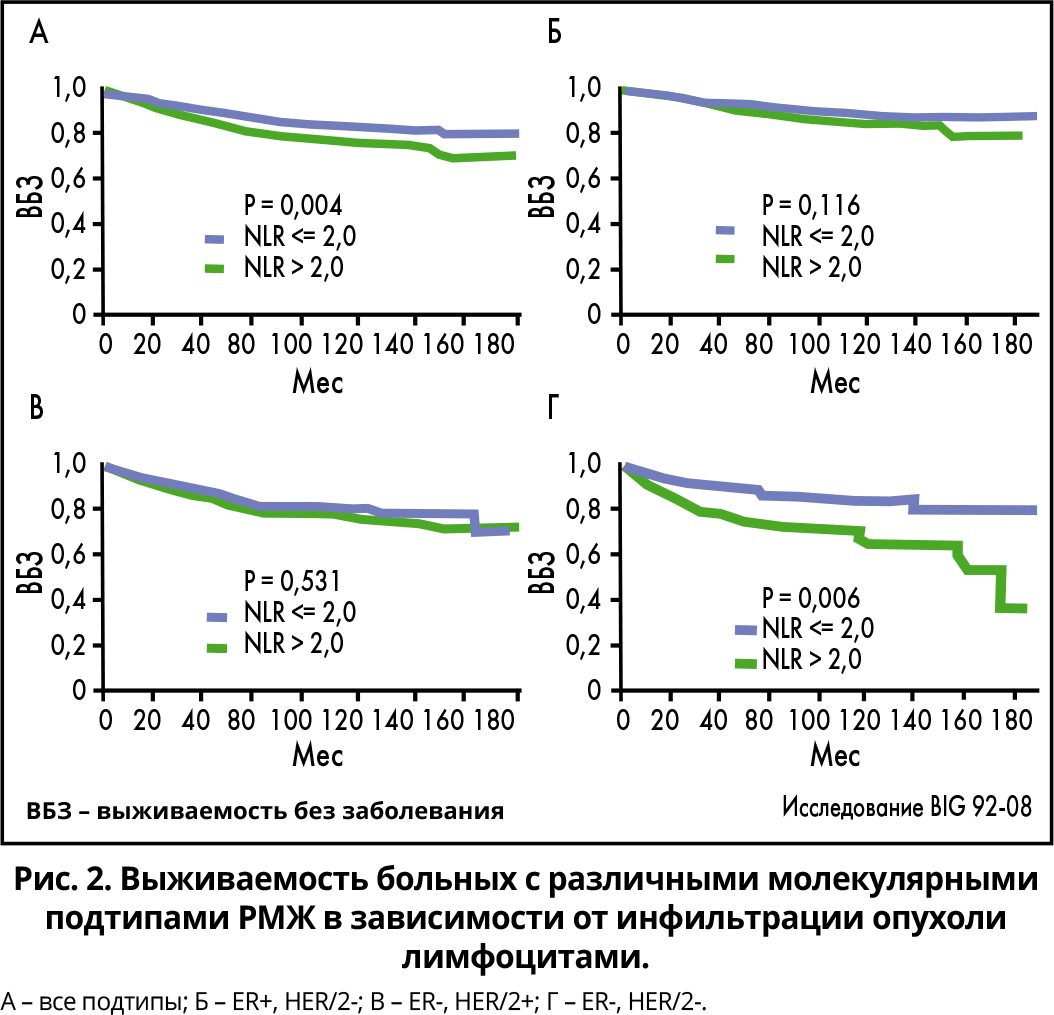
Пока еще остается неясным, почему 6 различных молекулярных подтипов ТНРМЖ инфильтрированы лимфоцитами в разной степени. В целом базальные карциномы с высокой иммунной инфильтрацией характеризуются низкой клональной гетерогенностью и хорошим прогнозом. Однако, как показало исследование BIG 92-08, это положение справедливо только для ТНРМЖ и частично – для HER2+ РМЖ (рис. 2).
Ретроспективный анализ клинических исследований раннего HER2+ РМЖ показал связь между степенью иммунной инфильтрации опухоли и повышением частоты pCR после неоадъювантной терапии, улучшением бессобытийной и общей выживаемости, а также увеличением периода времени без прогрессирования.
Прогностическое значение инфильтрации опухоли лимфоцитами при метастатическом HER2+ РМЖ пока не установлено. В то же время ретроспективный анализ результатов известного исследования Cleopatra выявил положительную зависимость между инфильтрацией опухоли лимфоцитами >20%, применением пертузумаба и долгосрочной выживаемостью, которая превысила 50 мес без достижения медианы выживаемости. В случае отсутствия инфильтрации опухоли лимфоцитами медиана выживаемости при том же режиме терапии составила 36,6 мес.
У больных люминальным ER+ РМЖ инфильтрация опухоли лимфоцитами имеет прямо противоположный эффект и обычно ассоциирована с агрессивным фенотипом, плохим ответом на эндокринную терапию и низкой выживаемостью. Пока еще этот феномен объяснить не удалось. Понятно только одно: механизмы канцерогенеза и опухолевой прогрессии при эстроген-зависимых видах раках сильно отличаются от таковых при HER2+ и ТНРМЖ. Влияние иммунной системы на развитие люминальной ER+ опухоли еще следует оценить. Прогностическое значение инфильтрации лимфоцитами опухолей молочной железы с различными фенотипами представлено в таблице.
Иммунный тип и экспрессия PD-L1
Проект The Cancer Genome Atlas подтвердил наличие более высокой частоты экспрессии мРНК PD-L1 у больных ТНРМЖ. Это и другие исследования показали также, что рецептор PD-L1 не экспрессируется в нормальной ткани молочной железы. Позитивный PD-L1 в клетках рака ассоциирован с высокой инфильтрацией опухоли лимфоцитами, коррелирует с высокой гистологической градацией (G), большими размерами опухоли (T>3) и более высокой экспрессией маркера пролиферации Kі‑67. Секвенирование РНК показало также высокую экспрессию в клетках тройного негативного РМЖ не только рецепторов PD-L1, но и PD‑1 и CTLA‑4.
Сегодня активно разрабатываются генные модули для классификации молекулярных подтипов РМЖ. Из 5 модулей экспрессии генов, впервые описанных Desmedt и соавт. (маркеры инвазии, ангиогенеза, апоптоза, пролиферации и иммунного ответа), только модуль иммунного ответа коррелировал с прогнозом в подгруппе больных ER-, HER2-. Прогностическая ценность сигнатур иммунных генов еще будет уточняться.
Несмотря на очевидные признаки иммуногенности некоторых молекулярных подтипов ТНРМЖ, окончательные рекомендации по терапии этих форм рака с помощью ингибиторов иммунных контрольных точек отсутствуют. Это связано с тем, что основные клинические исследования по изучению проблемы продолжаются: в исследовании KEYNOTE‑012 оценивается эффективность анти-PD‑1 антитела пембролизумаба, в исследовании MPDL328A – атезолизумаба. Всего, по данным ресурса Clinical.trial, сегодня в мире проводится 140 исследований, посвященных проблеме иммунотерапии РМЖ.
Поскольку действие химиотерапевтических препаратов и ингибиторов иммунных контрольных точек является синергичным, в перспективе для лечения иммунозависимых форм РМЖ обсуждаются многочисленные терапевтические комбинации антител анти-PD‑1/анти-PD-L1 с известными цитостатиками.
Тройной негативный парадокс
Десять лет назад ТНРМЖ считался монолитной (как ее называли – «огнеупорной») болезнью с короткой безрецидивной и общей выживаемостью. Клиницисты давно отметили, что опухоли этого иммуногистохимического подтипа хорошо реагируют на первую линию химиотерапии (часто – полной регрессией при неоадъювантном режиме), однако после этого быстро наступает рецидив заболевания. Такая особенность опухоли была названа L.A. Carey и соавт. тройным негативным парадоксом.
После того как были изучены интегративные кластеры опухоли, доказана ее гетерогенность и разработана молекулярная классификация ТНРМЖ, появились условия для проведения персонифицированного лечения соответствующей группы больных. Оказалось, что отдельные молекулярные подтипы могут быть чувствительными как к некоторым известным химиотерапевтическим препаратам (соли платины, капецитабин, иринотекан, наб-паклитаксел), так и к таргетным терапевтическим агентам (лапатиниб, цетуксимаб, бевацизумаб, эверолимус).
Новое направление в лечении ТНРМЖ скоро будет доступно за счет использования современных иммунотерапевтических препаратов – ингибиторов иммунных контрольных точек, вакцин и иммунных антагонистов.
Еще один парадокс заключается в том, что не все, а только базальный иммунный подтип ТНРМЖ будет отвечать на иммунотерапию. Об этом свидетельствуют тканевые биомаркеры (внутриопухолевая инфильтрация Т-лимфоцитами, экспрессия рецепторов PD‑1, PD-L1 и CTLA‑4), которые экспрессируются только у части больных. Почему не все молекулярные подтипы ТНРМЖ являются иммунозависимыми, еще предстоит выяснить.
В любом случае сегодня мы становимся свидетелями значительного прогресса в трансляционных и клинических исследованиях, объектом которых является ТНРМЖ. И первые результаты этого прогресса мы уже наблюдаем при лечении наших пациентов.
Спеціальний випуск тематичного номеру газети «Здоров’я України» «Онкологія, гематологія, хіміотерапія» 2017 р.



.jpg)