21 жовтня, 2017
Метастатичний рак грудної залози під час вагітності

Частота раку грудної залози (РГЗ) під час вагітності становить 1 на 3000. У Румунії РГЗ є найчастішим злоякісним новоутворенням у жінок. За даними ВООЗ, смертність від РГЗ складає 14,78 на 100 000 жінок на рік. Вік, в якому народжують жінки, постійно збільшується, тож РГЗ під час вагітності сьогодні зустрічається частіше, ніж 20 років тому. Muenst і співавт. [35] продемонстрували захисний ефект вагітності до 20 років щодо розвитку РГЗ, відсутність такого ефекту при народженні першої дитини у віці між 30 і 34 роками та підвищення ризику РГЗ у жінок, які народжують уперше після 35 років.
Рак грудної залози складається з багатьох патологічних підтипів, які відрізняються один від одного генетично й молекулярно. Карцинома грудної залози, діагностована під час вагітності, може відрізнятися від РГЗ, що розвинувся в післяпологовому періоді.
Структура грудної залози змінюється в різних фізіологічних періодах – у пубертаті, на початку сексуальної активності, у післяпологовому періоді й післяменопаузі, зазнаючи клітинного поділу, диференціації та росту. Кількість стовбурових клітин грудної залози залежить від гормональних змін, властивих кожному з фізіологічних періодів. Збільшення кількості стовбурових клітин корелює з підвищенням ризику розвитку РГЗ під час вагітності. Прогноз і тактика лікування пацієнток з РГЗ залежать від гістологічного ступеня (диференціації), статусу рецепторів естрогенів (ER) і прогестерону (PR), а також рівня експресії рецептора епідермального фактора росту людини 2 (HER2).
Asztalos і співавт. [9] встановили, що нормальне клітинне середовище грудної залози після вагітності асоціюється з підвищеною регуляцію генів, пов’язаних із запаленням. Автори визначили неоднакову регуляцію тих самих генів при пухлинах грудної залози в жінок, які народжували вперше або мали декілька пологів в анамнезі.
Дослідження на тканині грудної залози людини показали, що вагітності в більш молодому віці зменшують кількість рецепторів та активність міжклітинних взаємодій, що знижує подальший ризик розвитку РГЗ.
У цій статті представлено випадок метастатичного РГЗ, діагностованого у 37-річної жінки під час її 7-ї вагітності. Згідно з Гельсинською декларацією, від пацієнтки було отримано інформовану згоду на публікацію даних. Головна мета цієї роботи – наголосити на важливості клінічного обстеження на всіх етапах вагітності для діагностування будь-яких новоутворень грудної залози.
Клінічний випадок
Вагітна, 37 років, мешканка сільської місцевості, не працює, у жовтні 2016 р. була направлена районним лікарем у клініку Filantropia, що в Бухаресті, Румунія, на 30-му тижні 7-ї вагітності для обстеження з приводу раку лівої грудної залози з метастазами у шкірі.
Фізикальний огляд: шкіра бліда, функціональний статус низький. Пацієнтка мала обмежену здатність до самообслуговування і приблизно 50% часу вдень проводила в ліжку, переважно через постійну задишку і тахіпное, які почали повільно прогресувати декілька тижнів тому.
Пацієнтка залежала від оксигенотерапії, мала помірну тахікардію і нормальний артеріальний тиск, проте дослідження серця (зокрема визначення фракції викиду лівого шлуночка) не проводились. Індекс маси тіла (ІМТ) становив <18,5 кг/м2, під час цієї вагітності маса тіла не збільшилася. Під час попередніх вагітностей під спостереженням не перебувала, лабораторні дослідження не проводилися (крім періоду госпіталізації перед пологами).
З медичного анамнезу: новоутворення в лівій грудній залозі було помічено 2 роки тому. Пацієнтка має 6 дітей віком від 1 до 15 років; усіх дітей вигодовувала груддю. Останні пологи були рік тому в умовах сільської амбулаторії. Патологічні або радіологічні дослідження грудних залоз під час перебування в пологовому будинку не здійснювались. Виразку на грудній залозі, яка з’явилася рік тому, пацієнтка вважала наслідком грудного вигодовування.
Діагноз РГЗ пацієнтці був встановлений 2 тижні тому, під час її 7-вагітності, в іншій лікарні.
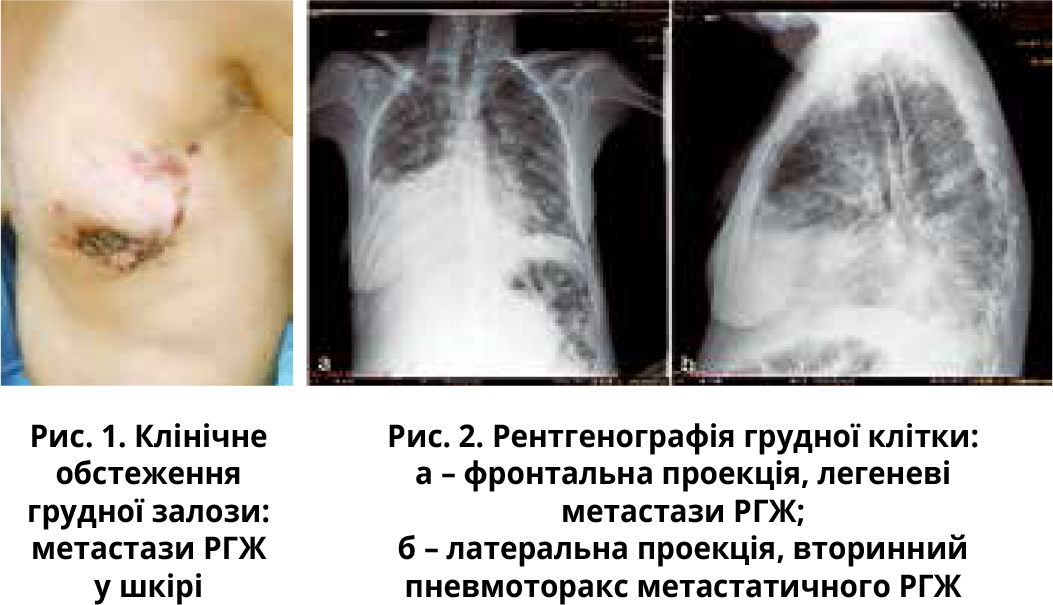
Клінічне обстеження грудних залоз виявило глибоку й таку, що ледь пальпується, пухлину, щільно прикріплену до оточуючих тканин, розміром приблизно 4 см, зі зміненою шкірою, зокрема з виразково-некротичною ділянкою у верхньому зовнішньому квадранті лівої грудної залози, почервонінням і болючістю (рис. 1). За даними рентгенографії грудної клітки (рис. 2), пухлина охоплювала майже всю ліву грудну залозу із сателітними ураженнями шкіри (T4b) та іпсілатеральні пахвові й надключичні лімфатичні вузли (N3) з метастазами в легенях і двостороннім плевральним випотом (M1). Через респіраторні симптоми був проведений скринінг на туберкульоз (результат негативний).
Патологічне дослідження показало інфільтративну (інвазивну) протокову карциному грудної залози. Мікроскопічно відзначалася внутрішньопротокова епітеліальна проліферація з безладним розповсюдженням крізь строму у вигляді тяжів і скупчень клітин (рис. 3а), атиповими пухлинними клітинами (рис. 3б), поодинокими тубулярними утвореннями з ядром у центрі гістологічного ступеня 3 (рис. 3в) і периневральною інвазією (рис. 3г). Пухлинні клітини були низькодиференційованими (високий гістологічний ступінь), сильно поліморфними, з нерівними контурами й вираженими ядерцями, еозинофільною цитоплазмою і високим мітотичним індексом.
.jpg) На парафінових зрізах тканини, фіксованої формаліном, застосували комерційну панель з антитілами до таких антигенів: макроскопічний полікістозний рідкий білок 15 (GCDFP‑15; клон 23A3, Leica Biosystems, Велика Британія, готовий до використання – ГДВ, вилучення антигену в етилендіамінтетраоцтовій кислоті – ЕДТК, 20 хв), цитокератин (CK) 7 (клон OV-TL 12/30, Dako Cytomation, Данія, розведення 1:200, вилучення антигену в EDTA, 15 хв), E-кадгерин (клон 36B5, Leica Biosystems, Велика Британія, ГДВ, вилучення антигену в EDTA, 15 хв), HER‑2/neu (клон SP3, Cell Marque, США, розведення 1:300, вилучення антигену в EDTA, 20 хв), рецепторів естронів (ER, клон 6F11, Leica Biosystems, Велика Британія, ГДВ, вилучення антигену в EDTA, 20 хв), рецепторів прогестерону (PR, клон 16, Leica Biosystems, Велика Британія, ГДВ, вилучення антигену в EDTA, 20 хв) та Ki‑67 (клон MM1, Leica Biosystems, Велика Британія, ГДВ, вилучення антигену в EDTA, 20 хв).
На парафінових зрізах тканини, фіксованої формаліном, застосували комерційну панель з антитілами до таких антигенів: макроскопічний полікістозний рідкий білок 15 (GCDFP‑15; клон 23A3, Leica Biosystems, Велика Британія, готовий до використання – ГДВ, вилучення антигену в етилендіамінтетраоцтовій кислоті – ЕДТК, 20 хв), цитокератин (CK) 7 (клон OV-TL 12/30, Dako Cytomation, Данія, розведення 1:200, вилучення антигену в EDTA, 15 хв), E-кадгерин (клон 36B5, Leica Biosystems, Велика Британія, ГДВ, вилучення антигену в EDTA, 15 хв), HER‑2/neu (клон SP3, Cell Marque, США, розведення 1:300, вилучення антигену в EDTA, 20 хв), рецепторів естронів (ER, клон 6F11, Leica Biosystems, Велика Британія, ГДВ, вилучення антигену в EDTA, 20 хв), рецепторів прогестерону (PR, клон 16, Leica Biosystems, Велика Британія, ГДВ, вилучення антигену в EDTA, 20 хв) та Ki‑67 (клон MM1, Leica Biosystems, Велика Британія, ГДВ, вилучення антигену в EDTA, 20 хв).
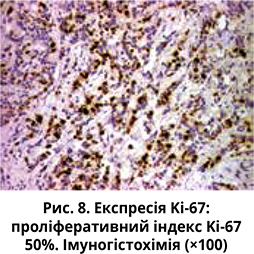
Імуногістохімічне (ІГХ) дослідження підтвердило походження карциноми: позитивні GCDFP‑15 і CK 7 у цитоплазмі пухлинних клітин (рис. 4), інвазивна карцинома протокового (дуктального) типу – позитивний Е-кадгерин у пухлинних клітинах (рис. 5). На мембранах пухлинних клітин були відсутні HER2/neu (ІГХ-оцінка 0, рис. 6), проте наявні обидва типи гормональних рецепторів (ER – рис. 7а, PR – рис. 7б). Проліферативний індекс Ki‑67 становив 50% (рис. 8).
.jpg) Ступінь диференціації пухлини визначили напівкількісним методом: кожному гістологічному параметру (процент утворення трубочок, ступінь ядерного поліморфізму, точне мітотичне число) давали оцінку від 1 до 3 балів. Сума цих оцінок (3+3+2=8) свідчила, що інвазивна протокова карцинома була низькодиференційованою (G3).
Ступінь диференціації пухлини визначили напівкількісним методом: кожному гістологічному параметру (процент утворення трубочок, ступінь ядерного поліморфізму, точне мітотичне число) давали оцінку від 1 до 3 балів. Сума цих оцінок (3+3+2=8) свідчила, що інвазивна протокова карцинома була низькодиференційованою (G3).
Як зовнішній позитивний контроль використали зразки тканини грудної залози з відомим статусом HER2/neu (2+), CK 7, Е-кадгерину, GCDFP‑15, ER та PR, як позитивний контроль Ki‑67 – зразок тканини нормального лімфатичного вузла. З цією метою також можна використовувати внутрішні антигени пацієнта (за наявності). Щоб оцінити специфічність ІГХ-тестів щодо ідентифікації хибнопозитивних реакцій фарбування, застосовували негативні контрольні реагенти – зразки тканин пацієнтки, в яких первинні антитіла були замінені на аналогічні неімунні сироваткові імуноглобуліни.
Результати повного й біохімічного аналізів крові, як і коагуляційних тестів, були в межах норми.
Мультидисциплінарна команда запропонувала хіміотерапію з метою підвищення якості життя й запобігання передчасним пологам. Хіміотерапію (доксорубіцин 600 мг/м2 + циклофосфамід 600 мг/м2) планували розпочати після скринінгу на туберкульоз та оцінки серцевої функції.
Через значне й неочікуване посилення задишки на 3-й день перебування в клініці пацієнтці був проведений кесарів розтин під спинальною анестезією. Народилася дівчинка з масою тіла 1700 г та оцінкою за шкалою Апгар 6/7/8. Післяпологове акушерське обстеження патології не виявило.
Під.jpg) час хірургічного втручання в жінки було виявлено пухлину розмірами 1,0×0,5 см у правій частці печінки.
час хірургічного втручання в жінки було виявлено пухлину розмірами 1,0×0,5 см у правій частці печінки.
Наступного дня пацієнтку перевели до пульмонологічного відділення для лікування гострої дихальної недостатності. Візуалізуючі дослідження показали наявність метастазів в легенях, печінці та кістках, а також значний перикардіальний випіт. Початок хіміотерапії відклали через суттєве погіршення функціонального статусу. Два дні потому в пацієнтки розвинулася тампонада серця; було проведене нове хірургічне втручання – перикардіальне вікно. На жаль, патологічне дослідження перикардіального зразка не було здійснено.
Незважаючи на стабілізацію гемодинамічних параметрів, пацієнтці все ще не можна було призначати хіміотерапію; було розпочате підтримувальне лікування. Тиждень потому пацієнтку перевели до паліативного закладу. За декілька днів було зареєстровано смерть.
Обговорення
Н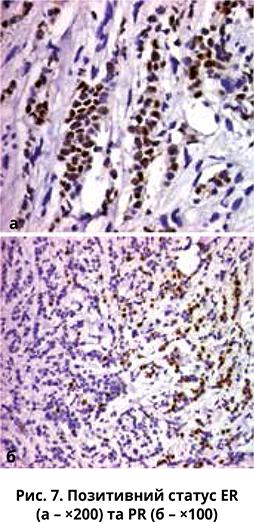 аведений клінічний випадок підкреслює важливість повного фізикального обстеження під час кожного візиту вагітної до клініки. Такі обстеження особливо необхідні у пацієнток з обмеженим доступом до медичних закладів. Вік матері понад 32 роки й паритет асоціюються з підвищеним ризиком РГЗ; у жінок у досимптомній фазі захворювання пухлина може не пальпуватися.
аведений клінічний випадок підкреслює важливість повного фізикального обстеження під час кожного візиту вагітної до клініки. Такі обстеження особливо необхідні у пацієнток з обмеженим доступом до медичних закладів. Вік матері понад 32 роки й паритет асоціюються з підвищеним ризиком РГЗ; у жінок у досимптомній фазі захворювання пухлина може не пальпуватися.
Вважається, що репродуктивні фактори та кількість живонароджень виявляють захисні ефекти завдяки гормональним змінам під час вагітності й лактації, проте це дійсно так лише в жінок, які народжують до 25 років. Наразі відомо, що клітинні й молекулярні механізми, відповідальні за вагітність, чинять негативний вплив на туморогенез.
У сучасному медичному світі завдяки досягненням у діагностиці та лікуванні злоякісних новоутворень подібні клінічні випадки вбачаються архаїчними. Раніше вважалося, що РГЗ, діагностований під час вагітності, є більш агресивним, проте все більше авторів зазначають відсутність суттєвих розбіжностей у безрецидивній і загальній виживаності пацієнток з РГЗ, діагностованим і належно лікованим під час вагітності, порівняно з вагітними пацієнтками з такою самою стадією захворювання.
Основні типи інвазивної карциноми грудної залози класифікують за анатомопатологічними ознаками: інфільтративна протокова, інвазивна часточкова, протокова/часточкова, слизова (колоїдна), трубочкова (тубулярна), медулярна й папілярна карциноми.
Оцінка гістологічного ступеня (тобто ступеня диференціації пухлини) є визначною для прогнозування РГЗ і має включатися в усі алгоритми ведення пацієнток із цим захворюванням.
Гістологічний ступінь залишається незалежним прогностичним фактором при ER-позитивних пухлинах навіть після включення генних сигнатур у багатомірні моделі.
 У представленому випадку для підтвердження походження карциноми було проведено ІГХ-тестування, оскільки інфільтративний РГЗ був низькодиференційованим і рак in situ не визначався (маркери CK 7 і GCDFP‑15). Загалом протокові та часточкові карциноми незалежно від того, чи є вони інвазивними або ж карциномами in situ, можна відрізнити у зрізах, зафарбованих гематоксиліном й еозином; проте в обговорюваному випадку точний діагноз був встановлений за допомогою ІГХ-дослідження (E-кадгерин). У клініці, в якій працюють автори, в усіх інвазивних карциномах грудної залози досліджуються молекулярні маркери, зокрема ER, PR, HER2/neu та Ki‑67, що допомагає обрати оптимальну тактику лікування.
У представленому випадку для підтвердження походження карциноми було проведено ІГХ-тестування, оскільки інфільтративний РГЗ був низькодиференційованим і рак in situ не визначався (маркери CK 7 і GCDFP‑15). Загалом протокові та часточкові карциноми незалежно від того, чи є вони інвазивними або ж карциномами in situ, можна відрізнити у зрізах, зафарбованих гематоксиліном й еозином; проте в обговорюваному випадку точний діагноз був встановлений за допомогою ІГХ-дослідження (E-кадгерин). У клініці, в якій працюють автори, в усіх інвазивних карциномах грудної залози досліджуються молекулярні маркери, зокрема ER, PR, HER2/neu та Ki‑67, що допомагає обрати оптимальну тактику лікування.
Велике дослідження, яке проводилося протягом 30 років та охопило понад 50 000 випадків, показало, що відсутність ER та PR, позитивний статус HER2/neu і Ki‑67, потрійний негативний статус і базальноподібний фенотип пухлини при РГЗ частіше виявляються клінічно, ніж під час скринінгу. За даними E. Cardonick і співавт. [17], біологічні особливості РГЗ визначаються не власне вагітністю, а віком вагітної.
У представленому випадку статус ER і PR був позитивним, статус HER2/neu – негативним. Слід відзначити клінічний вигляд РГЗ із метастазами у шкірі, надключичних і пахвових лімфатичних вузлах у вагітної. На думку багатьох авторів, шкірні метастази асоціюються з РГЗ частіше, ніж будь-яка інша жіноча злоякісна пухлина. Частота виявлення таких метастазів при РГЗ становить 2,42%.
Як і в невагітних пацієнток, наявність пухлини, що пальпується, і кровотечі із соска мають бути приводом для подальшого обстеження, яке дасть змогу підтвердити чи спростувати діагноз РГЗ. Представлений клінічний випадок підтверджує, що вагітність затримує діагностику раку, хоча, за даними літератури, така затримка зазвичай становить лише 2 міс. У цієї пацієнтки через неналежне ведення попередніх вагітностей необхідні дослідження не проводилися, що не дозволило своєчасно розпочати лікування.
Варіанти лікування РГЗ під час вагітності такі самі, як і в невагітних жінок, і включають хірургічне втручання та хіміотерапію, адаптовані до клінічних симптомів і терміну вагітності з метою захисту плода від побічних ефектів.
Променева терапія під час вагітності є дискусійним питанням. Так, румунське Національне керівництво з акушерства та гінекології вважає її протипоказаною. Деякі дослідження зазначають, що променеву терапію можна відкласти до пологів, щоб запобігти гематологічним ускладненням у матері і плода.
Ведення вагітних з РГЗ має здійснювати мультидисциплінарна команда, що складається з акушера-гінеколога, медичного онколога, онкохірурга, неонаталога, анестезіолога, психолога та спеціально навчених медичних сестер. Подружні пари мають отримувати консультацію стосовно варіантів лікування, можливих побічних ефектів для матері і плода, а також прогнозу захворювання. Після пологів пацієнтки повинні перебувати під пильним наглядом.
У наведеному випадку, зважаючи на гестаційний вік 30 тижнів та результати патологічного дослідження, мультидисциплінарна команда вирішувала питання, чи буде одночасна хіміо- та глюкокортикоїдна терапія в інтересах матері та дитини. Були проведені необхідні лабораторні тести для виключення легеневого туберкульозу. Невдовзі потому через дихальну недостатність і постійну потребу в кисні було здійснено кесарів розтин. Надавалася паліативна допомога, але смерть виявилася невідворотною.
Висновки
Наведений клінічний випадок свідчить про необхідність рутинного фізикального обстеження, зокрема грудних залоз, протягом усієї вагітності та одразу після народження дитини. Через несвоєчасне встановлення діагнозу в пацієнтки та метастатичний погано диференційований інфільтративний РГЗ, позитивний за ER/PR та негативний за HER2/neu, отримати задовільні результати лікування не вдалося, хоча життя і здоров’я новонародженої дівчинки були збережені.
Список літератури знаходиться в редакції.
Переклав з англ. Олексій Терещенко
Спеціальний випуск тематичного номеру газети «Здоров’я України» «Онкологія, гематологія, хіміотерапія» 2017 р.