2 листопада, 2017
Несостоятельность понятия аллергии на йод и гиперчувствительность к йодсодержащим контрастным препаратам

 В последние годы пациенты нередко обращаются к врачу с жалобами на аллергию на йод, йодсодержащие контрастные препараты (ЙКП) и морепродукты. Кроме того, среди врачей различных специальностей распространено мнение о существовании аллергии на йод и специфичной перекрестной аллергии между ЙКП и другими, богатыми йодом веществами.
В последние годы пациенты нередко обращаются к врачу с жалобами на аллергию на йод, йодсодержащие контрастные препараты (ЙКП) и морепродукты. Кроме того, среди врачей различных специальностей распространено мнение о существовании аллергии на йод и специфичной перекрестной аллергии между ЙКП и другими, богатыми йодом веществами.
 В связи с этим данная публикация имеет целью, прежде всего, показать, что йод не вызывает специфичной перекрестной аллергической реакции между богатыми им веществами, что возникающая перекрестная реактивность неспецифична, а представление о существовании «йодной аллергии», или «аллергии на йод», ошибочно и может привести к немотивированному отказу от внутривенного введения ЙКП у пациентов с непереносимостью йодсодержащих антисептиков или морепродуктов. Вместе с тем в статье обсуждаются клинические особенности развития гиперчувствительности (ГЧ) к ЙКП, а также современные подходы к ее диагностике, лечению и профилактике.
В связи с этим данная публикация имеет целью, прежде всего, показать, что йод не вызывает специфичной перекрестной аллергической реакции между богатыми им веществами, что возникающая перекрестная реактивность неспецифична, а представление о существовании «йодной аллергии», или «аллергии на йод», ошибочно и может привести к немотивированному отказу от внутривенного введения ЙКП у пациентов с непереносимостью йодсодержащих антисептиков или морепродуктов. Вместе с тем в статье обсуждаются клинические особенности развития гиперчувствительности (ГЧ) к ЙКП, а также современные подходы к ее диагностике, лечению и профилактике.
Известно, что йод является важнейшим микроэлементом, необходимым для синтеза гормонов щитовидной железы. В кишечнике йод превращается в его йодид-ионизированную форму. Главные пищевые источники йода – рыба, йодированная соль, а также йодаты, использующиеся как консерванты в хлебе. Контрастные вещества в основном являются производными трийодбензойной кислоты, в них содержится небольшое количество свободного йода. В литературе последних лет активно обсуждается возможность того, что ГЧ к ЙКП обусловливается ионом йода, входящим в их состав. Так, показано, что у части пациентов, проявлявших ГЧ к ЙКП, определялся положительный патч-тест на йодсодержащие дезинфектанты, что подтверждает такую точку зрения. Вместе с тем отсутствие перекрестной реактивности на ЙКП у части пациентов вызывает сомнение в этом.
В частности, в ходе изучения реактивности Т-клеточных клонов, специфичных к определенному контрастному препарату, не было выявлено перекрестной реактивности таких клонов, более того, они не реагировали на йодид калия. Такие результаты предполагают существование специфических Т-клеточных эпитопов в молекулах контрастных препаратов, которые могут содержать и не содержать йод. Это предположение базируется также на особенностях их бензеновых составляющих, наличии функциональных групп и боковых цепей и требует дальнейшего изучения.
Рассматривая понятия «перекрестная реактивность» и «аллергия на йод», следует отметить, что существует доказательство наличия неспецифической перекрестной реактивности между контрастными препаратами и аллергией на морепродукты и другие пищевые агенты. Так, было описано, что в 5% случаев из 112 303 эпизодов внутривенного введения ЙКП наблюдались аллергические реакции.
Относительный риск развития таких реакций у пациентов с аллергией на морепродукты увеличивался в 3 раза. При этом риск развития вышеуказанных реакций у пациентов с аллергией на яйца, молоко или шоколад увеличивался в 2,9 раза, на фрукты или клубнику – в 2,6 раза, у больных с бронхиальной астмой – в 2,2 раза, что свидетельствует о том, что аллергия на морепродукты увеличивает риск возникновения реакции при внутривенном введении ЙКП (как и наличие ГЧ к пищевым и ингаляционным аллергенам). Кроме того, эти данные позволяют предположить, что по меньшей мере у 85% пациентов с аллергией на морепродукты при введении им внутривенно ЙКП не будут возникать симптомы непереносимости последних.
В доступной литературе отсутствуют исследования о ГЧ при введении контрастных препаратов у пациентов с непереносимостью повидон-йода, часто используемом в медицине. При этом вероятные механизмы реакций на контрастные препараты, аллергии на морепродукты и дерматита от использования повидон-йода различны, поскольку в первом случае происходит активация неспецифических иммунных медиаторов молекулой контрастного вещества, во втором – наблюдается ГЧ, опосредованная иммуноглобулином (Ig) E к рыбному мышечному белку, а в третьем – развивается контактный дерматит вследствие раздражающего эффекта препарата. Кроме того, имеется мало доказательств того, что элементарный йод или йодид вызывают реакции идиосинкразии при использовании ЙКП или повидон-йода. Доказательства же того, что элементарный йод или йодид участвуют в развитии ГЧ в случае употребления в пищу морепродуктов, вовсе отсутствуют. В связи с этим мнение о том, что йод способствует специфической перекрестной реактивности между этими веществами, является необоснованным.
С учетом всего вышеприведенного можно констатировать, что использование понятия «аллергия на йод» является нелогичным, а точнее, просто ошибочным, поскольку он базируется на бездоказательных убеждениях пациентов и части врачей. От этого понятия следует отказаться и заменить на его приемлемые в практике формулировки, например, «ГЧ к контрастным веществам», «нарушенная толерантность или нетолерантность к пищевым морепродуктам», «повидон-йод-индуцированный контактный дерматит». В связи с этим специалисты должны избегать употребления ошибочного понятия и не задавать пациенту вопрос, есть ли у него «аллергия на йод», в связи с отсутствием его клинической значимости.
В отличие от ошибочного понятия «аллергия на йод», термин «ГЧ к ЙКП» имеет совершенно реальное применение в клинике. Реакции ГЧ к контрастным препаратам могут быть немедленного и замедленного характера. Немедленные реакции обычно развиваются в течение часа после инъекции препарата. По клинической выраженности они могут быть легкими (тошнота, рвота, умеренная крапивница, бледность кожи), средней тяжести (выраженная рвота, распространенная крапивница, нарушения дыхания, озноб, отек гортани) и тяжелыми (отек легких, нарушения сердечного ритма или остановка сердца, коллапс). Замедленные же реакции наблюдаются в сроки от нескольких часов до нескольких недель после введения ЙКП. Как правило, такие реакции носят нетяжелый характер (сыпь, эритема, крапивница, ангиоотек, иногда повышение температуры тела) и склонны к самоликвидации.
Распространенность ГЧ к ЙКП
Тяжелые анафилактические реакции немедленного типа наблюдались у 0,071% пациентов, которым вводились ионные контрастные препараты, и у 0,035% пациентов, которым вводились неионные. При этом если из подсчетов исключить случаи с введением иопромида, то частота развития анафилаксий в связи с неионными препаратами снизится до 0,005% случаев. Хотя частота анафилактических реакций на неионные контрастные препараты очень низка, количество пациентов, у которых развиваются подобные реакции, все же значительно выросло вследствие увеличивающегося числа манипуляций с применением контрастных препаратов.
Реакции ГЧ замедленного типа на ЙКП представлены, как правило, умеренными кожными (макулярными, макулопапулярными и уртикарияподобными) проявлениями, которые проходят в течение недели. Так, макулопапулярная экзантема составляет до 50% всех подобных кожных проявлений, а тяжелые кожные реакции наблюдаются лишь у 0,02% больных, получавших йогексол. Кроме того, частота развития кожных проявлений на 1-й и 7-й дни после применения неионных контрастных препаратов составляет 0,9 и 2,9% соответственно. Так, кожный зуд и крапивница встречаются в 6% случаев после применения ионных и в 0,9% – неионных контрастных препаратов. Недавние исследования, проведенные в Азиатско-Тихоокеанском регионе в 2014 г., показали, что распространенность ГЧ немедленного типа составила 6,4-31,2% для ионных контрастных препаратов и 0,16-7,7% – для неионных. В целом в последние годы усредненная частота реакций немедленного типа для всех ЙКП составляет 0,16-2,21%. Распространенность же реакций замедленного типа в 1982 г. составила 0,03-16,5%, а в последние годы – 0,03-1,95%. Также отмечено, что чаще реакции ГЧ к ЙКП наблюдаются у женщин.
Этиология и патогенез ГЧ к ЙКП
В настоящее время применяют ЙКП в виде 2,4,6-трийодированных производных бензена, которые для удобства можно разделить на высокоосмолярные ионные мономеры, низкоосмолярные неионные мономеры, низкоосмолярные ионные димеры, изоосмолярные неионные димеры. Перечень указанных ЙКП приведен в таблице.
Ионные мономеры содержат карбоксильную группу и две относительно короткие боковые цепи, неионные же мономеры имеют длинные боковые цепи, богатые гидроксильными группами, в трех положениях (обычно две цепи идентичны). Необходимо отметить, что различные неионные мономеры имеют общие одну или две боковые цепи. Димеры содержат два трийодированных производных бензена, связанных вместе. У ионного димера йоксаглата эти две производные различны, в то время как два неионных димера (йотролан и йодиксанол) имеют идентичные производные бензена. Йодиксанол является производной йогексола и его четыре идентичные боковые цепи имеют тот же состав, что и две боковые цепи йогексола. Каждая из боковых цепей йотролана имеет дополнительную группу СН2ОН.
Все контрастные препараты представляют собой химически достаточно инертные вещества, которые обычно вводятся в объеме 60-120 г в течение короткого интервала времени для достижения наибольшего эффекта контрастирования. После введения такие низкомолекулярные вещества быстро смешиваются с циркулирующей кровью и затем выходят через стенку кровеносных сосудов во внеклеточную жидкость. Основная часть введенного контрастного вещества у пациентов с сохраненной функцией почек обычно выделяется в неизмененном виде в течении 24 ч. Благодаря отрицательному заряду ионные контрастные препараты могут связываться с белками плазмы в небольшой степени, а неионные практически не связываются с ними, что имеет значение для развития реакций ГЧ.
В целом современные ЙКП обладают хорошим профилем безопасности и вызывают реакции ГЧ лишь у предрасположенных к ним пациентов. Описаны случаи немедленных реакций ГЧ при приеме пероральных контрастных препаратов. У детей чаще встречаются анафилактоидные реакции на подобные препараты (0,18-3% случаев), и такие реакции у них труднее распознать, чем у взрослых.
Традиционно среди реакций ГЧ выделяют немедленные (развивающиеся в течении 1 ч) и замедленные (развивающиеся через 1 ч и более после введения препарата). В основе развития реакций ГЧ немедленного типа лежит способность ЙКП вызывать высвобождение гистамина и других вазоактивных веществ тучными клетками органов, подвергшихся воздействию соответствующих препаратов. У пациентов с такими реакциями ГЧ отмечается повышенный уровень гистамина и триптазы в плазме. Уровень указанных биомаркеров может коррелировать с тяжестью реакций ГЧ. При этом концентрация триптазы может быть наибольшей при тяжелых реакциях ГЧ и анафилаксии.
Реакции ГЧ на ЙКП, как правило, могут рассматриваться как реакции неимунной ГЧ вследствие активации системы комплемента и других медиаторов неспецифического иммунитета. Поскольку они могут развиваться уже после первого введения препарата, его повторное введение часто не вызывает развития реакций ГЧ, а антитела класса IgЕ выявляются редко. Вместе с тем в последнее десятилетие были получены данные о том, что ЙКП способны вызывать и иммунные реакции ГЧ, развитие которых подтверждается положительными результатами прик-тестов и низкой частотой перекрестно положительных реакций. В этих случаях формирование первичной сенсибилизации таких пациентов может быть связано с предшествующим приемом галогенизированных бензенов в качестве пищевых добавок, пестицидов и гербицидов и напоминает развитие анафилактических реакций на мышечные релаксанты, когда к ним определяются антитела класса IgЕ, но пациенты отрицают использование ранее указанных препаратов. Кроме того, отсутствие реакций на последующее введение ЙКП не может рассматриваться как довод против IgЕ-опосредованных механизмов развития реакций ГЧ. Подобная ситуация напоминает утрату с течением времени ГЧ к β-лактамным антибиотикам.
В основе развития реакций ГЧ замедленного типа (IV тип по классификации Джелла и Кумбса) лежат препарат-реактивные Т-клетки, которые после распознавания препарата или его метаболитов пролиферируют и регулируют воспалительные реакции кожи. Этот факт подтверждается частыми положительными результатами патч-тестов и отсроченного внутрикожного теста; наличием Т-клеточной инфильтрации участков пораженной кожи, способностью препаратов, вызвавших реакцию, стимулировать пролиферацию периферических Т-клеток; возможностью выделения из таких культур препарат-специфических CD4+- и CD8+-Т-клеток.
Отсроченные реакции ГЧ часто наблюдаются у пациентов, получавших препараты интерлейкина‑2, являющегося мощным стимулятором Т-клеток. Чаще такие реакции возникают после применения неионных димерных препаратов. Разнообразие клинических проявлений этих реакций на коже объясняется широким спектром цитокинов, продуцируемых Т-клетками, стимулированными ЙКП. Существуют также данные о том, что незначительные кожные проявления опосредованы CD4+-Т-клетками, а тяжелые буллезные реакции – цитотоксическими CD8+-Т-клетками. Развитие кожных проявлений на 1-2-й день после введения ЙКП предполагает, что при этом активируются уже существующие клоны препарат-специфических Т-клеток, а предшествующая реакция на ЙКП может определять развитие более тяжелых проявлений при последующем его введении. Так, в литературе описаны результаты отсутствия развития кожных реакций после повторного введения ЙКП, что предполагает важное значение ко-факторов в развитии реакции или делецию препарат-реактивных клонов Т-клеток вследствие предшествующего введения препарата. При этом у части пациентов препарат-специфические Т-клетки могут циркулировать годами, а у других – исчезать в течение нескольких месяцев.
Очень часто пациенты с реакциями ГЧ замедленного типа демонстрируют кожную чувствительность ко многим веществам. Так, отмечено, что существует перекрестная реактивность Т-клеточных клонов, специфичных к ЙКП. Однако сегодня не существует достоверных способов предсказать возможность перекрестной реактивности в зависимости от структуры указанных препаратов.
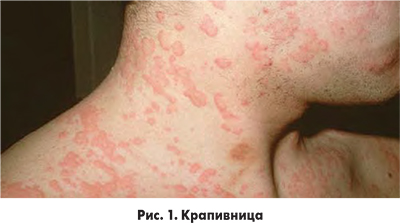
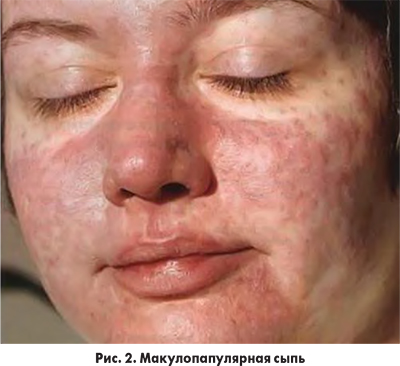
Клинические проявления реакций ГЧ к ЙКП немедленного типа могут варьировать от легких кожных проявлений до развития тяжелой анафилаксии. У большинства пациентов симптомы ГЧ этого типа развиваются в первые 5-15 мин после введения препарата и длятся на протяжении 30-60 мин. Время проявления реакции может колебаться от возникновения буквально «на игле» до 30 мин. В отдельных случаях реакции могут продолжаться до 6 ч и даже до 1 сут. Клинические проявления реакций ГЧ к ЙКП чаще всего протекают в виде кожных проявлений – высыпаний подобных крапивнице (рис. 1), макулярных, макулопапулярных высыпаний (рис. 2), обычно разрешающихся в течение 1 нед.
Наиболее частым проявлением является макулопапулярная экзантема. Кожные высыпания могут сопровождаться ангиоотеком, повышением температуры тела и эозинофилией крови. В период выздоровления может наблюдаться шелушение в области первичных высыпаний. Появление высыпаний подобных крапивнице в поздние сроки после введения ЙКП, как правило, не сопровождается развитием состояний, угрожающих жизни, в отличие от крапивницы, возникающей сразу после введения препарата. В более тяжелых случаях наблюдаются нарушения деятельности сердечно-сосудистой и дыхательной систем, что заставляет врача подумать о возможном развитии анафилаксии.
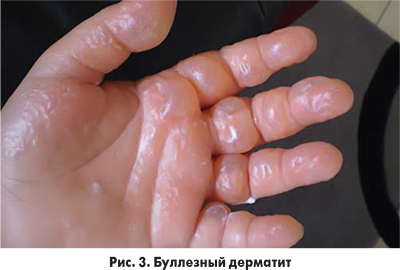
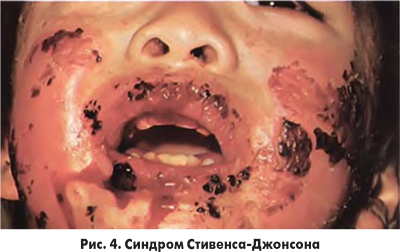
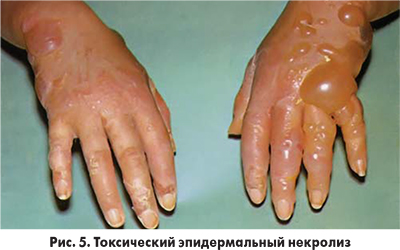
Тяжелые кожные проявления после введения ЙКП наблюдаются редко, примерно в 0,02% случаев. Каких-либо специфических черт такие проявления не имеют. В литературе описаны буллезные (рис. 3), фиксированные лекарственные проявления, острый генерализованный экзематозный пустулез, буллезная экзантема, синдром Стивенса-Джонсона (рис. 4) и токсический эпидермальный некролиз (рис. 5) вследствие введения ЙКП. Эти случаи требуют привлечения к лечению пациентов дерматолога и проведения лабораторного обследования для выявления возможных поражений внутренних органов (печени, почек, желудочно-кишечного тракта, органов дыхания и др.).
Все перечисленные формы лекарственных реакций подробно описаны в соответствующей литературе.
Диагностика ГЧ к ЙКП базируется на общих принципах диагностики лекарственной аллергии и включает подробный сбор аллергологического анамнеза, физикальное обследование пациента, проведение кожных и лабораторных тестов с предполагаемыми препаратами-аллергенами.
Одним из основных и широко используемых подходов в диагностике ГЧ к лекарственным препаратам является проведение кожных проб, к которым относят прик-тест, внутрикожную пробу и патч-тест.
Прик-тест проводится на тыльной стороне предплечья с использованием преимущественно часто применяемых препаратов. Если это возможно, то всегда нужно тестировать действующее вещество и другие вещества, входящие в состав препарата. У пациентов, страдающих крапивницей, прик-тест должен проводиться с минимальной концентрацией с последовательным ее увеличением.
Концентрации препаратов для проведения прик-тестов описаны в литературе. Результаты реакций оцениваются с помощью стандартных критериев. Положительной реакцией считают образование волдыря более 3 мм в диаметре с окружающей эритемой через 20 мин после проведения пробы. Тестирование лекарственных препаратов требует оценки результатов прик-тестов и через 24 ч после проведения пробы. Прик-тест имеет хорошую диагностическую ценность в исследовании реакций ГЧ немедленного типа, например, вызванных β-лактамными антибиотиками и анестетиками.
Внутрикожная проба проводится только в случае, если прик-тест дал отрицательный результат. Данная проба не проводится у пациентов с синдромом Стивенса-Джонсона, токсическим эпидермальным некролизом, лейкоцитокластическим васкулитом, поскольку может вызвать повторное развитие указанных патологий. С осторожностью внутрикожная проба должна проводиться больным с синдромом медикаментозной реакции с эозинофилией и системными симптомами (DRESS-синдром). Внутрикожные пробы не применяются в случаях крапивницы, ангиоотека и анафилаксии. Широко используются при исследовании β-лактамных антибиотиков и анестетиков.
При этом одной из основных областей их применения является диагностика ГЧ замедленного типа на антибиотики, радиоконтрастные препараты, соли платины, гепарины. Проведение этих проб требует наличия стерильных форм препаратов, поэтому их применение может быть ограничено наличием коммерческих форм выпуска. Тем не менее в центрах, имеющих специальное оборудование и соответствующий опыт, могут изготавливаться формы для тестирования из неинъекционных препаратов (например, могут растворяться порошки из капсул или таблетки, лишенные оболочки). Такие диагностические формы изготавливаются в ламинарных боксах с последующей стерилизующей фильтрацией с использованием одноразовых систем. Растворы для тестирования изготавливают не позднее чем за 2 ч до проведения проб. Следует тщательно оценить возможные риски и иметь необходимое оборудование и медикаменты для оказания неотложной помощи пациентам.
Внутрикожная проба проводится стерильным шприцем, начиная с минимальной концентрации, которая может быть последовательно увеличена. Отрицательный контроль выполняется с 0,9% раствором натрия хлорида или со специальным растворителем, используемым для разведения препарата. Положительный контроль может быть выполнен с раствором гистамина 1 мг/мл. Исследуемый раствор вводят в дозе от 0,02 до 0,05 мл или в объеме, достаточном для образования папулы диаметром 1-3 мм. Время оценки варьирует от 20 до 30 мин. Оценка результатов зависит от использованного объема исследуемого препарата. Положительной считается реакция, если диаметр образовавшегося элемента больше 2 диаметров инъекционной папулы или превышает на 3 мм ее диаметр. При оценке через 24 ч и позднее реакция считается положительной при развитии инфильтрированного эритематозного элемента. Однако данный метод в настоящее время нуждается в стандартизации.
Патч-тесты применяются для поиска подозреваемого препарата при генерализованной экземе, системном контактном дерматите, синдроме бабуина (синдром аллергического контактного дерматита), макулопапулярной сыпи, остром генерализованном эритематозном пустулезе и фиксированной медикаментозной сыпи. В некоторых случаях применение патч-теста оправдано при DRESS-синдроме, однако данная проба практически не используется при крапивнице, синдроме Стивенса-Джонсона, токсическом эпидермальном некролизе, васкулитах.
В зависимости от исследуемых групп препаратов кожные пробы имеют различное диагностическое значение. Прогностическое значение кожных проб на лекарственные препараты в случае отрицательных результатов этих проб до настоящего времени остается окончательно не установленным. В литературе упоминаются случаи, когда после отрицательного патч-теста у пациента были получены положительные результаты внутрикожной пробы. Более того, было показано повторное развитие у пациента клинической кожной реакции на препарат после отрицательных патч-, прик-тестов и внутрикожной пробы. Сообщается, что до 10-17% пациентов после отрицательных кожных проб проявляют клиническую реактивность после приема тестовой дозы препарата. Такие случаи наблюдались при приеме β-лактамных антибиотиков, макролидов, парацетамола, кортикостероидов, а также рентгеноконтрастных препаратов. Таким образом, при проведении кожных проб у больных с нетяжелыми реакциями замедленной ГЧ рекомендуют такой алгоритм: проводят медикаментозный патч-тест; если результат отрицательный, то выполняют другие кожные пробы с немедленным и отсроченным учетом результатов. В случае ГЧ немедленного типа проводят патч-тест и внутрикожную пробу.
У пациентов, имеющих в анамнезе реакции ГЧ к ЙКП замедленного типа (например, генерализованную экзантему), целесообразно проведение патч-тестов и внутрикожных проб с отсроченной оценкой их результата (через 1-3 дня) для определения препарата, который удовлетворительно переносится. Пробы выполняют с неразведенным препаратом, поскольку разведения 1/10 дают много ложнонегативных результатов. Если препарат, вызвавший ранее клиническую реакцию ГЧ, при кожном/внутрикожном тестировании дает отрицательный результат, то все равно необходимо избегать его повторного применения, так как прогностическое значение такого тестирования пока окончательно не доказано.
Поскольку серьезными противопоказаниями к проведению провокационных медикаментозных тестов являются генерализованная буллезная сыпь, острый генерализованный экзантематозный пустулез, токсический эпидермальный некролиз, синдром Стивенса-Джонсона, тяжелые проявления анафилаксии, то такое тестирование с ЙКП в настоящее время в большинстве случаев не рекомендуется.
К сожалению, возможности лабораторной диагностики реакций ГЧ к ЙКП пока ограничены. Так, определение специфических IgE к лекарственным препаратам возможно не для всех из них, а сам метод широко используется без достаточных доказательств его эффективности. Выявление специфических IgE (например, к пенициллину, мышечным релаксантам, химопапаину, столбнячному анатоксину и др.) еще не устанавливает диагноз лекарственной аллергии. Только сочетание клинических проявлений, результатов кожных проб и выявление специфических IgE может свидетельствовать об IgE-зависимом механизме ГЧ. В настоящее время мировой рынок преимущественно занимают три основные тест-системы – ImmunoCAP (ThermoFisher, ранее Phadia), Immulite (Simens), Hytec‑288 (Hycor).
Все они используют общий принцип взаимодействия аллергена с сывороточным IgE, определяемым вторичным конъюгатом анти-IgE с ферментом, катализирующим превращение специфического субстрата с появлением света, цвета или флюоресценции. Для лабораторной диагностики немедленных реакций ГЧ может быть применен тест активации базофилов с оценкой экспрессии CD63 или CD203c. Чувствительность теста составляет 46,2-61,5%, специфичность 88,4-100%. Однако в настоящее время отсутствует убедительная доказательная база клинической значимости теста и требуется его дальнейшее изучение.
Учитывая, что тучные клетки и базофилы являются одними из основных клеток-эффекторов реакции ГЧ немедленного типа, особую важность приобретает определение медиаторов (гистамина, триптазы, карбоксипептидов, химаз, гепаринов, высвобождающихся немедленно, лейкотриенов, простагландинов и цитокинов, продуцируемых de novo), выделяемых этими клетками при их активации. Наиболее часто в клинической практике определяют концентрацию гистамина, триптазы и лейкотриенов, хотя убедительных данных о практическом использовании таких анализов для диагностики ГЧ к ЙКП пока нет.
Участие Т-лимфоцитов в развитии реакций ГЧ замедленного типа к лекарственным препаратам – хорошо доказанный факт. Лабораторная диагностика этого типа ГЧ основывается на количественной оценке активности препарат-специфических Т-лимфоцитов. В настоящее время применяется как традиционный тест трансформации лимфоцитов, так и современные методы оценки с помощью многоцветной проточной цитометрии. Так, после стимуляции Т-лимфоцитов на их поверхности начинают экспрессироваться активационные маркеры, такие как СD25, CD69, CD71 и HLA-DR. Эти активационные молекулы легко определяются с помощью проточной цитометрии. В настоящее время не достаточно доказательной базы для применения этих маркеров в клинической практике.
В частности, ограничены доказательства применения CD69 как маркера ГЧ замедленного типа. Учитывая, что Т-клетки опосредуют развитие множества реакций подобного типа с поражением кожи, достаточно широко используется оценка экспрессии кожного хоминг-рецептора – кожного лимфоцит-ассоциированного антигена (CLA). Экспрессия CLA на активированных Т-лимфоцитах периферической крови проводится методом проточной цитометрии. Кроме того, некоторые хемокиновые рецепторы (CCR) могут усиливать свою экспрессию на мембранах Тх1- и Тх2-клеток – CCR4, CCR7 и CCR10.
В литературе имеется значительное число данных, подтверждающих возможность определения некоторых цитокинов для установления природы побочных реакций на лекарственные препараты. Определение цитокинов может проводиться двумя основными коммерчески доступными методами, к которым относятся ферментативная иммуносорбентная «точка» (Enzyme-Linked ImmunoSpot, ELISPOT) и проточная цитометрия.
Однако несмотря на кажущееся изобилие лабораторных методов диагностики реакций ГЧ, практически ни один из них не получил широкого распространения в определении ГЧ к ЙКП.
Лечение пациентов с ГЧ к ЙКП основано на общих принципах оказания медицинской помощи пациентам с лекарственной аллергией, включая анафилаксию. В настоящее время отсутствуют достоверные данные о реальной возможности прогнозирования развития тяжелых анафилактических реакций на ЙКП. Имеется информация о том, что в Великобритании на протяжении 10 лет отмечено 10 смертей вследствие анафилактических реакций на ЙКП, а большинство умерших при жизни ранее получали данные препараты.
Но, как правило, пациенты с анафилактическими реакциями выздоравливали, если получали своевременную и соответствующую медицинскую помощь. Необходимо подчеркнуть, что пациенты после введения ЙКП должны оставаться под наблюдением медицинского персонала не менее чем 15 мин, и при этом обязательно должен сохраняться венозный доступ. Как указывалось выше, реакции немедленной и замедленной ГЧ к ЙКП обычно проявляются кожными нарушениями различной степени тяжести, при которых элиминация препарата-аллергена, применение антигистаминных препаратов, топических и системных глюкокортикоидов имеют достаточно высокую терапевтическую эффективность.
Основные же принципы оказания помощи пациентам с лекарственной аллергией, в том числе анафилаксией, вызванной введением ЙКП, не отличаются от общепринятых и детально описаны в «Уніфікованому клінічному протоколі екстреної, первинної, вторинної (спеціалізованої) та третинної (високоспеціалізованої) медичної допомоги «Медикаментозна алергія, включаючи анафілаксію» (2015).
Профилактика развития ГЧ к ЙКП
Установлено, что основным фактором риска развития тяжелой реакции ГЧ является наличие в анамнезе у пациента задокументированной подобной реакции на контрастные препараты. Если пациент нуждается в проведении исследования с контрастированием, ему необходимо вводить другой (лучше ранее не использованный) контрастный препарат и избегать применения средства, ранее вызвавшего реакцию ГЧ. Низкая перекрестная реактивность между различными ЙКП с большой долей вероятности предусматривает, что другой препарат может переноситься удовлетворительно. Тем не менее необходимо учитывать возможность перекрестной реактивности, а также тот факт, что диагностическая ценность отрицательного прик-теста в таких случаях окончательно не доказана.
Согласно существующей точке зрения сообщение пациентом об «аллергии на йод» не является фактором риска аллергических реакций на контрастные препараты, но указание в анамнезе об аллергии на морепродукты увеличивает риск побочных эффектов при введении ЙКП. Аллергию на морепродукты саму по себе не следует рассматривать как абсолютное противопоказание к внутривенному контрастированию. Нет никаких оснований полагать, что «аллергия на йод», указанием на которую являются кожные реакции при использовании антисептиков, будет иметь особое значение при внутривенном введении контрастных веществ.
Пациенты, имеющие в анамнезе реакцию ГЧ немедленного типа, должны иметь браслет «аллергика» с указанием названия причинно-значимого препарата. Такие пациенты обязательно должны иметь соответствующие записи в амбулаторной карте, а также должны быть внесены в базы данных лечебных учреждений, где пациенты могут получать медицинскую помощь.
Эффективность премедикации глюкокортикоидами и антигистаминными препаратами в предотвращении реакций ГЧ к ЙКП остается противоречивой. Опубликованы данные о развитии серьезных анафилактических реакций после проведенной полноценной премедикации. Последняя может проводиться глюкокортикоидами (бетаметазон, метилпреднизолон, преднизолон) для уменьшения проявлений симптомов нарушения дыхания и гемодинамики, а также инъекционными формами антигистаминных препаратов І поколения (гидроксизин, клемастин, дифенгидрамин, хлорфенирамин) для снижения клинических проявлений дыхательных и кожных реакций.
Комбинация циметидин-клемастин может несколько снижать возможность развития ангиоотека. Примером премедикации у пациентов с ранее развивавшимися реакциями ГЧ к ЙКП может служить следующая схема: назначение перорально 50 мг преднизолона за 13, 7 и 1 ч до введения и 50 мг дифенгидрамина внутривенно или внутримышечно, или перорально за 7 и 1 ч до инъекции. В неотложных ситуациях 50 мг метилпреднизолона вводится каждые 4 ч до введения контрастного препарата.
Следует отметить, что нет убедительных данных о том, что наличие аллергии на другие вещества или продукты может служить предиктором тяжелых реакций ГЧ к неионным препаратам. В то же время неконтролируемая бронхиальная астма может быть фактором риска бронхоспазма, а сердечно-сосудистые заболевания и прием β-блокаторов могут утяжелять течение анафилаксии, вызванной введением ЙКП. Существуют также немногочисленные данные, предполагающие, что наличие аллергических реакций на морепродукты может быть фактором риска развития ГЧ к ЙКП.
В настоящее время нет общепризнанного протокола для профилактики развития реакций ГЧ замедленного типа у пациентов, имевших их ранее. Предполагается целесообразность перорального назначения преднизолона в дозе 50 мг за день до введения ЙКП и по 25 мг ежедневно в течение 3 дней после этого. Если симптомы реакции развиваются, то дозу преднизолона увеличивают до 50 мг/сут. Поскольку эффективность такой профилактики окончательно не доказана, то у пациентов с предшествующими тяжелыми кожными реакциями необходимо избегать повторного применения любых ЙКП.
Среди пациентов, формирующих группу риска, следует выделить также: 1) больных с документированными экзантемами и контактным дерматитом при использовании препаратов; 2) больных с активными проявлениями вирусных инфекций; 3) больных, принимающих гидралазин, страдающих системной красной волчанкой, лимфомой, перенесших трансплантацию костного мозга. Описаны также случаи повышения риска развития кожных проявлений ГЧ к ЙКП у пациентов, получавших терапию интерлейкином‑2.
В случае необходимости проведения визуализации у пациентов, имеющих доказанную ГЧ к ЙКП, радиолог имеет возможность выбора других методов без применения контраста, например, ультразвукового исследования, магнитно-резонансной томографии, ядерного резонанса и др.
Список литературы находится в редакции.
Тематичний номер «Пульмонологія, Алергологія, Риноларингологія» № 3 (40), жовтень 2017 р.