11 листопада, 2017
Маркеры гиперкоагуляции у пациентов с онкологическими заболеваниями

 Взаимосвязь между венозными тромбозами и онкологическими заболеваниями известна еще с XIX века, когда французский врач Armand Trousseau в 1865 г. в одной из своих лекций описал случай мигрирующего тромбофлебита и злокачественной опухоли [1]. Хотя работа A. Trousseau касалась венозного тромбоза у пациентов с раком желудка, тем не менее сегодня термин «синдром Труссо» используется для обозначения любого типа проявлений тромбоэмболического синдрома у онкологических больных (артериальный и венозный тромбоз, небактериальный тромботический эндокардит, тромботическая микроангиопатия, венозная окклюзия и др.).
Взаимосвязь между венозными тромбозами и онкологическими заболеваниями известна еще с XIX века, когда французский врач Armand Trousseau в 1865 г. в одной из своих лекций описал случай мигрирующего тромбофлебита и злокачественной опухоли [1]. Хотя работа A. Trousseau касалась венозного тромбоза у пациентов с раком желудка, тем не менее сегодня термин «синдром Труссо» используется для обозначения любого типа проявлений тромбоэмболического синдрома у онкологических больных (артериальный и венозный тромбоз, небактериальный тромботический эндокардит, тромботическая микроангиопатия, венозная окклюзия и др.).
У пациентов с раком могут иметь место различные типы расстройств системы гемостаза, что в свою очередь ухудшает прогноз и повышает уровень смертности. Онкопатология связана с 4-7-кратным увеличением риска венозной тромбоэмболии (ВТЭ). Однако даже без проявления тромбоза у большинства больных раком наблюдаются изменения в системе гемостаза, обнаруживаемые с помощью лабораторных тестов, которые показывают разную степень активации коагуляционного процесса и характеризуются гиперкоагуляционным состоянием [2]. Нарушение баланса между свертывающей и противосвертывающей системами у онкологических пациентов способствует развитию тромботических осложнений.
Отличительные черты онкологической патологии – наличие распространенных форм рака и тяжелая сопутствующая патология, проявляющаяся в развитии ВТЭ. Наиболее часто тромботические осложнения развиваются при опухолях яичника, поджелудочной железы, желудка, легкого, прямой и толстой кишок, грудной железы и могут носить самый разный характер (тромбоз глубоких и поверхностных вен нижних конечностей, подключичных вен, верхней полой вены и др.). В настоящее время установлено, что тромбоэмболические осложнения являются второй причиной смерти у больных злокачественными новообразованиями. Основную роль в патогенезе разнообразных тромботических осложнений у онкологических больных играют изменения системы гемостаза, вызываемые как самой опухолью, так и применяемыми методами лечения (хирургическое вмешательство, радио-, химио- и гормональная терапия).
Патогенез опухоль-ассоциированного тромбоза
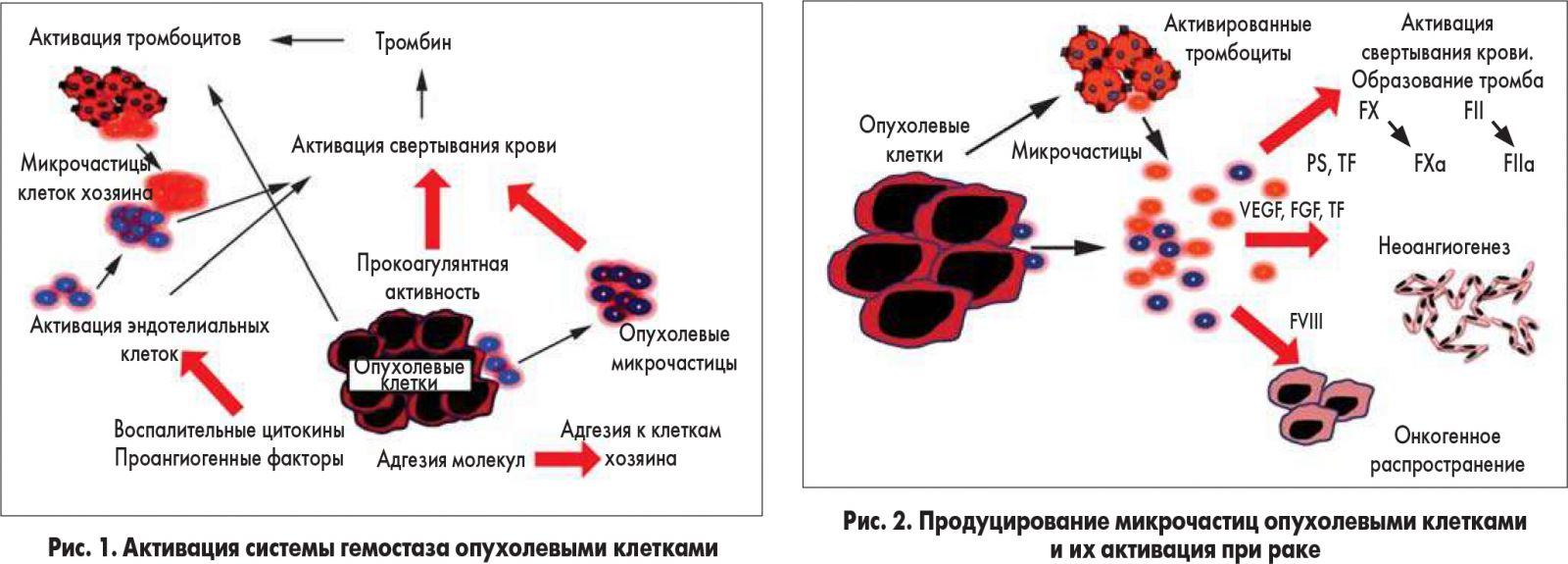
Патогенез опухоль-ассоциированной гиперкоагуляции является комплексным и мультифакторным. Очень важным обстоятельством служит то, что опухолевые клетки обладают способностью активировать гемостатическую систему хозяина. Этот феномен обусловливают те же онкогены, которые отвечают за клеточную неопластическую трансформацию. Опухолевые клетки активируют систему гемостаза различными способами. В этом процессе опухолевая ткань способна экспрессировать прокоагулянтные белки, такие как тканевой фактор (TF), цистеиновая протеиназа (CP), фактор VII, прокоагулянтные микрочастицы (МР), воспалительные цитокины, проангиогенные факторы, продуцировать адгезивные молекулы, связывающие тромбоциты, эндотелиальные клетки и лейкоциты путем выделения растворимых факторов или путем прямого адгезивного контакта [3, 4] (рис. 1).
Протромботические механизмы опухоли
Факторы, усиливающие тромбогенность новообразований, являются сложными и отражают взаимодействие различных механизмов, которые могут быть суммированы на основе классической триады Вирхова: повреждение эндотелия сосуда, гиперкоагуляция и нарушения движения крови (стаз крови).
Изменение факторов системы гемостаза при раке
Опухолевые клетки обладают способностью качественно и количественно модифицировать плазматические и клеточные компоненты системы гемостаза либо непосредственно оказывая влияние на синтез и секрецию прокоагулянтных субстанций, либо опосредованно, через внутриклеточные цитокин-медиаторные механизмы.
I. Синтез и секреция прокоагулянтных субстанций
Тканевой фактор – клеточный прокоагулянт и основной инициатор коагуляции. TF представляет собой трансмембранный гликопротеин, состоящий из 263 аминокислотных остатков. В физиологических условиях прокоагулянтная активная форма TF не определяется в циркуляции крови и на поверхности интактного эндотелия [5]. Сверхэкспрессия TF считается отличительной чертой злокачественного фенотипа, что было показано при описании свойств тромбопластина лейкемических клеток [6], в супернатанте образцов пациентов с промиелоцитарным лейкозом [7], на поверхности микрочастиц [8]. Индуцируя провоспалительный ответ путем синтеза и секреции опухолевых цитокинов, таких как интерлейкин‑1β (IL‑1β), фактор некроза опухоли (TNF), фактор роста эндотелия сосудов (VEGF), злокачественные клетки активируют экспрессию TF на поверхности моноцитов/макрофагов и эндотелия [9]. Степень тканевой экспрессии TF в первичной опухоли коррелирует с уровнем циркулирующего антигена [10]. Сверхэкспрессия TF имеет специфическую биологическую роль и выступает посредником при росте опухоли и метастазов [11].
Цистеиновая протеиназа (раковый прокоагулянт) – это эндопептидаза (м.м. 68 кДа, 674 аминокислотных остатка), субстратом которой является фактор X. СР обладает способностью напрямую активировать фактор X без включения фактора XII и протеолитически расщеплять молекулу на нескольких участках [12]. У пациентов в полной ремиссии, а также в экстрактах из нормальных тканей СР не обнаружена. Экспрессия СР при острой промиелоцитарной лейкемии ингибируется транс-ретиноевой кислотой. Это подтверждает гипотезу о том, что недифференцированные клетки экспрессируют СР, а после восстановления дифференцировки ее экспрессия подавляется [13]. Уровень СР определяют с использованием иммуноферментного анализа. Он значительно повышен у 85% больных со злокачественными опухолями (наиболее активно СР экспрессируется при остром промиелоцитарном лейкозе).
Фактор VII является кофактором TF, который необходим для его прокоагулянтной активности. Эндогенный синтез фактора VII из внепеченочных опухолевых клеток способен активировать коагуляцию через фактор Xa посредством проинвазивных сигнальных путей [14]. Протеолитически активный фактор VII в комбинации с TF индуцирует антиапоптозный эффект.
Протромбин/тромбин – ключевой протеолитический фермент коагуляции. Он продуцируется различными типами опухоли и проявляет плейотропные биологические эффекты в процессах ангиогенеза и пролиферации опухоли [15]. У пациентов с низкодифференцированной карциномой фактор II вызывает внутрисосудистую коагуляцию, увеличивает адгезию тромбоцитов in vitro и образование метастазов in vivo [16].
Фактор VIII / фактор фон Виллебранда. Различные виды рака связаны с повышенными уровнями фактора фон Виллебранда и фактора VIII вследствие вызванного опухолью провоспалительного цитокинового ответа (IL‑6, TNF) [17, 18].
Фактор V является кофактором X. При экспрессии фактора V рецептор, активирующий опухолевые клетки, функционально участвует в катализе протромбиназного комплекса. Увеличение коагуляционной активности у пациентов с раком грудной железы коррелирует с присутствием единичного нуклеотидного полиморфизма в гене фактора V и увеличивает тромботический риск [19, 20].
Фактор XIII – фибринстабилизирующий фактор. Опухолевые клетки рака грудной железы имеют активность, подобную таковой у фактора XIII. Катализ поперечно сшитого фибрина и его отложений потенцирует рост опухоли и метастазы [21]. При использовании электронной микроскопии фибриногена/фибрина было показано, что фибрин является интегральным компонентом исследуемых опухолей. Отложение фибрина потенцирует метастатическую эмболию, которая улавливает циркулирующие опухолевые клетки в сосудистом слое и способствует адгезии к эндотелию. Уровни фибриногена плазмы значительно увеличены у пациентов с множественной миеломой и раком грудной железы [22, 23].
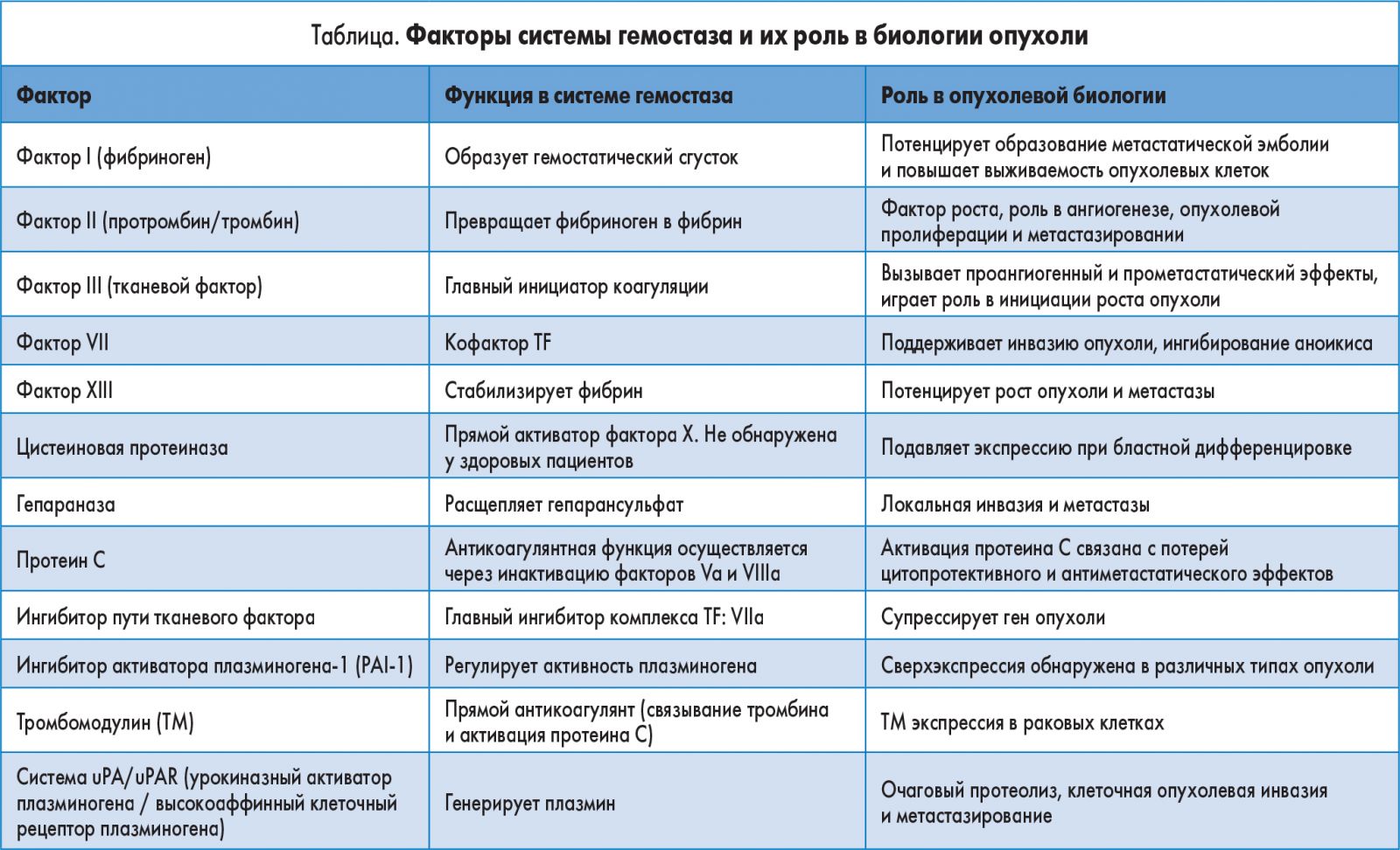
Прокоагулянтные микрочастицы – это субмикронные внеклеточные везикулы. Их прокоагулянтная способность определяется экспрессией отрицательно заряженного фосфатидилсерина (PS) и функционально активным TF [24]. Опухолевые клетки активно выделяют МР и способствуют их образованию тромбоцитами. Экспрессия TF и PS на поверхности тромбоцитов и опухолевых MP приводит к активации свертывания крови и образованию тромбов. Повышенное содержание проангиогенных факторов тромбоцит-опухолевых МР (VEGF, фактор роста фибробластов – FGF – и тромбоцитарный фактор роста – PDGF) делает эти соединения важными медиаторами процесса неоангиогенеза (рис. 2). Увеличение МР-ассоциированной прокоагулянтной активности было определено у пациентов с миелопролиферативными новообразованиями. При внутриклеточном изменении МР опухолевые клетки переносят онкогенный сигнал и усиливают ангиогенный фенотип.
Гепараназа-эндоглюкуронидаза – фермент, который расщепляет гепарансульфат. Обнаружена сверхэкспрессия почти во всех известных злокачественных новообразованиях. Опухолевые клетки секретируют гепараназу, которая индуцирует экспрессию TF, активирует фактор X и инактивирует ингибитор TF [25].
II. Механизм супрессии природных антикоагулянтов
Протеин С в присутствии тромбина инактивирует факторы Va и VIIIа. Протеин С выполняет цитозащитную и антиметастатическую функции независимо от коагуляции. Связь между увеличением частоты тромботических событий и приобретенной резистентностью к протеину С, не связаннной с фактором Лейдена, наблюдалась при множественной миеломе и колоректальном раке.
Протеин S – кофактор протеина С, активность которого может быть ингибирована циркулирующими парапротеинами.
Антитромбин III – основной плазменный белковый фактор, который инактивирует факторы IIa, IXa, Xa, XIa, XIIa, калликреин, плазмин. У пациентов со злокачественными заболеваниями наблюдается снижение уровня антитромбина III.
Ингибитор пути тканевого фактора (TFPI) – основной ингибитор комплекса TF: VIIa. Сверхэкспрессия гепараназы индуцирует увеличение функционально неактивного TFPI в плазме.
III. Фибринолиз
Фибрин. У онкологических больных отложение фибрина вокруг опухолевых клеток является основным фактором развития венозных тромбозов, что связано с опухолевым ростом и метастазированием. Локальное отложение фибрина образует матрицу для роста опухоли и ангиогенеза. Фибрин представляет собой каркас для опухолевого роста, защищает опухолевые клетки от естественных клеток-киллеров и участвует в ангиогенезе. Опухолевые клетки экспрессируют на своей поверхности все белки, необходимые для регуляции фибринолитических путей. Дерегуляция в генерации нормальной фибринолитической активности наблюдалась у пациентов с солидными опухолями.
Д-димер. Среди лабораторных методов диагностики венозной тромбоэмболии наиболее важным является исследование Д-димера (чувствительность 90%). Высокий уровень Д-димера выявляется у большей части больных с опухолевыми заболеваниями.
Ингибитор активатора плазминогена‑1 (PAI‑1) – важный регулятор активности плазминогена. Сверхэкспрессия PAI‑1 наблюдается при различных типах опухолей.
Ингибитор фибринолиза, активированный тромбином (TAFI), блокирует связывание плазминогена с фибрином. Имеются данные о повышении уровня TAFI у пациентов с раком и тромбоэмболией.
Протеиназный ингибитор фибринолиза (α2-антиплазмин, α2-макроглобулин) секретируется в опухолевую микросреду (в высоких дозах) при раке с увеличением риска венозного тромбоэмболизма. Иммуногистохимическое исследование показало экспрессию ингибитора фибринолиза только в раковых клетках, что объясняет отсутствие фибринолитической активности в некоторых опухолях.
IV. Активация эндотелия
Кровеносные сосуды и эндотелиальные клетки играют важную роль в контроле процессов гемостаза, тромбоза и воспаления. Эндотелиальная тромборегуляция осуществляется путем селективной экспрессии медиаторов (молекул клеточной адгезии) в ответ на специфичность агонистов. Синтезированные медиаторы участвуют во всех фазах гемостаза и регулируют сосудистую реактивность. Интактный эндотелий является антикоагулянтом и обладает профибринолитическими свойствами в физиологических условиях. С точки зрения триады Вирхова эндотелий теряет свои тромборезистентные свойства при повреждении, например при повреждении стенки сосуда, механическом или химическом повреждении, воспалении. Злокачественный процесс вызывает дерегулирование эндотелиального гомеостаза, который можно более точно определить как активацию, а не повреждение, поскольку эндотелиальные клетки сохраняют свои функциональные свойства при отсутствии нарушения целостности ткани. Факторы активации эндотелия при злокачественном процессе включают в себя дисфункцию эндотелия (сверхэкспрессия адгезивных молекул), потерю антикоагулянтных и приобретение прокоагулянтных свойств, переключение на проангиогенный фенотип.
Сверхэкспрессия адгезивных молекул. Эндотелиальная экспрессия селектинов и лигандов из суперсемейства иммуноглобулинов увеличивается под влиянием опухоль-индуцированных цитокинов и клеточных взаимодействий. Опухоль-ассоциированные макрофаги выделяют TNF, IL‑1, IL‑6, IFN-γ, которые увеличивают экспрессию адгезивных молекул через активацию de novo синтеза мРНК. Увеличение экспрессии адгезивных молекул ICAM‑1, VCAM‑1 и E-селектина посредством NF-κB активации было обнаружено при совместном культивировании эндотелиальных и опухолевых клеток.
Тромбомодулин (ТМ) – важный эндотелиальный клеточный рецептор тромбина, который действует как прямой антикоагулянт. Связывание ТМ с тромбином активирует протеин С и инактивирует протеолитическое расщепление прокоагулянтных субстратов. Циркулирующие опухолевые цитокины уменьшают уровень ТМ, что приводит к расщеплению его молекулы и увеличивает эндотелиальную экспрессию. Существует обратная связь между экспрессией ТМ и клеточной пролиферацией in vivo. Сниженная регуляция при отсутствии экспрессии ТМ обнаружена в метастатических очагах. Интерференция системы тромбомодулин – протеин С, которая возникает в результате снижения ТМ, приводит к развитию приобретенной резистентности к протеину С, что является одним из факторов, обусловливающих приобретение эндотелием прокоагулянтных свойств.
В ответ на стимулы из микроокружения опухоли антагонистическое дерегулирование наблюдается в эндотелиальной экспрессии комплексов vWF/ADAMTS13, TF/TFPI, PAI‑1/активаторы плазминогена. Цитокин-активированный эндотелий высвобождает высокомолекулярные комплексы фактора фон Виллебранда, которые являются гиперактивными для агрегации тромбоцитов, образования тромбов и адгезии, тогда как экспрессия ADAMTS13 подавляется. Локальная прокоагулянтная активность эндотелия дополнительно усиливается действием гепараназы, которая индуцирует экспрессию TF и одновременно расщепляет его ингибитор TFPI с поверхности эндотелиальных клеток. Различные механизмы микрососудистой дисфункции в сочетании с активацией коагуляции являются основным патогенетическим фактором в развитии тромботической микроангиопатии при злокачественных новообразованиях. Некоторые важные компоненты системы гемостаза и их роль в биологии опухоли представлены в таблице.
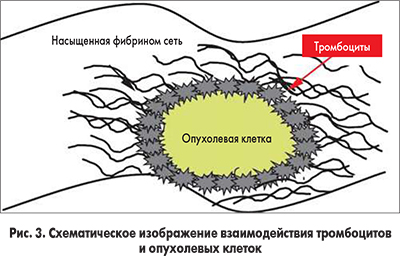 Тромбоциты. Опухолевые клетки содержат различные мембранные рецепторы, которые могут непосредственно связываться с тромбоцитами и приводить к их активации. При использовании проточной и флуоресцентной микроскопии было обнаружено наличие тромбоцит-опухолевых клеточных агрегатов in vitro и in vivo [26] (рис. 3).
Тромбоциты. Опухолевые клетки содержат различные мембранные рецепторы, которые могут непосредственно связываться с тромбоцитами и приводить к их активации. При использовании проточной и флуоресцентной микроскопии было обнаружено наличие тромбоцит-опухолевых клеточных агрегатов in vitro и in vivo [26] (рис. 3).
Рост опухоли зависит от ангиогенеза. В тромбоцитах хранятся различные факторы, регулирующие ангиогенез, такие как VEGF, FGF, эпидермальный, гепацитарный и инсулиноподобный факторы роста, ангиопоэтин, лизофосфатидная кислота, сфингозин‑1-фосфат, лиганд CD40, желатиназа А, матричные металлопротеиназы, гепараназа.
Было показано, что большинство из этих ангиогенных агентов прямо или косвенно участвуют в ангиогенезе. Тромбоциты также содержат антиангиогенные агенты, к которым относятся ангиостатин, тромбоспондин‑1, тромбоцитарный фактор 4, эндостатин, трансформирующий фактор роста β (TGF-β) и тканевой ингибитор матричных металлопротеиназ – TIMPs [27, 28].
Тромбоцитоз. Одной из основных причин развития опухолевого тромбоцитоза является увеличение продукции тканями хозяина и опухолью тромбоцитопоэтических цитокинов. Этот процесс опосредует синтез тромбопоэтина печенью, который усиливается в ответ на чрезмерную продукцию опухолью IL‑6, увеличивая тем самым количество тромбоцитов, в свою очередь способствующих росту опухоли [29].
Заключение
Онкологические пациенты имеют высокий риск тромботических осложнений, что связано с нарушением системы свертывания крови. У этих больных отмечаются повышенные уровни плазменных факторов коагуляции, таких как фибриноген (фактор I), факторы V, VIII, IX и X, и продуктов деградации фибрина/фибриногена, а также увеличение количества тромбоцитов (тромбоцитоз). При этом особый интерес представляет измерение конечных продуктов каскадных реакций, в том числе пептидов, высвобождающихся во время протеолитической активации системы коагуляции: фрагмент протромбина 1+2, пептид, активирующий протеин С, пептиды, активирующие факторы IX и X, фибринопептид А, тромбин-антитромбиновый комплекс, комплекс плазмин-антиплазмин и Д-димер.
В исследованиях последних лет показано, что высокий уровень этих маркеров коррелирует с тяжестью заболевания и плохим прогнозом. При этом степень гиперкоагуляции может спрогнозировать риск смерти от рака. Поэтому нарушения в системе гемостаза у онкологических больных требуют проведения ранней лабораторной диагностики и комплексной коррекции на всех этапах лечения.
Литература
1. Trousseau A. Phlegmasia alba dolens. Lectures on clinical medicine, delivered at the Hotel-Dieu, Paris / A. Trousseau. London: New Sydenham Society, 1872; 281-295.
2. Falanga A., Russo L. Epidemiology, risk and outcomes of venous thromboembolism in cancer. Hamostaseologie, 2012; 32(2): 115-125.
3. Magnus N., D’Asti E., Meehan B. et al. Oncogenes and the coagulation system-forces that modulate dormant and aggressive states in cancer. Thromb Res, 2014; 133(Suppl 2): S1-S9.
4. Falanga A., Marchetti M., Vignoli A. Coagulation and cancer: biological and clinical aspects. J Thromb Haemost, 2013; 11(2), 223-233.
5. Chu A.J. Tissue factor, blood coagulation, and beyond: an overview. Int J Inflam, 2011; 2011:367284.
6. Eisemann G., Stefanini M. Thromboplastic activity of leukemic white cells. Proc Soc Exp Biol Med, 1954; 86(4):763-5.
7. Gralnick H.R., Abrell E. Studies of the procoagulant and fibrinolytic activity of promyelocytes in acute promyelocytic leukaemia. Br J Haematol, 1973; 24(1): 89-99.
8. Shoji M., Hancock W.W., Abe K. et al. Activation of coagulation and angiogenesis in cancer: immunohistochemical localization in situ of clotting proteins and vascular endothelial growth factor in human cancer. Am J Pathol, 1998; 152(2): 399-411.
9. Contrino J., Hair G., Kreutzer D.L., Rickles F.R. In situ detection of tissue factor in vascular еndothelial cells: correlation with the malignant phenotype of human breast disease. Nat Med, 1996; 2(2): 209-15.
10. Rao L.V. Tissue factor as a tumor procoagulant. Cancer Metastasis Rev, 1992; 11(3-4): 249-66.
11. Rak J., Milsom C., May L. et al. Tissue factor in cancer and angiogenesis: the molecular link between genetic tumor progression, tumor neovascularization, and cancer coagulopathy. Semin Thromb Hemost, 2006; 32(1): 54-70.
12. Gordon S.G., Mourad A.M. The site of activation of factor X by cancer procoagulant. Blood Coagul Fibrinolysis, 1991; 2(6): 735-9.
13. Falanga A., Consonni R., Marchetti M. et al. Cancer procoagulant and tissue factor are differently modulated by all-trans-retinoic acid in acute promyelocytic leukemia cells. Blood, 1998; 92(1): 143-51.
14. Koizume S., Jin M.S., Miyagi E. et al. Activation of cancer cell migration and invasion by ectopic synthesis of coagulation factor VII. Cancer Res, 2006; 66(19): 9453-60.
15. Nash G.F., Walsh D.C., Kakkar A.K. The role of the coagulation system in tumour angiogenesis. Lancet Oncol, 2001; 2(10): 608-13.
16. Nierodzik M.L., Plotkin A., Kajumo F., Karpatkin S. Thrombin stimulates tumor-platelet adhesion in vitro and metastasis in vivo. J Clin Invest, 1991; 87(1): 229-36.
17. Zwicker J.I., Furie B.C., Furie B. Cancer-associated thrombosis. Crit Rev Oncol Hematol, 2007; 62(2): 126-36.
18. Vormittag R., Simanek R., Ay C. et al. High factor VIII levels independently predict venous thromboembolism in cancer patients: the cancer and thrombosis study. Arterioscler Thromb Vasc Biol, 2009; 29(12): 2176-81.
19. Van De Water L., Tracy P.B., Aronson D. et al. Tumor cell generation of thrombin via functional prothrombinase assembly. Cancer Res, 1985; 45(11 Pt 1): 5521-5.
20. Tinholt M., Viken M.K. Common genetic polymorphisms in the coagulation factors 5 and 10 genes are associated with risk of breast cancer and correlate with increased coagulation activity (121/3290F). Presented at the Annual Meeting of the American Society of Human Genetics, Boston, MA, October 25, 2013.
21. Hettasch J.M., Bandarenko N., Burchette J.L. et al. Tissue transglutaminase expression in human breast cancer. Lab Invest, 1996; 75(5): 637-45.
22. Van Marion A.M., Auwerda J.J., Lisman T. et al. Prospective evaluation of coagulopathy in multiple myeloma patients before, during and after various chemotherapeutic regimens. Leuk Res, 2008; 32(7): 1078-84.
23. Kirwan C.C., McDowell G., McCollum C.N. et al. Early changes in the haemostatic and procoagulant systems after chemotherapy for breast cancer. Br J Cancer, 2008; 99(7): 1000-6.
24. Falanga A., Tartari C.J., Marchetti M. Microparticles in tumor progression. Thromb Res, 2012; 129(Suppl. 1): S132-6.
25. Nadir Y., Brenner B. Heparanase multiple effects in cancer. Thromb Res, 2014; 133(Suppl. 2): S90-4.
26. Palumbo J.S., Talmage K.E., Massari J.V. et al. Platelets and fibrin(ogen) increase metastatic potential by impeding natural killer cellmediated elimination of tumor cells. Blood, 2005; 105: 178-185.
27. Italiano-Jr. J.E., Richardson J.L., Patel-Hett S. et al. Angiogenesis is regulated by a novel mechanism: pro- and antiangiogenic proteins are organized into separate platelet alpha granules and differentially released. Blood, 2008; 111: 1227-1233.
28. Peterson J.E., Zurakowski D., Italiano-Jr J.E. et al. Normal ranges of angiogenesis regulatory proteins in human platelets. Am J Hematol, 2010; 85: 487-493.
29. Stone R.L., Nick A.M., McNeish I.A. et al. Paraneoplastic thrombocytosis in ovarian cancer // N Engl J Med, 2012; vol. 366: 610-618.
Тематичний номер «Онкологія» № 4 (50), жовтень 2017 р.