16 листопада, 2017
Сахарат железа в лечении анемии у пациентов с хронической почечной недостаточностью
21-22 сентября в Виннице состоялся V съезд нефрологов Украины, в котором, помимо профильных специалистов, принимали участие также урологи, врачи общей практики – семейной медицины, реаниматологи, хирурги, трансплантологи и др.

В рамках мероприятия было заслушано много докладов, посвященных наиболее актуальным проблемам нефрологии. Среди выступлений, вызвавших у присутствующих особый интерес, был доклад руководителя отдела эфферентных технологий ГУ «Институт нефрологии НАМН Украины» (г. Киев), доктора медицинских наук, профессора Ирины Алексеевны Дударь, которая подробно остановилась на проблеме коррекции анемии у пациентов с хронической почечной недостаточностью (ХПН).
– Анемия является наиболее частым коморбидным состоянием, осложняющим течение хронической болезни почек (ХБП). По мере прогрессирования ХБП распространенность анемии возрастает и достигает максимума в популяции больных, получающих почечнозаместительную терапию. Согласно результатам международных исследований, от 23 до 77% пациентов с ХПН VД стадии имеют снижение уровня гемоглобина ниже целевых значений. По сведениям, полученным из Почечной базы данных США (United States Renal Data System – USRDS), частота случаев анемии среди пациентов диализных центров составляет 58%. Высокая распространенность анемии, ее негативное влияние на течение ХБП, прогноз и качество жизни больных стимулируют непрерывный поиск эффективных средств для коррекции этого состояния.
Железодефицит считается основной причиной снижения концентрации гемоглобина, миоглобина, уменьшения активности цитохромов, пероксидазы, нуклеозидных редуктаз, каталазы у пациентов с ХБП. Однако, помимо снижения уровня гемоглобина, дефицит железа приводит к дисфункции вышеперечисленных ферментных систем. Низкий уровень гемоглобина ассоциирован с более быстрыми темпами падения почечной функции.
При ведении таких пациентов следует руководствоваться клиническими практическими рекомендациями по анемии при ХБП, разработанными инициативной группой по улучшению глобальных исходов заболеваний почек (Kidney Disease: Improving Global Outcomes – KDIGO) (2012). Согласно указанным рекомендациям проведение скрининга необходимо у всех пациентов с ХБП.
У больных без анемии концентрацию гемоглобина необходимо измерять:
• 1 р/год (у пациентов с ХБП ІІІ);
• не реже 2 р/год (у пациентов с ХБП IV-V до диализа);
• каждые 3 мес (у пациентов с ХБП V на гемодиализе и перитонеальном диализе).
У больных с анемией, не получающих лечения эритропоэзстимулирующими средствами (ЭСС), концентрацию гемоглобина необходимо измерять:
• каждые 3 мес (у пациентов с ХБП III-V до диализа и на перитонеальном диализе);
• ежемесячно (у пациентов с ХБП V на гемодиализе).
При наличии клинических показаний определение уровня гемоглобина проводят чаще.
- Анемию диагностируют у взрослых пациентов и детей старше 15 лет с ХБП, если концентрация гемоглобина <130 г/л у мужчин и <120 г/л у женщин. У пациентов детского возраста с ХБП диагноз «анемия» устанавливают в случае, если концентрация гемоглобина:
• <110 г/л (у детей от 1,5 до 5 лет);
• <115 г/л (у детей 5-12 лет);
• 120 г/л (у детей 12-15 лет).
Пациентам с ХБП, у которых выявлена анемия, показано расширенное обследование: клинический анализ крови, включающий концентрацию гемоглобина, индексы эритроцитов, количество и дифференциальный подсчет лейкоцитов, количество тромбоцитов; абсолютное число ретикулоцитов; уровень ферритина сыворотки; насыщение трансферрина сыворотки (НТС); уровни витамина В12 и фолатов в сыворотке.
Существует два важных аспекта оценки состояния обмена железа: наличие запасов железа в депо и доступность железа для эффективного эритропоэза. Уровень сывороточного ферритина указывает на степень запасов железа. НТС, которое рассчитывается по формуле: насыщение трансферрина × 100 / общую железосвязывающую способность сыворотки. НТС – маркер доступности железа для эритропоэза. На уровень сывороточного ферритина влияет воспаление; поскольку он является реактантом острой фазы, его величину надо осторожно интерпретировать у пациентов с ХБП, особенно диализных, так как у них может присутствовать субклиническое воспаление.
Своевременная коррекция анемии и достижение целевых значений уровня гемоглобина положительно влияют на замедление темпов прогрессирования ХПН, снижение риска госпитализаций, наступления кардиоваскулярных событий и смерти от всех причин. Кроме того, нескорригированный дефицит железа понижает чувствительность к терапии ЭСС. Адекватное количество доступного железа стимулирует эритропоэз и уменьшает потребность в эритропоэтине (Rozen-Zvi B. et al., 2008).
У пациентов с ХБП и анемией, не получающих лечения железом или ЭСС, рекомендуется проводить пробную терапию внутривенными препаратами железа (или 1-3-месячный курс пероральных железосодержащих препаратов на додиализных стадиях ХБП) в случаях, когда требуется увеличить концентрацию гемоглобина без начала терапии ЭСС, при этом НТС ≤30% и ферритин ≤500 нг/мл (мкг/л).
У пациентов с ХБП на терапии ЭСС, не получающих дополнительного лечения железом, рекомендуется проведение пробной терапии внутривенными препаратами железа (или 1-3-месячный курс пероральных препаратов железа на додиализных стадиях ХБП), если требуется увеличить концентрацию гемоглобина или снизить дозу ЭСС, при этом НТС ≤30% и ферритин ≤500 нг/мл (мкг/л) (KDIGO, 2012).
Результаты сравнительных исследований говорят о существенных преимуществах парентеральных препаратов железа в гемодиализной популяции. Сегодня наиболее безопасным соединением железа для парентерального введения является железа сахарат. В базе данных FDA (Food and Drug Administration – Управление по контролю качества пищевых продуктов и лекарственных средств США) – наибольшая частота нежелательных побочных реакций (в т. ч. летальных) ассоциирована с применением декстранов железа и натрий-железоглюконатного комплекса (25-30 и 11% случаев соответственно). В свою очередь, препараты железосахарозного комплекса вызывали нежелательные побочные явления менее чем в 5% случаев.
- По данным Wysowski и соавт. (2010), железа сахарат в отличие от декстранов железа и натрий-глюконатного комплекса железа характеризуется наименьшей частотой побочных эффектов (в т. ч. серьезных и летальных), госпитализаций и вмешательств, связанных с возникшими на фоне приема препарата побочными явлениями.
Частота возникновения нежелательных побочных реакций напрямую коррелирует с дозой препарата. Ранее считалось, что введение высоких доз (до 1000 мг) 1 р/нед оптимально для насыщения депо железа и повышения уровня гемоглобина. Сегодня подобная тактика считается нецелесообразной. В исследованиях показано, что доза ≥400 мг достоверно повышает риск возникновения кардиоваскулярной патологии, серьезных побочных реакций, смерти от любых причин (на 21%), смерти вследствие сердечно-сосудистых событий (на 41%) (Ballie B. et al., 2010).
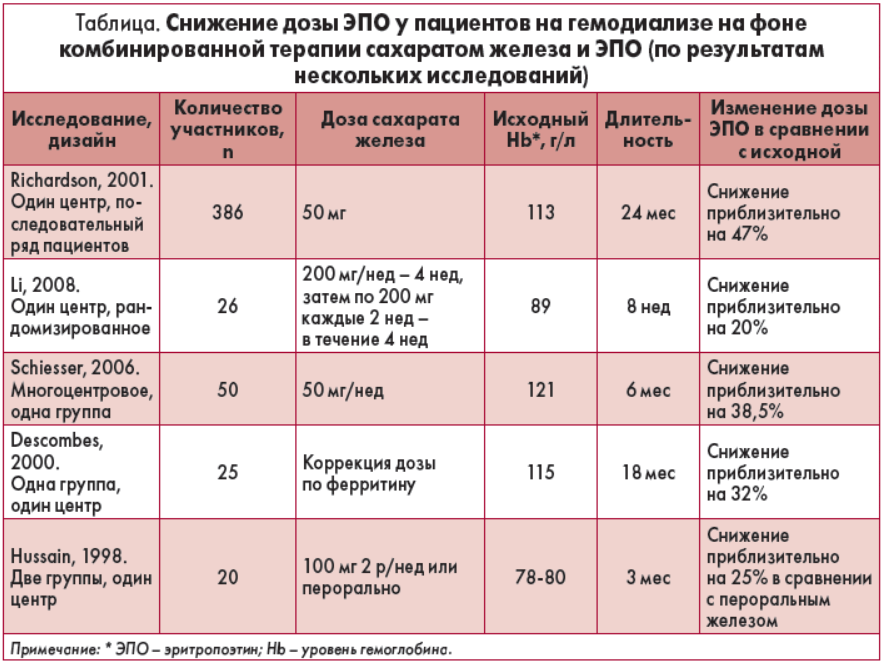
К настоящему времени накоплено достаточно убедительных доказательств эффективности парентеральных препаратов сахарата железа (табл.).
На украинском фармацевтическом рынке сахарат железа представлен препаратом Суфер® (железа (III) гидроксид сахарозный комплекс) производства ООО «Юрия-Фарм». Суфер® выпускают в форме раствора для инъекций, который содержит железо в концентрации 20 мг/мл.
Нами проведено собственное исследование эффективности и безопасности применения препарата Суфер® для коррекции анемии у пациентов с ХБП VД стадии, находящихся на гемодиализе и не получающих ЭСС. В исследовании приняли участие 30 пациентов; за неделю до начала лечения был проведен скрининг, затем последовала 4-недельная терапия препаратом Суфер®, через 2 нед (±4 дня) после введения последней дозы Суфера больные прошли заключительное обследование. Препарат вводили внутривенно капельно в дозе 200 мг 3 р/нед, предварительно растворив его в 0,9% растворе хлорида натрия в соотношении 1:20. Обязательным условием лечения являлось отсутствие нежелательных явлений на введение первой тест-дозы препарата.
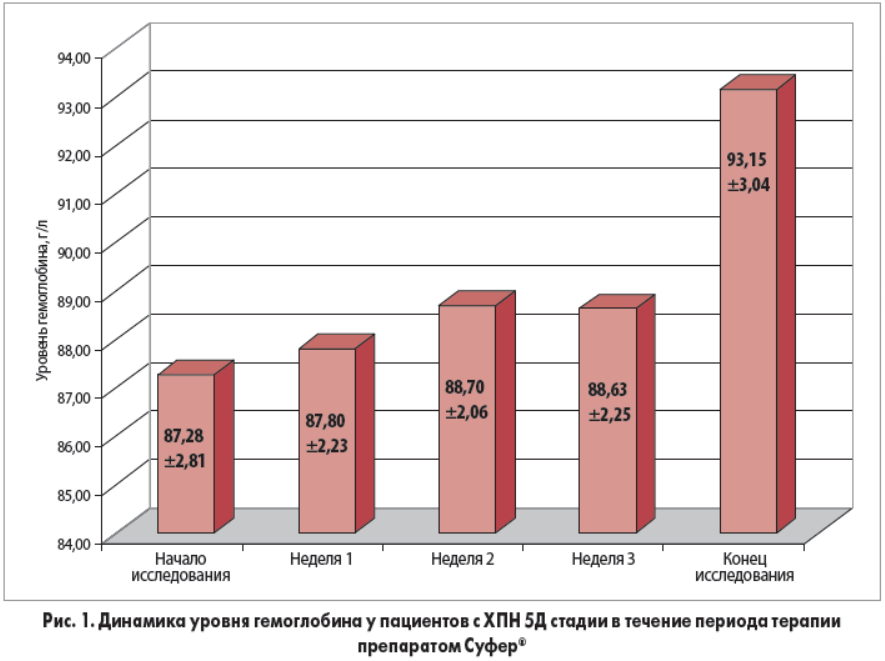
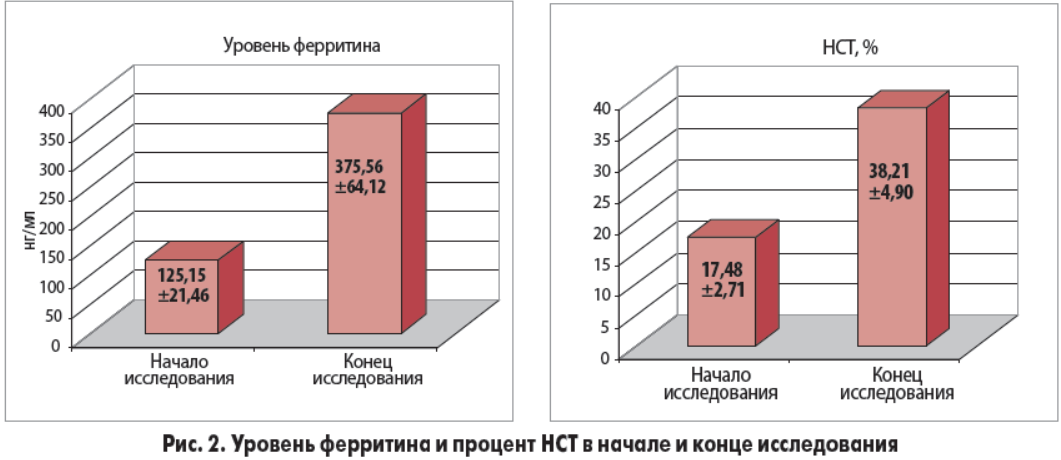
В ходе исследования было установлено, что ферротерапия с использованием препарата Суфер® сопровождалась достоверным увеличением уровня гемоглобина (рис. 1), сывороточного ферритина (р<0,001) и ростом степени НСТ (р<0,001) (рис. 2). Прирост гемоглобина за 4 нед терапии в среднем составил 5,9 г/л. Средний уровень ферритина повысился с 125,15±21,46 до 375,56±64,12 нг/мл, уровень НТС – с 17,48±2,71 до 38,21±4,9%.
- Внутривенное введение сахарозного комплекса гидроксида железа (III) позволило в 76,67% случаев достичь у пациентов целевых значений ферритина и НТС, а в 40% – целевого уровня гемоглобина.
Препарат хорошо переносился пациентами, побочных явлений не зафиксировано. По результатам данного исследования был сделан вывод, что препарат Суфер® (железа (III) гидроксид сахарозный комплекс) – эффективен и безопасен в лечении больных ХПН, сопровождающейся железодефицитной анемией.
Диагностика обмена железа является общепринятым методом обследования получающих гемодиализ пациентов с анемией. Коррекция железодефицита – первый шаг в лечении этого состояния. При выборе препаратов железа для терапии пациентов с диализными стадиями ХБП предпочтение следует отдавать парентеральным формам, наиболее безопасной из которых является железа сахарат. Препарат Суфер® (железа (III) гидроксид сахарозный комлекс) производства ООО «Юрия-Фарм» – эффективное и безопасное средство коррекции железодефицита у этой когорты пациентов.
Подготовила Мария Маковецкая
Медична газета «Здоров’я України 21 сторіччя» № 20 (417), жовтень 2017 р.