4 грудня, 2017
Перекрестки нейроэндокринологии
.jpg) 25-27 апреля в г. Трускавце прошла XIX Международная конференция «Возрастная стратегия профилактики, терапии и реабилитации в неврологии». В рамках мероприятия много внимания было уделено лечению пациентов с сочетанными заболеваниями. О когнитивных нарушениях, развивающихся при острых нарушениях мозгового кровообращения (ОНМК) на фоне сахарного диабета (СД) 2 типа, рассказала заведующая кафедрой неврологии № 2 Харьковского национального медицинского университета, доктор медицинских наук, профессор Елена Леонидовна Товажнянская.
25-27 апреля в г. Трускавце прошла XIX Международная конференция «Возрастная стратегия профилактики, терапии и реабилитации в неврологии». В рамках мероприятия много внимания было уделено лечению пациентов с сочетанными заболеваниями. О когнитивных нарушениях, развивающихся при острых нарушениях мозгового кровообращения (ОНМК) на фоне сахарного диабета (СД) 2 типа, рассказала заведующая кафедрой неврологии № 2 Харьковского национального медицинского университета, доктор медицинских наук, профессор Елена Леонидовна Товажнянская.
В начале своего доклада профессор обратила внимание, что под термином «нейроэндокринный перекресток» следует понимать взаимоотягощающее влияние трех весомых и социально значимых патологий – СД 2 типа, инсульта и когнитивного дефицита. Какое же действие оказывают данные заболевания друг на друга?
На сегодняшний день хорошо известно, что СД является независимым фактором риска развития как инсульта, так и когнитивного дефицита, повышая риск развития и той, и другой патологии более чем в 2 раза. Кроме того, инсульт также является самостоятельным и независимым фактором риска развития постинсультных когнитивных нарушений (ПИКН), увеличивая риск возникновения когнитивной дисфункции, включая деменцию, более чем в 2 раза. В свою очередь, когнитивная дисфункция очень негативно влияет на течение постинсультного периода и СД. Действительно, пациент с когнитивным нарушением не в состоянии четко, адекватно и правильно выполнять все рекомендации невролога, эндокринолога, а также других смежных специалистов. Несомненно, к лечению пациентов с СД необходимо подключать и кардиолога, поскольку артериальная гипертензия и ишемическая болезнь сердца встречаются у большинства таких больных.
Статистические взаимосвязи СД 2 типа, инсульта и когнитивного дефицита имеют и свои патогенетические предпосылки. Прежде всего следует обратить внимание на определенные особенности типов инсульта при диабете. Как уже было сказано выше, распространенность инсульта у лиц с диабетом существенно возрастает. Однако это касается в первую очередь ишемического инсульта, заболеваемость которым среди больных СД 2 типа составляет 44,9 случая на 1 тыс. человек, тогда как в общей популяции данный показатель составляет 22,7 случая на 1 тыс. человек. В то же время риск развития геморрагического инсульта практически не отличается от общепопуляционного риска. Таким образом, у лиц с СД наблюдается смещение соотношения распространенности ишемического и геморрагического инсульта в сторону первого – 11:1.
Среди подтипов клинически значимого инсульта у пациентов с диабетом чаще встречается атеротромботический инсульт, обусловленный диабетической макроангиопатией мозговых сосудов. При этом его распространенность в каротидном бассейне существенно выше (в 2,5 раза), чем в вертебробазилярном.
Церебральные инфаркты при СД (по данным магнитно-резонансной томографии) встречаются в 3,5 раза чаще, чем регистрируются клинически значимые ишемические инсульты. При этом более чем в 50% случаев это лакунарные инфаркты, в 25% – кортикальные или субкортикальные (>20 мм в диаметре), в 20% – сочетание лакунарных и других инфарктов.
Повышение уровня глюкозы в крови может быть реактивной транзиторной реакцией в ответ на выраженный стресс у лиц без СД, быть проявлением ранее диагностированного СД, манифестацией СД у лиц с ранее не выявленным заболеванием. Связь между гипергликемией и неблагоприятным исходом после инсульта в первую очередь касается инфарктов крупных сосудов, однако она менее очевидна при лакунарном инсульте.
Не следует забывать, что течение инсульта у лиц с СД характеризуется более тяжелым течением, более длительным и неполным восстановлением неврологических функций. Большинство исследователей сходятся во мнении, что основной причиной данных нарушений является гипергликемия, которая в остром периоде инсульта может протекать в трех вариантах:
- реактивная, транзиторная реакция у лиц без СД в ответ на выраженный стресс;
- проявление ранее диагностированного СД;
- манифестация СД у лиц с ранее не выявленным заболеванием.
Гипергликемия оказывает отрицательное влияние на метаболические процессы в пенумбре – зоне ишемии, которая потенциально может восстановиться. Этот эффект реализуется за счет нескольких механизмов:
- нарушение восстановления проходимости сосуда вследствие активации тканевых факторов, дисбаланса системы тромбин-антитромбин, повышения коагуляции;
- снижение реперфузии (снижение уровня оксида азота и повышение простациклинов с последующей вазоконстрикцией);
- углубление реперфузионного повреждения (усиление выраженности оксидативного стресса и воспалительного ответа, рост уровня цитокинов, что приводит к повреждению нейронов, отеку ткани мозга и нарушению проницаемости гематоэнцефалического барьера);
- прямое повреждение, обусловленное дисфункцией митохондрий, активацией анаэробного гликолиза и развитием лактатацидоза, энергодефицитом.
Для выявления как гипо-, так и гипергликемии у больных с ОНМК необходим тщательный мониторинг и контроль уровня глюкозы крови, поскольку от данных мероприятий может существенно зависеть дальнейшее течение заболевания. Коррекцию гипергликемии рекомендуется проводить при уровне глюкозы в крови >10 ммоль/л в первые сутки ОНМК, а по истечении 48 ч – >8,2 ммоль/л.
Согласно статистическим данным, пик гипергликемических состояний приходится на вторые сутки от начала инсульта. Дальнейшая динамика гликемии имеет определенное прогностическое значение. Гипергликемия в первые сутки ОНМК, которая самостоятельно нормализуется в течение 48 ч, считается предиктором последующего благоприятного исхода. Стабильная или прогрессирующая гипергликемия часто является предвестником летального исхода. Гипергликемия в сочетании с инсулинорезистентностью и нормальным содержанием уровня кортизола в крови также считается прогностически неблагоприятным фактором.
Нарушения, развивающиеся после перенесенного инсульта (двигательные и когнитивные, психологические, нарушения речи, судорожный синдром, невропатическая боль), хорошо известны. Наиболее распространенными из них являются двигательные и когнитивные нарушения, развивающиеся более чем у половины пациентов. Столь высокую частоту когнитивных нарушений объясняют результаты исследования, проведенного X. Chen и соавт. (2014). Было показано, что нейрональное повреждение при инсульте возникает не только в зоне острой церебральной ишемии, но и в неишемизированных участках головного мозга, имеющих тесные синаптические связи с первичным очагом поражения. Прежде всего это гиппокамп, таламус, черная субстанция – то есть структуры, отвечающие за различные аспекты когнитивного функционирования.
Таким образом, возможны два варианта развития постинсультных когнитивных нарушений. При первом варианте ишемизации подвергаются «стратегически важные» мозговые структуры, тесно связанные с регуляцией когнитивной деятельности (префронтальная кора, медиальные отделы височных долей, таламус, базальные ганглии (хвостатое ядро, бледный шар), прилегающее белое вещество, область стыка затылочной, височной и теменной коры (угловая извилина). В этих случаях выраженные когнитивные нарушения развиваются остро с последующей стабилизацией.
Однако чаще всего встречается второй вариант, когда ишемическое повреждение развивается не в стратегически важных зонах, а в тех, которые связаны синаптическими связями с зонами когнитивного функционирования. В этом случае когнитивная дисфункция развивается медленно и может постепенно прогрессировать в течение 6-7 мес после перенесенного инсульта. Именно такой вариант развития постинсультных когнитивных нарушений часто ускользает от внимания врачей. Своевременное их выявление чрезвычайно важно у пациентов с СД, поскольку и сам диабет является независимым фактором риска нарушения когнитивных функций.
Патогенез когнитивной дисфункции при СД достаточно изучен и связан прежде всего с сосудистыми и метаболическими нарушениями. Ведущую роль в формировании когнитивной дисфункции при СД отводят инсулинорезистентности, сопровождающейся стимуляцией катаболизма структурных белков в силу недостатка поступления глюкозы в клетку. Считается, что инсулинорезистентность является основной причиной накопления в нейронах β-амилоида, усиленного фосфорилированием τ-протеина и, как следствие, – нейродегенерации.
Гипергликемия приводит к гликозилированию белковых молекул внутри клетки и снижению их функциональной активности.
Также свой вклад в формирование когнитивных расстройств при СД вносят микро- и макроангиопатии. Гипергликемия приводит к ряду изменений в сосудистой стенке (повреждению базальной мембраны, изменению эндотелия, развитию склероза и гиалиноза), нарушению системы свертывания крови, замедлению кровотока и микротромбированию сосудов. Атеросклеротические изменения (макроангиопатия) при диабете носят диффузный, многосегментарный и двусторонний характер. Часто встречается крупносегментарный и циркулярный медиакальциноз и кальцифицирующий склероз (набухание стенок артерий, пропитывание их солями кальция).
Для пациентов с СД 2 типа, перенесших ОНМК, характерны определенные особенности когнитивной дисфункции. Если ее причиной является сосудистая катастрофа, то, скорее всего, будут наблюдаться снижение скорости психомоторных реакций, обработки информации, речевой активности; нарушение внимания; проблемы воспроизведения при относительно сохранном процессе запоминания.
Если основной причиной когнитивного дефицита является СД, на первый план выступят нарушения памяти.
Диагностический комплекс пациентов с СД и ОНМК должен включать тщательный мониторинг уровня глюкозы крови и оценку уровня HbA1c, балльную оценку по шкалам, нейровизуализацию, ультразвуковую допплерографию сосудов, лабораторное исследование. Следует учитывать, что при СД могут развиваться и другие связанные с данным заболеванием острые состояния, которые по своей клинической картине сходны с инсультом. Это гипогликемия, гипергликемия и гиперосмолярность.
Гипогликемия обычно манифестирует признаками адренергической активности (потливость и тахикардия), очаговыми неврологическими проявленими, возникающими до еды или после физической нагрузки (гипогликемия до 2-2,5 ммоль/л).
Гипергликемия (уровень сахара крови >8 ммоль/л при разовом исследовании или >6,7 ммоль/л при мониторировании) наблюдается у 43% пациентов с острым инсультом.
Гиперосмолярность при гипергликемии ведет к уменьшению мозгового кровотока, фокальному неврологическому дефициту, нарушению сознания (гликемия >25-40 ммоль/л и осмолярность плазмы >320 ммоль/л при отсутствии значимого кетоацидоза).
Таким образом, дифференциальный диагноз инсульта и метаболических нарушений легко осуществить с помощью определения уровня гликемии.
Неотложную помощь при инсульте у больных с СД оказывают по традиционным алгоритмам интенсивной терапии. Они предполагают контроль артериального давления, температуры тела, насыщения кислородом, гликемии; стабилизацию водно-электролитного баланса; электрокардиографический мониторинг. Для реканализации сосудов при ишемическом инсульте могут применяться тромболизис, антикоагулянты, ингибиторы агрегации тромбоцитов. С целью предупреждения образования или уменьшения вторичного поражения нейронов назначают антигипоксанты и нейропротекторы. Более быстрого и полного восстановления неврологических функций можно достичь благодаря проведению ранней нейрореабилитации (речевой, двигательной).
В настоящее время отсутствуют доказательства того, что агрессивное снижение уровня глюкозы улучшает клинические исходы при остром инсульте, о чем свидетельствуют результаты таких крупных исследований, как GIST-UK и NICE-SUGAR. Сейчас проводится фундаментальное исследование III фазы SHINE, в котором сравнивают стандартный подход к контролю глюкозы и интенсивный контроль глюкозы у пациентов с гипергликемией и острым ишемическим инсультом.
Очень важным моментом в терапии инсульта у пациентов с СД является выбор нейропротектора. С учетом сложности патофизиологического каскада при ишемическом инсульте одной из перспективных терапевтических стратегий является выбор препарата с мультимодальным действием, направленным на ряд ключевых механизмов ишемического каскада. Следует принимать во внимание, что когнитивные нарушения при СД 2 типа представляют собой гетерогенную патологию, сочетающую сосудистые нарушения мозга и нейродегенеративные процессы. Поэтому перспективной может быть смешанная патогенетическая терапия с использованием препаратов нейропротекторного и антиапоптотического действия. Желательно, чтобы эти эффекты были реализованы в одном препарате, поскольку пациенты с СД 2 типа уже принимают достаточно много других лекарственных средств (сахароснижающие, антигипертензивные, гиполипидемические и др.). Таким препаратом является Актовегин. Он обладает нейропротекторными, метаболическими и микроциркуляторными эффектами, то есть оказывает положительное влияние на течение инсульта, СД и когнитивных нарушений.
Указанные особенности Актовегина были подтверждены результатами нескольких многоцентровых рандомизированных плацебо-контролируемых исследований. В частности, исследованиями по изучению эффективности Актовегина при диабетической полинейропатии, постинсультных когнитивных нарушениях и когнитивных расстройствах в целом.
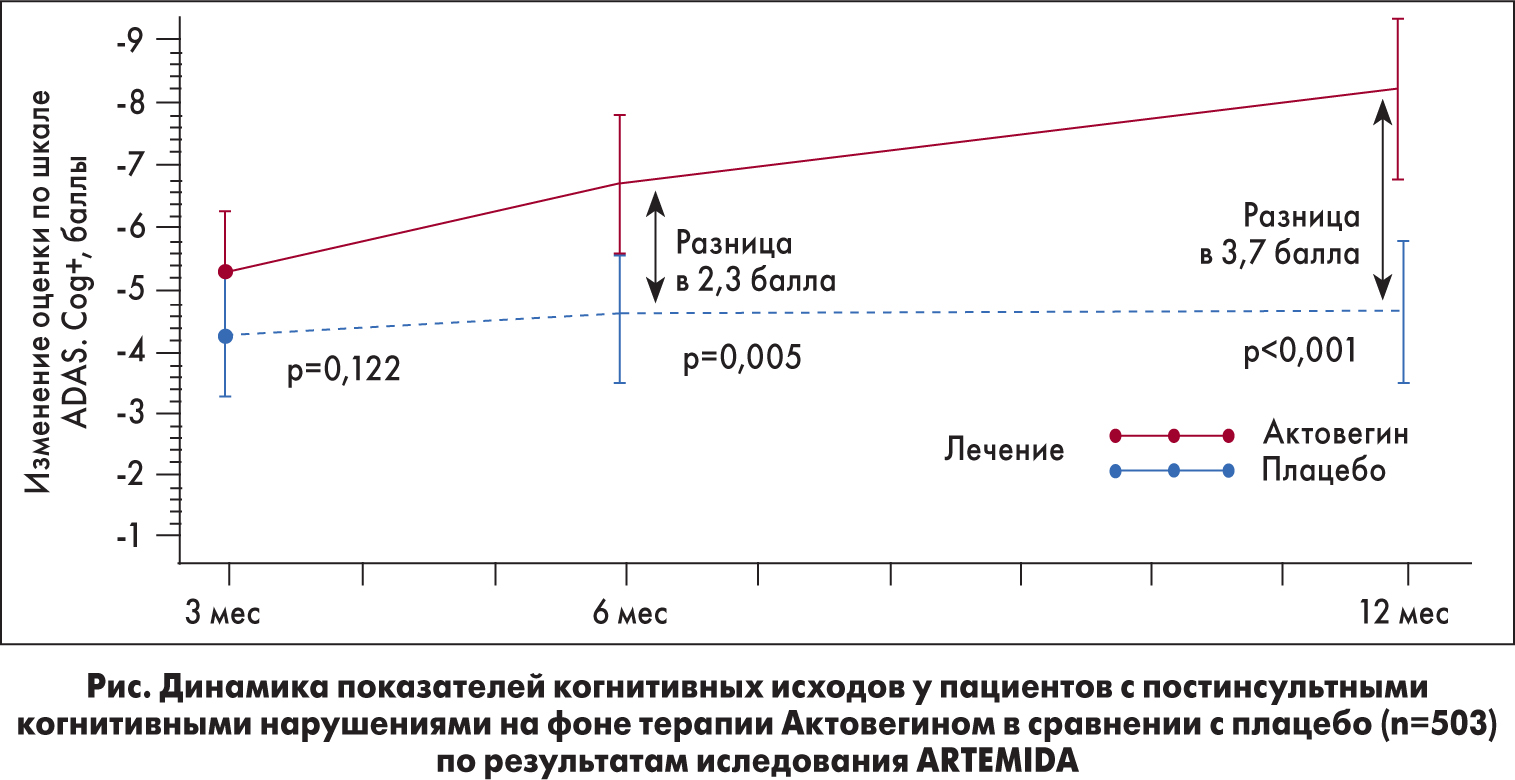
Возможность улучшения когнитивной функции с помощью препарата Актовегин у пациентов с постинсультными когнитивными нарушениями была продемонстрирована в исследовании ARTEMIDA. Для участия в нем были отобраны 503 пациента, у которых с момента развития инсульта, подтвержденного с помощью компьютерной или магнитно-резонансной томографии, прошло не более 6 дней. Пациенты были рандомизированы в 2 группы – для применения Актовегина и для приема плацебо. Пациенты группы активной терапии в течение 6 мес принимали Актовегин по следующей схеме: в дозе 2000 мг/сут внутривенно до 20 дней с последующим переходом на перораль-ный прием препарата в дозе 1200 мг/сут. Пациенты контрольной группы по такой же схеме получали плацебо.
Оценку влияния Актовегина на выраженность когнитивных нарушений проводили по завершении фазы активной терапии (через 6 мес) и в конце периода наблюдения (через 12 мес). Первичной конечной точкой исследования считали изменение оценки расширенной версии когнитивной подшкалы шкалы оценки тяжести болезни Альцгеймера (ADAS-cog+) через 6 мес лечения по сравнению с исходным значением. Результаты исследования ARTEMIDA продемонстрировали, что Актовегин достоверно улучшает когнитивный статус у пациентов с постинсультными когнитивными нарушениями по окончании курса терапии. Следует отметить, что разница между группами по степени восстановления когнитивных функций в последующие 6 мес наблюдения не только сохранялась, но еще больше увеличивалась (рис.). Препарат отличался благоприятным профилем безопасности и хорошо переносился пациентами.
Около 20% пациентов, включенных в данную клиническую группу, имели СД, поэтому результаты, полученные в указанном исследовании, можно экстраполировать на пациентов с СД, у которых развилось ОНМК.
Таким образом, патогенетическая, нейропротекторная и метаболическая терапия с использованием препарата Актовегин помогает нивелировать церебральные нарушения у пациентов с СД, перенесших инсульт.
Подготовил Вячеслав Килимчук
Статья печатается при поддержке компании ООО «Такеда Украина»
Тематичний номер «Діабетологія, Тиреоїдологія, Метаболічні розлади» № 3 (39), жовтень 2017 р.