13 грудня, 2017
Дифференциация и активация остеокластов
Остеокласты – это специализированные клетки, образующиеся из гематопоэтической линии моноцитов/макрофагов, которые развиваются и прикрепляются к матрице кости, выделяя далее кислоты и литические ферменты, разрушающие кость. Открытие в системе остеокластов сигнального пути RANK обеспечило понимание механизмов остеокластогенеза и активации резорбции кости, а также путей гормонального влияния на структуру и массу костной ткани. Дальнейшее изучение этого сигнального пути способно создать молекулярную основу с целью разработки медикаментов для лечения остеопороза и других заболеваний, сопровождающихся потерей костной массы.
Кость является ригидным, однако динамичным органом, который постоянно формируется, обновляется и восстанавливается. Микроструктура кости построена таким образом, чтобы обеспечить максимальную прочность на фоне минимальной массы соответственно физиологическим потребностям организма. Как же поддерживаются структура кости и ее функции? Как индуцируются изменения в метаболизме костной ткани? После формирования кость подлежит процессу под названием ремоделирование, который включает разрушение (резорбцию) и образование (синтез) костной ткани. Эти процессы в микромасштабе происходят во всем скелете. Ремоделирование кости – основной метаболический процесс, регулирующий ее структуру и функции на протяжении взрослой жизни. Ключевыми участниками ремоделирования являются остеокласты [1, 2]. Дисбаланс в ремоделировании способен привести к значительным нарушениям структуры и функции скелета, а потенциально – к увеличению смертности и сокращению длительности жизни.
Большинство заболеваний скелета у взрослых являются следствием чрезмерной активности остеокластов, ведущей к дисбалансу ремоделирования с преобладанием резорбции [3]. Подобные болезни включают остеопороз, заболевания периодонта, ревматоидный артрит, множественную миелому, метастазы раковых опухолей. Для лиц с остеопорозом переломы костей непосредственно угрожают жизни. На данный момент в группе риска подобных переломов находятся более 70 млн людей во всем мире. Недавние открытия, касающиеся понимания дифференциации и активации остеокластов, основываются на анализе семейства биологически связанных протеинов, подобных фактору некроза опухолей (ФНО) и его рецепторам (ФНОР): остеопротегерина (OPG), рецептораактиватора ядерного фактора кB (RANK) и его лиганда (RANKL), которые регулируют функцию остеокластов [4]. Исследование этих сигнальных путей обеспечивает глубокое понимание того, как различные физиологические и патофизиологические сигналы осуществляют свое действие, индуцируя остеокластогенез, рассасывание кости и ремоделирование скелета, таким образом контролируя массу костной ткани.
Остеокластогенез
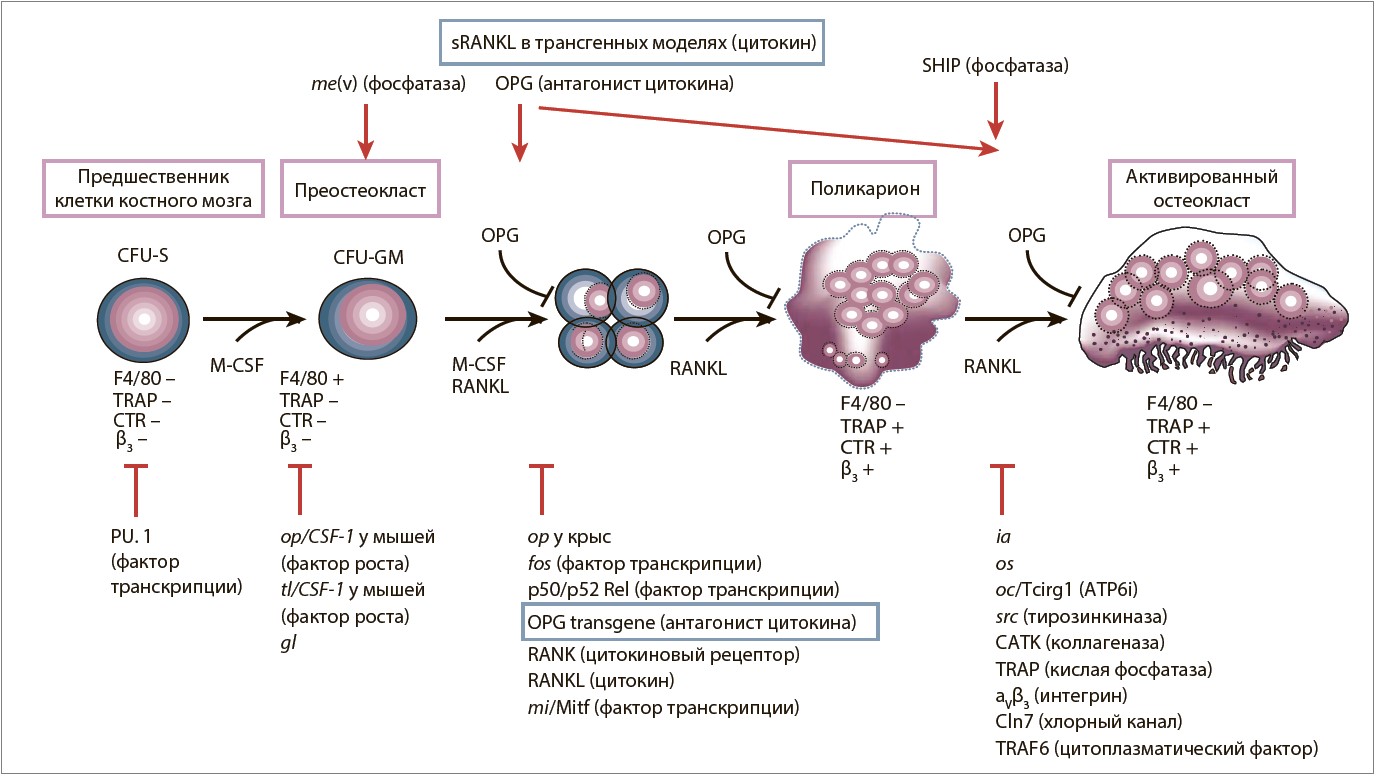
Остеокласт является тканеспецифической макрофагальной многоядерной клеткой (поликарионом), образующейся в процессе дифференциации клетокпредшественников моноцитов/макрофагов на поверхности кости или поблизости от нее (рис. 1). Существенный прогресс в понимании остеокластогенеза произошел тогда, когда в клеточных системах на основе клеток костного мозга или селезенки и стромальных клеток были получены остеокласты [5]. Тогда был сделан вывод, что для остеокластогенеза требуется тесный контакт между стромальными клетками и клетками костного мозга. Для остеокластогенеза необходимы два гемопоэтических фактора: ФНОродственный цитокин RANKL и полипептидный фактор роста CSF‑1 (колониестимулирующий фактор‑1) [6, 7], а далее происходит активация RANK на поверхности клетокпредшественников [8, 9]. Для экспрессии генов, типизирующих линию остеокластов, необходимо присутствие и CSF‑1, и RANKL.
Рис. 1. Остеокластогенез
Схема развития и дифференциации гемопоэтической клетки-предшественника в зрелые остеокласты – поликарионы (многоядерные клетки), образовавшиеся в результате слияния 10-20 отдельных клеток. Созревание происходит в костной ткани из одноядерных клеток с некоторыми чертами макрофагов, роисходящих из периферической крови. Для остеокластогенеза необходимы колониестимулирующий фактор-1 (CSF-1) и RANKL, действие которых также показано на рисунке. OPG способен связывать и нейтрализовать RANKL, что негативно влияет и на остеокластогенез, и на активацию зрелых остеокластов. В нижней части рисунка показаны одногенные мутации, блокирующие остеокластогенез и активацию остеокластов. Курсивом выделены естественные мутации грызунов и человека, обычным шрифтом представлены результаты прицельного мутагенеза. В верхней части показаны одногенные мутантные аллели, усиливающие остеокластогенез, активирующие функции остеокластов и увеличивающие их выживаемость, что приводит к остеопорозу. Все эти мутации являются нулевыми, кроме OPG [22] и sRANKL [77], представленных в моделях чрезмерной экспрессии у трансгенных мышей (выделены голубыми рамками).
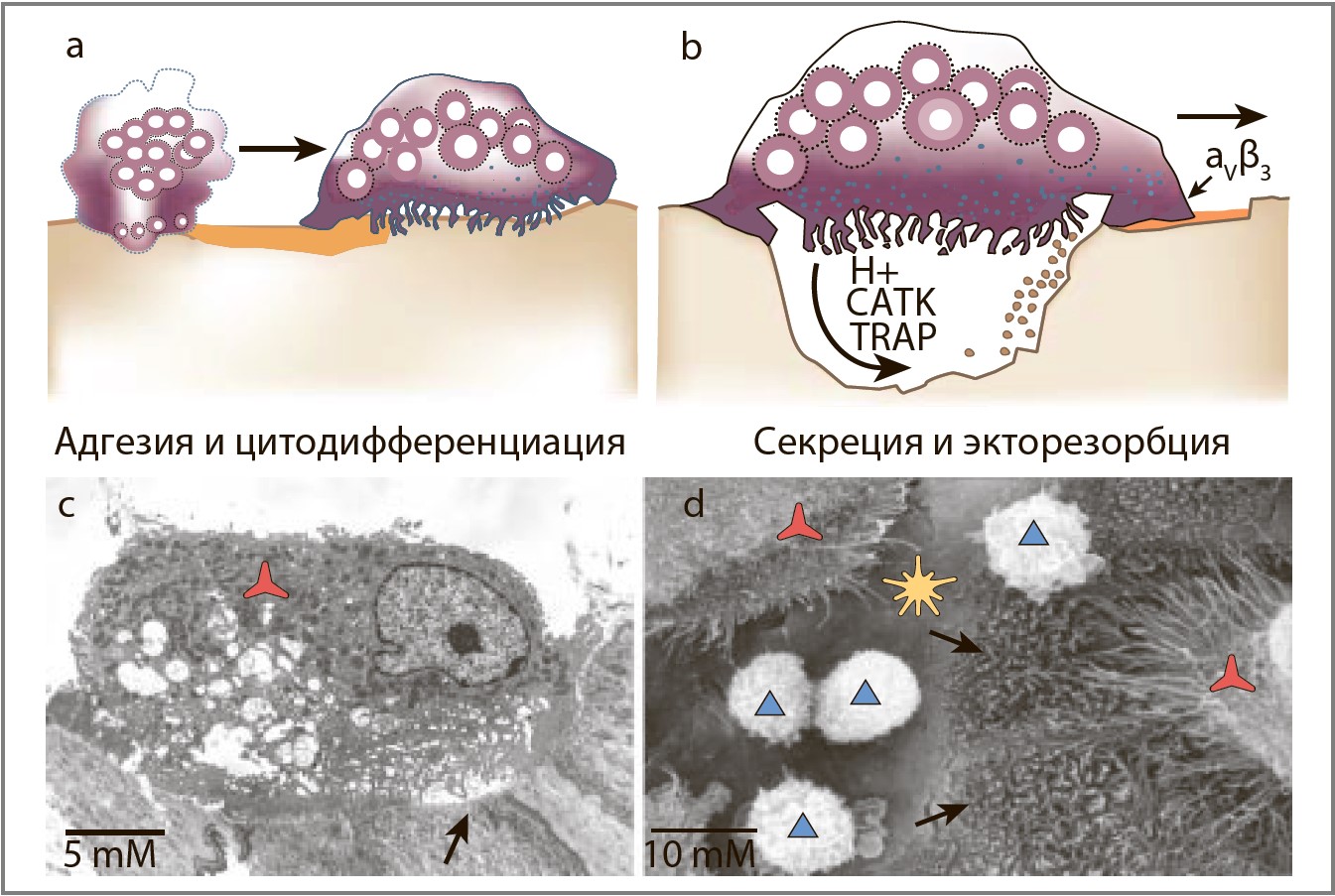
Зрелый многоядерный остеокласт активируется специфическими сигналами, ведущими к инициации ремоделирования кости (рис. 2). Вследствие этого тело остеокласта поляризируется, и в ответ на активацию RANK его лигандом [10] подлежит внутренним структурным изменениям. Эти изменения – перестройка актинового цитоскелета и образование тесной связи между поверхностью кости и базальной мембраной остеокласта – подготавливают условия для резорбции костной ткани, создавая своеобразный герметично закрытый отсек. Далее эта внешняя вакуоль закисляется путем экспорта ионов водорода [11], в нее поступают литические ферменты (тартратрезистентная кислая фосфатаза, прокатепсин К) и формируется т. н. резорбционная впадина (лакуна Хоушипа). Так остеокласт приводит к рассасыванию прилежащей костной ткани. Продукты деградации (фрагменты коллагена, растворенные кальций и фосфаты) попадают в циркуляторное русло. RANKL активирует зрелые остеокласты in vitro и ведет к быстрому рассасыванию кости in vivo [10, 12]. Жизнедеятельность остеокластов и их участие в последующих циклах резорбции костной ткани частично регулируется гормонами и цитокинами [13]. RANKL и интерлейкин (ИЛ) 1 увеличивают продолжительность жизни зрелого остеокласта in vitro и in vivo [14, 15].
Рис. 2. Активация резорбции костной ткани
Поликарионы под воздействием CSF-1 и RANKL прикрепляются к кости и дифференциируются в зрелый остеокласт (a). RANKL стимулирует активацию остеокластов, индуцируя секрецию протонов и литических ферментов в закрытую резорбционную вакуоль между базальной поверхностью остеокласта и поверхностью кости. Секреция протонов приводит к повышению кислотности в этом закрытом пространстве, что, в свою очередь, вызывает активацию ферментов TRAP и CATK, ответственных за деградацию минеральной и коллагеновой составляющих кости (b). Фотография трансмиссионной электронной микроскопии активированного остеокласта мыши с видимой неровной границей лакуны резорбции на поверхности бедренной кости (красный «пропеллер» – остеокласт, черная стрелка – резорбционное углубление) (c). Фотография сканирующей электронной микроскопии человеческих остеокластов, полученных in vitro на срезах кортикальной кости из мононуклеаров периферической крови, подвергавшихся действию CSF-1 и RANKL (красный «пропеллер» – остеокласт; черная стрелка – впадина резорбции, в которой обычно ровная поверхность кости рассосалась, обнажив коллагеновые пучки; желтые звездочки – нерезорбированная поверхность кости; голубые треугольники – мононуклеары (потенциальные предшественники остеокластов) (d).
Остеокластогенез и активацию остеокластов регулируют как минимум 24 гена или генных локуса [16, 17]. Нарушение функции этих генов блокирует развитие и/или функции остеокластов, приводя к аномально высоким уровням минерализации кости и хряща (т. н. остеопетроз), или, наоборот, к усиленному остеокластогенезу и активации этих клеток, ассоциируемых с остеопенией [17, 18, 19, 20]. Такие гены осуществляют свое действие на разных стадиях жизни остеокласта, влияя на образование и выживание клетокпредшественников, их способность к дифференциации, прикрепление к кости и выделение литических ферментов (рис. 1).
Регуляторная ось RANKL/RANK/OPG
Важным моментом в изучении регуляции остеокластогенеза стало обнаружение OPG – растворимого белка, блокирующего образование остеокластов in vitro и резорбцию кости in vivo [22, 23, 24]. Поскольку OPG – это ФНОродственный протеин, неудивительно, что другой ФНОродственный поверхностный белок RANKL является ключевым цитокином, регулирующим остеокластогенез и резорбцию костной ткани [6, 7, 25, 26]. RANKL связывает и активирует белок RANK – трансмембранный сигнальный рецептор [26]. Экспрессия RANK на гемопоэтических клеткахпредшественниках является необходимым условием дифференциации и активации остеокластов, а также рассасывания кости и гормональной регуляции гомеостаза кальция [27, 28].
Полипептид RANKL – трансмембранный протеин типа II, размещенный на поверхности клеток в виде растворимой формы [7, 25, 26]. Гормоны и другие стимуляторы резорбции костной ткани in vivo индуцируют экспрессию RANKL на остеогенных стромальных клетках [30, 31]. Экспрессия RANKL остеобластами координирует ремоделирование кости путем стимуляции ее рассасывания остеокластами, что, в свою очередь, активирует остеосинтез прилежащими остеобластами. Это сочетание противоположных процессов носит название «сопряжение» (coupling) [32]. В таком случае OPG действует в качестве рецептораловушки, блокируя связывание RANKL с RANK. OPG также вырабатывается остеобластами в ответ на действие анаболических агентов (эстрогены, некоторые костные морфогенетические белки) [32, 33]. Чрезмерная экспрессия OPG блокирует продукцию остеокластов, что вызывает остеопетроз у мышей, в то время как его делеция сопровождается усиленным ремоделированием и остеопорозом [21, 22]. Таким образом, координация экспрессии RANKL и OPG необходима как для позитивной, так и для негативной регуляции костной плотности путем контроля активности RANK в остеокластах.
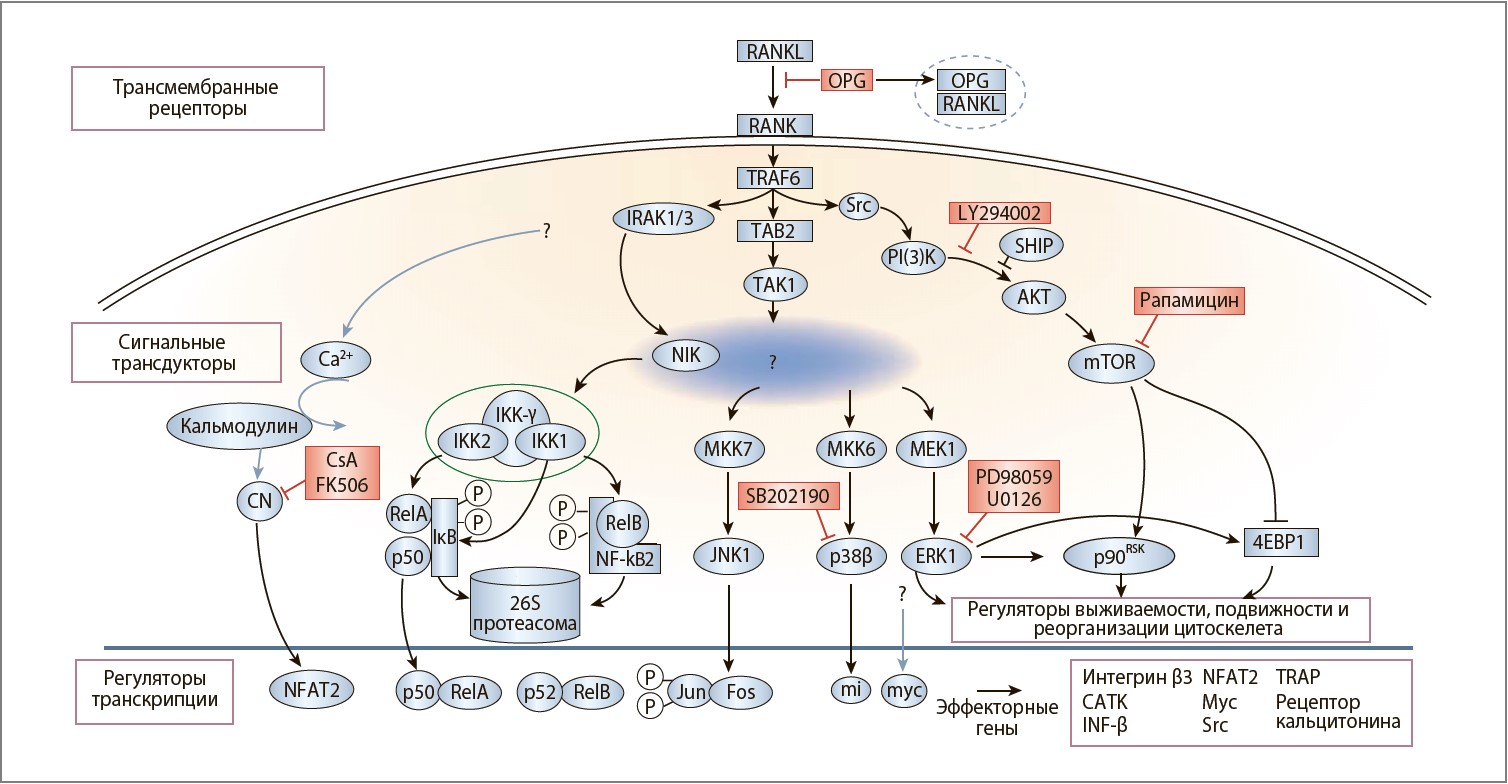
Активация RANK его лигандом ведет к экспрессии остеокластспецифических генов во время дифференциации, активации резорбции кости и дальнейшего жизненного цикла остеокластов. Сигнальная система RANK опосредована разнообразными цитоплазматическими факторами. Во время остеокластогенеза и активации остеокластов «включаются» как минимум пять отдельных сигнальных каскадов, опосредованных протеинкиназами – ингибитором киназы ядерного фактора кВ, cJunNтерминальной киназой, стрессактивируемой протеинкиназой p38, внеклеточной сигналрегулируемой киназой и протеинами Src (рис. 3).
Рис. 3. Сигнальный путь RANK в остеокластах
Белки с установленными эффектами, задействованные в передаче сигналов RANK во время развития и активации остеокластов, составляют сигнальный каскад от цитоплазматической мембраны до ядерных эффекторов. RANK и OPG являются ФНОР-опосредованными белками, а RANKL – ФНО-опосредованным цитокином, специфически взаимодействующим с RANK или OPG. Представленные на рисунке белки связаны стрелками или линиями, демонстрирующими их взаимодействие и функциональные ассоциации согласно данным литературы. Красные прямоугольники показывают точки приложения известных ингибиторов малых молекул.
Ключевым предварительным шагом RANKсигнализации является связывание ФНОРассоциированных цитоплазматических факторов (ФАЦФ) со специфическими доменами RANK [9, 34, 35]. Показано, что ФАЦФ‑2, 5 и 6 связываются с RANK, а мутации ФАЦФ‑6 ведут к остеопетрозу вследствие деактивации остеокластов [36, 37].
Модуляция RANKиндуцированного остеокластогенеза
Существует несколько уровней контроля сигнального пути RANK, способных усилить или затормозить остеокластогенез и активацию этих клеток. Активация находящихся на поверхности остеокластов рецепторов к ИЛ‑1, колониестимулирующему фактору‑1, простагландину Е2, ФНО потенцирует остеокластогенез in vitro и стимулирует резорбцию кости in vivo.
Сигнальный путь RANK негативно контролируется OPG in vitro и in vivo [22, 23]. Есть также доказательства существования механизмов обратной связи, которые прекращают функционирование сигнального пути RANK после его активации. Индукция остеокластогенеза RANKL ведет к усилению секреции интерферона (ИФ) β, который снижает экспрессию белка c-Fos – важного фактора развития остеокластов [63, 64]. ИФ-γ также обладает негативным действием на этот сигнальный путь. Связывание ИФ-γ с его рецепторами ведет к разрушению ФАЦФ‑6 и угнетению остеокластогенеза in vitro [65]. Эти данные являются противоречивыми, поскольку ИФ-γ применяется в лечении остеопетроза, увеличивая резорбцию кости. ИЛ‑4 также продемонстрировал негативное влияние на остеокластогенез [60]. Наконец, давно известно, что связывание кальцитонина с его рецепторами угнетает активацию остеокластов, что обусловливает его терапевтическое использование.
Гормональный контроль резорбции кости
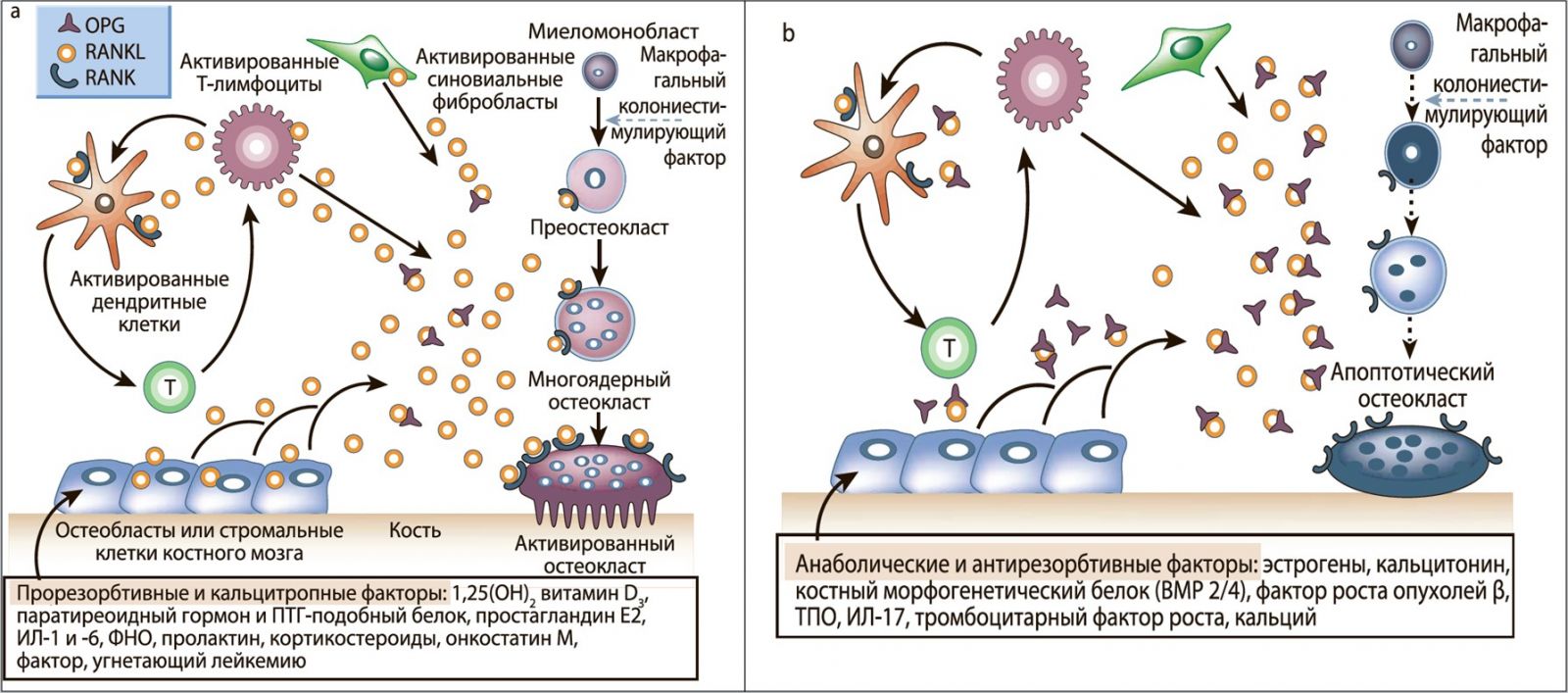
Некоторые гормоны, цитокины и гуморальные факторы также влияют на плотность костной ткани и гомеостаз кальция путем индукции экспрессии RANKL в клетках кости (рис. 4). Большинство гормонов, регулирующих обмен кальция, и пререзорбтивных цитокинов усиливают экспрессию матричной РНК RANKL в клеточных линиях и культурах остеобластов [32, 33]. OPG, блокирующий RANKLиндуцированный остеокластогенез, способен угнетать образование остеокластов и рассасывание кости, возникающие в ответ на действие кальцитропных факторов. Данное явление свидетельствует о том, что сигнальный путь RANK интегрирует различные гуморальные сигналы, регулирующие гомеостаз кальция и резорбцию кости. Вышесказанное подтверждает тот факт, что мыши с отсутствием RANK резистентны к индукции рассасывания костной ткани вследствие действия ФНО, ИЛ‑1β и паратгормонродственного пептида [27].
Важным источником RANKL в кости выступают также Tклетки [29]. Их активация in vitro и in vivo сопровождается усилением остеокластогенеза и резорбции кости. Это позволяет предположить, что воспалительные состояния и некоторые лейкемии стимулируют патологическую потерю костной массы [66].
Гуморальные факторы, снижающие резорбцию кости и увеличивающие ее плотность, например эстрогены, обладают противоположным действием на систему остеобласт/остеокласт: экспрессия OPG усиливается, а экспрессия RANKL снижается, что ведет к сниженной активации RANK и меньшему количеству активных остеокластов в кости соответственно. Были также отмечены экспрессия OPG и аномальное возрастание плотности кости под действием тромбопоэтина [67] (рис. 4).
Рис. 4. Гормональная регуляция резорбции кости
Схематическое представление механизма действия прорезорбтивных и кальцитропных факторов (a), анаболических и антиостеокластических факторов (b). RANKL экспрессируется в остеобластах, активированных Т-клетках, синовиальных фибробластах, стромальных клетках костного мозга и далее связывается со специфическим мембранным рецептором RANK, запуская каскад ФАЦФ-опосредованных киназных реакций, стимулирующих дифференциацию, активацию и выживание остеокластов. Напротив, экспрессия OPG вызывается факторами, блокирующими катаболизм кости и обеспечивающими анаболические реакции. OPG связывает и нейтрализует RANKL, что ведет к блокаде остеокластогенеза и снижению выживаемости уже существующих остеокластов.
От исследований к клинике
Существующие методы лечения остеопороза в основном замедляют снижение минеральной плотности кости, уменьшая риск переломов. Рекомендуемые препараты должны быть направлены на остеокластопосредованную резорбцию кости и включают эстрогены, бифосфонаты и селективные модуляторы эстрогеновых рецепторов. Другими потенциальными мишенями противоостеопоротических препаратов являются остеокластспецифическая протеаза CATK, интегрин αvβ3, и c-Src-тирозинкиназа [7, 9].
Ключевая роль сигнального пути RANKL/RANK/OPG в регуляции костного метаболизма подтверждается открытием, что генетические мутации, сопровождающиеся активацией RANK или угнетением RANKL-связывающих свойств OPG, ассоциируются с семейной гиперфосфатазией и аномалиями костей [6872]. Некоторые мутации гена, кодирующего OPG, ассоциируются с идиопатической гиперфосфатазией (т. н. ювенильная болезнь Педжета) – аутосомным рецессивным заболеванием, характеризующимся деформациями длинных костей и кифозом [6971].
Данные, что мутации генов, кодирующих RANK и OPG, ведут к тяжелым заболеваниям костей у человека, свидетельствуют о том, что угнетение сигнальной системы RANKL может выступать действенной терапевтической стратегией при болезнях, сопровождающихся чрезмерной резорбцией кости. Считается, что блокада RANKL способна предупредить потерю костной массы вследствие менопаузы, рака, воспаления и др. Полностью человеческие моноклональные антитела, направленные против RANKL, являются возможным решением проблемы остеопороза (Bekker P. J. et al., неопубликованная информация). Привлекательным аспектом применения антител является избежание перекрестных реакций нейтрализации OPG и RANKактивирующих эндогенных антител. Клинические преимущества блокады RANKL требуют дальнейших исследований.
Список литературы находится в редакции.
Boyle W. J., Simonet W. S., Lacey W. S. Osteoclast differentiation and activation. Nature. Vol. 423. 15 May 2003. P. 337342.
Перевела с англ. Лариса Стрильчук
Медична газета «Здоров’я України 21 сторіччя» № 22 (419), листопад 2017 р.