28 грудня, 2017
Антибактеріальна терапія інфекції діабетичної стопи: сучасна стратегія і перспективи подальшого застосування антибіотиків
 Неадекватна стартова терапія інфекції дібетичної стопи (ДС) здатна призвести до негативних наслідків у лікуванні, а також до зростання резистентних штамів бактерій. Стратифікація ступеня тяжкості інфекції ДС – важлива складова у виборі адекватної антибіотикотерапії (АБТ). Лікування хірургічної інфекції ДС має бути спрямоване на хірургічний контроль джерела інфекції та антимікробну терапію з урахуванням індивідуальних чинників ризику пацієнта і мультирезистентних штамів бактерій. У ході численних досліджень, присвячених порівнянню новітніх препаратів і стандартних антибіотиків (АБ), не було виявлено переконливо кращої ефективності останніх із майже однаковою кількістю побічних ефектів. Хоча слід зауважити, що стосовно лінезоліду існує достатня доказова база щодо його переваги над ванкоміцином для застосування у деяких пацієнтів із підтвердженою інфекцією MRSA.
Неадекватна стартова терапія інфекції дібетичної стопи (ДС) здатна призвести до негативних наслідків у лікуванні, а також до зростання резистентних штамів бактерій. Стратифікація ступеня тяжкості інфекції ДС – важлива складова у виборі адекватної антибіотикотерапії (АБТ). Лікування хірургічної інфекції ДС має бути спрямоване на хірургічний контроль джерела інфекції та антимікробну терапію з урахуванням індивідуальних чинників ризику пацієнта і мультирезистентних штамів бактерій. У ході численних досліджень, присвячених порівнянню новітніх препаратів і стандартних антибіотиків (АБ), не було виявлено переконливо кращої ефективності останніх із майже однаковою кількістю побічних ефектів. Хоча слід зауважити, що стосовно лінезоліду існує достатня доказова база щодо його переваги над ванкоміцином для застосування у деяких пацієнтів із підтвердженою інфекцією MRSA.
 Цукровий діабет (ЦД) – комплекс метаболічних синдромів, у якому розрізняють дві групи. Одна група – це ЦД 1 типу, на частку якого припадає лише 5-10% людей із діабетом, друга група – це ЦД 2 типу, на частку якого припадає 90-95% осіб. Згідно з даними Міжнародної федерації діабету, в усьому світі нараховується близько 382 млн хворих на ЦД й очікується, що кількість осіб, які страждають на це захворювання, у 2025 році збільшиться до 552 млн. Наприклад, у Німеччині на ЦД хворіють 10,2% населення, у Швеції – 7,3%, у Франції – 6,2%, в Іспанії – 9,9%. У США цей показник сягає 9,3% і є однією з основних причин нетравматичних ампутацій (66 тис. операцій на рік вартістю 11 млрд доларів). Водночас загальна сума витрат на лікування хворих на ЦД сягає 176 млрд доларів [28, 29].
Цукровий діабет (ЦД) – комплекс метаболічних синдромів, у якому розрізняють дві групи. Одна група – це ЦД 1 типу, на частку якого припадає лише 5-10% людей із діабетом, друга група – це ЦД 2 типу, на частку якого припадає 90-95% осіб. Згідно з даними Міжнародної федерації діабету, в усьому світі нараховується близько 382 млн хворих на ЦД й очікується, що кількість осіб, які страждають на це захворювання, у 2025 році збільшиться до 552 млн. Наприклад, у Німеччині на ЦД хворіють 10,2% населення, у Швеції – 7,3%, у Франції – 6,2%, в Іспанії – 9,9%. У США цей показник сягає 9,3% і є однією з основних причин нетравматичних ампутацій (66 тис. операцій на рік вартістю 11 млрд доларів). Водночас загальна сума витрат на лікування хворих на ЦД сягає 176 млрд доларів [28, 29].
В Україні станом на 1 січня 2016 року зареєстровано 1 млн 223 тис. 607 хворих на ЦД (близько 3% населення). Проте кількість людей із недіагностованою патологією перевищує цю цифру в 3-4 рази. Слід зазначити, що кількість хворих на ЦД у нашій країні щороку зростає на 5-7%. Сьогодні ЦД є загрозливим захворюванням зі сталим збільшенням кількості хворих, серед яких у 93,1% випадків діагностовано ЦД 2 типу. Діабетична виразка стопи – основна патологія (виникає у 15-25% пацієнтів із ЦД), яка поступово производить до інвалідизації унаслідок хронічних ускладнень, одним з яких є розвиток інфекції. Частота інфікування виразок сягає 40-80% і характеризується швидким прогресуванням, масивною деструкцією тканин і, відповідно, ампутацією кінцівок. Від 40 до 60% (у деяких регіонах до 90%) усіх нетравматичних ампутацій здійснюють у хворих на ЦД. Щороку проводять близько 3370 ампутацій нижніх кінцівок, післяопераційна летальність при цьому становить близько 7%. Важливо зазначити, що при вчасно застосованому лікуванні й постійній профілактиці до 85% ампутацій можна запобігти. Позитивного результату досягають завдяки впровадженням ефективних лікувально-діагностичних програм [3, 4].
 Наприклад, B.M. Duhonet і співавт. (2016) в аналітичному аналізі, який тривав 15 років і до якого було залучено 1 млн 059 тис. 552 пацієнти з інфекцією ДС, виявили, що кількість ампутацій у США зменшилася з 33,2% у 1996 році до 17,1% у 2010 році. Периферична ангіопатія і периферична нейропатія як провідні чинники ризику інфекції ДС (ІДС) становили відповідно співвідношення ризиків, СР, 2,89; 95% довірчий інтервал, ДІ, 2,87-2,91 і СР, 2,62; 95% ДІ 2,60-2,64. Загальна кількість пацієнтів з ІДС зменшилася на 52% на тлі постійного зростання хворих на ЦД (на 104,2%). Завдяки щорічному збільшенню на 6,8% кількості хворих, які зверталися до лікарів з приводу консультації та медичного огляду стопи, було завчасно виявлено травматичні пошкодження і виразки, проведено профілактику інфекції, відтак – вдалося покращити кінцеві результати цієї проблеми [28]. Нижче у таблиці подано алгоритм обстеження пацієнтів із виразкою стопи.
Наприклад, B.M. Duhonet і співавт. (2016) в аналітичному аналізі, який тривав 15 років і до якого було залучено 1 млн 059 тис. 552 пацієнти з інфекцією ДС, виявили, що кількість ампутацій у США зменшилася з 33,2% у 1996 році до 17,1% у 2010 році. Периферична ангіопатія і периферична нейропатія як провідні чинники ризику інфекції ДС (ІДС) становили відповідно співвідношення ризиків, СР, 2,89; 95% довірчий інтервал, ДІ, 2,87-2,91 і СР, 2,62; 95% ДІ 2,60-2,64. Загальна кількість пацієнтів з ІДС зменшилася на 52% на тлі постійного зростання хворих на ЦД (на 104,2%). Завдяки щорічному збільшенню на 6,8% кількості хворих, які зверталися до лікарів з приводу консультації та медичного огляду стопи, було завчасно виявлено травматичні пошкодження і виразки, проведено профілактику інфекції, відтак – вдалося покращити кінцеві результати цієї проблеми [28]. Нижче у таблиці подано алгоритм обстеження пацієнтів із виразкою стопи.
У ході численних досліджень було доведено, що більшість ІДС від легкого до помірного ступеня тяжкості спричиняють грампозитивні бактерії, водночас тяжкі і/або хронічні форми інфекції частіше мають полімікробний характер, за участю грамнегативних бактерій і анаеробів. На сьогодні серед грампозитивних бактерій найпоширенішим із видів є стафілокок. Гемолітичні стрептококи верифікуються рідше, хоча на цей час Streptococcus agalactiae як важливий патоген набуває дедалі більшого значення, особливо у пацієнтів із тяжким імунодефіцитом і/або заавансованими формами артеріальної недостатності. Серед грамнегативних аеробних бактерій частіше висіваються ентеробактерії і синьогнійна паличка. Анаероби вважаються основними збудниками, здебільшого у пацієнтів з ішемією стопи або гангреною, і зазвичай становлять 10-50% ізолятів. Було висловлено припущення, що низький рівень вірулентності колонізуючої флори, такої як коагулазонегативні стафілококи і Corynebacterium spp., можуть відігравати патогенну роль навколо некротичних тканин або при ураженні кісток, хоча доказів цього наразі недостатньо [9, 11, 20].
Нові мікробіологічні дослідження ІДС у країнах Азії та Африки показали, що стафілокок залишається одним з основних збудників, хоч на нього і припадає значно менша частина всіх ізолятів (14-39%), ніж у подібних дослідженнях у країнах Західної Європи й США (70-80%).
Зменшення кількості ізолятів, у яких фігурує стафілокок, компенсується шляхом збільшення грамнегативних бактерій та анаеробів. Наразі немає чіткого пояснення очевидних відмінностей у мікробіологічних результатах, отриманих у країнах з високим економічним рівнем і країнах, що розвиваються. До можливих причин відносять невчасне звернення пацієнтів за медичною допомогою, відмінності у характері впливу мікроорганізмів на рановий процес (вологий клімат, дотримання особистої гігієни) або у використанні мікробіологічних методів дослідження. Проте немає жодних підстав вважати, що ці відмінності мають впливати на вибір емпіричної АБТ [8, 9, 11, 18, 22].
Цей вибір має, швидше, ґрунтуватися на клінічному оцінюванні тяжкості інфекції разом із розумінням, що кожен пацієнт може мати чинники ризику колонізації стійких до АБ бактерій, особливо резистентних до метициліну штамів золотистого стафілокока (MRSA).
Наприклад, M. Anvarinejad і співавт. (2015) встановили, що із 122 штамів бактерій, виділених у пацієнтів з ІДС, найчастіше верифікували золотистий стафілокок і кишкову паличку, 91% штамів мали полірезистентність до АБ (від ≥3 препаратів), 78% становили штами MRSA, 53% грам негативних бактерій мали β-лактамази розширеного спектра (БЛРС). Автори зазначили, що частота полірезистентних штамів за 10 років зросла у 3 рази (з 18% у 2004 році до 63,4% у 2014 році), і це свідчить про необхідність застосування у клінічній практиці вузькоспрямованої АБТ. Однак непокоїть той факт, що спостерігається постійне зростання кількості штамів ентерококів, резистентних до ванкоміцину (20,6%), що створює труднощі в лікуванні інфекції, позаяк більшість широко вживаних препаратів не знищують зазначених збудників інфекції [22]. Слід зауважити, що на сьогодні переважають випадки ІДС, спричинені полімікробною флорою (приблизно 59-62%) [11].
Стійкість збудників до АБ – важлива проблема у пацієнтів з ІДС, значення якої дедалі більше зростає. У низці досліджень були ідентифіковані основні чинники ризику на наявність резистентності до АБ в окремих пацієнтів. До таких чинників належать попередні курси АБТ та її тривалість, частота госпіталізацій із приводу тієї самої виразки, тривалість перебування у стаціонарі і наявність остеомієліту [15, 21].
В останні роки в усьому світі помітно загострилася проблема MRSA у пацієнтів з ІДС. Згідно із результатами дослідження у 1996 році частота штамів золотистого стафілокока, виділеного від пацієнтів з ІДС, у Каліфорнії становила 20%. Водночас під час проведення у 1999 році у Великій Британії схожого дослідження група науковців виявила, що частка MRSA становить 40%, а у 2001 році після повторного спостереження було встановлено, що частка штамів метицилін-резистентного золотистого стафілокока досягла 42,2%, поширеність MRSA із ранових мазків у популяції пацієнтів із ДС становила 31,3%. Дані багатьох подібних досліджень свідчать про патогенетичну роль MRSA в ІДС. Автори довели, що MRSA-ізоляти набагато частіше зустрічаються серед пацієнтів з інфікованою виразкою ДС, аніж серед пацієнтів з неінфікованими виразками стопи (61,1 проти 12,5%), що насамкінець призводить до значного збільшення терміну загоєння виразок стопи при ЦД [25].
Донедавна вважалося, що штами MRSA є патогеном, що асоціюється із закладами охорони здоров’я. Проте позалікарняні штами MRSA, які спричиняють тяжкі форми інфекції шкіри і м’яких тканин, набувають дедалі більшого значення. У ході багатоцентрового дослідження, яке проводилося у США, було доведено, що наявність позалікарняних штамів MRSA часто верифікується серед дорослих пацієнтів, яких ургентно госпіталізують у хірургічні відділення з приводу інфекціїі, і штами MRSA є додатковою загрозою для пацієнтів з ІДС. БЛРС – іще одна проблема, з якою борються в усьому світі. Поширеність бактерій, що продукують БЛРС у пацієнтів з ІДС, найчастіше відзначають у країнах, що розвиваються, і вони становлять приблизно 44,7% ізолятів з ІДС.
В опублікованих дослідженнях та оглядах з АБТ ІДС, які E.J. Peters і співавт. (2016) обрали для аналізу, було зауважено, що більшість робіт присвячено АБТ інфекцій, спричинених грампозитивною флорою, однак звертає на себе увагу факт зростання рекомендацій для пацієнтів з ургентними випадками ІДС, у яких домінуючим чинником є грамнегативна флора, особливо Pseudomonas aeruginosa, у країнах, що розвиваються, з теплим кліматом. Порівняльні дослідження характеризувалися різноманітним профілем порівняння – від рутинних широко вживаних препаратів (цефтріаксон і цефазолін; кліндаміцин і цефалексин) до сучасних (тайгециклін і ертапенем, з ванкоміцином і без нього). Клінічна ефективність вирізнялася широким спектром результатів – від 48 до 90%.
В одному з досліджень з високою якістю доказів порівнювали моксифлоксацин з піперациліном/тазобактамом у 233 пацієнтів (тривалість лікування <21 дня) з ІДС середнього і тяжкого ступеня, які потребували госпіталізації. Не було виявлено істотної різниці у впливі застосованих схем терапії на ефективність препаратів, що оцінювалась за клінічними й бактеріологічними даними, частоту ампутацій кінцівки, побічні ефекти за ходом лікування. Схожі результати були отримані під час порівняння тайгецикліну і ертапенему з ванкоміцином і без нього у 944 пацієнтів (тривалість лікування 11-12 днів). Автори зазначили, що більшість досліджень спонсорувалися виробниками препаратів й отримані результати не довели перевагу нових АБ порівняно із загальноприйнятими схемами АБТ [10]. Такі ж дані отримані й зроблені висновки за результатами 8 рандомізованих контрольованих досліджень при лікуванні остеомієліту в пацієнтів з ІДС.
Порівнювали захищені β-лактами з одним із таких препаратів, як імепенем, цефокситин, офлоксацин, лінезолід, ертапенем і моксифлоксацин. Також не було встановлено істотного впливу на вищенаведені показники порівняння (ефективність, побічні ефекти, частоту ампутацій тощо).
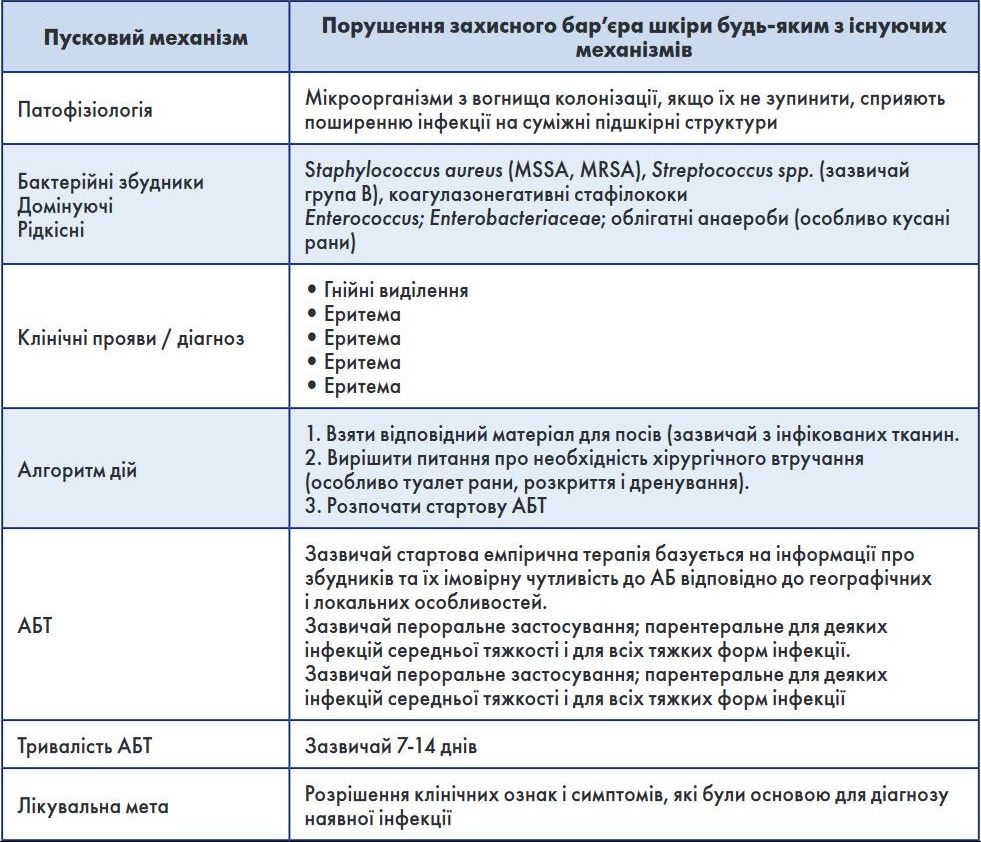
Рівень клінічної ефективності коливався в межах 61-94%, середня тривалість лікування становила від 6 до 42 днів. Отже, вибір АБ для більшості ІДС залишається значною мірою питанням експертного висновку, як і критерії, що використовують для вибору схем і тривалості лікування окремо як для остеомієліту, так і інфекції шкіри і м’яких тканин. Так само досі не отримано переконливих висновків, чи існує необхідність у застосуванні різних видів ад’ювантної терапії. Ці питання наразі залишаються предметом дискусії, і для їхнього остаточного вирішення необхідно продовжувати дослідження [6, 19, 25, 26, 31, 32]. Клінічно значущі спільні риси ІДС і місцевої інфекції шкіри та м’яких тканин, алгоритм діагностики і лікування наведені в таблиці 2 [23, 24].
Таблиця 2. Клінічно значущі спільні риси ІДС і місцевої інфекції шкіри та м’яких тканин (модифіковано за B. Lipsky і співавт., 2016)
Зазвичай під час вибору схеми АБТ при ІДС оцінюють тяжкість інфекції (легка, помірна і тяжка), що дозволяє визначати ключові напрями в алгоритмі лікування: як швидко розпочати стартову терапію; що необхідно для призначити лікування; чи є потреба у застосуванні хірургічних методів; яку емпіричну АБТ широкого спектра слід призначити; який оптимальний шлях введення препаратів. Очевидно, що вибір припадає на препарати, які довели свою ефективність при лікуванні ІДС з урахуванням можливості алергічних рекцій і впливу на перебіг супутніх захворювань. Наприклад, при легких інфекціях застосовують пероральний шлях введення (іноді тільки місцевий) АБ; інфекції помірної тяжкості і всі тяжкі форми починають із парентерального введення з подальшим переходом на пероральний шлях у клінічно стабільних пацієнтів. Згідно із світовими рекомендаціями для пацієнтів за відсутності ризику рідкісних або резистентних патогенів ефективними є β-лактами (пеніциліни і цефалоспорини раннього покоління) – у разі неприємного запаху з рани або гангрени, а також ознак ішемії додають протианаеробні препарати. У пацієнтів з імовірною наявністю рідкісних або резистентних штамів призначають режими широкого спектра (у тому числі антипсевдомонадні β-лактами, захищені β-лактами, карбапенеми або цефалоспорини останньої генерації). Після отримання результатів чутливості верифікованих збудників переходять на цілеспрямовану вузьку АБТ.
Залишається невирішеною проблемою MRSA-інфекція [12, 13, 16, 17]. На жаль, лише деяким центрам доступні експрес-методи на основі ланцюгової полімеразної реакції виявлення зазначених збудників у біологічних рідинах і тканинах, що значно зменшує необхідність застосування емпіричної АБТ стосовно MRSA-інфекції. За можливості клініцистам слід ураховувати й економічну складову АБТ без втрати ефективності лікування. У деяких ургентних випадках ситуацію полегшують фторхінолони з меншою ймовірністю виникнення резистентності. Слід постійно проводити моніторинг ефективності призначеного лікування. У разі відсутності покращення місцевих або загальних симптомів інфекції впродовж 2-3 днів розглядають необхідність хірургічного лікування, а також повторюють забори матеріалу (з глибоких тканин) для отримання культури бактерій, які не вдалося верифікувати при перших спробах. Після отримання результатів змінюють режим АБТ, при цьому застосування потужних препаратів останньої генерації «наосліп» навряд чи є обґрунтованим. Наразі немає достовірних даних, які свідчили б про вищу ефективність бактерицидних препаратів порівняно із бактеріостатичними при лікуванні ранової інфекції у пацієнтів без імуносупресії.
У разі позитивної відповіді на терапію розглядають питання необхідної тривалості АБТ: чим менша її тривалість, тим краще, позаяк АБТ часто асоціюється з низкою негативів, як-от: побічні ефекти, взаємодія з іншими ліками, які приймає пацієнт (і не завжди з позитивним впливом), зростання фінансових витрат, розвиток резистентних штамів бактерій. Висновки більшості проспективних досліджень з лікування ІДС із залученням тільки м’яких тканин довели, що 1-2-тижнева тривалість АБТ є цілком достатньою, більш тривале лікування необхідне лише за наявності бактеріємії. Основним показанням для тривалої АБТ при ІДС є інфекція кісток. Згідно з даними експериментальних моделей на тваринах і результатами клінічних досліджень, більшість авторів рекомендують застосовувати АБ упродовж 4-6 тиж. Результати низки спостережень довели можливість ефективного використання АБТ упродовж ≥ 3 міс при ураженні кістки без хірургічного видалення або резекції. При цьому лише проведення АБТ допускається тоді, коли пацієнт або медична команда вважають за краще уникнути хірургічного втручання. У разі хірургічного видалення уражених кісток отримання короткотривалої АБТ цілком достатньо. Порівняльне дослідження щодо тривалості АБТ при остеомієліті у пацієнтів із ЦД не виявило значної різниці між 6- і 12-тижневим застосуванням АБ [14, 24].
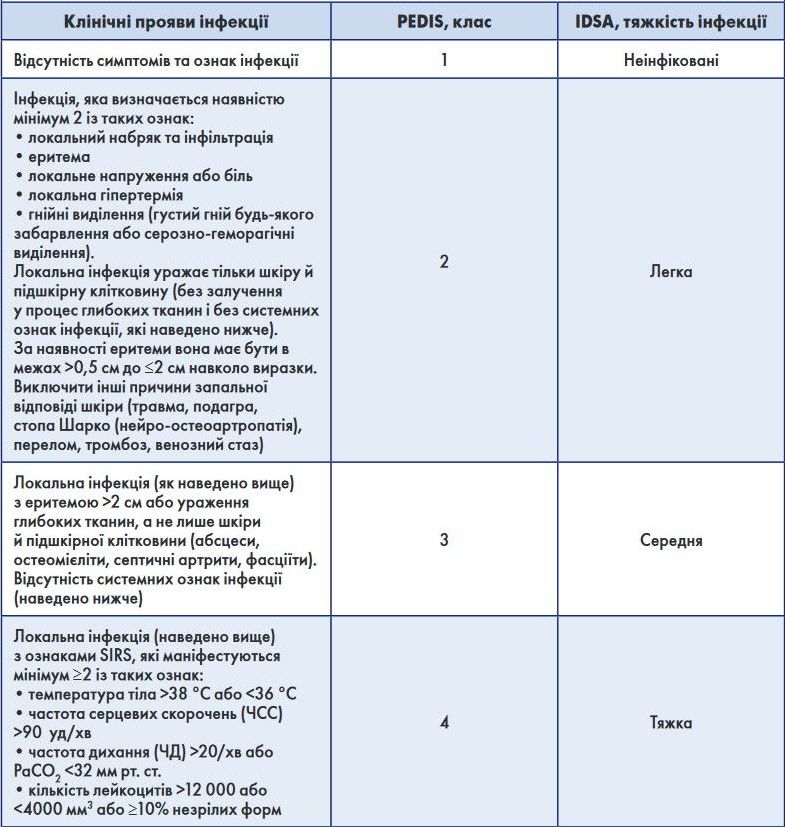
При синдромі ДС (СДС) експерти пропонують класифікувати інфекційний процес за шкалою PEDIS (Perfusion, Extent, Depth, Infection, Sensation; IWGDF, 2003): 1-й ступінь – неінфікована ДС; 2-й ступінь – залучення в інфекційний процес шкіри і підшкірної клітковини (поверхнева виразка, панарицій, мозольний/підшкірний абсцес, бешиха, целюліт); 3-й ступінь – глибокі абсцеси, флегмона, виразка або ураження глибоких тканин (фасціїт, тендовагініт, міонекроз, остеомієліт, гангрена); 4-й ступінь – наявність ознак системної запальної відповіді (лімфангоїт, бактеріємія, інтоксикація, залучення в інфекційний процес інших органів). Класифікація інфекції ДС, розроблена Американським товариством з інфекційних хвороб та інтернаціональною робочою групою із проблем діабетичної стопи, подана в таблиці 3 [20].
Таблиця 3. Класифікація ІДС, розроблена Американським товариством
з інфекційних хвороб та інтернаціональною робочою групою із проблем діабетичної стопи (модифіковано за B.A. Lipsky і співавт., 2012)
Примітки. IDSA – Американське товариство з інфекційних хвороб; PaCO2 – парціальнитй тиск вуглецю в тканинах; PEDIS – перфузія, поширеність/розміри, глибина/дефект тканин, інфекція і чутливість; SIRS – синдром системної запальної відповіді. Ішемія призводить до тяжких форм інфекції; зазвичай наявність критичної ішемії корелює з тяжкими формами ІДС. Ситемна інфекція часто проявляється й іншими клінічними ознаками, такими як гіпотензія, порушення ментального статусу, блювання, або явними метаболічними розладами (ацидоз, тяжка гіперглікемія, азотемія тощо).
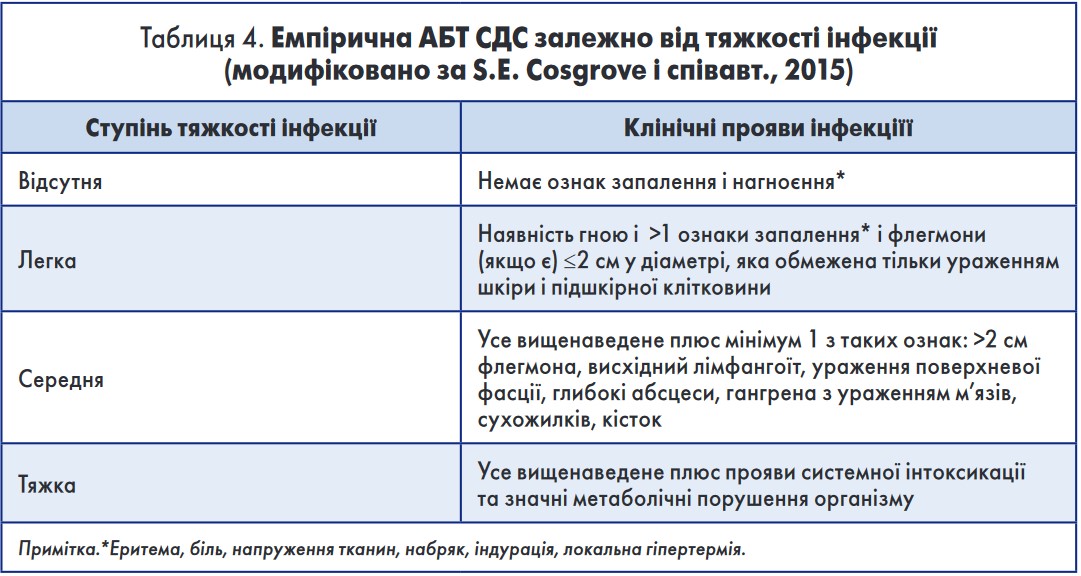
Нижче наведено підходи й коментарі до емпіричної АБТ СДС залежно від тяжкості інфекції (табл. 4) згідно з рекомендаціями, розробленими робочою группою з антимікробної терапії госпіталю Johns Hopkins [7].
Легкі форми інфекції
Пероральні схеми лікування
- Амоксицилін/клавуланат по 875 мг усередину 2 р/добу, або
- Цефалексин по 500 мг усередину 4 р/ добу, або
- Цефуроксим аксетил по 500 мг усередину 2 р/добу, або
- Кліндаміцин по 300 мг усередину 3 р/ добу (перекриває MRSA).
Парентеральні схеми лікування
- Кліндаміцин по 600 мг внутрішньовенно 3 р/добу (перекриває MRSA), або
- Оксацилін 1-2 г внутрішньовенно кожні 4 год, або
- Цефазолін 1-2 г внутрішньовенно кожні 8 год.
Інфекції середньої тяжкості
- Ертапенем 1 г внутрішньовенно 1 р/ добу, або
- Ципрофлоксацин* по 500 мг усередину 3 р/добу, або ципрофлоксацин по 400 мг внутрішньовенно 2 р/добу плюс 1 із перелічених препаратів: кліндаміцин (по 600 мг внутрішньовенно 3 р/добу або 300 мг усередину 3 р/ добу), або метронідазол по 500 мг внутрішньовенно всередину 3 р/добу.
*Уникати застосування фторхінолонів в амбулаторних пацієнтів.
- За наявності ризику MRSA додати ванкоміцин у схеми, у яких відсутній кліндаміцин.
Чинники ризику MRSA
- В анамнезі колонізації або інфекція MRSA.
- Попередня (не менше 3 міс) або наявна госпіталізація >2 тиж.
- Інфікування можливе під час догляду в будинках для осіб похилого віку, а також від хронічних носіїв.
- Парентеральні наркомани.
Тяжкі форми інфекції
- Піперацилін/тазобактам по 4,5 г внутрішньовенно 4 р/добу, або
- Ципрофлоксацин* по 400 мг внутрішньовенно 2 р/добу, або азтреонам по 2 г внутрішньовенно 3 р/добу плюс
- Кліндаміцин по 600 мг внутрішньовенно 3 р/добу.
*Уникати застосування фторхінолонів в амбулаторних пацієнтів.
За наявності ризику MRSA (див. вище)
- Піперацилін/тазобактам по 4,5 г внутрішньовенно 4 р/добу плюс ванкоміцин або
- Ципрофлоксацин* по 400 мг внутрішньовенно 2 р/добу, або азтреонам по 2 г внутрішньовенно 3 р/добу плюс
- Метронідазол по 500 мг внутрішньовенно 3 р/добу плюс ванкоміцин.
*Уникати застосування фторхінолонів в амбулаторних пацієнтів.
Коментар до схем лікування
Організаційні питання
Слід дотримуватися мультидисциплінарного підходу до лікування інфекції СДС, а саме – залучати до консультації та узгодження тактики лікування фахівців із ранового процесу, судинних і загальних хірургів, інфекціоністів та фармакологів.
Виключити наявність некротичного фасціїту у разі тяжкого стану пацієнта з вираженою інтоксикацією.
Застосовувати препарати вузького спектра дії за наявності культури і визначення чутливості отриманої флори до АБ.
Мікробіологія
Флегмони за відсутності ран та інфікованих виразок, некоректне застосування АБ – β-гемолітичні стрептококи, S. aureus.
Інфіковані виразки, хронічні виразки і рани з попередньою АБТ – S. aureus, β-гемолітичні стрептококи, Enterobacteriaceae.
Частий контакт із водою – полімікробна флора, існує ймовірність інфекції Pseudomonas.
Хронічні рани з тривалою АБТ – аеробні грампозитивні коки, дифтероїди, Enterobacteriaceae, інші грамнегативні штами, у тому числі Pseudomonas.
Некрози і/або гангрена – змішана флора (Гр+ і Гр-) плюс анаероби.
Діагностика
Отримання культури при санації ран і виразок є додатовим компонентом для подальшої коректної АБТ. Не рекомендується біопсія кістки без підтвердження наявної інфекції. Уникати промивання та дренування виразок і ран без виділень.
Обережно здійснювати ревізію дна виразки. За наявності металевих конструкцій для корекції стопи проводити АБТ як при остеомієліті, з одночасною хірургічною санацією.
Плантарний фасціїт і інфекція глибоких просторів потребують візуалізаційних методів діагностики.
Наявність гнильних виділень свідчить про анаеробну інфекцію.
Ядерний магнітний резонанс за чутливістю і специфічністю – найкращий з існуючих методів діагностики інфекції м’яких тканин і кісток при СДС.
Тривалість лікування
Тривалість лікування залежатиме від того, як швидко організм відповість на призначене лікування, а також від нормалізації показників крові.
Краща схема лікування – короткі курси АБТ з адекватним хірургічним лікуванням (7-10 днів в післяопераційному періоді) і дещо довше при остеомієліті.
Перехід на пероральне застосування АБ при стабілізації стану пацієнтів.
Нижче наводимо клінічний підхід до стартової антимікробної терапії СДС, запропонований D.N. Gilbert і співавт. (2016). Лікування базується на локалізації і типі інфекції і у визначених випадках – на ідентифікації збудника [33].
Клінічний підхід до стартової антимікробної терапії СДС (модифіковано за D.N. Gilbert et al. The Sanford guide to antimicrobial therapy, 2016, 46-th edition)
СДС (у 2/3 пацієнтів відзначається тріада – нейропатія, деформація стопи (Шарко) і виразки від компресії).
Легка форма (маленькі виразки, пульсація збережена).
Змішана флора: S. aureus (у тому числі MRSA), S. agalactiae, S. pyogenus predominate.
Пероральне застосування: диклоксацилін по 500 мг 4 рази, або цефалексин по 500 мг 4 рази, або амоксицилін/клавуланат 875/125 мг 2 рази (не MRSA).
Доксициклін по 100 мг 2 рази або триметоприм/сульфаметоксазол по 1-2 таблетки 2 рази (MRSA, може не діяти на стрептококи).
Кліндаміцин 300-450 мг 3 рази (діє на MSSA, MRSA і стрептококи).
Середня форма тяжкості
Змішана флора: S. aureus (у тому числі MRSA), S. agalactiae, S. pyogenes predominate, плюс імовірні Coliforms.
Пероральне застосування: див. вище.
Парентеральна терапія: ампіцилін/сульбактам 3 г кожні 6 год, або піперацилін/тазобактам 4,5 г кожні 8 год, або ертапенем (або інші карбапенеми) + ванкоміцин (або інші альтернативні засоби, що застосовують проти MRSA) до моменту виключення MRSA.
Принципи лікування: 1) за необхідності й можливості – реваскуляризація; 2) ерадикація інфекції; 3) усунення компресії на виразку.
Тяжка форма (ураження всіх тканин кінцівки, у тому числі кісток; запалення, лихоманка, нейтрофілія, системна інтоксикація й органна дисфункція).
Змішана флора: S. aureus (у тому числі MRSA), S. agalactiae, S. pyogenes predominate, Coliforms, плюс анаеробні бактерії. Місце ентерококів у цьому переліку збудників не з’ясоване.
Парентеральна терапія: ванкоміцин внутрішньовенно 1,0 г кожні 12 год + β-лактами/інгібітори β-лактамаз, або ванкоміцин внутрішньовенно 1,0 г кожні 12 год + меропенем внутрішньовенно 1 г кожні 8 год, або імепенем внутрішньовенно 0,5 г кожні 6 год, або доріпенем внутрішньовенно (1 год інфузія) 0,5 г кожні 8 год.
Інші альтернативи:
1. Лінезолід внутрішньовенно 600 мг кожні 12 год або даптоміцин 6 мг/кг кожні 24 год.
2. Ципрофлоксацин або левофлоксацин, або моксіфлоксацин, або азтреонам + метронідазол замість β-лактамів / інгібіторів β-лактамаз.
Контроль рівня глюкози, ідентифікація флори з виділень, реваскуляризація, якщо потрібна і можлива, ерадикація інфекції, усунення компресії на виразку.
В Україні група дослідників під керівництвом А.С. Єфімова розробила таку схему призначення АБ при СДС [4].
1. При інфекціях, що не загрожують ампутацією кінцівки:
- фторхінолони (левофлоксацин, ципрофлоксацин);
- пеніциліни (амоксиклав);
- лінкозаміди (лінкоміцин, кліндаміцин);
- цефалоспорини першого ряду (цефалексин, цефазолін).
2. При інфекціях, що загрожують ампутацією кінцівки:
- фторхінолони та лінкозаміди;
- ампіцилін-сульбактам;
- цефалоспорини другого ряду (цефуроксим);
- до лікування обов’язково додають метронідазол.
3. При інфекціях, які загрожують життю пацієнта:
- тієнам;
- ванкоміцин і азтреонам і метронідазол;
- кліндаміцин та ампіцилін/сульбактам.
При остеомієліті комбінують два препарати, що накопичуються у кістковій тканині, – кліндаміцин або лінкоміцин та фторхінолон або цефалоспорин. Останнім часом з’явилися публікації, у яких висвітлюються недоліки та побічні ефекти при застосуванні фторхінолонів у хворих на ЦД. Нещодавно було встановлено, що деякі фторхінолони (особливо пефлоксацин) мають гіпералгезуючий ефект. Механізм цієї дії полягає у порушенні гальмівних процесів у ноцицептивній системі. Фторхінолони – це інгібітори ГАМК-рецепторів. Цей ефект посилюється за наявності нестероїдних протизапальних препаратів [1]. Під час лікування фторхінолонами може виникнути стан гіпоглікемії, яка розвивається унаслідок певних процесів. По-перше, деякі фторхінолони активують вивільнення інсуліну з панкреатичних острівців шляхом блокади АТФ-чутливих калієвих каналів. По-друге, вони стимулюють секрецію інсуліну та пригнічують калієві АТФ-канали дозозалежним чином [5]. Загалом при СДС застосовують тривалі курси АБТ, мінімальна тривалість яких становить 7-14 днів.
Емпіричну АТБ гнійно-некротичних форм ІДС, згідно з критеріями PEDIS, запропоновану В.М. Мавродієм і Н.К. Дзюбаном (2014), наведено в таблиці 5 [2].
Одним із важливих аспектів, які стосуються ІДС, є втрата кінцівки внаслідок прогресування інфекції. Відомо, що ризик ампутації кінцівки у хворих на ЦД у 30-40 разів вищий, ніж у пацієнтів без ЦД. Периферична нейропатія (91%), виразкування, інфекція, периферична ангіопатія – чинники, що ускладнюють перебіг виразок стопи і призводять до ампутації кінцівок у хворих на ЦД [29]. Низький рівень соціально-екномічного статусу, куріння, чоловіча стать, ниркова патологія, а також високий рівень цукру і тригліцеридів асоціюються з ризиком ампутацій. У багатьох дослідженнях доведено, що ризик високих ампутацій зростає на 42% у пацієнтів, які неодноразово отримували АБТ порівняно з пацієнтами без попереднього застосування АБ. Тривалі необґрунтовані курси АБТ сприяють селекції резистентних штамів, утруднюють проведення подальшого лікування і підвищують ризик ампутацій [17, 28-30].
За класифікацією Вагнера ризик ампутації нижньої кінцівки на 61% нижчий у пацієнтів, які раніше отримували консервативні процедури, ніж у тих, кому лікувальні заходи не проводили. Зростання на один пункт у класі за Вагнером призводить до збільшення вірогідності ампутацій на 65% у госпіталізованих пацієнтів з інфекційними ускладненнями нижньої кінцівки. При госпіталізації рівень глюкози <11,09 ммоль/л асоціюється з меншими показниками захворюваності й летальності. Тобто належний глікемічний контроль є критичним чинником для ІДС і сприяє швидшій ліквідації та загоєнню виразки. Хронічна гіперглікемія – найбільш частий етіологічний чинник ускладнень ЦД. Іще одним застереженням є те, що інформація про попереднє застосування АБ базується на самооцінці пацієнтів, а не на медичних протоколах. Недотримання фармакологічного лікування ЦД корелює з підвищеним ризиком ампутації. Доведено, що цей ризик був нижчий у пацієнтів, які отримували консервативне лікування до госпіталізації.
Протоколи антимікробної терапії для амбулаторних хворих із СДС потребують постійного перегляду. Контроль захворювання до госпіталізації може істотно зменшити кількість ампутацій у хворих із СДС. Знання чинників, що позначаються на перебігу захворення, і їх вплив на частоту ампутації мають вирішальне значення у забезпеченні мультидисциплінарних команд інформацією для розроблення оптимальних протоколів догляду і терапії для пацієнтів із ЦД. Отже, регулярне консервативне лікування і дотримання профілактичних заходів із корекції ЦД – важливі чинники, які сприяють значному зниженню ризику ампутації кінцівок.
Водночас залишаються без відповіді питання, де і коли можуть бути застосовані ці чи інші (новітні) препарати, особливо їх місце в емпіричній терапії, або чи слід їх застосовувати тільки у випадках підтверджених інфекцій, спричинених бактеріями з множинною антибіотикорезистентністю. Для вирішення цих питань необхідні подальші дослідження. Крім того, потрібен аналіз економічної ефективності й доцільності застосування нових АБ. Тільки з часом буде зрозуміло, чи здатне широке застосування АБ більше і швидше впливати на виникнення і поширення резистентності до лікування збудників порівняно із тим, що відзначають клініцисти на сучасному етапі АБТ.
При лікуванні ІДС виникає необхідність дистанційного контролю та корекції відповідних заходів у пацієнтів із ЦД. Чи реально і можливо лікарю на відстані амбулаторно провести АБТ? Наразі немає достатніх доказів, аби рекомендувати якісь із наявних АБ чи які можна віднести до першої лінії лікування легких форм ІДС. Хоча у випадку лінезоліду принаймні існує достатня доказова база щодо переваг його застосування над ванкоміцином для застосування у деяких пацієнтів із підтвердженою інфекцією MRSA. Місце нових АБ в АБТ інфекцій, викликаних грамнегативними збудниками, мабуть, найбільш незрозуміле. Дані in vitro свідчать про те, що, наприклад, спектри активності тайгецикліну і цефтобіпролу стосовно ІДС-асоційованих грамнегативних бактерій є недостатніми, щоб рекомендувати їх для широкого застосування в емпіричній терапії. Наразі є небагато даних клінічних досліджень, які дозволили б припустити, що ці препарати в майбутньому матимуть клінічне значення. А такі властивості, як введення 1 р/ день або активність щодо грамнегативних і мультирезистентних грампозитивних штамів бактерій, виправдовують застосування цих препаратів [25].
Отже, АБТ залишається однією з важливих складових комплексного лікування ІДС. З іншого боку, зростає криза внаслідок розвитку резистентності бактерій до АБ, пов’язана із широким застосуванням АБТ. Проблема загострилася настільки, що в майбутньому ми можемо не мати ефективних препаратів для лікування інфекцій і ІДС посідатиме одне з перших місць у цьому переліку. До виникнення АБ ампутації кінцівки були чи не єдиним методом лікування ІДС. Із появою пеніциліну (і сульфаніламідів) ситуація кардинально змінилася – частота ампутацій зменшилася із 70 до 30%, смертність – з 10-9 до 4%. Після інсуліну АБ стали важливою ланкою лікування інфекційних ускладнень у хворих на ЦД. Стало можливим проводити ампутації нижче коліна й безпечно накладати первинні шви для закриття ранових дефектів.
Сьогодні на ринку представлено чимало ефективних антибактеріальних препаратів для лікування ІДС для перорального, парентерального і місцевого застосування. В останні роки, крім комплексного лікування, починають використовувати додаткові методи (гіпербаричну оксигенацію, фактор стимуляції загоєння ран, терапію стовбуровими клітинами) і технології (вакуум-терапію, розвантаження стопи, реваскуляризацію кінцівки) [14-16, 21]. Незважаючи на впровадження нових методів і технологій лікування ІДС, не можна ігнорувати проблему надмірного й нераціонального застосування антибактеріальних препаратів. За останні 30 років накопичений багатий досвід для розроблення рекомендацій з урахуванням таких критеріїв, як наявність інфекції у рані; які збудники спричинили інфекцію; яку місцеву терапію і хірургічну тактику слід застосувати; яку оптимальну АБТ призначити. Для оптимізації АБТ при ІДС B.A. Lipsky (2016) запропонував таку схему застосування АБ: чітко визначені показання, фокус на спектр збудників, короткий курс терапії. Зазначається, що за останні роки, крім тенденції зростання резистентності бактерій, зменшується кількість нових АБ на ринку, що потребує пошуку нових напрямів і джерел для їхнього синтезу (одним із таких є ґрунт). З великої когорти препаратів було виділено тейксобактин, який характеризується унікальним механізмом дії стосовно більшості грампозитивних бактерій (у тому числі мультирезистентних) і на який покладаються великі надії в майбутньому [24]. Існує й інший шлях – відродження старих методик, зокрема застосування бактеріофагів, що доведено останніми дослідженнями в країнах Європи. Використання підходу, який поєднує сучасні й майбутні інноваційні технології, допоможе покращити результати лікування ІДС.
Висновки
- СДС є складною проблемою, розв’язання якої потребує великих зусиль та коштів. У найближчому майбутньому вона не стане менш актуальною через постійне зростання поширеності випадків в усьому світі.
- За останні десятиліття у фахівців помітно зросли знання процесів патофізіології, діагностики та лікування хірургічних ускладнень СДС, зокрема інфекції м’яких тканин і кісток стопи. ІДС – гетерогенна група інфекцій у різноманітній популяції пацієнтів. Тому важко визначити одне оптимальне й універсальне лікування, у тому числі вибір антибактеріальних препаратів і тривалість їх введення для всієї популяції пацієнтів.
- Розв’язання проблеми полягає в реалізації керівних принципів і рекомендацій стосовно лікування ІДС, моніторування процесів і результатів лікування, постійне навчання медичних працівників і хворих, проведення нових досліджень для покращення результатів лікування і зниження частоти ампутацій і летальності у пацієнтів з ІДС.
- Розв’язання проблеми полягає в реалізації керівних принципів і рекомендацій стосовно лікування ІДС, моніторування процесів і результатів лікування, постійне навчання медичних працівників і хворих, проведення нових досліджень для покращення результатів лікування і зниження частоти ампутацій і летальності у пацієнтів з ІДС.
Література
1. Игонькина С.И. и др. Влияние фторхинолонов на систему болевой чувствительности // Боль. – 2004. – № 3. – С. 17-19.
2. Мавродий В.М. Синдром диабетической стопы / В.М. Мавродий, Н.К. Дзюбан // Український терапевтичний журнал. – 2014. – № 3-4. – С. 104-114.
3. Приступюк М.О. Удосконалення хірургічної техніки ампутації пальців та лікування хворих із синдромом дібетичної стопи / М.О. Приступюк, Б.Г. Безродний // Эндокринная хирургия / Endocrine Surgery. – 2015. – № 8 (72): 113-117.
4. Розробка та впровадження методів діагностики та лікування синдрому діабетичної стопи /Б. Безродний, І. Колосович, В. Короткий і співавт. // Звіт про науково-дослідну роботу, 2015, м. Київ, № держреєстрації 0114U003980. – 33 с.
5. Шлапак І.П., Галушко О.А. Цукровий діабет: погляд з позиції лікаря-анестезіолога: навч. посібник. – К.: Книга-плюс, 2010. – 60 с.
6. Abbas M. In diabetic foot infections antibiotics are to treat infection, not to heal wounds / M. Abbas, I. Ukay, B.A. Lipsky // Expert Opin. Pharmacother. – 2015; 16 (6): 821-32.
7. Antibiotic Guidelines 2015-2016. Treatment Recommendations For Adult Inpatients / S. E. Cosgrove, E. Avdic, K. Dzintars et al. // The Johns Hopkins Hospital Antimicrobial Stewardship Program, 2015. – 164.
8. Antibiotic Therapy and Culture Results For Diabetic versus Non-Diabetic Foot Wounds / L. Faroqi, R. Guberman, J. Vernaleo et al. // Journal of Diabetic Foot Complications. – 2013; 4 (5): 24-28.
9. Association of bacteria in diabetic and non-diabetic foot infection – An investigation in patients from Bangladesh /M. Karmaker, S. K. Sanyal, M. Sultana et al. // J Infect. Pub. Health, 2016; 9 (3): 267-277.
10. A systematic review of the effectiveness of interventions in the management of infection in the diabetic foot / E.J. Peters, B.A. Lipsky, A.R. Berendt et al. // Diabetes Metab Res Rev., 2012; 28 (1): 142-62.
11. Bacterial etiology and antibiotic susceptibility pattern of diabetic foot infections in Tabriz, Iran.
12. Bader M.S. Management of hospitalized patients with diabetic foot infection / MS Bader, A. Alavi // Hosp. Pract, 1995-2014; 42 (4): 111-25.
13. Bader M.S. Medical Management of Diabetic Foot Infections / M.S. Bader, A. Brooks // Postgraduate Medicine. – 2012; 124 (2): 102-113.
14. Diabetic foot infections: what have we learned in the last 30 years? / I. Uсkay, J. Aragоn-Sаnchez, D. Lew et al. // Internat. J Infect. Dis. – 2015; 40: 81-91.
15. Diabetic foot infections: recent literature and cornerstones of management / I. Uсkay, K. Gariani, V. Dubois-Ferriеre et al. // Curr. Opin. Infect. Dis. – 2016; 29 (2): 145-52.
16. Diabetic foot infection in hospitalized adults / D.E. Katz, N.D. Friedman, E. Ostrovski et al. // J. Infect. Chemother. – 2016; 22 (3): 167-73.
17. Diabetic Foot Infection: Preliminary Results of a Fast-Track Program with Early Endovascular Revascularization and Local Surgical Treatment / N. Troisi, L. Ercolini, E. Chisci et al. // Ann. Vasc. Surg. – 2016; 30: 286-91.
18. Do diabetic foot infections with methicillin-resistant Staphylococcus aureus differ from those with other pathogens? / B. Zenelaj, C. Bouvet, B.A. Lipsky et al. // Int. J Low Extrem. Wounds. 2014, 13 (4): 263-72.
19. Ertapenem versus piperacillin/tazobactam for diabetic foot infections in China: a Phase 3, multicentre, randomized, double-blind, active-controlled, non-inferiority trial / Z.R. Xu, X.W. Ran, Y. Xian et al. // J. Antimicrob. Chemother. – 2016; 71 (6): 1688-96.
20. 2012 Infectious Diseases Society of America Clinical Practice Guideline for the Diagnosis and Treatment of Diabetic Foot Infectionsa/B. A. Lipsky, A. R. Berendt, P. B. Cornia et al. // Clin. Infect. Dis. – 2012; 54 (12): 132-173.
21. Interventions in the management of infection in the foot in diabetes: a systematic review / E.J. Peters, B.A. Lipsky, J. Aragоn-Sаnchez et al. // Diabetes Metab. Res. Rev. – 2016; 32 (1): 145-153.
22. Isolation and Antibiotic Susceptibility of the Microorganisms Isolated from Diabetic Foot Infections in Nemazee Hospital, Southern Iran/ M. Anvarinejad, G. Pouladfar, A. Japoni et al. // J Pathog. – 2015; http://dx.doi.org/10.1155/2015/328796.
23. Lipsky B.A. Medical Treatment of Diabetic Foot Infections / B.A. Lipsky // Clin. Infect. Dis. – 2004; 39: 104-14.
24. Lipsky B.A. Diabetic foot infections: Current treatment and delaying the ’post-antibiotic era’ / B.A. Lipsky // Diabetes Metab. Res. Rev. – 2016; 32 (1): 246-53.
25. Nesrene S. Omara Novel antibiotics for the management of diabetic foot infections / N.S. Omar, M.R. El. – Nahas, J. Gray // International Journal of Antimicrobial Agents. – 2008; 31: 411-419.
26. Omar N.S. Novel antibiotics for the management of diabetic foot infections / N.S. Omar, M.R. El-Nahas, J. Gray / Internat. J Antimicrob. Agents. – 2008; 31 (5): 411-419.
27. Phase 3 study comparing tigecycline and ertapenem in patients with diabetic foot infections with and without osteomyelitis / L. Lauf, Z. Ozsvаr, I. Mitha et al. // Diag. Microb. Infect. Dis. – 2014; 78: 469-480.
28. Predictors of Severity in Diabetic Foot Infections / D. Callahan, J. Keeley, H. Alipour et al. // Ann. Vasc. Surg. 2016; 33 (1); 103-8.
29. Retrospective cohort study evaluating the incidence of diabetic foot infections among hospitalized adults with diabetes in the United States from 1996-2010 / B.M. Duhon, El. O. Hand, C.K. Howell et al. // American Journal of Infection Control. – 2016; 44: 199-202.
30. Risk Factors for Foot Amputation in Patients Hospitalized for Diabetic Foot Infection / M.T. Quilici, F.S. Del Fiol, A.E. Vieira et al. // J Diabetes Res. – 2016; http://dx.doi.org/10.1155/2016/8931508.
31. Systemic antibiotics for treating diabetic foot infections / A. Selva Olid, I. Solа, L.A. Barajas-Nava et al. // Cochrane Database of Systematic Reviews: ed. JohnWiley & Sons, Ltd. –2015; 9: 82 p.
32. Tissue penetration and exposure of cefepime in patients with diabetic foot infections / W. So, J.L. Kuti, A. Shepard et al. // Internat. J Antimicrob. Agents. – 2016; 47 (3):
247-248.
33. The Sanford Guide to Antimicrobial Therapy 2016 (46th edition) / D.N. Gilbert; H.F. Chambers; G.M. Eliopoulos et al. // Sperryville, Va: Antimicrobial Therapy, 2016. – 246.
Тематичний номер «Хірургія, Ортопедія, Травматологія» № 4 (30), грудень 2017 р.