4 січня, 2018
Железодефицит в практике семейного врача
Железодефицит (ЖД) относится к числу наиболее актуальных и глобальных проблем современной медицины. Согласно последним статистическим данным, около 2 млрд людей (≥30% населения земного шара) страдают этой патологией.
Наиболее часто ЖД диагностируют у женщин репродуктивного возраста с обильными менструальными выделениями, а также у пациентов с различными хроническими воспалительными заболеваниями (ХВЗ): у 45% больных воспалительными заболеваниями кишечника (ВЗК), у 43-100% пациентов с хронической сердечной недостаточностью (ХСН), у 24-85% больных хронической болезнью почек (ХБП) и 42,6% пациентов онкологических клиник (Cappellini М. et al., 2017).
ЖД ассоциируется с ухудшением качества жизни, прогрессивным снижением работоспособности, появлением усталости, а также развитием депрессии и когнитивных нарушений. ЖД является предиктором смертности при ХСН и ХБП (Peyrin-Biroulet L. et al., 2015). Такая высокая распространенность ЖД и неблагоприятные последствия обосновывают рассмотрение данной проблемы в практической деятельности врачей общей практики, в том числе семейных врачей, которые могут первыми распознать признаки дефицита железа, вовремя назначить необходимые препараты для его коррекции, предотвратив тем самым развитие железодефицитной анемии (ЖДА) и других осложнений.
Механизм возникновения ЖД при ХВЗ
Железо необходимо для всех живых организмов, так как его анионы входят в состав функциональных групп белков, транспортирующих кислород, и ферментов, катализирующих реакции образования энергии и различные метаболические процессы. Избыток свободного железа вызывает локальное повреждение тканей за счет повышенного образования радикалов, а также посредством активизации бактерий, использующих железо организма хозяина. Поэтому безопасные границы содержания железа в организме очень невелики и строго контролируются во избежание развития как ЖД, так и перегрузки этим микронутриентом.
Большое значение в обмене железа отводится процессам его транспортировки и хранения. Перенос ионов железа осуществляет главный железотранспортный белок – трансферрин, депонируется железо в другом белке – ферритине. Универсальным гуморальным регулятором метаболизма этого микроэлемента является гепсидин – белок, богатый цистеином и синтезируемый в печени. Именно гепсидин и его трансмембранный рецептор, ферропортин, контролируют основные пути транспорта железа и его биодоступность в организме человека. Уровень гепсидина регулируется плазменной концентрацией железа и размерами депо этого нутриента по принципу обратной связи. Ингибирующее влияние на гепсидин оказывают основные потребители железа – клетки-предшественники эритроцитов. Действие гепсидина заключается в снижении активности белка ферропортина, отвечающего за выход ионов железа из клетки в кровь: происходит накопление железа в энтероцитах, ферритине и задержка железа внутри макрофагов. Гепсидин – белок острой фазы воспаления, уровень которого повышается при любых воспалительных процессах и бактериальных инфекциях; в таких условиях синтез и высвобождение гепсидина индуцируются циркулирующими провоспалительными цитокинами, в частности интерлейкином-6. В результате увеличивается деградация ферропортина, блокируется выход железа из макрофагов и растет клеточное содержание железа. В конечном итоге это приводит к снижению уровня циркулирующего железа и развитию ЖД.
Различают абсолютный и функциональный ЖД. Абсолютный возникает при истощении общего запаса железа в организме, функциональный – при неспособности железа выйти из макрофагов ретикулоэндотелиальной системы, что обусловливает возникновение кинетического дисбаланса между увеличением потребности в железе костного мозга и запасами этого микроэлемента. Таким образом, пациенты с ХВЗ имеют более высокие потребности в железе, необходимые для поддержания относительно высокого уровня циркулирующего железа, по сравнению со здоровыми лицами. В результате значительного истощения запасов железа и длительного существования ЖД развивается ЖДА с присущей ей клинической картиной, нарушением работы многих внутренних органов и развитием характерных осложнений.
Новая дефиниция ЖД
Во врачебной среде существует некоторая неопределенность в отношении необходимости диагностирования и лечения ЖД у пациентов с ХВЗ: совпадение клинических проявлений ЖД с признаками основного заболевания, нечеткость лабораторных данных затрудняют диагностику этого состояния. Поэтому многие врачи недооценивают ЖД, несмотря на то что он может спровоцировать развитие ЖДА. Частично такая ситуация обусловлена гетерогенностью рекомендаций по диагностике и лечению ЖД при ХВЗ.
 В настоящее время существует несколько дефиниций ЖД, одна из них разработана и представлена ВОЗ. К сожалению, термин, сформулированный ВОЗ, не предназначен для использования в клинических ситуациях, протекающих с повышением уровня ферритина, в том числе ХВЗ. Группа экспертов под руководством М. Cappellini (2017), проанализировав разнообразные определения ЖД, представленные разными медицинскими сообществами, рекомендуют в клинической практике применять следующую дефиницию этого состояния:
В настоящее время существует несколько дефиниций ЖД, одна из них разработана и представлена ВОЗ. К сожалению, термин, сформулированный ВОЗ, не предназначен для использования в клинических ситуациях, протекающих с повышением уровня ферритина, в том числе ХВЗ. Группа экспертов под руководством М. Cappellini (2017), проанализировав разнообразные определения ЖД, представленные разными медицинскими сообществами, рекомендуют в клинической практике применять следующую дефиницию этого состояния:
Клиника ЖД
Большинство из клинических проявлений ЖД (усталость, истощение) являются неспецифическими; это означает, что врачи не всегда вовремя распознают это состояние, вследствие чего ЖД не диагностируется и его коррекция не проводится.
Железодефицит при ХСН
Распространенность ЖД при ХСН возрастает по мере прогрессирования кардиологической патологии. Этиология ЖД при ХСН еще окончательно не изучена, но доказана ее связь с уменьшением абсорбции железа в желудочно-кишечном тракте (ЖКТ) вследствие отека и увеличения гастроинтестинальных потерь, что частично обусловлено приемом антитромбоцитарных и антикоагулянтных препаратов, но в большей мере является следствием хронического воспалительного процесса. Диагностика ЖД при ХСН осложняется тем фактом, что основные симптомы ХСН (усталость, непереносимость физической нагрузки) совпадают с ключевыми признаками ЖД. Усталость у пациентов с ХСН может быть обусловлена ЖД и ассоциирована со снижением переносимости физической нагрузки и работоспособности. В одном исследовании, в котором применялся тест с 6-минутной ходьбой, было показано, что физическая нагрузка чаще провоцировала появление жалоб у пациентов с ХСН и ЖД по сравнению с больными ХСН, но не имевшими такого сопутствующего состояния (35 vs 27% соответственно; р=0,028); наиболее распространенным клиническим проявлением была усталость.
Сопутствующий ЖД при ХСН не только ограничивает переносимость физических нагрузок, но и ухудшает качество жизни вне зависимости от наличия анемии. В исследовании FAIR-HF у пациентов с ХСН, получавших внутривенные (в/в) инъекции железа по поводу ЖД, результаты теста с 6-минутной ходьбой значительно улучшились (р<0,001 на 4, 12 и 24-й нед) по сравнению с группой плацебо (Ankerи S. et al., 2009).
Доказано, что ЖД неблагоприятно влияет на исходы ХСН: наличие ЖД ассоциировано с возрастанием риска смертности на 40-60% и увеличением длительности стационарного лечения. Оказывается, риск госпитализации пациентов, не получавших лечение по поводу ЖД, возрастает в 2 раза по сравнению с больными, прошедшими курс терапии препаратами железа (относительный риск – ОР – 2,23; 95% ДИ 1,59-3,42; р<0,010). G. Filippatos и соавт. (2013) утверждают, что коррекция ЖД позволяет уменьшить длительность госпитализации больных ХСН (отношение шансов – ОШ – 0,39; 95% ДИ 0,19-0,82; р=0,009). Таким образом, скрининг ЖД является независимой терапевтической целью у больных ХСН.
Железодефицит при ХБП
ЖД при ХБП обусловлен снижением гастроинтестинальной абсорбции железа, мальнутрицией и кровопотерей, их повреждающее действие усиливается на фоне хронического воспалительного процесса. Кровопотеря у больных ХБП, как правило, обусловлена частым забором крови (в диагностических целях) и проведением некоторых лечебных манипуляций (диализ). Потребление железа также возрастает при использовании препаратов, стимулирующих эритропоэз: терапия эритропоэтином, необходимая для эффективной коррекции анемии почечного генеза, может усугубить ЖД и стать причиной недостаточного ответа на введение эритропоэтина. Доказано, что анемия, развивающаяся на фоне ХБП, ассоциируется со снижением качества жизни. Т. Drueke и соавт. (2006) установили, что нормализация уровня гемоглобина приводит к значительному улучшению физического функционирования (р<0,001).
Наибольшая значимость ЖД при ХБП заключается в его способности трансформироваться в хроническую анемию. Анемия почечного генеза ассоциирована с увеличением риска заболеваемости и смертности. По данным С. Kovesdy и соавт. (2006), низкий уровень гемоглобина у больных ХБП, не нуждающихся в проведении диализа, коррелирует с достоверным возрастанием риска смертности в преддиализный период и развития терминального заболевания почек (ОШ при гемоглобине <11, 11-12 и 12-13 г/дл составляет соответственно 2,57 (95% ДИ 1,85-3,58), 1,97 (95% ДИ 1,45-2,66) и 1,19 (95% ДИ 0,86-1,63) по сравнению с уровнем гемоглобина >13 г/дл (р<0,001 во всех случаях).
Неблагоприятное прогностическое влияние на исходы ХБП подтвердили D. Keith и соавт. (2004). Исследователи установили, что пациенты с ХБП II-III стадии, у которых наступил летальный исход в течение периода наблюдения, гораздо чаще были подвержены анемии (II стадия – 42,1%; III стадия – 42,2%) по сравнению с выжившими больными (II стадия – 24%; III стадия – 28,3%).
Анемия при ХБП ассоциируется с высоким уровнем кардиоваскулярной заболеваемости, увеличением частоты госпитализации (ОШ 2,18; 95% ДИ 1,76-2,70), являясь одной из основных причин возникновения кардиоренального анемического синдрома.
Железодефицит при ВЗК
Основными причинами возникновения ЖД при ВЗК являются нарушение гастроинтестинальной абсорбции железа вследствие хронического воспаления, резекции кишечника (особенно при болезни Крона), мальнутриция и хроническая кровопотеря. В данном случае ЖД хорошо поддается медикаментозной коррекции до развития ЖДА.
ЖДА является одним из наиболее распространенных осложнений и частой внекишечной манифестацией ВЗК. Согласно литературным данным, около 50% больных ВЗК с диагностированной ЖДА не получают необходимого лечения. Авторы недавно опубликованного исследования утверждают, что 1/3 пациентов с ВЗК не знают о наличии у них анемии и не обсуждают возможность ее возникновения с лечащим врачом (Danese S. et al., 2014). При этом большинство пациентов объясняют беспокоящую их слабость ВЗК, но не ЖДА. На самом деле, хроническая усталость, вызванная ЖДА, может быть достаточно интенсивной и снижать качество жизни больных ВЗК и анемией в той же мере, как абдоминальная боль и диарея. Восполнение запасов железа способствует значительному улучшению качества жизни пациентов с язвенным колитом и болезнью Крона (р<0,001); изменения уровня гемоглобина (но не активности основного заболевания) ассоциированы с увеличением значений шкалы SF-36 (р=0,005).
Диагностика ЖД при ХВЗ
В настоящее время нет единого международного согласительного документа по диагностике и коррекции ЖД при ХСН, ХБП и ВЗК вне зависимости от наличия ЖДА. В некоторых руководствах ЖД выделяется в качестве самостоятельного состояния, при этом для его диагностики рекомендуется определить уровень гемоглобина, сывороточного ферритина и насыщения трансферрина. Несмотря на некоторое единодушие в выборе диагностических маркеров, эксперты различных международных организаций не смогли прийти к единому мнению в отношении определения пороговых значений указанных параметров. Принимая во внимание тот факт, что уровень сывороточного ферритина изменяется в условиях хронического воспаления, некоторые ведущие специалисты рекомендуют дополнительно установить активность воспалительного процесса посредством определения С-реактивного белка (СРБ) и скорости оседания эритроцитов. При этом в руководствах не вводятся пороговые значения этих показателей (наиболее распространенным нормативным значением СРБ является концентрация 5 мг/л, однако в некоторых согласительных документах этот показатель не считается верным). М. Cappellini и соавт. (2017), проведя тщательный анализ положений современных руководств по диагностике ЖД и анемии при различных ХВЗ, сформулировали следующий постулат:
 Согласно мнению указанной группы экспертов, первоначальное обследование при этих заболеваниях должно включать оценку сывороточного ферритина, насыщения трансферрина, а также уровня гемоглобина (для диагностики ЖД, протекающего с низким или нормальным содержанием гемоглобина, а также для дифференциальной диагностики с ЖДА, при которой содержание железа находится в пределах нормативных значений, а концентрация гемоглобина снижена или сохранена). Следует принять во внимание проведение диализа при ХБП, активность и тяжесть воспалительного процесса при ВЗК. Поэтому М. Cappellini и соавт. считают, что гематологическое обследование больных ВЗК должно сочетаться с определением уровня СРБ, фекального кальпротектина/лактоферрина, при необходимости – с проведением инструментального обследования (эндоскопическое и ультразвуковое исследование).
Согласно мнению указанной группы экспертов, первоначальное обследование при этих заболеваниях должно включать оценку сывороточного ферритина, насыщения трансферрина, а также уровня гемоглобина (для диагностики ЖД, протекающего с низким или нормальным содержанием гемоглобина, а также для дифференциальной диагностики с ЖДА, при которой содержание железа находится в пределах нормативных значений, а концентрация гемоглобина снижена или сохранена). Следует принять во внимание проведение диализа при ХБП, активность и тяжесть воспалительного процесса при ВЗК. Поэтому М. Cappellini и соавт. считают, что гематологическое обследование больных ВЗК должно сочетаться с определением уровня СРБ, фекального кальпротектина/лактоферрина, при необходимости – с проведением инструментального обследования (эндоскопическое и ультразвуковое исследование).
Лечение ЖД при ХВЗ
Способы коррекции ЖД
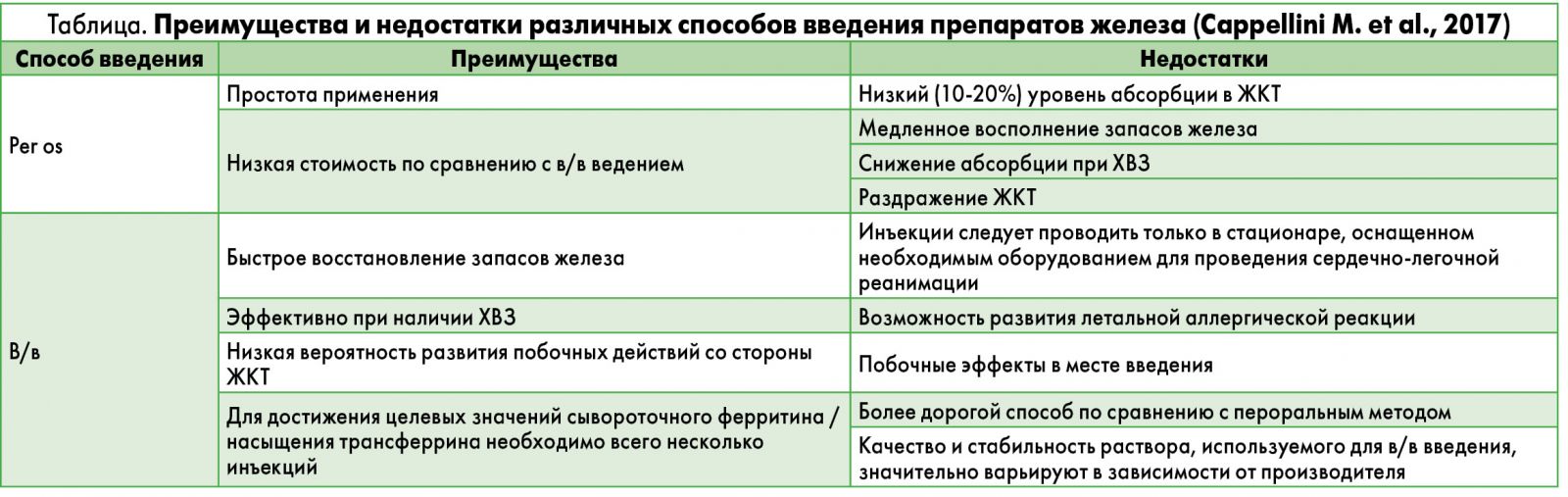
В настоящее время лечение ЖД условно подразделяют на 2 подгруппы в зависимости от использования перорального или в/в способа введения препаратов железа; преимущества и недостатки каждого из них представлены в таблице.
Для лучшего понимания особенностей медикаментозной коррекции ЖД следует привести результаты систематического обзора, выполненного L. Peyrin-Biroulet и соавт. (2015), в котором ученые проанализировали положения 29 профессиональных руководств (8 американских, 6 европейских, 4 британских, 3 канадских, 2 международных, 2 французских, 1 польского, 1 австралийского, 1 мексиканского, 1 японского) по диагностике и лечению ЖД. В подавляющем большинстве практических руководств (18 из 27) пероральный способ введения препаратов назван первой линией терапии при ЖД. Пероральную терапию рекомендуется назначать представителям общей популяции, больным ВЗК, ХСН, ХБП, детям, а также беременным женщинам.
В/в способ введения препаратов железа рассматривается в качестве альтернативного метода лечения, который следует применять при недостаточной эффективности пероральной терапии, непереносимости или мальабсорбции солей железа. Этот способ коррекции ЖД также может использоваться при лечении анемии, индуцированной химиотерапией, абсолютном и функциональном ЖД. Авторы обзора подчеркивают, что в/в введение препаратов железа у больных ХСН может спровоцировать перегрузку объемом и ухудшить течение основного заболевания.
Цели терапии
В некоторых практических руководствах по диагностике и лечению ЖД назначенная терапия считается эффективной при условии достижения строго фиксированных значений гемоглобина, в других терапевтической целью является повышение уровня гемоглобина на 1-2 г/дл в месяц. При ХБП, ХСН и ВЗК рекомендуется тщательно контролировать уровень ферритина: по окончании курса лечения его значения должны превышать 100 мкг/л (в некоторых руководствах вводится более высокое пороговое значение: >200 мкг/л).
В некоторых согласительных документах в качестве терапевтической цели используется другой показатель – насыщение трансферрина. Критерием эффективности проводимой терапии является увеличение исходных значений данного маркера на 20% (в двух рекомендациях указываются иные пороговые значения: 30 и 50% соответственно).
Препарат выбора для перорального приема
В качестве препарата выбора для проведения пероральной терапии может рассматриваться Сорбифер Дурулес, содержащий 320 мг сульфата железа, что соответствует 100 мг двухвалентного железа и 60 мг аскорбиновой кислоты, улучшающей всасывание и усвоение данного микроэлемента. В отличие от препаратов трехвалентного железа прием Сорбифер Дурулеса позволяет достаточно быстро (спустя 2-3 нед) восстановить уровень гемоглобина. Кроме того, технология производства препарата обеспечивает постепенное и непрерывное высвобождение ионов железа, равномерное поступление лекарственного средства в течение длительного времени, что позволяет избежать создания высокой локальной концентрации железа и предотвратить раздражение слизистой оболочки ЖКТ. Специальная оболочка, которой покрыты таблетки Сорбифер Дурулес, защищает зубы от образования на них желтой каймы при длительном курсе лечения. Рекомендованная схема применения предполагает прием 1 таблетки 2 р/сут на протяжении 3-4 мес под контролем клинического анализа крови до нормализации уровня гемоглобина. Эффективность препарата Сорбифер Дурулес в лечении ЖД различного генеза подтверждена многими отечественными учеными, в том числе А. И. Мартыновым и соавт. (2000), Г. И. Козинец и соавт. (2008).
Таким образом, ЖД – это чрезвычайно распространенное состояние в практике семейного врача, своевременная и эффективная коррекция которого позволит повысить качество жизни больных ВЗК, ХСН и ХБП, уменьшить заболеваемость и смертность в этих когортах больных. Высокая терапевтическая эффективность Сорбифер Дурулеса, хорошая переносимость, обусловленные составом и техническими особенностями производства, позволяют успешно использовать данный препарат для лечения ЖД в амбулаторной практике даже у пациентов с тяжелыми сопутствующими заболеваниями.
Список литературы находится в редакции.
Медична газета «Здоров’я України 21 сторіччя» № 24 (421), грудень 2017 р.