15 січня, 2018
Профилактика и лечение тромбозов: множество граней одной проблемы
Темы, связанные с профилактикой и лечением венозных и артериальных тромбозов, обсуждались в ходе многих заседаний ХVIII Национального конгресса кардиологов Украины. Помимо кардиологов в дискуссиях участвовали врачи смежных специальностей. На научных сессиях обсуждались не только современные подходы к ведению пациентов высокого кардиоваскулярного риска с острыми состояниями, но и проблемы, связанные с качеством препаратов, которые применяются в лечении таких больных.
 Член-корреспондент НАМН Украины, руководитель отдела реанимации и интенсивной терапии ГУ «ННЦ «Институт кардиологии им. Н.Д. Стражеско» НАМН Украины» (г. Киев), доктор медицинских наук, профессор Александр Николаевич Пархоменко провел мастер-класс «Персонифицированный подход к профилактике венозного тромбоэмболизма (ВТЭ) у кардиологических пациентов».
Член-корреспондент НАМН Украины, руководитель отдела реанимации и интенсивной терапии ГУ «ННЦ «Институт кардиологии им. Н.Д. Стражеско» НАМН Украины» (г. Киев), доктор медицинских наук, профессор Александр Николаевич Пархоменко провел мастер-класс «Персонифицированный подход к профилактике венозного тромбоэмболизма (ВТЭ) у кардиологических пациентов».
– Ежегодная заболеваемость ВТЭ среди представителей европеоидной расы в США составляет 104-183 случая на 100 тыс. человеко-лет (Not. Rev. Cardiol., 2015). В нашей стране такая статистика не ведется, однако если ориентироваться на показатели европейских стран, то частота развития ВТЭ может достигать 65 тыс. случаев в год. В связи с тем что возникновение ВТЭ сопряжено с высоким риском смерти, вопросы профилактики этих осложнений сегодня актуальны как никогда. Особого внимания заслуживают выявление и коррекция факторов риска, распространенность которых среди разных категорий пациентов очень велика. Однако, несмотря на накопленные теоретические знания, имеющиеся инструменты для оценки риска возникновения ВТЭ и наличие эффективных препаратов для их предупреждения, до сих пор мы не видим широкого внедрения профилактических мероприятий в повседневную врачебную практику. Это обусловлено прежде всего недостаточной настороженностью врачей, а также их инертностью, особенно когда речь идет о пациентах нехирургического профиля.
Между тем 50-70% симптоматических ВТЭ и 70-80% фатальных тромбоэмболий легочной артерии (ТЭЛА) развиваются именно у таких больных (W. Geets, 2008). Один только факт госпитализации по поводу острого терапевтического заболевания связан примерно с 8-кратным увеличением относительного риска развития ВТЭ, и такие пациенты составляют почти 25% среди тех, кто перенес данные осложнения (CHEST, 2004).
ТЭЛА – ведущая причина внезапной смерти у нехирургических пациентов в стационаре, причем в большинстве случаев диагноз устанавливается только при аутопсии (D.R. Hirsch et al., 1995). Особенно высокий риск ВТЭ характерен для пациентов, находящихся на лечении в отделениях интенсивной терапии и реанимации. Эти больные имеют ряд дополнительных специфических факторов риска: развитие сепсиса, получение вазопрессорной терапии, проведение медикаментозной седации, применение механической вентиляции, установка центрального венозного катетера, наступление терминальной стадии почечной недостаточности.
Профессор А.Н. Пархоменко озвучил результаты международного регистра ENDORSE, включившего данные более 68 тыс. пациентов хирургического и терапевтического профиля из 358 клиник 32 стран, оказывающих медицинскую помощь при острых состояниях. Согласно полученным результатам повышенный риск ВТЭ по критериям Американской коллегии торакальных врачей (АССР) имели почти 50% терапевтических больных. При этом наиболее частыми причинами развития у них ВТЭ были сердечно-сосудистые заболевания, острая сердечная недостаточность (СН), легочные инфекции, острые неинфекционные респираторные заболевания.
Кроме недостаточной профилактики ВТЭ, существует еще одна проблема – неправильное или необоснованное применение антикоагулянтов. На первый взгляд она кажется не такой актуальной, как первая. Тем не менее, согласно результатам украинского исследования «Территория безопасности», схемы назначения антикоагулянтов пациентам с острым коронарным синдромом (ОКС) и СН не соответствовали рекомендованным в 20 и 33% случаев соответственно. В то же время у части больных с низким риском ВТЭ (оценка по шкале Падуа <4 баллов) антикоагулянты применялись необоснованно, что увеличивало риск кровотечений без доказанной пользы (А.Н. Пархоменко и соавт., 2015). Эти данные свидетельствуют о недостаточном понимании врачами подходов к назначению антикоагулянтов.
В ходе выступления лектор поднял несколько важных вопросов в области тромбопрофилактики, которые часто вызывают затруднение у врачей. Между тем ответы на них можно получить в современных рекомендациях.
? Когда оценивать риск развития венозного тромбоза у госпитализированных пациентов?
Эксперты рекомендуют индивидуально оценивать риск ВТЭ и кровотечения у всех пациентов при госпитализации или прохождении стационарного лечения; при этом указывается на необходимость обсуждения с пациентами пользы и рисков, сопряженных с проведением тромбопрофилактики. Оценку риска необходимо проводить регулярно и как минимум каждые 48 ч (Шотландские междисциплинарные рекомендации, SIGN, 2010, 2014).
? Как оценивать риск венозного тромбоза при госпитализации у терапевтических больных?
Для оценки риска ВТЭ у госпитализированных пациентов терапевтического профиля рекомендовано использовать шкалу Падуа (CHEST, 2012; SIGN, 2010, 2014), где сумма баллов ≥4 указывает на высокий риск развития ВТЭ. Например, если пациент в возрасте старше 70 лет с ограниченной подвижностью, инфарктом миокарда (ИМ) в анамнезе и нарастающими симптомами СН набирает по шкале Падуа 5 баллов, это свидетельствует в пользу назначения медикаментозной профилактики ВТЭ.
? Как проводить медикаментозную профилактику ВТЭ у госпитализированных терапевтических пациентов?
Больным с высоким риском развития ВТЭ рекомендуется в качестве профилактики антикоагулянтная терапия с применением низкомолекулярного гепарина (НМГ) или фондапаринукса. Пациентам с высоким риском ВТЭ и активным кровотечением или при высоком риске возникновения большого кровотечения рекомендуется применение механических методов (компрессионные чулки, перемежающаяся пневматическая компрессия). При низком риске развития ВТЭ не рекомендовано применение медикаментозной или механической профилактики (CHEST, 2012).
 Использование простой шкалы для оценки риска и выполнение несложных рекомендаций по профилактике ВТЭ будут способствовать сохранению жизни многих больных. Доступность современных эффективных антикоагулянтов значительно облегчает задачу врача и делает тромбопрофилактику более удобной и безопасной как на госпитальном этапе, так и при ее продлении.
Использование простой шкалы для оценки риска и выполнение несложных рекомендаций по профилактике ВТЭ будут способствовать сохранению жизни многих больных. Доступность современных эффективных антикоагулянтов значительно облегчает задачу врача и делает тромбопрофилактику более удобной и безопасной как на госпитальном этапе, так и при ее продлении.
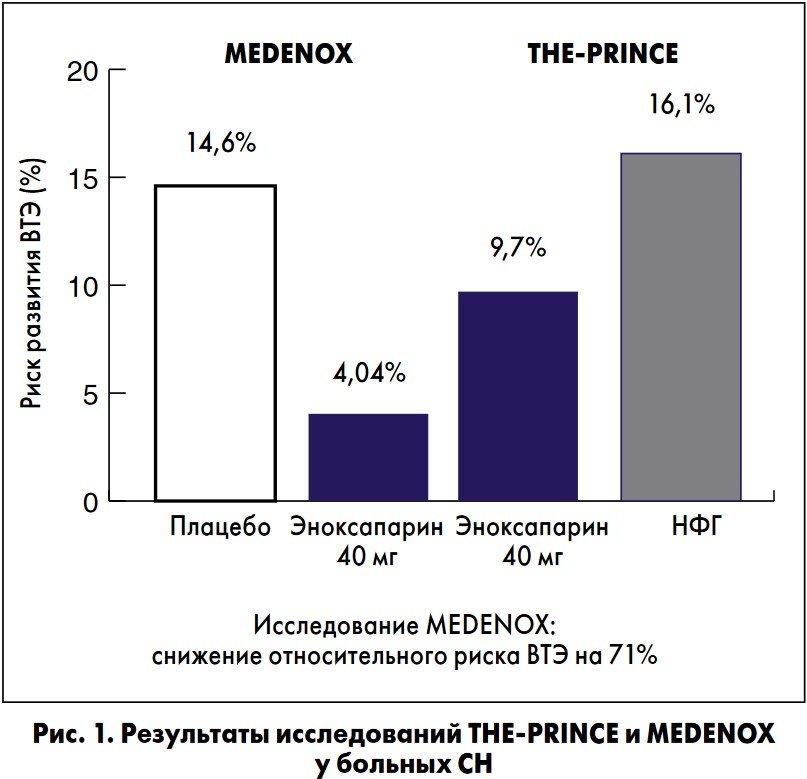
Один из таких антикоагулянтов – эноксапарин – в свое время способствовал переходу тромбопрофилактики на качественно новый уровень, продемонстрировав высокую эффективность в профилактике тромбоза глубоких вен (ТГВ) и ТЭЛА у пациентов терапевтического профиля (исследование MEDENOX), а также меньший риск возникновения больших кровотечений по сравнению с нефракционированным гепарином (НФГ) (метаанализ P. Missmetti, 2000). Эноксапарин также оказался эффективен в снижении риска ВТЭ у достаточно тяжелой категории пациентов – с СН ІІІ-IV функционального класса по NYHA (исследования MEDENOX и ТHE-PRINCE; рис. 1).
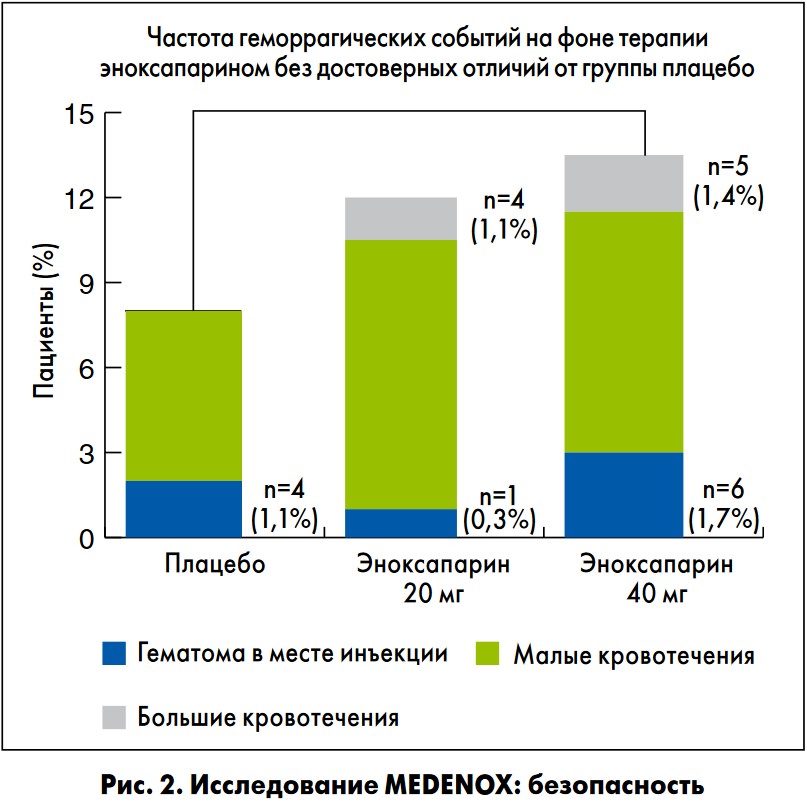 В первом исследовании терапия эноксапарином в дозе 40 мг/сут подкожно способствовала снижению относительного риска ВТЭ у пациентов с СН на 71% и увеличению выживаемости в течение 3 мес наблюдения (M.M. Samama, 2006). При этом частота геморрагических осложнений на фоне терапии эноксапарином не отличалась достоверно от таковой в группе плацебо (рис. 2).
В первом исследовании терапия эноксапарином в дозе 40 мг/сут подкожно способствовала снижению относительного риска ВТЭ у пациентов с СН на 71% и увеличению выживаемости в течение 3 мес наблюдения (M.M. Samama, 2006). При этом частота геморрагических осложнений на фоне терапии эноксапарином не отличалась достоверно от таковой в группе плацебо (рис. 2).
Сегодня эноксапарин широко применяется в клинической практике для профилактики и лечения тромбозов благодаря благоприятному профилю эффективность/безопасность.
Недавно были опубликованы результаты систематического обзора, которые показали, что эноксапарин так же эффективен в первичной профилактике ВТЭ у пациентов с острыми терапевтическими заболеваниями и у пациентов, подвергающихся ортопедическим вмешательствам, как и прямые пероральные антикоагулянты.
Авторы отмечают также, что терапия эноксапарином в дозе 40 мг 1 р/сут является более безопасной по сравнению с приемом прямых пероральных антикоагулянтов (С. Cimminiello et al., 2017).
В настоящее время эноксапарин рекомендован к применению для профилактики ВТЭ в самых разных клинических ситуациях: при госпитализации терапевтических пациентов высокого риска, проведении общехирургических вмешательств, ортопедических операциях по замене коленного или тазобедренного суставов. Длительность терапии эноксапарином для уменьшения риска развития ВТЭ составляет 6-14 дней или проводится в течение периода госпитализации. Однако вероятность развития ВТЭ после выписки может оставаться достаточно высокой.
? Как обеспечить продленную профилактику ВТЭ у пациентов высокого риска и целесообразен ли такой подход с точки зрения безопасности?
Целесообразность продленной тромбопрофилактики у пациентов нехирургического профиля с высоким риском оценивалась в исследовании EXCLAIM с применением эноксапарина. Полученные результаты продемонстрировали достоверное уменьшение частоты развития комбинированной первичной конечной точки (симптомный и асимптомный ТГВ, симптомная/фатальная ТЭЛА) при продленной терапии эноксапарином.
Вопрос о продленной тромбопрофилактике все еще остается открытым, ведь пока что не разработано четких критериев для решения вопроса о ее назначении. Тем не менее есть основания предполагать, что такой подход может принести пользу пациентам с выраженным снижением подвижности, онкологическими заболеваниями, протромботическими состояниями (антифосфолипидный синдром, тромбофилия). Для улучшения выявления больных с наиболее высоким риском ВТЭ и предполагаемой пользой от продленной тромбопрофилактики необходима разработка соответствующих инструментов. С этой целью в одном из исследований оценивалась роль исходного уровня D-димера как предиктора развития постгоспитальной ВТЭ у остро заболевших терапевтических пациентов (Cohen et al., 2011). Авторы сделали вывод, что у больных с исходным уровнем D-димера >2 верхних границ нормы наблюдается гораздо большая частота ВТЭ в постгоспитальном периоде (оценивали на 35-й день).
В рамках научной секции проводилось интерактивное голосование, в ходе которого практическим врачам было предложено ответить на вопросы, касающиеся проведения тромбопрофилактики в реальной практике. Оказалось, что всего лишь 52% голосовавших специалистов оценивают риск ВТЭ у своих пациентов. Кроме того, по итогам голосования можно сделать вывод, что при оценке риска многие из них не всегда получают объективные результаты. Так, выяснилось, что только 41% тестируемых знают, что для оценки риска ВТЭ у терапевтических пациентов следует использовать шкалу Падуа.
Интерактивный круглый стол «Правильный выбор лечения в неотложной ситуации: оценка и цена риска» предоставил возможность участникам конгресса обсудить вопросы, касающиеся качества препаратов, используемых в лечении пациентов высокого риска. Антитромботическое лечение требует существенных финансовых затрат, что побуждает врачей и пациентов к поиску путей удешевления фармакотерапии. Одним из них является замена оригинальных препаратов генериками или биосимилярами. Но всегда ли врач, назначая и те и другие, может рассчитывать на эффективность и безопасность лечения, задекларированные для оригинального препарата? Во всех ли случаях стремление удешевить терапию способствует экономии средств?
 Свою точку зрения по этим вопросам озвучила доктор медицинских наук, профессор кафедры фармакоэкономики Национального фармацевтического университета Министерства здравоохранения Украины (г. Харьков) Наталья Владимировна Бездетко.
Свою точку зрения по этим вопросам озвучила доктор медицинских наук, профессор кафедры фармакоэкономики Национального фармацевтического университета Министерства здравоохранения Украины (г. Харьков) Наталья Владимировна Бездетко.
– НМГ относятся к биологическим лекарственным средствам, а их аналоги называют биосимилярами. Биосимиляры – это полученные с помощью биотехнологического воспроизведения биологические лекарственные препараты с установленной (на основании сравнительных доклинических и клинических исследований) подобностью по характеристикам качества, биологической активности, эффективности и безопасности зарегистрированному референтному биологическому лекарственному средству, период патентной защиты которого закончился.
Профессор Н.В. Бездетко отметила, что генерики принципиально отличаются от биосимиляров, и если идеальный генерик класса А (то есть с доказанной терапевтической эквивалентностью референтному препарату) может быть идентичным «оригиналу», то биосимиляр всегда только подобен. Невозможность разработки копии биологического препарата, которая обладала бы таким же профилем эффективности и безопасности, – ключевой момент. Принципиальные различия в подходах к оценке терапевтической эквивалентности генериков и биосимиляров отражены и в современных регулирующих документах. Так, в руководстве Европейского агентства лекарственных средств (ЕМА) по клиническим и доклиническим исследованиям препаратов, содержащих НМГ, отмечается, что при установлении клинической эквивалентности биосимиляров НМГ нельзя полагаться на стандарты, принятые для генериков.
Процесс создания копии биологического препарата чрезвычайно трудный, что обусловлено сложной структурой его молекулы. Например, молекула эноксапарина содержит 21 стереоизомер, и, таким образом, при ее копировании возможен как минимум 21 вариант пространственной ориентации. Между тем от этого зависит качество связи белка с субстратом, ведь форма последнего точно соответствует определенному участку структуры молекулы (модель ключа и замка). Вот почему воспроизвести все уникальные структурные особенности молекулы биологического препарата практически невозможно даже при полном соблюдении технологии производства.
Профессор Н.В. Бездетко обратила внимание слушателей на тот факт, что в Украине до 2014 года отсутствовали регуляторные требования для регистрации биосимиляров. Большинство же биосимиляров, присутствующих сегодня на украинском фармацевтическом рынке, были зарегистрированы до момента появления соответствующего приказа МЗ Украины. Таким образом, в отсутствие доказательств равной клинической эффективности и безопасности говорить о взаимозаменяемости оригинальных биотехнологических лекарственных средств и их биосимиляров следует с большой осторожностью. Учитывая нынешние реалии, предстоит ответить на ключевой вопрос: всегда ли назначение более дешевых препаратов у пациентов с острыми состояниями приводит к уменьшению затрат? Профессор Н.В. Бездетко на простом примере продемонстрировала, что в таких ситуациях использование генериков или биосимиляров может не только не удешевить терапию, а, напротив, увеличить ее стоимость. Это подтверждают и результаты расчета затрат на лечение оригинальным эноксапарином (Клексан®) и его биосимилярами пациента с ОКС и массой тела 80 кг при применении дозы 100 анти-Ха МЕ/кг 2 р/сут (табл.).
Однако самой высокой ценой, которую мы платим за неправильный выбор, является здоровье пациента.
 Взгляд клинициста на озвученную проблему представила профессор ГУ «Днепропетровская медицинская академия МЗ Украины» (ДМА), доктор медицинских наук Елена Акиндиновна Коваль.
Взгляд клинициста на озвученную проблему представила профессор ГУ «Днепропетровская медицинская академия МЗ Украины» (ДМА), доктор медицинских наук Елена Акиндиновна Коваль.
Лектор рассказала о результатах небольшого слепого исследования, проводившегося на клинической базе кафедры внутренней медицины ДМА, в котором сравнивали фармакокинетический профиль различных формуляций эноксапарина у пациентов с острым ИМ (ОИМ). Оценивалась динамика активированного частичного тромбопластинового времени (АЧТВ) как один из принятых показателей оценки фармакокинетики биосимиляров (но не как отражение эффективности действия на фоне введения оригинального эноксапарина или эноксапарина отечественного производства). Решение о назначении того или иного препарата принимали лечащие врачи; лаборатория, независимо от решения врачей, слепым методом оценивала показатели АЧТВ каждые 3 ч. У пациентов, получавших Клексан® и биосимиляр, наблюдалась различная динамика АЧТВ в течение 48 ч от начала терапии, и эти отличия были особенно выраженными в первые 6-9 ч после введения препаратов. Применение оригинального препарата Клексан® приводило к более предсказуемому изменению АЧТВ в первые 9 ч, что особенно важно для догоспитального и раннего госпитального этапов лечения ОИМ, а также при планирующемся чрескожном коронарном вмешательстве. Эти данные в очередной раз подтверждают, что клиницисты не зря придают большое значение выбору препарата для лечения пациентов с острыми состояниями.
Профессор Е.А. Коваль подчеркнула важность одновременного эффективного воздействия на каждое звено гомеостаза у пациентов с высоким сердечно-сосудистым риском – только при соблюдении этого условия возможно заблокировать специфическое взаимодействие между тромбоцитами и лейкоцитами и предотвратить тромбообразование. Следовательно, каждый компонент антитромботического и противовоспалительного лечения (антиагрегант, антикоагулянт, статин) должен быть «на высоте» в отношении эффективности. С полной уверенностью этого можно ожидать, применяя оригинальные препараты, эффекты которых тщательно изучены.
Например, для оригинального клопидогреля (Плавикс®) установлено достоверное выраженное влияние на ключевой модулятор связи тромбоза и воспаления – CD40L у здоровых добровольцев (А. Hermann et al., 2001).
Множество исследований было посвящено изучению эффектов оригинального эноксапарина. В частности, для него установлено выраженное ингибирование высвобождения фактора фон Виллебранда у пациентов с ОКС, что ассоциировалось с достоверным снижением частоты неблагоприятных событий по сравнению с группой НФГ. В этом исследовании G. Montalescot и соавт. (1998) изучали прогностическую ценность пяти биомаркеров воспаления и тромбообразования у пациентов с ОКС, а также влияние терапии НФГ и эноксапарином на эти маркеры. Согласно результатам многовариантного анализа повышение уровня фактора фон Виллебранда в первые 48 ч являлось независимым и достоверным предиктором неблагоприятного исхода ОКС и потребности в реваскуляризации миокарда на 14-е и 30-е сутки наблюдения. Для специалистов, работающих с «острыми» больными, совершенно очевидно, что разница в динамике лабораторных показателей коагуляции действительно может иметь серьезные клинические последствия.
Для генерических препаратов подобные исследования, как правило, не проводятся, следовательно, их эффекты могут быть непредсказуемыми, антиагрегантная или антикоагулянтная активность – снижена или увеличена. Когда идет речь о спасении жизни пациента, путь проб и ошибок неприемлем – мы должны рассчитывать на те эффекты, благодаря которым оригинальные препараты обеспечивали снижение риска осложнений и смерти в рандомизированных исследованиях. Например, применение эноксапарина в виде болюса при перкутанном коронарном вмешательстве рассчитано на максимально быстрое начало действия антикоагулянта и предсказуемую фармакокинетику. Любые изменения – более позднее начало антикоагулянтного эффекта, недостаточное ингибирование Ха-фактора – в критические минуты могут сделать бесполезными усилия врачей и затраты на процедуру.
Достаточно убедительным аргументом в пользу данной позиции стало описание клинического случая – лечения пациентки 49 лет с ОИМ, которой при позднем (более 24 ч) обращении был правильно установлен диагноз (острый Q-ИМ передней, боковой стенки, верхушки левого желудочка, Killip I) и назначена терапия на первичном этапе оказания медицинской помощи. Терапия включала ацетилсалициловую кислоту (АСК), генерический клопидогрель и биосимиляр эноксапарина в адекватных дозах. На раннем этапе стационарного лечения антиагрегантная терапия осуществлялась только клопидогрелем (в связи с наличием в анамнезе операции по поводу язвенной болезни); был назначен курс эноксапарина (5 дней), а также вся необходимая терапия, включая эплеренон, статин, ингибитор АПФ, β-блокатор и диуретик.
На фоне проведения лечения уже на 2-3-и сутки ОИМ на электрокардиограмме описывается уже как циркулярный, появляется шум трения перикарда. На 17-й день пребывания в стационаре неврологический статус пациентки резко ухудшился, диагностирован ишемический инсульт лобно-височно-теменной области справа. Клопидогрель и НМГ были отменены, назначена АСК (75 мг), а на 6-й день после этого зарегистрированы повторная негативная неврологическая динамика и развитие ишемического инсульта лобной доли слева. На 85-й день после поступления в стационар (50 из которых были проведены в отделении интенсивной терапии) пациентка была выписана со стойким неврологическим дефицитом и потребностью в постоянной посторонней помощи.
Анализируя данный клинический случай, нельзя не обратить внимание на два факта:
1) динамика лабораторных показателей в процессе лечения (тромбоциты, лейкоциты, показатели коагулограммы) на фоне проводимой терапии не только не изменялась, но и ухудшалась;
2) все назначенные препараты были генерическими, что соответствовало настоятельной просьбе со стороны родственников максимально удешевить медикаментозное лечение.
По мнению профессора Е.А. Коваль, сохранение высокого тромбогенного потенциала крови во время лечения было в значительной степени обусловлено недооценкой ишемического и переоценкой геморрагического рисков у пациентки как неназначением двойной антитромбоцитарной терапии (ДАТ), так и назначением моноантитромбоцитарной терапии генериком клопидогреля.
Между тем данные исследования CHANCE (2013) продемонстрировали эффективность ДАТ в предотвращении развития инсульта у пациентов с высоким риском (перенесших малый ишемический инсульт или транзиторную ишемическую атаку). Исследование включало более 5 тыс. пациентов, рандомизированных в течение 24 ч после появления симптомов на две группы. Первая группа получала ДАТ (АСК + оригинальный клопидогрель) 21 день, в дальнейшем – только клопидогрель до 90 дней; вторая – комбинацию АСК (75 мг/сут) и плацебо на весь срок наблюдения. Оказалось, что тактика с применением ДАТ на первом этапе лечения и последующим приемом клопидогреля превосходит монотерапию АСК в снижении риска развития последующих неблагоприятных сердечно-сосудистых событий. Следует отметить, что применение ДАТ у этой популяции пациентов не было сопряжено с большей частотой геморрагических событий по сравнению с приемом только АСК.
Кроме того, нельзя сбрасывать со счетов и назначение пациентке исключительно генерических препаратов на всех этапах лечения. Нет сомнений, что на отечественном фармацевтическом рынке присутствуют качественные генерики и их применение помогает соблюдать современные стандарты лечения многих сердечно-сосудистых заболеваний, требующих длительного (пожизненного) приема препаратов. Однако в острых ситуациях нельзя рассчитывать на везение.
Что касается финансового аспекта, то затраты на медикаментозную терапию пациентки значительно увеличились в процессе лечения осложнений и в связи с необходимостью проведения парентерального питания, приема антибиотиков для профилактики вторичных инфекций и приобретения многочисленных цитопротекторов, назначенных неврологом. Кроме того, состояние пациентки при выписке вызывает опасения, что, несмотря на трудоспособный возраст (49 лет), она сможет в ближайшее время вернуться в профессию и иметь возможность вести обычную жизнь.
Таким образом, неблагоприятные и даже трагические исходы у пациентов, которые в силу своего возраста могли бы еще долгие годы полноценно жить и трудиться, служат своеобразным ответом на вопрос о том, какова цена неверных решений у больных высокого риска, переоценки специалистами геморрагического риска одновременно с недооценкой тромботического, который все же превалирует у больных с атеротромбозом.
Подготовила Наталья Очеретяная