19 березня, 2018
Этиопатогенетические принципы восполнения кровопотери
 Под кровопотерей подразумевают состояние организма, возникающее в ответ на объемную потерю цельной крови (J.I. Vincent et al., 2013). Подобно другим критическим состояниям, оно имеет 4 фазы течения:
Под кровопотерей подразумевают состояние организма, возникающее в ответ на объемную потерю цельной крови (J.I. Vincent et al., 2013). Подобно другим критическим состояниям, оно имеет 4 фазы течения:
1-я – выраженные гемодинамические и метаболические нарушения;
2-я – ответная реакция организма на проведенные реанимационные мероприятия и интенсивную терапию (ИТ);
3-я – гиперметаболический ответ;
4-я – формирование синдрома полиорганной недостаточности (СПОН) и/или выздоровление.
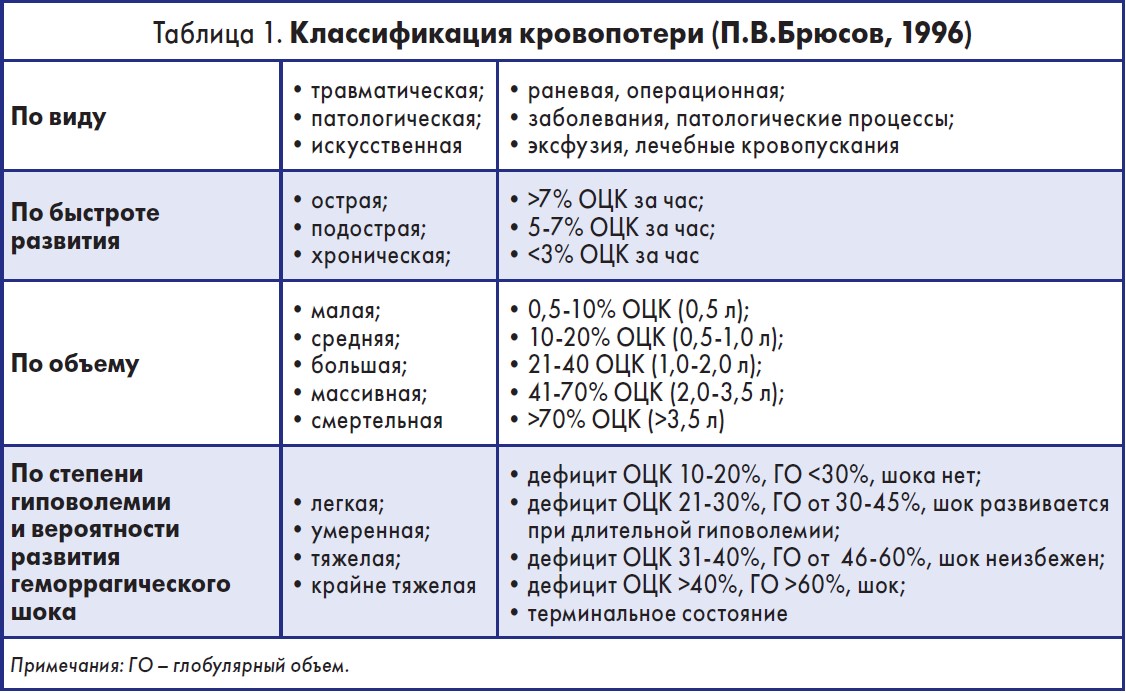
Общая классификация кровопотери представлена в таблице 1.
Кровопотеря является одной из составляющих гиповолемии, под которой подразумевают уменьшение объема циркулирующей крови (ОЦК) в кровеносном русле, что нарушает доставку и экстракцию О2 тканями. Несвоевременно или неправильно восполненная кровопотеря вследствие нарастающего повреждения эндотелиального гликокаликса (ЭГК) ускоряет формирование СПОН.
Эндотелиальный гликокаликс, расположенный на границе взаимодействия кровотока и эндотелия, выполняет важную роль в регуляции сосудистого гомеостаза. Это молекулярный слой из протеогликанов, гликопротеинов, гликолипидов, который осуществляет пристеночные метаболические процессы и предупреждает прямой контакт клеток крови с клетками эндотелия (рис. 1).
Рис. 1. Морфологическая структура гликокаликса
(М. Bernard van den Berg., M. Nieuwdorp, E. Stroes et al. Endothelial Luminal Glycocalyx. Р. 689. In: Aird W.C.,
Ed. Endothelial Biomedicine, Cambridge University Press. 2007. 1500 p.)
Основные функции ЭГК (А.В. Максименко, А.Д. Турапиев, 2011):
- регуляция сосудистого гомеостаза и тонуса (протекторный барьер);
- поддержание интерстициального жидкостного равновесия (селективное молекулярное сито);
- контроль взаимодействия клеток крови и сигнальных соединений с сосудистой стенкой.
Функция ЭГК как селективного молекулярного сита заключается в обеспечении избирательной фильтрации компонентов плазмы крови и регуляции проницаемости сосудистой стенки. В норме ЭГК проницаем для низкомолекулярных соединений (молекул воды, ионов, небольших гидрофильных веществ). В зависимости от заряда макросоединения ЭГК избирательно проницаем для высокомолекулярных соединений. Разрушение ЭГК (волокнистой пористой матрицы) приводит к увеличению сосудистой проницаемости для макромолекул (преимущественно белков плазмы крови или введенных флуоресцентно меченных декстранов с различным молекулярным весом), что обусловливает развитие тканевого отека (C.C. Micbel, 1997; X. Hu et al., 1999; R.H. Adamson et al., 2004).
D. Chappell и соавт. (2008) описали 2 типа сдвига жидкости в интерстициальное пространство:
- безколлоидный сдвиг (только H2O и электролиты) через интактную сосудистую стенку (введение избытка изотонических кристаллоидов);
- белково-коллоидный сдвиг через поврежденную сосудистую стенку (H2O + электролиты + белки, в концентрациях, близких к плазме).
Кровопотеря быстро формирует белково-коллоидный сдвиг жидкости в интерстициальное пространство.
Первой на снижение ОЦК реагирует гемодинамика. Основной причиной нарушений ее параметров является несоответствие между объемом и емкостью сосудистого русла. Возникающая на этом фоне тканевая гипоксия сопровождается нарушением окислительно-восстановительных процессов в клетках с преимущественным поражением центральной нервной системы, почек, печени. Нарушаются водно-электролитный баланс и кислотно-щелочное равновесие, гормональные соотношения и ферментативные процессы. Быстро формируется порочный круг, который может привести к терминальному состоянию и летальному исходу. Гипотермия является независимым фактором риска увеличения кровотечения и смерти, поскольку она:
- снижает синтез белков острой фазы и факторов свертывания;
- уменьшает активность факторов коагуляции (снижение температуры на каждый 1 °C приводит к снижению активности факторов свертывания на 10%);
- замедляет коагуляционный каскад (в основном за счет удлинения начальной фазы коагуляции);
- удлиняет время свертывания (при снижении температуры ниже 33 °C);
- снижает метаболизм цитрата (К.С. Sihler, L.M. Napolitano, 2010).
Ацидоз может развиваться вследствие снижения тканевой перфузии и последующего высвобождения продуктов анаэробного метаболизма. Ацидоз:
- снижает образование тромбина;
- уменьшает активность комплекса фактор VIIа – тканевой фактор: снижение рН с 7,4 до 7,0 уменьшает активность комплекса фактор VIIа – тканевой фактор на 55%;
- угнетает коагуляционный каскад (основное воздействие на фазу распространения);
- замедляет активность фактора VII (снижение рН с 7,4 до 7,0 уменьшает активность фактора VIIа более чем на 90%);
- снижает активность комплекса Xa – Va (снижение рН с 7,4 до 7,0 уменьшает активность комплекса Xa – Va на 70%) (D. Bolliger et al., 2010; Z.H. Meng et al., 2003).
Даже при сравнительно небольшой кровопотере (20% ОЦК), как правило, возникают изменения в системе гемостаза. Кратковременная фаза гиперкоагуляции быстро сменяется фазой гипокоагуляции, что свидетельствует о формировании синдрома диссеминированного внутрисосудистого свертывания. «Летальная триада» (гипотермия, ацидоз, коагулопатия) открывает «ворота смерти», ставя под сомнение эффективность хирургического контроля над кровотечением (O. Grottke et al., 2008).
В целом вид и скорость развития, объем и степень кровопотери предопределяют вероятность возникновения геморрагического шока (как правило, дефицит ОЦК >30%). Поэтому при кровотечении основной задачей является своевременное использование эффективных и надежных методов его остановки до возникновения симптомов геморрагического шока.
Согласно современному определению шок – это состояние, сопровождающееся нарушением доставки и утилизации О2 тканями организма, энергодефицитом в клетках с последующим формированием полиорганной дисфункции/несостоятельности. Специфика геморрагического шока – потеря эритроцитов и нарушение доставки О2 к тканям (М. Ceccona et al., 2014; L.J. Kaplan, 2015). Вот почему для поддержания и улучшения доставки О2 к тканям организма необходимо восстановить внутрисосудистый объем, а своевременная агрессивная коррекция волемического статуса (инфузионная ресусцитация) является неотъемлемым компонентом ИТ кровопотери, поскольку способствует улучшению исходов и предупреждению органной дисфункции.
Тип и объем инфузионно-трансфузионной терапии (ИТТ) должны быть тщательно подобраны в соответствии с дефицитом ОЦК, риском развития органной дисфункции и индивидуальными особенностями пациента (E.A. Hoste et al., 2014; В.В. Кузьков и соавт., 2015). Неадекватная волемическая нагрузка увеличивает длительность госпитализации у каждого 5-го пациента, способствует росту летальности. Практика показала, что нынешним врачам-интенсивистам при проведении ИТ свойственна тенденция к избыточной инфузии, приводящей к гиперволемии и гиперхлоремии, сопровождающихся целым рядом осложнений (J.L. Vincent, 2014). По данным A.D. Shaw и соавт. (2015), избыточная инфузия может индуцировать развитие синдрома системного воспалительного ответа, усугублять повреждения ЭГК и способствовать переходу органной дисфункции в недостаточность. Поэтому ИТТ рассматривается как самостоятельная область медицинских знаний и является одной из наиболее дискутабельных тем медицины. Сегодня жидкостная ресусцитация является первой терапевтической интервенцией в лечении геморрагического шока (A. Bougle et al., 2013).
Имеются существенные доказательства того, что определенные типы жидкостей, используемые для жидкостной ресусцитации, могут независимо ухудшать результаты лечения (К. Raghunathan et al., 2014). Это подтверждает востребованность концепции дифференцированной внутривенной инфузионной терапии, разработанной R. Zander и соавт. в 2005 году, согласно которой дифференцированная внутривенная ИТТ направлена либо на внеклеточный (жидкостное замещение), либо на внутрисосудистый (объемное замещение) объем, либо на объем как внеклеточной, так и внутриклеточной жидкости (электролитное замещение). И если применяемый для восполнения дефицита внутрисосудистого объема раствор (объемное замещение) должен содержать как коллоидно-онкотические, так и осмотические компоненты, то раствор, корригирующий дефицит внеклеточного объема (жидкостное замещение), должен по электролитному составу соответствовать плазме и одновременно содержать все осмотически активные компоненты.
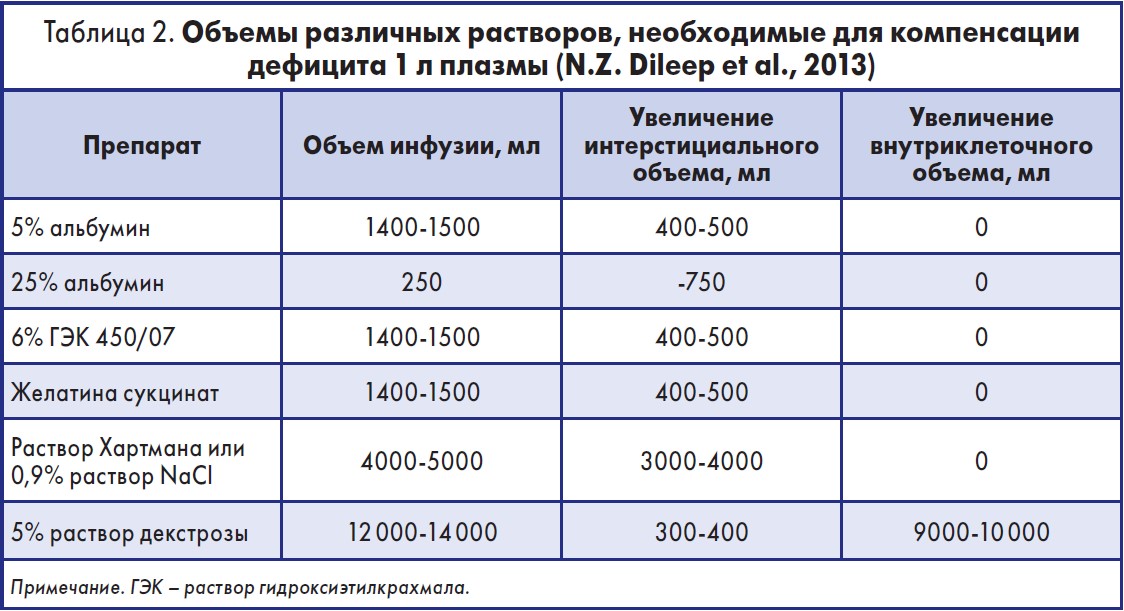
Поскольку движение жидкости с растворенными в ней веществами между различными водными пространствами организма происходит по законам осмоса и под действием основных сил (осмотического, гидростатического, онкотического давления), врач должен четко понимать, как пройдет распределение применяемых растворов между водными секторами организма. N.Z. Dileep и соавт. (2013) показали, что для увеличения объема плазмы на 1 л необходимо ввести различные объемы коллоидов и кристаллоидов (табл. 2).
Избыточное введение несбалансированных солевых растворов способствует резкому увеличению объема и отеку интерстиция, а растворы глюкозы формируют не только интерстициальный, но и внутриклеточный отек. Поэтому поддержание внутрисосудистого объема и перфузии тканей при кровопотере необходимо проводить с учетом международных рекомендаций относительно типа раствора и его дозы (Е.А.К. Hoste et al., 2014; К. Mahashwart, 2016).
Характеристика препаратов для лечения кровопотери
Восполнение дефицита ОЦК, как правило, начинают с кристаллоидных растворов, в состав которых входят растворенные в воде электролиты (0,9% раствор NaCl, растворы Хартмана, Рингер-лактата, Рингер-малата, стерофундин). В зависимости от компонентности их дифференцируют на:
- несбалансированные (0,9% раствор NaCl);
- частично сбалансированные (растворы Хартмана, Рингер-лактат, Рингер-ацетата);
- полностью сбалансированные (стерофундин ISO, Рингер-малат).
0,9% раствор NaCl представляет собой прозрачную бесцветную жидкость. В 1 л раствора содержится 9 г натрия хлорида. При внутривенной инфузии раствор быстро перемещается из сосудистого русла в интерстициальное пространство и внутрь клеток. Плазмозамещающий (волемический) коэффициент раствора равен 0,22; период полувыведения составляет около 40 минут. Содержание Na+ превышает концентрацию его в плазме на 10%, Cl- – на 50%. Раствор не содержит других электролитов и донаторов резервной щелочности.
Неконтролируемое повышение концентрации Na+ в плазме крови приводит к развитию гиперосмолярности и переходу жидкости из интерстициального, а затем и клеточного пространства организма в сосудистое русло. Это не только увеличивает в нем объем жидкости, но и создает угрозу внутриклеточных дегидратации и гиперкалиемии. Поэтому согласно рекомендациям NICE (2014) во время проведения внутривенной инфузионной терапии у взрослых преимущество необходимо отдавать кристаллоидным растворам с содержанием Na в границах его плазменной концентрации (130-154 ммоль/л).
Однако самую большую опасность представляет высокая концентрация Cl- в растворе. Cl- является основным анионом внеклеточной жидкости, влияющим на кислотно-щелочное состояние крови. Так, метаанализ, проведенный D. Orbegozo Corte’s и соавт. (2014), включал 37 клинических исследований. В ходе анализа ученые установили, что введение неограниченного (>2 л) объема 0,9% раствора NaCl способствует развитию гиперхлоремического метаболического ацидоза. В двойных слепых рандомизированных исследованиях N.S. Nuraei и соавт. (2010), D.F. Hadimioglu и соавт. (2008) установлено достоверное увеличение плазматической концентрации Cl- и снижение pH крови после введения 0,9% раствора NaCl. В больших двойных слепых проспективных исследованиях (N.S. Nuraei et al., 2010; B.U. Wu et al., 2011; M.P. Modi et al., 2012) установлена прямая корреляция между формированием гиперхлоремического ацидоза и нарушением почечного кровотока и гломерулярной фильтрации. Клинически это проявляется симптомами повышения объема интерстициальной жидкости и острой дисфункцией почек. Lobo и соавт. (2002) доказали, что введение больших объемов 0,9% раствора NaCl удлиняло сроки восстановления моторики кишечника, создавало условия для развития синдрома интраабдоминальной гипертензии, увеличивало сроки заживления анастомозов и послеоперационных ран. Клинические исследования D.A. Brandstrup и соавт. (2003), D.S. Schotola и соавт. (2012) выявили снижение сократимости миокарда и ответа на инотропную поддержку при инфузии 0,9% раствора NaCl. Таким образом, несбалансированный по отношению к плазме 0,9% раствор NaCl при неконтролируемом по объему введении оказывает на организм целый ряд негативных влияний.
К частично сбалансированным растворам относят растворы Рингера-лактата и Хартмана. Их плазмозамещающий (волемический) коэффициент равен 0,3, а период полувыведения составляет приблизительно 40 минут. В качестве щелочного резерва в них используется лактат (молочная кислота).
Лактат – первый органический ион, который использовали для достижения сбалансированности кристаллоидных растворов. Метаболизм лактата – энергозатратный процесс и требует большого количества кислорода (1 моль лактата потребляет 3 моля О2). Внутрипеченочный глюконеогенез лактата прекращается при pH ≤7,1 или ВЕ – 15 ммоль/л. Возникающая печеночная дисфункция быстро увеличивает концентрацию лактата вплоть до критической (8 ммоль/л), что ассоциируется с высокой вероятностью неблагоприятных исходов.
В клинических испытаниях M.V. Karaca и соавт. (2006), C.S. Chanimov и соавт. (2006), А.Н. O’Malley и соавт. (2008), а также других исследователей доказана возможность эффективной коррекции метаболического ацидоза растворами Хартмана и Рингер-лактата без развития клинически значимого ацидоза, что связывали с наличием у растворов щелочного резерва (лактат) и щелочным рН. Однако при тканевой гипоксии, когда синтез лактата превышает его потребление, возникает избыточное накопление молочной кислоты, или гиперлактатемия.
Гиперлактатемия нарушает метаболизм глюкозы в митохондриях и способствует дисфункции печени (D.J. Taylor et al., 1992; N.E. Madias, 1986; G.S. Hall, 2010). Лактатацидоз увеличивает частоту сердечных сокращений (pH >7,2), снижает контрактильность миокарда (pH <7,1), сосудистый ответ на катехоламины, почечно-печеночный кровоток. При этом повышается минутная вентиляция, возникает диспноэ, снижаются податливость диафрагмы (K.J. Gunnerson et al., 2006; B.X. Levy et al., 2008) и мозговой кровоток, что изменяет психический статус больных (O.V. Kruse et al., 2013). Поскольку все критические состояния сопровождаются помимо тканевой гипоксии еще и лактатацидозом, это ограничивает возможность применения частично сбалансированных электролитных растворов.
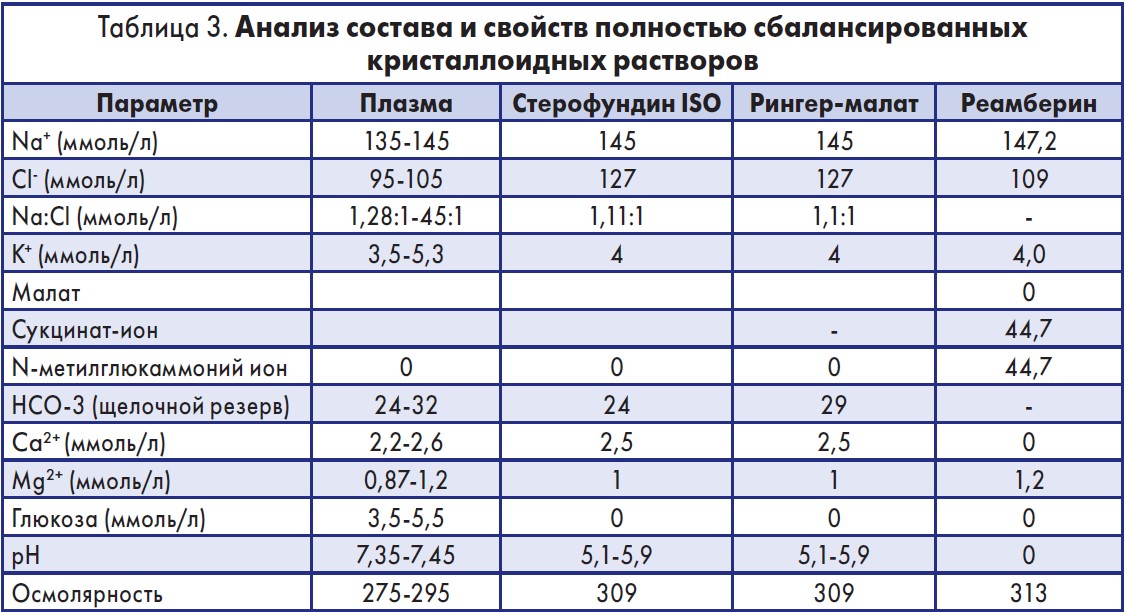
К сбалансированным кристаллоидным растворам относят растворы (табл. 3), содержащие плазменную концентрацию всех электролитов и безопасный щелочной резерв, подвергающийся быстрому метаболизму без высокого потребления О2 (ацетат, малат, уксусная, яблочная и янтарная кислоты).
Ацетат (CH3COO-) играет важную роль в углеводном и липидном обмене. Его метаболизм происходит в основном в мышечной ткани. Любой метаболический путь должен быть электронейтрален по балансу. Ацетат представляет собой основание и, следовательно, после присоединения Н+ окисляется уксусной кислотой. На 1 моль уксусной кислоты требуется 2 моля О2. Химическое уравнение реакции ацетата натрия с кислородом следующее: СН3-СООNa+2О2-CО2+Н2О+NaHCO3.
Влияние ацетата можно обобщить следующим образом: «Ацетат замещает жиры как окислительное топливо без воздействия на окисление глюкозы». Все ткани имеют ферменты, необходимые для метаболизма ацетата. Ощелачивающий эффект ацетата проявляется очень быстро: концентрация НСО3- увеличивается спустя 15 мин после начала его внутривенного введения. Ацетат является источником энергии, поставляющим 209 ккал/моль. Таким образом, ацетат имеет ряд значительных преимуществ по сравнению с другими метаболизируемыми анионами.
Малат изучен недостаточно. При потреблении 1,5 моля O2 1 моль малата метаболизирует до 2 молей бикарбоната натрия. В результате ощелачивающее действие наступает намного медленнее, чем у ацетата, что является показанием к сочетанному их применению.
На международном фармакологическом рынке сбалансированные кристаллоиды представлены растворами Плазмалит А, Плазмалит Р, Плазмалит‑148, йоностерил, стерофундин, стерофундин ISO, Рингера-малат, реамберин.
Электролитный состав растворов стерофундин ISO и Рингер-малата соответствует плазме по количественному содержанию ионов Na+, K+, Cа2+, Mg2+, Cl-. В открытом многоцентровом рандомизированном исследовании К. Hafizah и соавт. (2015) указывают на минимизацию угрозы развития гиперхлоремического ацидоза при использовании стерофундина ISO у больных некардиохирургического профиля. Н. Kim и соавт. (2013) в двойном слепом сравнительном исследовании эффективности сбалансированных и несбалансированных кристаллоидов при трансплантации почек показали осутствие кислотно-щелочных и электролитных нарушений у больных с тяжелой травмой при использовании сбалансированных кристаллоидных растворов. Мультицентровое двойное слепое кластерное рандомизированное исследование эффективности периоперационного применения сбалансированных и несбалансированных растворов (SPLIT, 2015) с участием 2262 пациентов не выявило статистически значимых изменений электролитного и кислотно-щелочного состояний, а угроза гиперхлоремического ацидоза была минимальной.
Таким образом, применение сбалансированных кристаллоидных растворов значимо снижает риск развития гиперхлоремического ацидоза и интерстициального отека тканей, минимизирует риски формирования респираторного дистресс-синдрома взрослых, сокращает время нахождения больных на искусственной вентиляции легких, предотвращает развитие послеоперационного илеуса и острой почечной дисфункции, ускоряет заживление ран и снижает выраженность болевого синдрома. Тем самым уменьшается степень структурных повреждений органов-мишеней, формирующих СПОН. Поэтому гайдлайн «Внутрисосудистая объемная терапия у взрослых», принятый научными медицинскими обществами Германии в 2016 году, и Консенсус по периоперативной гемодинамической терапии у пациентов некардиохирургического профиля (SAESP, Бразилия, 2016) рекомендуют проводить объемное инфузионное замещение у взрослых пациентов сбалансированными кристаллоидными и/или сбалансированными коллоидными растворами (уровень доказательности В).
Поскольку большая по объему и стремительная кровопотеря по своей сути является острой и абсолютной гиповолемией и сопровождается потерей как внутрисосудистого, так и внеклеточного объемов, для восполнения их дефицита необходимо проводить и жидкостное (коррекция внеклеточного объема), и объемное (коррекция внутрисосудистого объема) замещение.
Для объемного замещения используют коллоидные растворы, содержащие как коллоидно-онкотические, так и осмотические компоненты. Эти растворы дифференцируют на искусственные (ГЭКи, желатин) и естественные (альбумин). Введенные внутривенно, изоонкотические коллоиды почти полностью остаются внутри незаполненной сосудистой системы (М. Rehm et al., 2000; M. Jacob et al., 2012), что позволяет быстро стабилизировать гемодинамику пациентов в начальную (6 ч) стадию острого гиповолемического шока и является важнейшей частью лечения (Е. Rivers et al., 2001; D. Chappel et al., 2013).
Растворы ГЭК
ГЭК – природные полисахариды, получаемые из амилопектинового крахмала, либо из клубней картофеля (пентастарчи), либо из зерен кукурузы восковой спелости (гетастарчи). Крахмал – это полимер глюкозы с разветвленной структурой, он плохо растворим и быстро метаболизируется a-амилазой. Чтобы сделать молекулу крахмала более растворимой и повысить ее устойчивость в кровотоке (D. Totoda et al., 2014), гидроксильную часть молекулы крахмала заменили гидроксиэтилированным остатком.
Основные характеристики ГЭК:
- степень молярного замещения. Это отношение гидроксиэтилированной части молекулы к незамещенной части или количество гидроксиэтильных групп на 10 глюкозных остатках амилопектина (0,6 – гексакрахмал; 0,5 – пентакрахмал; 0,4 – тетракрахмал). Молекула ГЭК с более низкой степенью замещения быстрее элиминируется из русла, что уменьшает риск нежелательных последствий;
- характер замещения или отношение С2/С6. Представляет расположение атома углерода скелетона глюкозы, где преимущественно появляется замещение (гидроксиэтилирование). Чем ниже соотношение, тем меньше устойчивость к α-амилазе, меньше время циркуляции в русле и ниже кумуляция препарата в тканях;
- молекулярная масса (450, 200, 130 кД). Чем больше масса, тем дольше молекула циркулирует в русле, а следовательно, увеличивается выраженность побочных эффектов (кумуляция, нефротоксичность, негативное влияние на гемостаз).
По величине молекулярной массы выделяют три поколения ГЭК:
I поколение – молекулярная масса равна 450 кД, степень молярного замещения – 0,6-0,7(стабизол);
II поколение – молекулярная масса равна 200-240 кД, степень молярного замещения – 0,5-0,6 (рефортан, гекодез);
III поколение – молекулярная масса равна 130 кД, степень молярного замещения составляет 0,4 (кукуруза) или 0,42 (картофель). К этому поколению относятся гекотон, волювен, тетраспан.
При сохранении активности волемического действия низкие молекулярная масса, степень и характер замещения предопределили наиболее высокий профиль безопасности у ГЭК ІІІ поколения (Zander, 2009; N. Dileep, Lobo et al., 2013), который дополнительно повысился при растворении ГЭК 130/04 в сбалансированном электролитном растворе (тетраспан 6%, B. Braun).
Тетраспан 6% изотоничен, что исключает перемещение жидкости во внутриклеточное пространство и развитие таких осложнений, как гипонатриемическая энцефалопатия, отек головного мозга, дыхательная недостаточность. Препарат изоионен, это предупреждает развитие таких ятрогенных нарушений электролитных расстройств, как гиперхлоремический ацидоз, снижение концентрации кальция, удлинение времени свертываемости крови. Тетраспан 6% сохраняет кислотно-основной баланс благодаря содержанию носителей резервной щелочности (ацетат, малат) в количестве, эквивалентном емкости гидрокарбонатного буфера крови. Он также оказывает влияние на системный воспалительный ответ, уменьшая секрецию провоспалительных интерлейкинов, снижая уровень экспрессии эндотелиальных адгезивных молекул (sVCAM‑1). Это уменьшает органно-системную дисфункцию.
Детально преимущества и недостатки растворов ГЭК представлены в таблице 4.
Метаанализ накопления ГЭК, проведенный M.L.N.G. Malbrain (2014), включал 37 клинических и 11 экспериментальных исследований. Локализация накопления ГЭК в коже была выявлена в 11 исследованиях, в почках – в 12, в печени – в 8, в костном мозге – в 5. При этом длительность накопления ГЭК в коже составляла >8 лет, в почках – 10 лет. Было показано, что распределение ГЭК по органам сопоставимо у людей и животных (C.J. Wiedermaun et al., 2014), а введение ГЭКов может повышать риск развития острой печеночной недостаточности и необходимость в проведении заместительной почечной терапии; доза раствора ГЭК, превышающая 10 мл/кг, создает угрозу нестабильности гемостаза.
Однако, несмотря на опасения относительно нежелательных влияний на гемостаз, функцию почек, кумуляцию в тканях, применение растворов ГЭК возможно по определенным показаниям (острый период гиповолемического шока) с ограничением дозы (не более 10 мл/кг) и по сопутствующей патологии (исходная патология почек).
Растворы желатины
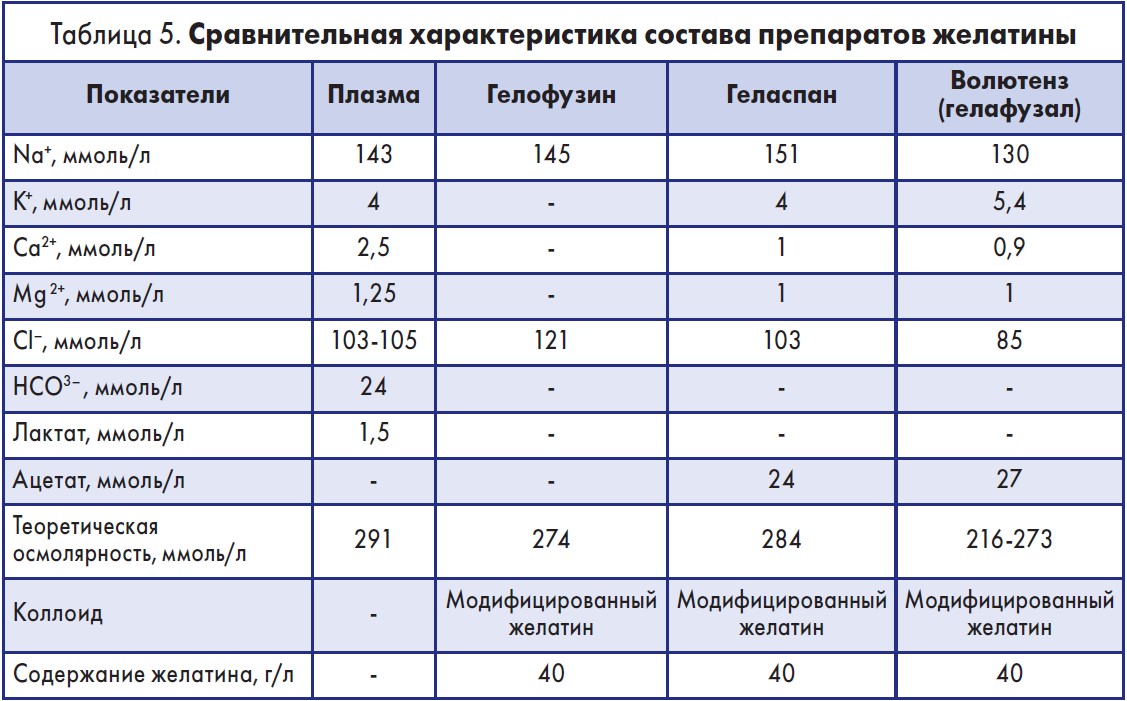
Желатин – это макромолекулярный протеин, полученный из тканей млекопитащих. Поскольку желатин может быть растворен в различных солевых растворах, сегодня выделяют сбалансированные (геласпан, волютенз) и несбалансированные (гелофузин) его препараты. Их характеристика представлена в таблице 5.
Желатин производят из коллагеновой ткани (хрящей) крупного рогатого скота методом термической деградации, гидролиза и сукцинирования. По этой причине в некоторых работах раствор называют сукцинированным желатином.
В отличие от модифицированного жидкого желатина, глобулярная молекула которого имеет слабый отрицательный заряд и активно проходит через поры сосудистой мембраны, сукцинированные молекулы модифицированного желатина имеют выраженный электронегативный заряд. Вместе с тем вытягивание протеиновых цепей обусловливает увеличение их объема, что затрудняет прохождение молекул через поры сосудистой стенки. Это обеспечивает стабильность и устойчивость волемического и гемодинамического эффекта препарата, который сопоставим с таковым у 6% ГЭК 130 и у 5% альбумина (D.N. Lobo et al., 2010). Однако, в отличие от ГЭКов, препарат меньше влияет на функцию почек (Р. Schortgen et al., 2001). В то же время препараты желатины практически не влияют на гемостаз, это объясняет их предпочтительное использование для восполнения острой кровопотери. Таким образом, сукцинированный желатин является препаратом выбора у пациентов с исходной гипокоагуляцией и поражением почек.
При острой (>7% ОЦК за 1 ч) по быстроте развития, большой (до 40% ОЦК) или массивной (41-70% ОЦК) по объему и тяжелой по степени гиповолемии и вероятности развития геморрагического шока кровопотере эффективное лечение невозможно без агрессивной коррекции волемического статуса не только сбалансированными (или частично сбалансированными) кристаллоидами, искусственными (растворы желатина, ГЭК) и естественными (растворы сывороточного человеческого альбумина) коллоидами, но и компонентами и препаратами крови. При этом чрезвычайно важно соблюдать качественный и количественный состав последних.
Если в 2007 г. в Оксфордском пособии по анестезиологии (K.G. Alman, I.H. Wilson) восполнение дефицита ОЦК при кровопотере рекомендовали начинать с кристаллоидов, коллоидов и эритроцитарной массы (ЭМ), а потом вводить свежезамороженную плазму (СЗП) в соотношении: 1 доза СЗП на 6 доз ЭМ, то с 2009 г. стратегия восполнения меняется. Основанием для этого послужила разработанная в 2005 г. Институтом хирургических исследований Армии США (г. Сан-Антонио, Техас) стратегия «damage control resuscitation» (DCR) для военной медицины и последующее внедрение ее в гражданскую медицину. Именно благодаря этой стратегии при лечении гражданской политравмы удалось в 1-е сут снизить летальность с 87,5 до 26%, в 30-е – с 57 до 27%. Не было увеличения смертности вследствие СПОН среди пациентов, которым восполняли кровопотерю по этой схеме (J. Duchesne et al., 2008; J. Holcomb et al., 2008; M. Borgman et al., 2007).
Суть стратегии DCR сводится к изменению отношения между СЗП и ЭМ до 1:1 или 1:1,5 и к раннему введению СЗП. Было доказано, что раннее введение СЗП увеличивает прокоагулянтную активность и антитромботический потенциал крови (D. Bolliger et al., 2010; J. Roback et al., 2010), а смесь из 1 единицы ЭМ (250 мл), СЗП (250 мл) и тромбомассы имеет 29% гематокрита (Ht), ее протромбиновый индекс (ПТИ) равен 62%, а количество тромбоцитов в ней достигает 85×109/мл. Это обеспечивает снижение риска коагуляционных нарушений и стабильный эффект терапии (K. Sihler, L. Napolitano, 2010; D. Shegovskikh et al., 2011). Поэтому рекомендовано раннее введение криопреципитата на фоне раннего введения СЗП и антифибринолитиков (C. Solomon et al., 2010; H. Shakur et al., 2010).
СЗП – человеческая донорская плазма, сепарированная из цельной крови или полученная путем плазмафереза, – стала доступной с 1941 года, и ее клиническое применение стабильно возрастает. Главным ее преимуществом перед другими коллоидами является содержание коагуляционных факторов. Каждая единица СЗП (250 мл) содержит 500-1000 мг фибриногена. Начальная доза введения препарата составляет 10-15 мл/кг, но суммарная не должна превышать 20 мл/кг. Активность факторов коагуляции в СЗП зависит от их концентрации в крови донора. В отличие от кристаллоидов СЗП уменьшает проницаемость эндотелия. СЗП должна вводиться согласно АВО-совместимости. Инфузия СЗП увеличивает коллоидно-осмотическое давление плазмы крови, способствует уменьшению интерстициального отека, препятствует развитию ДВС-синдрома и является основным компонентом его терапии. Комплекс мер по лечению и профилактике потенциальной или явной коагулопатии включает:
1. Визуальную оценку операционного поля (наличие капиллярного кровотечения является признаком коагулопатии).
2. Лабораторный мониторинг коагулопатии (подсчет количества тромбоцитов, определение уровней гематокрита (Ht), гемоглобина (Hb), фибриногена, активированное частичное тромбопластиновое время (АЧТВ) каждый час).
3. Применение для лечения избыточного фибринолиза:
- транексамовой кислоты (первоначальная доза – 1,0 г за 10 мин внутривенно, в дальнейшем инфузия 1,0 г за 8 ч);
- протинина (от 50 до 600 000 МЕ внутривенно капельно в физиологическом растворе).
4. Введение криопреципитата.
5. Введение СЗП.
6. Введение тромбоконцентрата.
7. Введение искусственных факторов свертывания крови (концентрат протромбинового комплекса (КПК) и рекомбинантного активированного фактора VII – rFVIIa) при кровотечении, рефрактерном к лечению.
Криопреципитат – содержит криоглобулиновую фракцию плазмы крови, выделенную из свежезаготовленной крови и сконцентрированную в объеме 10-20 мл. Создан в 1964 г. Judirh Graham Pool (1919-1975). Содержит: фактор VIII – 90 МЕ, фибриноген – 250 мг, фактор Виллебранда, фибронектин, IgA, IgG, ингибиторы фибринолиза. 2 единицы криопреципитата (40 мл) соответствуют 1 дозе СЗП (250 мл), что позволяет обеспечить рестриктивный тип кровезамещения.
Показания к введению криопреципитата:
- уровень фибриногена, равный 1,0-0,8 г/л, при наличии капиллярного кровотечения;
- коррекция избыточной капиллярной кровоточивости у пациентов с массивными трансфузиями при невозможности быстрого определения уровня фибриногена;
- врожденный дефицит фибриногена.
Начальная доза введения: 1 единица на 10 кг массы тела.
В последнее время на фармакологическом рынке появляется все больше препаратов, содержащих высокую и строго дозированную концентрацию факторов свертывания. Среди них в Украине наибольшее распространение получил концентрат протромбинового комплекса.
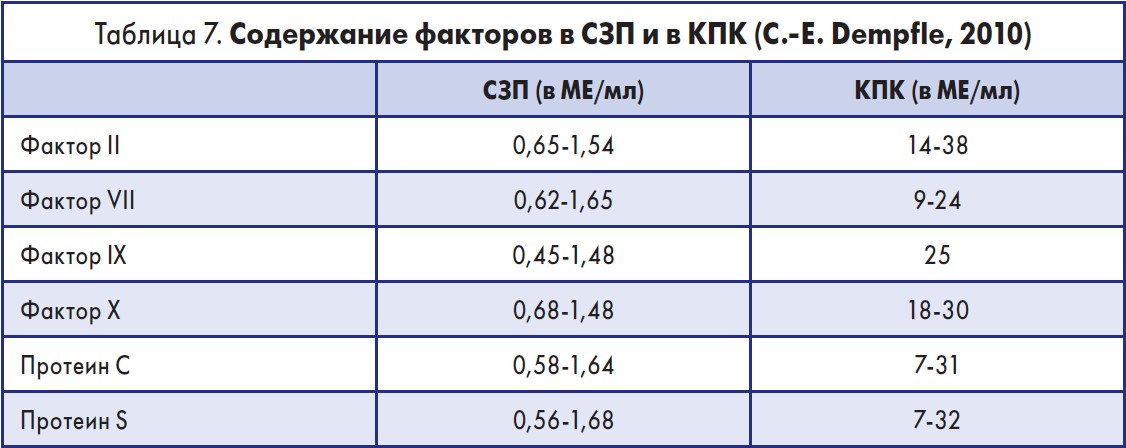
КПК человека содержит несколько факторов свертывания: фактор II – 220-760 МЕ, фактор VII – 180-480 МЕ, фактор IX – 500 МЕ, фактор Х – 360-600 МЕ, а также комплекс антикоагулянтов: протеин S – 140-640 МЕ, протеин С – 140-620 МЕ, гепарин – 100-250 МЕ. Общее содержание белка составляет 260-820 мг.
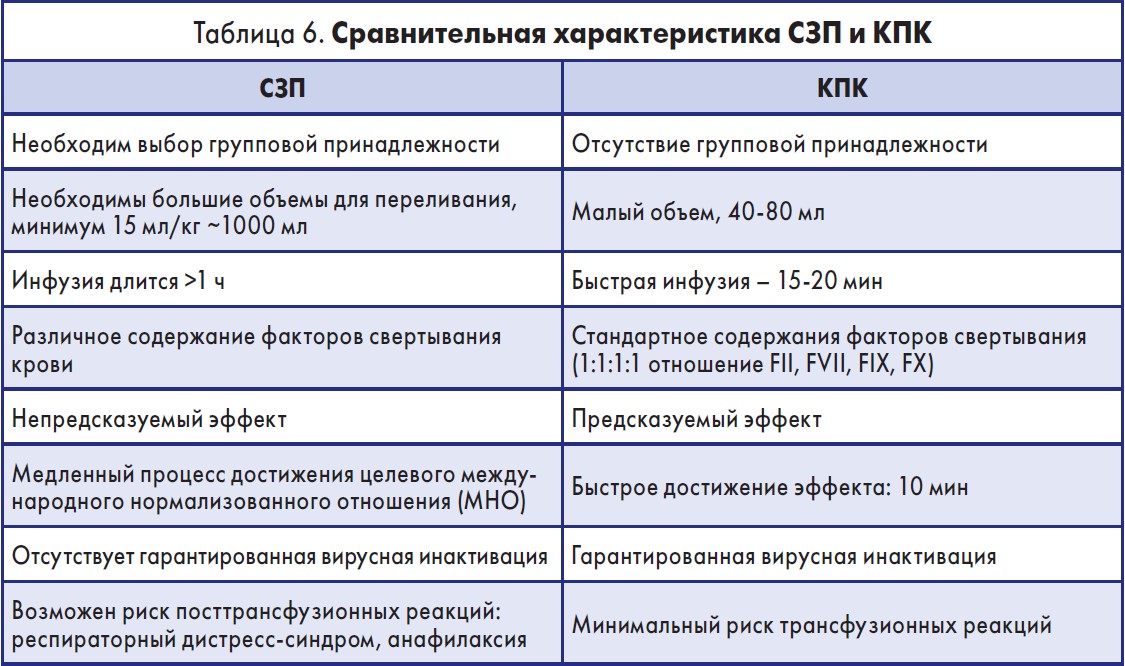
Фактически препарат представляет собой концентрированную СЗП, однако с ограниченным и строго дозированным набором факторов свертывания. Сравнительная характеристика СЗП и КПК человека и содержание факторов свертывания в этих препаратах представлены в таблицах 6 и 7.
Как видно из таблицы 7, содержание каждого фактора и белков в препарате Октаплекс превышает количество таковых в СЗП в 25 раз. Это подтверждается исследованиями L.L. Holland, J.P. Brooks (2006), установившими, что для изменения величины МНО с 1,7 до 1,3 необходимо 2 л плазмы или 1-2 дозы КПК.
Показания к введению препарата:
- Лечение кровотечений.
- Предоперационная профилактика и лечение кровотечений на фоне приобретенного дефицита факторов свертывания крови (лечение антагонистами витамина К).
- Предоперационная профилактика и лечение кровотечений при врожденном дефиците II и Х факторов свертывания крови.
- Технология введения КПК:
- рассчитать необходимую дозу по формуле: Х × МЕ × КПК = (протромбиновый индекс N – протромбиновый индекс больного) × вес больного (кг) × 0,5;
- ввести внутривенно струйно от 1 до 3 доз (1-3 флакона), или от 500 до 1500 МЕ;
- при отсутствии эффекта повторно ввести препарат через 20 мин.
Разовая доза препарата не должна превышать 3000 МЕ.
При лечении массивной кровопотери доза КПК, как правило, определяется эмпирически. Обычно введение 30 МЕ/кг КПК купирует геморрагический синдром (Е.М. Шифман и соавт., 2016).
Появляется все больше научных работ, свидетельствующих об эффективности КПК при дилюционной коагулопатии и массивной кровопотере, травме, оперативных вмешательствах, в акушерстве. Так, D. Bruce и T.J.C. Nokes (2008) показали, что введение КПК позволило выполнить кардиохирургические операции у больных, не получавших до операции варфарин, с развившимся кровотечением, которое не удается купировать переливанием компонентов крови. После введения КПК частичный или полный гемостаз был достигнут у 78% больных, на 64% уменьшилась потребность в трансфузиях эритроцитов, на 23% – в СЗП, на 22% – в концентрате тромбоцитов, на 70% – в криопреципитате.
В последнее время назначение фибриногена и/или КПК в качестве первой линии терапии ассоциируется со снижением частоты интраоперационного переливания крови. Более того, отмечается снижение также частоты массивного переливания, повторной ревизии и тромботических/тромбоэмболических событий (К. Gоrlinger, 2011). В исследовании Vrigina Arnеkian (2012) КПК применялся не по утвержденным показаниям для лечения обильного кровотечения после операции с искусственным кровообращением. Было обследовано 677 больных, в исследования включено 77 (11,4%) пациентов. Все они были разделены на 3 группы: пациентам 1-й (n=24) был назначен КПК, 2-й (n=26) – СЗП, участники 3-й (n=27) получали оба препарата. Средняя доза КПК для 1-й группы составила 10,0±3,5 МЕ/кг, в то время как в 3-й группе этот показатель был равен 14,1±11,2 МЕ/кг (р=0,09). За исключением фибриногена, изменения протромбинового времени, АЧТВ и количества тромбоцитов со временем были сопоставимыми для всех трех групп. У одного пациента из 2-й группы произошел инфаркт мозга. После анализа результатов исследования сделан вывод, что назначение низких доз КПК существенно уменьшает кровотечение после операции с искусственным кровообращением.
В ретроспективном экспериментальном комплексном исследовании (С. Manuela, 2012) оценивались клиническое применение и эффективность (по уровню снижения МНО) терапии КПК. В течение 4 лет было осуществлено 1194 введения КПК у 1152 пациентов (у 69,2% – для проведения пероральной антикоагулянтной терапии; у 17,3% – для лечения дисфункции печени; у 10,2% – при неконтролируемом кровотечении). Средняя доза препарата составила 20,37±7,00 МЕ/кг. Результаты исследования показали, что КПК эффективно и существенно снижает показания МНО у пациентов, требующих восстановления коагуляция крови. Так, средний показатель МНО до лечения составлял 4,52±3,16 по сравнению с 1,57±0,73 после окончания терапии (р<0,0001). КПК благотворно влиял на лечение пероральными антикоагулянтами и не приводил к возникновению тромбоэмболических осложнений. Успешным оказался и прием КПК в большинстве случаев кровотечений у пациентов с дисфункцией печени.
КПК применялся при акушерских кровотечениях у пациенток с приобретенным и врожденным дефицитом факторов свертывания крови (С. Larrain, 1994; S.A. Shobeiri et al., 2000). В случае массивной кровопотери применение КПК обоснованно, если все остальные варианты терапии исчерпаны (рекомендации Королевского колледжа акушеров и гинекологов, 2016, рекомендации Ассоциации анестезиологов Великобритании и Ирландии, 2016). В работе G. Michalska-Krzanowska (2014) проанализированы 4 случая применения КПК при кровотечениях, связанных с гипотонией матки после родов, после операции кесарева сечения, при приращении плаценты и самопроизвольном аборте. Общий объем кровопотери колебался от 1250 до 2300 мл. Эффективная доза препарата составляла 1000-1500 МЕ. Никаких нежелательных явлений, связанных с введением КПК, выявлено не было. Автор приходит к выводу, что своевременное введение КПК разрывает порочный круг, обусловленный гемодилюцией и коагулопатией, и снижает затраты на лечение.
В рекомендациях Европейской ассоциации анестезиологов по лечению пациентов с тяжелым периоперационным кровотечением (2013) при эмболии околоплодными водами на фоне вагинального родоразрешения образование стабильного сгустка достигалось введением транексамовой кислоты, концентрата фибриногена, тромбоцитов и КПК, а также эритроцитарной массы и СЗП в отношении 1:1 под контролем тромбоэластографии (Т. Annecke et al., 2010). В настоящее время продолжается изучение эффективности применения КПК в сочетании с концентратом фибриногена при послеродовых кровотечениях с объемом кровопотери от 2000 до 3000 мл (NCT01 910675).
К исскуственным факторам свертывания крови относят также rFVIIa.
В рекомендациях Европейской ассоциации анестезиологов по лечению пациентов с тяжелым периоперационным кровотечением (2013) применение rFVIIa рекомендуется рассмотреть в качестве последнего варианта лечения в силу риска тромбоэмболических осложнений (уровень доказательности 1В). До назначения rFVIIa следует оптимизировать концентрацию фибриногена и количество тромбоцитов (уровень доказательности 2С).
Показания к введению препарата:
- Гемофилия (независимо от наличия ингибиторов к факторам свертывания крови VIII и IX).
- Дефицит VII фактора свертывания крови.
- Тромбоцитопатии (болезнь Виллебранда III тип, болезнь Гланцмана, синдром Бернара-Сулье).
- Тромбоцитопения, рефрактерная к введению тромбоцитарной массы.
rFVIIa рекомендовано вводить до развития метаболических осложнений, тяжелого ДВС-синдрома, повреждения органов (СПОН, ОРДС) вследствие тяжелой гипоксии. rFVIIa должен быть использован, когда кровотечение продолжается, несмотря на введение: СЗП (5-10 мл/кг), криопреципитата (1-1,5 дозы/10 кг), тромбомассы (1 доза/10 кг), эритроцитарной массы (4-6 доз) или в тех случаях, когда возникает рецидив кровотечения и в лабораторных показателях: протромбиновое время или АЧТВ превышают в ≥1,8 раза средние значения, уменьшено количество тромбоцитов (<50×109л), снижен уровень фибриногена (<0,6-1,0 г/л).
Важным компонентом лечения кровопотери, безусловно, является аллогенная трансфузия крови. Доказано, что она достоверно увеличивает выживаемость только в двух когортах больных: с активным кровотечением и активной ишемией миокарда. При политравме для снижения летальности необходимо максимально быстро выявлять пациентов, нуждающихся в массивной гемотрансфузии, так как незамедлительное вмешательство позволяет предотвратить развитие коагулопатии (S.M. Bhananker et al., 2011; L.J. Kaplan, 2015). Этот тезис полностью применим к кровотечениям в акушерской практике. Трансфузию эритроцитарной массы используют для восстановления доставки О2 к тканям. То есть целью трансфузии является не восстановление специфического (произвольного или «пускового») уровня гемоглобина, она направлена на достижение физиологических показателей, а продолжающееся кровотечение и/или чрезмерное увеличение объема инфузионной терапии снижают ожидаемое увеличение количества эритроцитов.
Показания к трансфузии эритроцитов:
- Клинические признаки гипоксии/дизоксии.
- Проявления гипоперфузии на фоне лактат-ацидоза и повышения дефицита оснований (без предшествующего гиперхлоремического метаболического ацидоза).
- Активное кровотечение с развивающимся шоком.
- Невозможность остановки кровотечения хирургическими методами вследствие анатомических особенностей, коагулопатии, в полевых условиях оказания помощи.
Введение эритроцитарной массы необходимо продолжать до полного контроля над кровотечением, поскольку только это может продлить жизнь больного. Причем в большинстве рекомендаций (AAGBI guidelines, 2016; TCCC Guidelines Change, 2014) подчеркивается, что эритроциты 0 (I) группы должны быть всегда готовы для неотложной трансфузии в случае жизнеугрожающего кровотечения. Детям и женщинам детородного возраста рекомендовано использовать 0 (I) Rh отрицательные эритроциты, а у взрослых мужчин могут быть использованы 0 (I) Rh положительные эритроциты. Одногруппная кровь при массивной кровопотере должна быть готова к введению в течение 15-20 мин после получения образца крови. Причем в тактической военной медицине рекомендовано при геморрагическом шоке применять цельную одногруппную кровь непосредственно на поле боя. И если 25 лет назад оптимальным считалось достижение в результате гемотрансфузии уровня Hb – 100 г/л, Ht – 30%, то с ростом понимания рисков от гемотрансфузии взгляды изменились. Особую роль в этом сыграла разработка рестриктивной стратегии кровевосполнения у стабильных взрослых и детей (J.L. Carlson et al., 2012). R. Hebert и соавт. (1999) сравнивали две тактики гемотрансфузии: либеральную (показанием к трансфузии крови был уровень Нb <100-110 г/л) и ограничительную (уровень Нb <70-80 г/л). Исследование показало, что 30-дневная летальность была статистически достоверно меньшей среди пациентов, к которым применялась ограничительная тактика гемотрасфузии (больные по APACHE II <20 баллов, возраст – <55 лет). Клинические наблюдения больных с острой анемией, не позволявших по религиозным убеждениям вводить себе донорскую кровь, определили уровень Нb в 30 г/л как критический при остром кровотечении. Однако сейчас преобладает точка зрения, согласно которой уровни Нb и Ht не могут быть единственным критерием для определения показаний к гемотрансфузии.
Оптимальный уровень Нb у критических больных остается неизвестным и не может быть единственным критерием, определяющим показание к гемотрансфузии. При массивных профузных кровотечениях, когда нет уверенности в их быстрой остановке, показания к гемотрансфузии максимально расширяются. По решению Консенсусной конференции (2006) при условии нормоволемии показания к гемотрансфузиям отсутствуют при Нb ≥100 г/л (кроме профузного кровотечения). При Hb 60-90 г/л необходимо ориентироваться на величины артериального давления (АД) и центрального венозного давления (ЦВД), на то, продолжается или нет кровотечение, на наличие препаратов свежей крови, уровни венозного лактата (<2 ммоль/л) и SсvO2 (>70%).
Американская ассоциация банков крови (ААВВ) рекомендует (2012):
- У стабильных больных в отделениях интенсивной терапии переливание эритроцитов рассматривать при уровне Hb ≤70 г/л.
- У послеоперационных больных переливание рассматривать при уровне Hb ≤80 г/л при наличии таких симптомов, как боль в груди, ортостатическая гипотензия, тахикардия, реагирующая на инфузионную терапию, застойная сердечная недостаточность.
- У гемодинамически стабильных больных, поступивших с уже существующей патологией сердечно-сосудистой системы, при уровне Hb ≤80 г/л.
- У гемодинамически стабильных больных, поступивших с острым коронарным синдромом, рекомендован рестриктивный режим терапии вместо либерального.
Свои рекомендации ААВВ обосновывала тем, что при уровне Hb <35-40 г/л летальность значительно увеличивается даже у здоровых пациентов (L.J. Kaplan, 2015). Минимально допустимый уровень Hb не может быть <50 г/л (Е. Lustenberger et al., 2011). ASA рекомендует в качестве показателя для гемотрансфузии уровень Hb 60 г/л (2009). Работы L.J. Kaplan (2015) свидетельствуют о снижении послеоперационной летальности у больных, имеющих предоперационный уровень Hb ≥80 г/л. В 1999 г. сообщество TRICC (Transfusion Reguirements in Critical Care) задокументировало общую тенденцию к снижению 30-дневной летальности и значительное уменьшение летальности у пациентов <55 лет со среднетяжелой кровопотерей при целевом уровне Hb 70 г/л (рестриктивное кровевосполнение) в отличие от больных, получавших либеральное кровевосполнение. Исключением были пациенты с острым инфарктом миокарда или нестабильной стенокардией. Проспективное мультицентровое обсервационное когортное исследование CRIT, изучавшее взаимосвязь между анемией, трансфузией эритроцитарной массы и клиническими исходами, показало, что увеличение количества доз введенной эритроцитарной массы является независимым предиктором худшего исхода.
Однако рестриктивная стратегия кровевосполнения не может быть полностью использована при неостановленном кровотечении и клинических признаках геморрагического шока, свидетельствующих о недостаточном снабжении организма О2 или развивающихся энергодефицитных нарушениях клеточного метаболизма. Они сопровождают такие клинические состояния, как травма, хирургические ятрогении, разрыв аневризмы аорты, массивные желудочно-кишечные кровотечения, трансплантация органов (в первую очередь печени), ангиоинтервенционные технологии, акушерство.
Геморрагический шок требует массивных трансфузий. Понятие «массивная трансфузия» было введено в клиническую практику в 1960 г. и подразумевало введение >10 ед. крови за 24 часа. Сегодня это до 50 ед. крови за 24-48 ч (J.L. Carlson et al., 2012). Его внедрение позволило к 1970 году сократить летальность на 6,6%. В настоящее время выживаемость при массивной кровопотере определяется ранним распознаванием и агрессивным лечением коагулопатии, применением методов согревания, контролем степени хирургической агрессии, расширением использования компонентов трансфузионной терапии. Именно такая тактика обеспечивает сохранение жизни больного, невзирая на возможные риски и осложнения гемотрансфузий. Среди них ААВВ (2012) выделяет:
1. Заражение вирусными инфекциями.
Частота встречаемости в странах с высоким экономическим индексом развития составляет: для гепатита А – 1:1 млн доз; для гепатита В – от 1:6000 до 1:320 000 доз. У 10% инфицированных гепатит В переходит в хроническую форму. Заражение гепатитом С колеблется от 1:1,2 до 1:13 млн доз. У 80% инфицированных он переходит в хроническую форму.
Заражение ВИЧ колеблется от 1:1,4 до 1:11 млн доз; вирусом человеческой Т-клеточной лейкемии типа 1 – 1:250 000 доз, типа 2 – 1:2 млн доз.
Заражение цитомегаловирусом колеблется от 1:10 до 1:30 доз, вирусом Эпштейна-Барр – 1:200 доз, вирусом лихорадки Северного Нила – от 1:3000 до 1:5000 доз.
Заражение паразитарными инфекциями зависит от многих факторов и составляет: для малярии в целом 1:4 млн для стран с эндемичными заболеваниями – 1:3 дозам.
Бактериальная контаминация происходит с частотой инфицирования от 1:200 000 до 1:4,8 млн доз. Сепсис, связанный с трансфузией эритроцитов, развивается с частотой 1:2000 до 1:3000 доз.
2. Иммунологические риски:
- Посттрансфузионная пурпура (острая тромбоцитопения вследствие разрушения тромбоцитов реципиента тромбоцит-специфическими антителами донора), которая встречается крайне редко.
- АВО несовместимость встречается с частотой от 1:6000 до 1:33 000 доз. При этом частота смертельных исходов колеблется от 1:250 000 до 1:1 млн доз.
- Синдром TRALI (трансфузионно-ассоциированное острое повреждение легких) обусловлено наличием специфических антител (человеческий лейкоцитарный антиген HLA) в донорской плазме. Описан Барнардом в 1951 г., частота встречаемости колеблется от 2:10 000 до 9:10 000 доз.
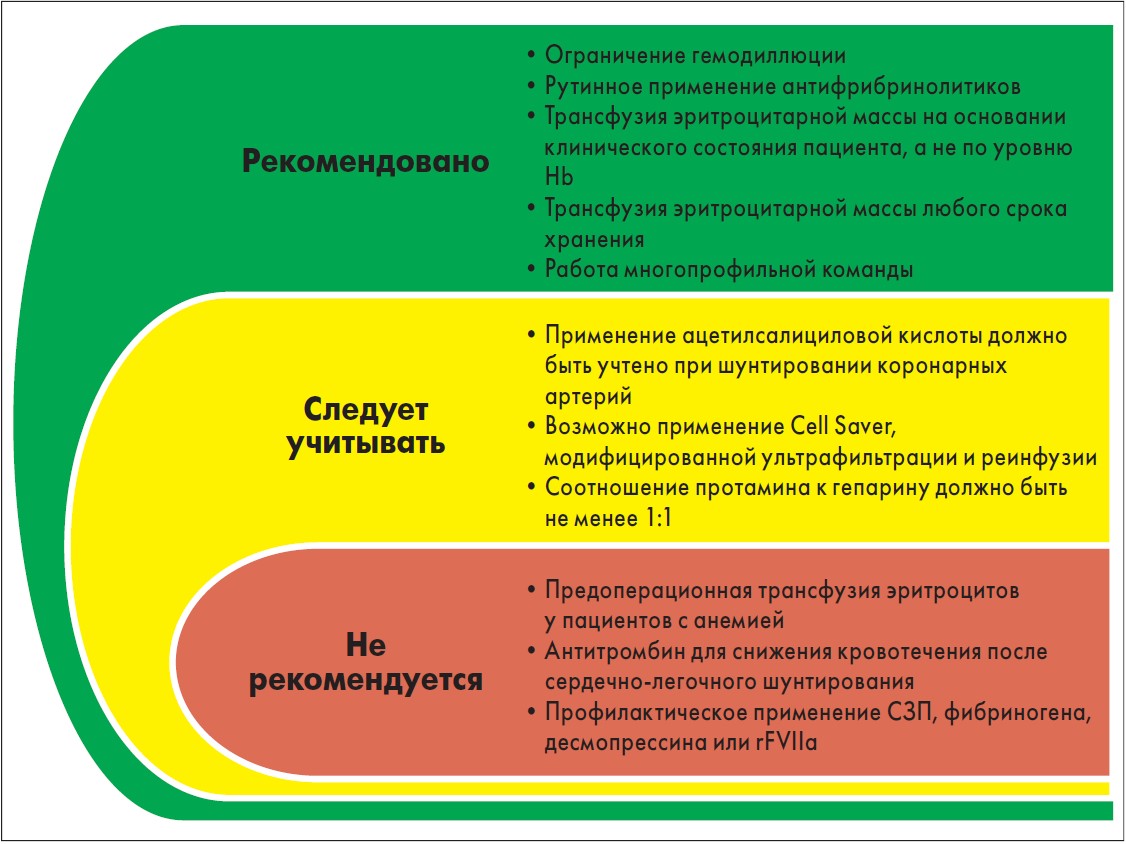
Актуальность проблемы обоснования принципов лечения кровопотери подтверждается большим количеством гайдлайнов, издаваемых в разных странах мира. В них утверждаются и научно обосновываются основные этиопатогенетические принципы ее восполнения. Так, в совместном гайдлайне EACTS/EACTA (2017) по восполнению кровопотери во время кардиохирургических операций даны следующие рекомендации (рис. 2).
Рис. 2. Алгоритм восполнения дефицита ОЦК в кардиохирургии
Восполняя дефицит ОЦК вследствие кровопотери, мы должны стремиться к целевым показателям, отражающим эффективность восполнения:
- Величина систолического АД – >90 мм рт. ст.
- Значения среднего АД – >65 мм рт. ст.
- ЦВД – не более 6,0 Н2О ст.
- 4. Величина SpO2 – >94% при FiO2=21%.
- Уровень Hb – >90 г/л при отсутствии кардиальной и/или дыхательной патологии.
- Количество тромбоцитов – >75×109/л.
- Уровень фибриногена – не ниже 3,0 г/л.
- Уровень Са2+ – >1,0 ммоль/л.
- Значения рН – >7,4.
- Уровень лактата – <2,0 ммоль/л.
- Скорость диуреза – >0,5 мл/кг/ч.
Соблюдение этих принципов обеспечивает улучшение конечных результатов лечения.
Тематичний номер «Хірургія, Ортопедія, Травматологія» № 1 (31), лютий 2018 р.