20 березня, 2018
Фіброзуючий медіастиніт як наслідок перенесеного туберкульозу: короткий огляд літератури
Фіброзуючий медіастиніт (ФМ), або фіброз середостіння, – це рідкісне захворювання, під час якого потовщення фіброзної тканини середостіння призводить до низки ускладнень – від легкого клінічного перебігу до обструкції судинних та дихальних структур, а також структур стравоходу [1].
Вступ
Найпоширенішою причиною цього стану є вторинна реакція на гістоплазмоз, випадки захворювань на який переважно описані в США [1]. Однак навіть серед пацієнтів з гістоплазмозом лише у 3 випадках на 100 тис. було діагностовано розвиток ФМ [2]. Серед інших причин, здатних провокувати виникнення ФМ, також виділяють туберкульоз (ТБ) [3], аспергільоз [4, 5] і віднедавна захворювання, пов’язане з імуноглобуліном G4 [6]. Спонтанна форма з некальцинуючим фіброзом вже була описана і також може бути асоційована з екстраторакальними фіброзними станами, такими як ретроперитонеальний (заочеревинний) фіброз, та іншими аутоімунними захворюваннями [7, 8].
У літературі описано 2 форми медіастиніту: гранулематозний медіастиніт (ГМ), за якого поширення фіброзу обмежується медіастинальними лімфовузлами, і ФМ [3]. У цій статті буде розглянуто відмінності між двома зазначеними формами захворювання.
Незважаючи на зв’язок між ТБ і ФМ, такі випадки майже не описані в літературі. Ось один із випадків медіастинального фіброзу, асоційованого з ТБ, з оглядом літератури, де описаний взаємозв’язок між цими двома станами.
Клінічний випадок
Чоловік, 74 роки, азіат (мешканець Пакистану), в анамнезі є інфаркт міокарда в 2007 р. і ТБ, повністю вилікуваний у 2010 році. Звернувся у березні 2013 р. зі скаргами на ядуху, що триває 4 тиж.
Після огляду грудної клітки було встановлено, що у пацієнта наявні помірні свистячі хрипи та зменшено надходження повітря до лівої легені. Комп’ютерна томографія (КТ) показала двостороннє рубцювання верхівок легень із множинними маленькими вузликами у середній та нижній частках справа, найбільший з яких мав розмір 4 мм, а також лівосторонній плевральний випіт. Під час викачування рідини з легень було видалено 500 мл трансcудату, посів останнього на ТБ був негативний. Посів мокротиння на ТБ також виявився негативний. Пацієнту було призначено тижневий курс лікування антибіотиками, стероїдами та інгаляторами.
Установлений діагноз: астма. Після виписки з лікарні пацієнтові відмінили прийом стероїдів і використання інгаляторів, оскільки відчутного покращення його стану не відбулося.
У жовтні 2013 р. чоловік знову був госпіталізований через повторний лівосторонній плевральний випіт, проте цього разу – у Великій Британії. Обстеження вентиляційної функції легень показало змішаний обструктивно-рестриктивний її тип з об’ємом форсованого видиху за 1-шу секунду 1,1 л (50% від належного), форсованим життєвим об’ємом легень 1,8 л (60%) і фактором переносу моноокису вуглецю 3,69 (50%). Ехокардіографія (ЕхоКГ) виявила, що фракція викиду лівого шлуночка становить 60%. Однак у пацієнта розвинулося незначне розширення правого передсердя з помірною гіпертрофією правого шлуночка і помірним підвищенням систолічного тиску легеневої артерії до 60 мм рт. ст. Коронарна ангіографія показала прохідність стентів. Пацієнта було направлено до регіонального центру з діагнозом «легенева гіпертензія», де йому було проведено катетеризацію правого передсердя, яка показала наступне: середній тиск легеневої артерії 31 мм рт. ст., тиск заклинювання в легеневій артерії 10 мм рт. ст., резистентність легеневих судин 512 дин/с на см‑5, відповідно, із прекапілярною легеневою гіпертензією.
Необхідно зазначити, що на повторній КТ (рис. 1) було виявлено нове кальциноване м’якотканинне утворення в середостінні й прикореневій зоні та діагностовано ФМ.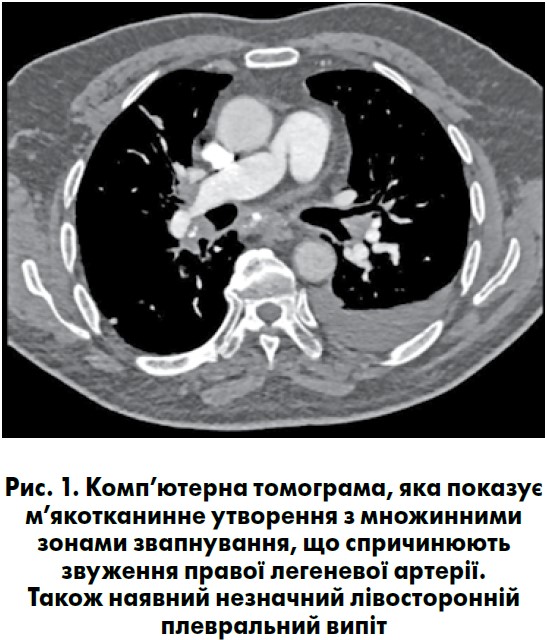
Після консультації з фахівцем стосовно доцільності хірургічного втручання було встановлено, що медіастинальний фіброз спричинював зовнішню деформацію судин із множинним центральним стенозом легеневої артерії та звуженням легеневих вен на бронхіальному рівні. Проте було прийнято рішення, що ангіопластика є надто ризикованою процедурою, здатною спровокувати розрив артерії через ураження великої кількості судин.
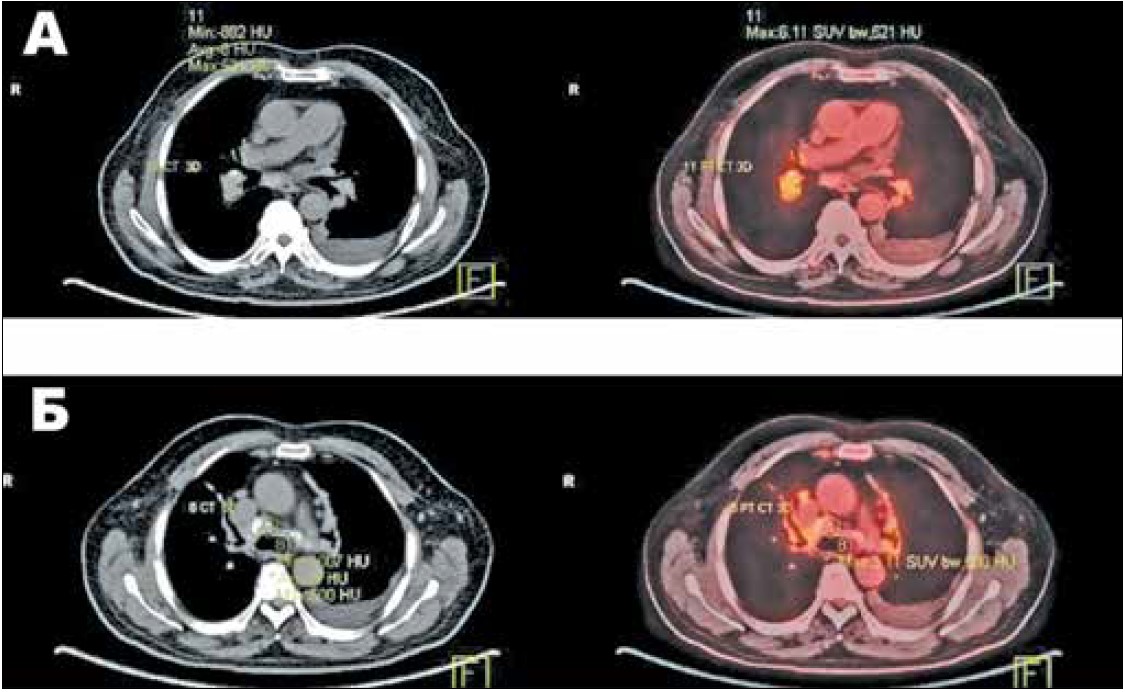
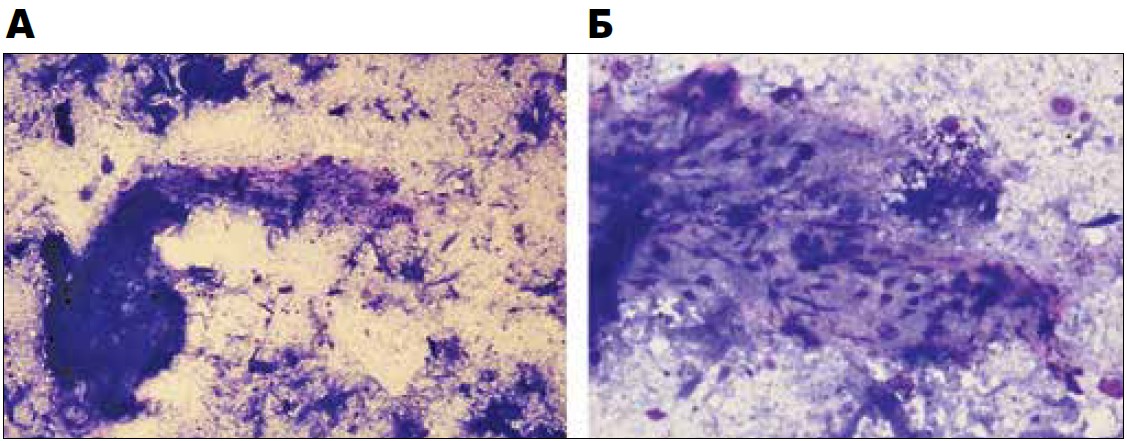
Позитронно-емісійна томографія із фтордезоксиглюкозою (ФДГ-ПЕТ) (рис. 2, A, Б) продемонструвала метаболічно активну, частково кальциновану прикореневу зону і м’якотканинне утворення середостіння. Пацієнт пройшов ендобронхіальне ультразвукове дослідження у травні 2014 р. і гістологічне дослідження мікробіоптату лімфовузлів середостіння (рис. 3, A, Б), яке виявило некроз тканин, антракозні макрофагоцити та поодинокі лімфоцити без наявності ознак гранульоми чи ракових клітин або негативно забарвлених імуноглобулінів G4. Бактеріологічне обстеження на ТБ і полімеразна ланцюгова реакція (ПЛР) були негативні, так само як і тести на гістоплазму, антинуклеарні антитіла та вірус імунодефіциту людини. З огляду на підвищену активність, що була виявлена під час ПЕТ-діагностики, у червні 2014 р. пацієнтові було призначено преднізолон по 60 мг щоденно з хіміопрофілактикою ТБ.
Після двох місяців лікування хворий відчув полегшення симптомів, його фізичний стан покращився до рівня показників 2007 року. Проте повторна КТ порівняно з попередньою діагностикою суттєвих покращень не виявила.
Рис. 2. На КТ (зліва) проглядаються кальциновані зони, ПЕТ (справа) показує підвищену ФДГ-ПЕТ метаболічну активність у новоутворенні середостіння (A) і прикореневих лімфовузлах (Б)
Рис. 3. Мікробіопсія новоутворення середостіння показує фіброзну тканину, яка містить веретеноподібні клітини з антракозними макрофагоцитами і некрозом тканин на задньому фоні, забарвлення за Май-Грюнвальдом-Гімзе (МГГ). МГГ×100 (A), МГГ×400 (Б)
Після зменшення дози преднізолону до 50 мг на добу дихання пацієнта погіршилося, і у вересні 2014 р. його знову було госпіталізовано з прогресуючою дихальною недостатністю. Пацієнтові призначили 3 дози метилпреднізолону внутрішньовенно, здійснили чергове видалення рідини об’ємом 500 мл з лівої плевральної порожнини і виписали зі стаціонара, призначивши 40 мг преднізолону на добу та фуросемід. Аби зменшити дозу стероїдів, у жовтні 2014 р. пацієнтові призначили мофетіл мікофенолат (ММФ) 500 мг 2 р/добу. До листопада 2014 р. він приймав лише 10 мг преднізолону щоденно. Упродовж наступних місяців пацієнт залишався залежним від стероїдних препаратів, унаслідок чого мав ускладнення, включаючи остеопоротичні переломи хребта та міопатію.
У січні 2015 р. стан пацієнта відзначався слабкістю, яка супроводжувалася периферичним набряком. Хворому знову призначили внутрішньовенний курс метилпреднізолону, сечогінні препарати й подальше видалення 660 мл транссудату з лівої плевральної порожнини. Повторна ЕхоКГ показала погіршення легеневої гіпертензії, що супроводжувалося систолічним тиском у легеневій артерії 78 мм рт. ст. Незважаючи на це, симптоми вдалося стабілізувати завдяки призначенню 5 г преднізолону на добу і 500 мг ММФ 2 р/ добу, постійному дренажу легень та обмеженню фізичних навантажень ходьбою до 300-400 м на добу.
Поширення
Ступінь поширення медіастинального фіброзу, що викликаний ТБ, маловідомий, оскільки в літературі описано небагато подібних випадків. C.G. Schowengerdt і співавт. (1969), які розглянули 180 випадків захворювання, зазначали, що на таку кількість хворих було встановлено всього 13 випадків ГМ і лише 1 випадок ФМ, при якому ТБ був визначений як збудник захворювання (через підтверджену наявність кислотостійких бактерій). Автори розглядали випадки, які в момент їхнього виникнення не підлягали такому сучасному методу діагностики ТБ, як ПЛР. Проте відмінність між частотою випадків ТБ при захворюванні на гранулематоз порівняно з випадками захворювань на фіброз може бути підтвердженням того, що ці два стани перебувають у динаміці, а ГМ виступає первинною активною інфекцією, на тлі якої найбільш ймовірно виявити кислотостійкі бактерії. Лише у деяких випадках ГМ призвів до ФМ, за якого рубцювання тканин перейшло на решту середостіння. Отже, ФМ може відповідати пізнішим стадіям порушеного процесу одужання у відповідь на активну інфекцію.
Ця теорія розглядається в описах багатьох наступних випадків, у яких тканина з фіброзного середостіння показала негативні результати стосовно наявності кислотостійких бактерій і бактерій, що спричиняють ТБ. Насправді це спостерігається і у випадках фіброзу, викликаного гістоплазмозом, під час яких здебільшого також не виявлено позитивних реакцій на бактерії [9]. Утім, треба зазначити, що через рідкісність цього захворювання неможливо чітко зрозуміти, чи ці дві форми репрезентативної вибірки випадків медіастиніту є різними етапами одного процесу чи окремими клінічними станами. Дослідження англомовної літератури виявило описи 5 окремих випадків цього захворювання [10-14] і 2 описи серій випадків. У першому описі серій, який було проведено T.M. Mole і співавт. (1995) [15], розповідається про 8 пацієнтів із ФМ, викликаним ТБ, і 1 окремий випадок, коли пацієнт одночасно хворів і на ТБ, і на гістоплазмоз. Другий опис серій випадків надає інформацію про ще 9 пацієнтів із ТБ, які мали утруднене ковтання, спричинене ФМ [16].
Підґрунтям для діагностування ФМ в усіх наведених випадках були рентгенографія грудної клітки і гастроскопія. Кінцевий діагноз було встановлено без проведення КТ і/або біопсії тканин середостіння.
Клінічні прояви захворювання
Первинні прояви ФМ залежать від того, які анатомічні структури уражені фіброзом. C.G. Schowengerdt і співавт. (1969) [3] виявили, що на ранніх стадіях захворювання на гранулематоз лише у чверті хворих (26%) були ушкоджені прилеглі структури порівняно з більш пізньою фіброзною стадією захворювання, де цей відсоток зростає втричі (83%). Найчастіше захворювання вражає верхню порожнисту вену (ВПВ), венозна обструкція спостерігається у понад 60% пацієнтів, які страждають на ФМ [3]. Іншими ураженими зонами можуть бути стравохід, трахея, бронхи, легеневі вена та артерія, нижня порожниста вена, грудна лімфатична протока, передсердя і зворотний гортанний нерв [3]. Обструкція ВПВ була також описана в дослідженнях клініки Майо (6 із 31 випадку) [17], T.M. Mole і співавт. (1995) (6 із 18 випадків) [15].
Хоча обструкція ВПВ і є характерним симптомом, повільно прогресуюча природа цього захворювання дозволяє сформувати додаткові судини, тому початок хвороби здебільшого безсимптомний. Прогресування захворювання часто призводить до дихальної недостатності, розширення вен шиї та верхньої ділянки грудної клітки, набряку обличчя і характерних ознак легеневого серця [9]. При ушкодженні структур бронхів може виникати прогресуюча задишка, кашель та кровохаркання. Хворий скаржиться на утруднене ковтання з поширенням на стравохід, охриплість голосу із защемленням зворотного гортанного нерва, а також неспецифічний біль і відчуття дискомфорту у грудях [15]. В описах окремих випадків ФМ, виникнення якого пов’язують із попереднім захворюванням на ТБ, зазначається, що клінічні прояви стали можливими через синдром ВПВ [10-11], обструкцію бронхів [12], компресії легеневої артерії [13], а також ушкодження поперечного синусу і суміжних з ним судинних структур [14].
Патогенез
Патогенез формування фіброзної тканини під час ФМ досі незрозумілий. Існує думка, що інфекція гістоплазмозу поширюється в організмі лімфатичною системою та внаслідок клітинної імунної відповіді провокує формування медіастинальних гранульом [1].
D.B. Flieder і співавт. дослідили гістоморфологію тканин, які було вилучено у 30 пацієнтів, що страждали на ФМ невстановленого походження. Вчені висунули думку, що ця патологія виникла внаслідок тристадійного прогресу фіброзно-запальних змін. I стадія характеризується набряклою фіброміксоїдною тканиною з численними веретеноподібними клітинами, еозинофілами, мастоцитами, лімфоцитами і клітинами плазми. На II стадії спостерігається розростання широкого прошарку хаотично розташованого колагену. На ІІІ – виявляють густо розміщений безклітинний колаген і поодинокі вкраплення дистрофічного звапнення [18].
Цікаво, що найновіші дослідження показали, що CD20-позитивні В-лімфоцити часто зустрічаються при імунофенотипуванні й здатні сприяти прогресуванню захворювання [19].
Діагноз
Сьогодні є декілька способів діагностування ФМ. До того як почали застосовувати сучасні методи скринінгу, підозри щодо виникнення захворювання виникали після рентгенографії грудної клітки, на якій було видно розширення середостіння і лімфаденопатію прикореневих і паратрахеальних ділянок [20].
Основним методом дослідження залишається КТ. У більшості випадків ФМ уражені фіброзом ділянки містять кальцинати, і завдяки цьому методу променевої діагностики в них краще ідентифікується компресія судинних і дихальних шляхів [20, 21]. Іноді також можна побачити дифузне утворення з м’яких тканин без звапнування [22], а для діагностування злоякісного процесу необхідні зразки уражених тканин (біоптат). Хоч зазвичай, щоб отримати зразок тканини, застосовують медіастиноскопію або методи хірургічного дослідження [3, 15], ми скористалися менш інвазивною технікою ендобронхіальної ультразвукової діагностики.
За допомогою магнітно-резонансної томографії (МРТ) можна легко розпізнати залучення у процес структур середостіння, проте цей метод не дуже ефективний для визначення кальцинатів, які є характерною ознакою ФМ [23]. МРТ виключає необхідність введення внутрішньовенного контрасту в судини, що важливо для пацієнтів з алергією на йод або хворих на гостру ниркову недостатність.
У літературі описаний досвід застосування методу пульмонологічної сцинтіографії [24-26] для візуалізації дефектів перфузії, а також методу ангіографії для виявлення пошкоджень судинної системи. Проте ці методи діагностики не дають змогу встановити діагноз ФМ; швидше, їх можна застосовувати як додаткові до КТ та МРТ. До того ж КТ- та МР-ангіографія здатні надати достатню деталізацію судинної патології без таких тестів [14].
Роль ФДГ-ПЕТ/КТ-сканування є незрозумілою. S. Chong і співавт. (2007) продемонстрували негативне поглинання ФДГ, зробивши висновок, що ПЕТ-сканування є доцільним, коли необхідно провести диференціювання для виявлення злоякісності [27]. Але інші вчені встановили, що активні запальні ураження також можна виявити за допомогою ПЕТ-діагностики; отже, метод можна застосовувати для того, щоб визначити відповідь на призначене лікування, хоча біопсія і залишається обов’язковою для виключення неопластичного процесу [28, 29].
Лікування та клінічні результати
ФМ можна лікувати за допомогою хірургічного втручання, так із використанням консервативного способу – медикаментозної терапії. Вибір на користь хірургічного втручання залежить від того, які анатомічні структури ушкоджено; утім, слід зазначити, що цей метод застосовують в останню чергу, бо таке втручання є доволі складним та ризикованим у разі ураження фіброзом ділянок біля життєво важливих структур організму.
У декількох випадках захворювання на фіброз, спричиненого ТБ (вони були наведені на початку цієї статті), результати виявилися різними. Зокрема, у випадку, який був описаний O. Ojeifo і співавт. (2015), пацієнт упродовж 6 міс лікувався від латентного ТБ на основі цитотоксичного тесту позитивного інтерферону-γ без доказів активного захворювання, що підтверджено мікробіологічними зразками [13]. Найбільшим втручанням було видалення хірургічним шляхом фіброзного новоутворення і вставлення розгалуженого алотрансплантату, щоб полегшити стан тяжкого стенозу головної правої легеневої артерії та ВПВ [13].
J. Fijołek і співавт. (2009) здійснювали лікування пацієнта, що повторно страждав на кровохаркання. Пацієнт пройшов два курси протитуберкульозної терапії, перш ніж було встановлено діагноз ФМ, що виник понад 10 років потому після первинного встановлення діагнозу ТБ [12]. Крім того, у пацієнта спостерігалося суттєве звуження правої нижньої легеневої вени і лівої легеневої артерії. Пацієнту був призначений пробний курс лікування преднізолоном по 60 мг на день протягом 2 міс без хірургічного втручання, проте новоутворення збільшилося і терапію було зупинено [12]. Утім, дослідники відзвітували, що симптоми хвороби не відновилися на момент публікації цієї статті.
C. Zhang і співавт. видалили фіброзне новоутворення, яке вже поширилося на аорту, легеневу артерію і ліве передсердя, і призначили пацієнтці курс протитуберкульозної терапії. Після цього спостерігався значний регрес симптомів, однак про періодичність подальших оглядів не зазначається [14]. Незважаючи на компресію судинних структур, з часом досить часто спостерігається розвиток колатерального кровообігу без набутої обструкції. N.G. Baikoussis і співавт. (2015) дійшли висновку, що такий стан доцільніше спостерігати, ніж втручатися в нього [10].
У випадках, що наведені T.M. Mole і співавт. (1995), 9 із 18 хворих на ФМ попередньо перенесли ТБ [15]. На жаль, автори не розповіли про наслідки, які спостерігались у пацієнтів, що хворіли на ТБ, а просто узагальнили результати. До того ж відсутня інформація щодо лікування стероїдними препаратами або протитуберкульозними засобами [15]. Декільком пацієнтам виконали хірургічну операцію, під час якої було здійснено шунтування ВПВ, лобектомію, висікання та видалення ураженої фіброзом тканини. Повторне медичне обстеження 12 з цих пацієнтів було проведене у період від 5 до 20 років після хірургічного втручання, у 10 з них не було виявлено жодних симптомів попереднього захворювання, включаючи трьох, які пройшли хірургічне лікування обструкції порожнистої вени [15]. Два пацієнти померли внаслідок розвитку злоякісного процесу, не пов’язаного з ускладненнями від медіастинального фіброзу.
Для пацієнтів із ФМ, що не був пов’язаний з попереднім захворюванням на ТБ, лікування і його результати виявилися аналогічними. T. Peikert і співавт. (2011) дослідили 80 випадків захворювань, які спостерігалися у клініці Майо у період з 1998 по 2007 рік, при цьому більшість пацієнтів попередньо хворіли на гістоплазмоз [19]. Усього 31 пацієнт отримав протигрибкове лікування, 5 хворих приймали стероїди, 2 пацієнти проходили експериментальне лікування тамоксифеном. Радіологічне втручання із судинною пластикою / стентуванням або ендобронхіальною балонною дилатацією / стентуванням провели 15 пацієнтам, тоді як 17 хворим було рекомендовано хірургічне втручання [19]. Із 34 пацієнтів, які пройшли повторне медичне обстеження після курсу терапії, у 6 (18%) спостерігалися певна симптоматика чи підтвердження захворювання після радіологічного обстеження; лише у 3 пацієнтів підтвердилася візуальна діагностика реакції на протигрибкову терапію і лише один пацієнт відреагував на протизапальну терапію [19]. Однак стан учасників усіх груп лікування, а саме 21 пацієнта, залишився стабільним. А от хворим, які перенесли ангіопластику чи стентування, знадобилося проведення повторних процедур у період від 6 до 12 міс. П’ятеро з 12 пацієнтів, які обстежувалися після хірургічного втручання, потребували стентування чи емболізації через повторне виникнення симптомів [19]. Проте рівень виживаності повністю відповідає контролю над віковими категоріями, лише 2 пацієнти померли внаслідок захворювання на ФМ.
Як показують результати одного з найновіших досліджень, хірургічне втручання слід застосовувати лише як останній захід, оскільки троє з 18 пацієнтів, яким зробили операцію на життєво важливих дихальних шляхах чи легеневих структурах, померло через ускладнення від пульмонектомії [30].
Як продемонстрували деякі дослідження, успішною показала себе і стероїдна терапія [31]. A.D. Sherrick і співавт. (1994) повідомляють, що троє з шести пацієнтів із дифузними змінами за даними радіологічних досліджень позитивно відреагували на лікування стероїдами, що було помітно під час повторної візуальної діагностики, проте жодному з чотирьох пацієнтів, які страждали на локалізований фіброз, не покращало [20]. Науковці висловили думку, що у разі обширного фіброзу може спостерігатися більш загальна імунна реакція організму, тому така форма захворювання краще піддається лікуванню протизапальними препаратами [20].
Тамоксифен, селективний модулятор рецепторів естрогену, був застосований у поєднанні зі стероїдами [32]. B.A. Savelli і співавт. (1997) застосовували стероїди і тамоксифен. Спершу це давало позитивний ефект, проте після припинення вживання тамоксифену хвороба знову прогресувала, тож її розвиток припиняли завдяки призначенню комбінованої терапії. Для порівняння: коли в одного з пацієнтів виник рецидив захворювання внаслідок зменшення дози стероїдів як частини комбінованої терапії з тамоксифеном, було вирішено підвищити дозу стероїдів, щоб знову викликати стан ремісії на тривалий час [29]. В іншому випадку завдяки лікуванню потрійною комбінацією ітраконазолу, тамоксифену та високих доз стероїдів вдалося зменшити ФДГ-активність під час ПЕТ-сканування [28].
Обговорення
У нашого пацієнта було декілька чинників, що викликали дихальну недостатність, зокрема помірна легенева гіпертензія, рецидивуючий плевральний випіт і пошкодження паренхіми легень унаслідок перенесеного ТБ. Медіастинальний фіброз виник через декілька років після лікування ТБ і був виявлений за допомогою КТ — найкращого методу променевої діагностики. ФДГ-ПЕТ допомогло встановити активність у пухлині, однак біопсія все ще була необхідна для виключення онкологічного процесу і повторного захворювання на ТБ. Було проведено ендобронхіальну біопсію за допомогою ультразвукової діагностики; вона є менш інвазивною порівняно з торакоскопічною хірургічною біопсією з відеопідтримкою чи медіастиноскопією, проте не дозволяє оцінити всі уражені ділянки. Важливо зазначити, що у нашому випадку біопсія виявила тканину, уражену фіброзом, без активного гранулематозного запалення і разом з ФДГ-ПЕТ авідністю. Ми робимо висновок, що це було активне фіброзне запалення.
Лікування передбачало призначення високих доз стероїдних препаратів та ТБ-хіміопрофілактики [12-14]. Після початку прийому стероїдів у пацієнта відзначалося полегшення симптомів, проте через 3 міс удруге виникло серйозне утруднення дихання, незважаючи на те що дозу стероїдів було зменшено з 60 до 50 мг. Після відновлення внутрішньовенної стероїдної терапії симптоми захворювання значно зменшилися. Повторна ФДГ-ПЕТ для оцінки зменшення активності в пухлині не проводилася, оскільки розміри ураженої ділянки, а не власне саме запалення, на нашу думку, були основним фактором, який провокував компресію локальних структур.
Призначення ММФ у нашому випадку як допоміжного лікарського засобу ґрунтувалося на успішному застосуванні цієї терапії в лікуванні заочеревинного фіброзу. P.J. Scheel і співавт. (2012) показали, що у 89% їхніх пацієнтів розміри новоутворення навколо аорти зменшилися на 25% [33], проте не виключалось і лікування стероїдами з огляду на наявність діабету. Хірургічне або радіологічне втручання було протипоказане через високий ризик. Хірургічне втручання слід застосувати в останню чергу, оскільки навіть після операції захворювання продовжує прогресувати й виникає необхідність повторного втручання упродовж 6-12 міс [19].
Зв’язок між ТБ і медіастинальним фіброзом усе ще складно зрозуміти, і це питання потрібно й надалі досліджувати на клінічних випадках. У цій статті ми охопили 2 форми медіастиніту – гранулематоз та фіброз. На сьогодні досі не з’ясовано, чи дійсно гранулематоз неминуче призводить до обширного фіброзу. Поки що відсутні дослідження, які показали б природний перебіг захворювання, і випадок, який ми навели, ілюструє ймовірність того, що антиген ТБ здатний викликати постійні запальні зміни в організмі навіть після лікування. Патогенез ФМ, спричиненого ТБ, усе ще залишається гіпотетичним і частково ґрунтується на нашому розумінні ФМ, спровокованого гістоплазмозом. Однак досі невідомо, чи збігається клінічний перебіг захворювання у випадку виникнення ФМ, викликаного ТБ, з таким самим при гістоплазмозі. Доцільним вбачається призначення пробної терапії, яка була успішною при лікуванні ФМ невстановленого походження чи спричиненого гістоплазмозом у випадках посттуберкульозного захворювання на медіастинальний фіброз.
Хоча стан нашого пацієнта і не покращився після прийому ММФ (незважаючи на позитивні результати під час його застосування при заочеревинному фіброзі [33]), нам вдалося покращити стан пацієнта, додавши до ММФ низькі дози кортикостероїдів. M. Inoue і співавт. описали перший випадок ФМ, викликаного імуноглобуліном G4 з високим рівнем сироваткового імуноглобуліну G4, порівняно з результатами гістологічних досліджень [34]. Спостерігаючи позитивну реакцію у відповідь на застосування стероїдів, автори пропонують брати до уваги рівень сироваткового імуноглобуліну G4 як індикатора щодо доцільності застосування стероїдів під час лікування цієї когорти пацієнтів [34]. Крім того, інші діючі речовини, такі як тамоксифен, або ж лікування, спрямоване на знищення B-лімфоцитів, мають бути розглянуті для кожного конкретного пацієнта [19].
Література
1. Loyd J.E., Tillman B.F., Atkinson J.B. et al. Mediastinal fibrosis complicating histoplasmosis. Medicine 1988; 67: 295-310.
2. Wheat L.J., Slama T.G., Eitzen H.E. et al. A large urban outbreak of histoplasmosis: clinical features. Ann Intern Med 1981; 94: 331-7.
3. Schowengerdt C.G., Suyemoto R., Main F.B. Granulomatous and fibrous mediastinitis. a review and analysis of 180 cases. J Thorac Cardiovasc Surg 1969; 57: 365-79.
4. Chatterjee D., Bal A., Singhal M. et al. Fibrosing mediastinitis due to Aspergillus with dominant cardiac involvement: report of two autopsy cases with review of literature. Cardiovasc Pathol 2014; 23: 354-7.
5. Wightman S.C., Kim A.W., Proia L.A. et al. An unusual case of Aspergillus fibrosing mediastinitis. Ann Thorac Surg 2009; 88: 1352-4.
6. Peikert T., Shrestha B., Aubry M.C. et al. Histopathologic overlap between fibrosing mediastinitis and IgG4-related disease. Int J Rheumatol 2012; 2012: 1-7.
7 Dehner L.P., Coffin C.M. Idiopathic fibrosclerotic disorders and other inflammatory pseudotumors. Semin Diagn Pathol 1998; 15: 161-73.
8. Fatourechi M.M., Hay I.D., McIver B. et al. Invasive fibrous thyroiditis (riedel thyroiditis): the mayo clinic experience, 1976-2008. Thyroid 2011; 21: 765-72.
9. Parish J.M., Rosenow E.C. Mediastinal granuloma and mediastinal fibrosis. Semin Respir Crit Care Med 2002; 23: 135-44.
10. Baikoussis N.G., Argiriou O., Kratimenos T. et al. Lipomatous hypertrophy of the interatrial septum and fibrosing mediastinal lymphadenopathy causing superior vena cava obstruction. Ann Card Anaesth 2015; 18: 609-11.
11. Ferrer Galvan M., Rodrіguez Portal J.A., Serrano Gorarredona M.P. et al. Fibrosing mediastinitis mimicking sarcoidosis. Clin Respir J 2015; 9: 125-8.
12. Fijolek J., Wiatr E., Błasinska-Przerwa K. et al. Fibrosing mediastinitis as an untypical complication of tuberculosis: case report. Pol Arch Med Wewn 2009; 119: 752-5.
13. Ojeifo O., Gilotra N.A., Kemp C.D. et al. Mediastinal fibrosis of the pulmonary artery secondary to tuberculosis. Ann Thorac Surg 2015; 100: e49-e50.
14. Zhang C., Yao M., Yu Z. et al. Rare fibrosing granulomatous mediastinitis of tuberculosis with involvement of the transverse sinus. J Thorac Cardiovasc Surg 2007; 133: 836-7.
15. Mole T.M., Glover J., Sheppard M.N. Sclerosing mediastinitis: a report on 18 cases. Thorax 1995; 50: 280-3.
16. Ramakantan R., Shah P. Dysphagia due to mediastinal fibrosis in advanced pulmonary tuberculosis. AJR Am J Roentgenol 1990; 154: 61-3.
17. Dines D.E., Payne W.S., Bernatz P.E. et al. Mediastinal granuloma and fibrosing mediastinitis. Chest 1979; 75: 320-4.
18. Flieder D.B., Suster S., Moran C.A. Idiopathic fibroinflammatory (fibrosing/sclerosing) lesions of the mediastinum: a study of 30 cases with emphasis on morphologic heterogeneity. Mod Pathol 1999; 12: 257-64.
19. Peikert T., Colby T.V., Midthun D.E. et al. Fibrosing mediastinitis: clinical presentation, therapeutic outcomes, and adaptive immune response. Medicine 2011; 90: 412-23.
20. Sherrick A.D., Brown L.R., Harms G.F. et al. The radiographic findings of fibrosing mediastinitis. Chest 1994; 106: 484-9.
21. McNeeley M.F., Chung J.H., Bhalla S. et al. Imaging of granulomatous fibrosing mediastinitis. AJR Am J Roentgenol 2012; 199: 319-27.
22. Atasoy C., Fitoz S., Erguvan B. et al. Tuberculous fibrosing mediastinitis: CT and MRI findings. J Thorac Imaging 2001; 16: 191-3.
23. Rholl K.S., Levitt R.G., Glazer H.S. Magnetic resonance imaging of fibrosing mediastinitis. AJR Am J Roentgenol 1985; 145: 255-9.
24. Mallin W.H., Silberstein E.B., Shipley R.T. et al. Fibrosing mediastinitis causing nonvisualization of one lung on pulmonary scintigraphy. Clin Nucl Med 1993; 18: 594-6.
25. Savolaine E.R., Schlembach P.J. Scintigraphy compared to other imaging modalities in benign superior vena caval obstruction accompanying fibrosing mediastinitis. Clin Imaging 1989; 13: 234-8.
26. Park H.M., Jay S.J., Brandt M.J. et al. Pulmonary scintigraphy in fibrosing mediastinitis due to histoplasmosis. J Nucl Med 1981; 22: 349-51.
27. Chong S., Kim T.S., Kim B.T. et al. Fibrosing mediastinitis mimicking malignancy at CT: negative FDG uptake in integrated FDG PET/CT imaging. Eur Radiol 2007; 17: 1644-6.
28. Takalkar A.M., Bruno G.L., Makanjoula A.J. et al. A potential role for F‑18 FDG PET/CT in evaluation and management of fibrosing mediastinitis. Clin Nucl Med 2007; 32: 703-6.
29. Kaya H., Rider K., Cho A.H. et al. The role of PET scan in monitoring the progression of fibrosing mediastinitis. Clin Imaging 2016; 40: 177-9.
30. Mathisen D.J., Grillo H.C. Clinical manifestation of mediastinal fibrosis and histoplasmosis. Ann Thorac Surg 1992; 54: 1053-8.
31. Ikeda K., Nomori H., Mori T. et al. Successful steroid treatment for fibrosing mediastinitis and sclerosing cervicitis. Ann Thorac Surg 2007; 83: 1199-201.
32. Savelli B.A., Parshley M., Morganroth M.L. Successful treatment of sclerosing cervicitis and fibrosing mediastinitis with tamoxifen. Chest 1997; 111: 1137-40.
33. Scheel P.J., Sozio S.M., Feeley N. Medical management of retroperitoneal fibrosis. Trans Am Clin Climatol Assoc 2012; 123: 283-90.
34. Inoue M., Nose N., Nishikawa H. et al. Successful treatment of sclerosing mediastinitis with a high serum IgG4 level. Gen Thorac Cardiovasc Surg 2007; 55: 431-3.
Реферативний переклад з англ. Ірини Олійник
BMJ Open Respiratory Research,
2017, Vol. 4-1.
Тематичний номер «Пульмонологія, Алергологія, Риноларингологія» № 1 (42), лютий 2018 р.