21 березня, 2018
Роль корекції дефіциту вітаміну D при ревматичних хворобах
Основна роль вітаміну D в організмі людини згідно із сьогоднішніми уявленнями полягає в регуляції (сумісно з паратиреоїдним гормоном – ПТГ) кальцій-фосфорного обміну, що відображається в регуляції (підвищенні) рівнів кальцію та фосфору в крові та інтерстиціальній рідині (H.F. Deluca, 2001). Вітамін D може надходити в організм перорально чи вироблятися ендогенно в шкірі під впливом ультрафіолетового випромінювання шляхом конвертації прекурсора 7-дегідрохолестеролу в превітамін D3 (Y. Arnson, 2007), а потім у вітамін D3 (холекальциферол) (M. Cutolo, 2008).
 Сонячне випромінювання забезпечує 80% потреби у вітаміні D, однак це залежить від багатьох факторів, таких як колір шкіри, застосування кремів та інших косметичних засобів, особливостей одягу та стилю життя. У північній півкулі з листопада по березень на широтах північніше 40 градусів північної широти інтенсивність сонячного випромінювання така, що достатньої стимуляції синтезу вітаміну D не відбувається.
Сонячне випромінювання забезпечує 80% потреби у вітаміні D, однак це залежить від багатьох факторів, таких як колір шкіри, застосування кремів та інших косметичних засобів, особливостей одягу та стилю життя. У північній півкулі з листопада по березень на широтах північніше 40 градусів північної широти інтенсивність сонячного випромінювання така, що достатньої стимуляції синтезу вітаміну D не відбувається.
Додаткове забезпечення вітаміном D можливо за рахунок уживання деяких продуктів (жирні сорти риби, яйця тощо), де міститься прекурсор ергостеролу, що потім конвертується в організмі у вітамін D. Проте забезпечення організму вітаміном D з їжею також є часто недостатнім – не більш як 20% від потреби (M. Cutolo, 2008).
Дефіцит вітаміну D є однією з основних проблем зі здоров’ям у всіх вікових групах населення в усьому світі, навіть у широтах із високим рівнем сонячного випромінювання, а також в індустріалізованих країнах (C. Palacois, 2014). За сучасними даними, поширеність дефіциту вітаміну D варіює від 2 до 30% у дорослій популяції та сягає 60% серед дітей і підлітків. Але накопичено недостатньо даних щодо поширеності дефіциту вітаміну D серед дітей різного віку, підлітків і вагітних (S. Stagi, 2014).
Одним із найважливіших наслідків дефіциту вітаміну D є розвиток остеопорозу (ОП) – системного захворювання скелета, при якому зменшується кісткова маса, порушується мікроархітектоніка кісткової тканини, збільшується крихкість кістки та підвищується ризик переломів. Системний ОП – складне багатофакторне захворювання, що характеризується зазвичай повільним безсимптомним прогресуванням до моменту розвитку переломів кісток, які в більшості випадків є першими достовірними ознаками ОП. Для ОП характерне виникнення спонтанних нетравматичних або неадекватних тяжкості травми переломів (L.J. Melton, 1993; В.М. Коваленко і співавт., 2013).
Метаболізм вітаміну D в організмі відбувається в декілька етапів (G. Legri et al., 2015):
- Абсорбція в кишечнику чи синтез у шкірі.
- Зв’язування з альбуміном (11,6%) або специфічним глікопротеїном (VDBP, vitamin D binding protein – вітамін-D-зв’язувальний протеїн).
- Транспорт у печінку, де він метаболізується до 25-гідроксивітаміну D (25(ОН)D, або кальцифедіол) – головної форми, що циркулює в крові.
- Гідроксилювання 25(ОН)D в 1,25-гідроксивітамін D (1,25(ОН)2D3, або кальцитріол) у нирках за допомогою α-гідроксилази.
Факторами, що регулюють продукцію 1,25(ОН)2D3, є:
1) гіпокальціємія – стимуляція ПТГ і підвищення конверсії 25(ОН)D в 1,25(ОН)2D3;
2) гіпофосфатемія;
3) низький або підвищений рівень 1,25(ОН)2D3 (за механізмом зворотного зв’язку, коли недостатність вітаміну за висхідними механізмами призводить до регуляції його продукції на вищому рівні).
Рецептори до вітаміну D, що залучені до метаболізму кальцію, локалізовані в кишечнику, нирках, паращитоподібних залозах і кістках.
Взаємодія 1,25(ОН)2D3 з його рецепторами (VDR, vitamin D receptor) у тонкому кишечнику підвищує транспорт кальцію зі слизової кишечника до циркулюючої крові; взаємодія з рецепторами на рівні кістки індукує мобілізацію кальцію; в нирках це призводить до реабсорбції кальцію в дистальних відділах канальців (H.F. Deluca, 2001).
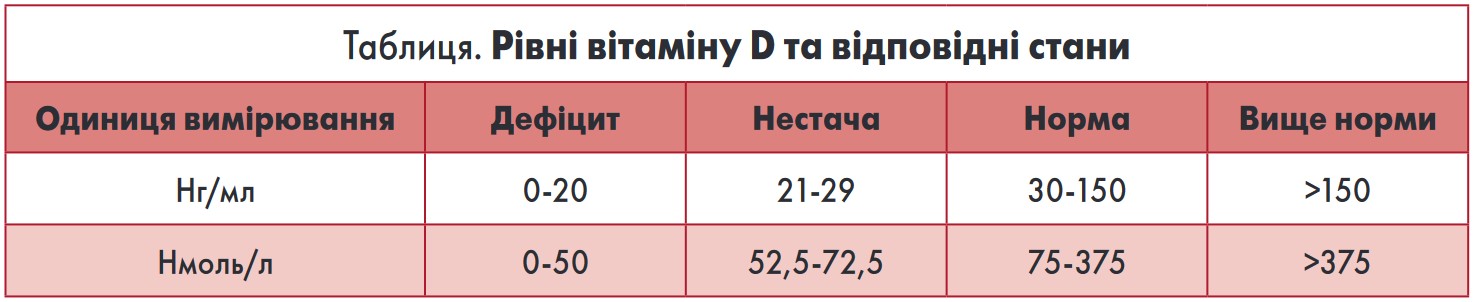
На сьогодні не існує єдиного загальноприйнятого консенсусу визначення оптимального рівня вітаміну D (M.F. Holick, 2007; A. Spiro, 2014). Однак рівні вітаміну D ≤10, 11-20, 21-29, ≥30 нг/мл розцінюються відповідно як тяжкий дефіцит, дефіцит, недостатність і достатній рівень (табл.).
Окрім впливу на кісткову мінералізацію, є й інші важливі функції вітаміну D, адже він має мішені в інших органах і тканинах, наприклад у головному мозку, простаті, молочній залозі та кишечнику, кардіоміоцитах (S. Pilz еt al., 2014; D.K. Tishkoff et al., 2008). До того ж протипухлинна активність включає індукцію апоптозу клітин деяких пухлин, таких як рак молочної залози, товстої кишки та простати. Деякі дослідження вказують на зв’язок між ризиком розвитку раку й рівнем 25(OH)D у сироватці крові (J. Fleet, 2008; J.C. Souberbielle et al., 2010). Це стало основою для появи концепції D-гормона, яка набула поширеності у зв’язку з отриманням нових даних (A.W. Norman, 2008).
«Некласичні» ефекти вітаміну D (D-гормона):
- регуляція обміну речовин;
- стимуляція продукції інсуліну;
- участь у функціонуванні імунної системи;
- протизапальний, антибактеріальний, протипухлинний, антигіпертензивний ефекти тощо;
- участь у роботі репродуктивної системи.
Останні наукові дані свідчать про те, що низький рівень вітаміну D тісно пов’язаний із:
- високим рівнем загальної смертності;
- ризиком виникнення серцево-судинних захворювань;
- ризиком розвитку онкопатології (рак молочної залози, простати та товстої кишки);
- саркопенією (втратою м’язової маси);
- ожирінням, метаболічним синдромом, а також розвитком інсулінорезистентності й цукрового діабету 1 та 2 типу в дорослих.
Вітамін D та аутоімунні захворювання
Вплив вітаміну D на імунну систему підтверджується тим фактом, що VDR представлені майже в усіх клітинах імунної системи, в тому числі CD8+ та CD4+ лімфоцитах, B-лімфоцитах, нейтрофілах, APC (antigen-presenting cells – антигенпрезентуючі клітини), макрофагах, а також хондроцитах і синовіоцитах синовіальної оболонки зони ерозій кістки при ревматоїдному артриті – РА (F. Baeke et al., 2010).
Показано, що вітамін D важливий у регуляції вродженого й адаптивного імунітету (J. Fleet, 2008).
Важливо, що при деяких аутоімунних хворобах, таких як розсіяний склероз, РА та запальні захворювання кишечника, T-клітини за рахунок самоураження підштовхують імунну систему до стимуляції запалення в периферичних тканинах. Механізм цих аутоімунних реакцій наразі невідомий, отож роль вітаміну D в патогенезі аутоімунних захворювань, здається, є більшою за ту, що відома науці на сьогодні (G. Legri et al., 2015).
Нині знайдено зв’язок між зниженням споживання вітаміну D та поширеністю аутоімунних хвороб (у тому числі цукрового діабету 1 типу й системного червоного вовчака – СЧВ). Наприклад, у більшості дітей із синдромом PFAPA (періодична гарячка, афтозний стоматит, фарингіт і запалення шийних лімфовузлів) був виявлений низький рівень вітаміну D у сироватці крові (S. Stagi et al., 2014), причому холекальциферол як адитивний засіб значно зменшував частоту та тривалість типового PFAPA. Це доводить гіпотезу, що дефіцит вітаміну D може бути важливим фактором ризику розвитку PFAPA, та визначає його роль як імунорегуляторного фактора, який запобігає розвиткові цього синдрому (S. Stagi et al., 2014). Крім того, зниження рівня вітаміну D виявлено у хворих на синдром Дауна. Ці хворі, за останніми даними, мають високий ризик аутоімунних розладів. Визначено, що гіповітаміноз вітаміну D у пацієнтів із синдромом Дауна є більш тяжким у тих, у кого розвинулися аутоімунні хвороби (S. Stagi et al., 2015).
Роль вітаміну D у формуванні вродженого й адаптивного імунітету
При формуванні вродженого імунітету активуються TLR (toll-подібні рецептори). Ці рецептори присутні в поліморфноядерних клітинах, макрофагах і моноцитах і розпізнають патогени, що порушують імунну реакцію (P.T. Liu et al., 2008).
1,25(OH)2D3 має ключову роль як у активації TLR, так і в протимікробній відповіді організму, в тому числі на інфікування мікобактерією туберкульозу (T.T. Wang et al., 2004). Крім того, аутокринна продукція вітаміну D у дендритних клітинах, здається, відіграє певну роль у регуляції діяльності Т-клітин (A. Antico et al., 2010).
Вітамін D чинить гальмівну дію на адаптивну імунну систему за рахунок пригнічення проліферації та продукції імуноглобулінів і сповільнення диференціації прекурсорів у плазматичні клітини (S. Chen et al., 2007). З іншого боку, цей вітамін гальмує проліферацію Th1-клітин, які відповідають за синтез інтерферону, інтерлейкіну‑2 (IL‑2) та активацію макрофагів (M. Cippitelli, A. Santoni, 1998; F. Mather et al., 2000). Вітамін D також впливає на дозрівання дендритних клітин, модулюючи функцію CD4+ Т-клітин (P.D. Lang, R. Aspinall, 2015).
Крім того, діючи на APC, вітамін D сприяє синтезу IL‑4, IL‑5 та IL‑10 (L. Adorini, G. Penna, 2008). Збільшення синтезу ІL‑10 за рахунок збільшення популяції CD4+, CD25+ лімфоцитів призводить до блокади T1 і пригнічення секреції IL‑17 T-ефекторами (G. Penna et al., 2008; A. Antico et al., 2010).
Вітамін D та СЧВ
Є багато доказових даних щодо високої поширеності зниження рівня вітаміну D при СЧВ, причому встановлено взаємозв’язок між активністю хвороби та дефіцитом вітаміну D (K. Muller et al., 1995; S. Stagi et al., 2014; R. Miskovic et al., 2015). У хворих на СЧВ зниження рівня вітаміну D зумовлене багатьма факторами ризику, передусім фоточутливістю, яка робить неможливим перебування пацієнтів на сонці. Крім того, ураження нирок і застосування глюкокортикоїдів (ГК) також призводить до порушень метаболізму вітаміну D.
Застосування протималярійних засобів, які впливають на метаболізм вітаміну D, – ще одна причина низького рівня останнього (T.C. Bames et al., 2004). Нарешті, існує таке явище, як антитіла проти вітаміну D, особливо у хворих на антифосфоліпідний синдром (J.F. Carvalho et al., 2007; M. Cutolo, K. Otsa, 2008).
Є також і суперечливі дані. Зокрема, R. Miscovic і співавт. (2015) не знайшли різниці в концентрації 25(OH)D між пацієнтами, що приймали добавки вітаміну D, і тими, хто цього не робив. Не виявлено також різниці в цьому показнику між пацієнтами, котрі приймали протималярійні препарати, й тими, хто не отримував такої терапії.
За даними A.M. Huisman і співавт. (2001), рівні вітаміну D у пацієнтів із фіброміалгією зіставні з такими у пацієнтів із СЧВ. Попри це, сучасні роботи наголошують на імуномодулюючій дії вітаміну D у цих хворих, причому визначено негативну кореляцію між рівнями вітаміну D та активністю СЧВ за даними досліджень ECLAM і SLEDAI. Насамкінець, адитивна терапія вітаміном D рекомендована в цих хворих у зв’язку з його потенційною імуномодулюючою дією (M. Cutolo, K. Otsa, 2008).
Змішане захворювання сполучної тканини – ЗЗСТ (синдром Шарпа)
Визначено значно нижчі рівні вітаміну D порівняно з такими у здорових осіб (E. Zold et al., 2008). Як при СЧВ, так і при інших ЗЗСТ нижчі рівні вітаміну D корелюють зі шкірними проявами (фоточутливість, еритема чи хронічний дискоїдний вовчак). Окрім того, ЗЗСТ може перейти в іншу, більш конкретизовану нозологічну форму, особливо в перші роки захворювання, причому рівні вітаміну D при трансформації залишаються низькими (E. Zold et al., 2008).
Системна склеродермія (ССД)
Продемонстровано високу поширеність дефіциту вітаміну D при ССД (A. Vacca et al., 2011; R. Rios-Fernandez et al., 2012). Крім того, пацієнти із ССД мають низьку мінеральну щільність кістки (МЩК) і високий ризик переломів (M.A. Omair et al., 2013). Дебют ССД у дитячому та підлітковому віці у 100% хворих асоціювався з дефіцитом вітаміну D (<20 нг/мл) і низькою МЩК (S.K. Shinjo et al., 2011).
Інші дані свідчать, що додавання вітаміну D знижує прогресування фіброзу (J.N. Artaza, K.C. Norris, 2009). Y. Arnson і співавт. (2011) показали значні відмінності рівнів вітаміну D у здорових осіб і хворих на ССД, особливо зі значним ураженням шкіри (значення рахунку Rodhan ≥10), причому спостерігалася зворотна залежність вираженості фіброзу й концентрації вітаміну D. Дані щодо впливу вітаміну D на ураження шкіри при ССД поклали початок успішного застосування його топічних форм (кальцитріол – аналог вітаміну D) при фіброзі шкіри внаслідок експериментальної склеродермії (A. Usategui et al., 2014).
Вітамін D та РА
У декількох дослідженнях ролі вітаміну D у хворих на РА підтримано гіпотезу щодо його участі в патогенезі хвороби. У дорослих із РА було виявлено негативну кореляцію між рівнями вітаміну D та кількістю хворобливих суглобів і результатами оцінки за DAS28 і HAQ (S. Patel et al., 2007). В експерименті на моделі ад’ювантного колаген-індукованого артриту в гризунів було показано, що добавка, яка містить 1,25(OH)2D, може перешкодити появі та прогресуванню хвороби. Ці дані потенційно надають вітаміну D (D-гормону) ключову роль у патогенезі РА (M.T. Cantoma et al., 1998). Результати досліджень свідчать, що низький рівень 25(OH)D у хворих на РА пов’язаний із розвитком кісткових ерозій та ОП (H.J. Haga et al., 2013; M.J. Higgins et al., 2013). Інші дані свідчать про наявність дефіциту вітаміну D у хворих на РА й негативну кореляцію між його рівнями, активністю хвороби та втратою кісткової маси (Q. Homg et al., 2014). Отже, асоціація рівнів вітаміну D з активністю РА на сьогодні чітко визначена (M. Cutolo et al., 2006; M. Rossini et al., 2010).
Ювенільний ідіопатичний артрит (ЮІА)
Відомо, що поняття ЮІА включає декілька нозологічних форм, які відрізняються за клінічною симптоматикою, особливостями аутоімунної відповіді тощо (В.М. Коваленко і співавт., 2016). На сьогодні чітко не встановлено зв’язок між рівнем 25(OH)D у сироватці крові та розвитком ЮІА. Деякі автори повідомили, що вітамін D може впливати на розвиток і прогноз ЮІА навіть за відсутності значних відмінностей рівнів 25(OH) при поліартикулярній та олігоартикулярній формах (J.A. Ellis et al., 2010; Y. Shapira et al., 2010).
У дослідженні за участю 152 хворих на різні субтипи ЮІА в усіх випадках було встановлено зниження рівнів вітаміну D. У пацієнтів з активною хворобою за DAS28 і частими рецидивами рівень 25(OH)D виявився нижчим, аніж у пацієнтів із неактивною хворобою в різних популяціях і при різних формах (полі- та олігоартикулярній тощо) (M.E. Miettinen et al., 2013; I. Bouaddi et al., 2014; S. Stagi et al., 2014).
Дослідження підкреслюють роль вітаміну D і кальцію в протекції кісткової тканини при ЮІА (C.F. Pelajo et al., 2012; M.K. Nisar et al., 2013; I. Bouaddi et al., 2014).
Сучасні рекомендації щодо менеджменту системного ГК-індукованого ОП
На сьогодні актуальними залишаються європейські рекомендації (F. Cosman et al., 2014), у яких серед пріоритетних заходів значиться прийом вітаміну D (800-1000 МО/добу) в осіб віком ≥50 років; а також рекомендації Американського коледжу ревматологів (2017), у яких вказується, що «…всі дорослі пацієнти, котрі приймають ГК у дозі ≥2,5 мг/добу протягом ≥3 міс, …мають оптимізувати споживання кальцію (800-1000 мг/добу) та прийом вітаміну D (600-800 МО/добу)».
Зазначимо, що вищенаведені дози та терміни використання вітаміну D є більшою мірою профілактичними, тоді як при встановленій нестачі чи дефіциті вітаміну D потрібно призначати вищі дози останнього.
Це стосується, в тому числі, призначення «базисних» антиостеопоротичних засобів, наприклад бісфосфонатів, коли дози вітаміну D, що рекомендують пацієнтам, можуть зростати в рази.
Важливо, що в рекомендаціях щодо ініціації антиостеопоротичної терапії при тривалому прийомі ГК окремо виділено групи пацієнтів, у яких оптимізація споживання кальцію й вітаміну D та модифікація способу життя мають переваги над прийомом бісфосфонатів, терипаратиду, деносумабу чи ралоксифену. Це дорослі віком ≥40 років із низьким ризиком переломів, які становлять значний відсоток ревматичних хворих, особливо в дебюті захворювання.
Отже, роль вітаміну D (або D-гормона) не обмежується впливом на кісткову тканину та запобіганням розвиткові системного ОП.
Важливою, але практично не вивченою є його протективна дія при аутоімунних хворобах. Роль вітаміну D поширюється за межі його участі в метаболізмі кальцію й має потенційний вплив на розвиток аутоімунних захворювань.
Індивідуальний підбір дози вітаміну D допомагає звести до мінімуму ризик розвитку побічних ефектів і водночас із профілактикою нових переломів, контролем болю та покращанням мобільності зберігає якість життя пацієнтів, у тому числі з ревматичними хворобами (РХ).
Висновки
- Вітамін D має розглядатись як аналог гормонів людського організму, оскільки чинить системну дію на організм і тканини, а також має свої рецептори в тканинах різних органів і систем (м’язово-скелетної, кишечника тощо).
- Позаскелетні ефекти вітаміну D полягають у регуляції роботи імунної системи, що може бути важливо для пацієнтів з аутоімунними хворобами.
- Призначення препаратів ГК пацієнтам, які й без того мають недостатній рівень вітаміну D, додатково пригнічує активність останнього, знижує всмоктування кальцію з кишечника й підвищує ризики розвитку кісткової патології, а також пригнічує позаскелетні ефекти вітаміну D.
- Зважаючи на високу ймовірність недостатності вітаміну D у пацієнтів із РХ і ризики лікування (вплив ГК на метаболізм вітаміну D), доцільно робити аналізи на наявність дефіциту вітаміну D.
- Необхідно включати вітамін D до адитивної фармакотерапії пацієнтів із РХ з аутоімунним механізмом розвитку з огляду на його роль у патогенезі цих захворювань.
- Застосування препаратів вітаміну D з метою нормалізації його рівня як додаткової терапії сприяє покращенню стану пацієнтів із РХ.
- Необхідні подальші дослідження для розуміння як ролі вітаміну D у патогенезі аутоімунних хвороб, так і його імуномодулюючої та протизапальної дії.
- Крім того, додаткові дослідження необхідні, щоб знайти найкращий препарат вітаміну D як дієтичну добавку.
- Потрібно застосовувати препарати холекальциферолу у відповідних дозах для компенсації та профілактики дефіциту вітаміну D при РХ.
Список літератури знаходиться в редакції.
Тематичний номер «Кардіологія, Ревматологія, Кардіохірургія» № 1 (56) лютий 2018 р.