21 березня, 2018
Якість життя пацієнтів з остеоартрозом: сучасний погляд на методи лікування та реабілітації
Щорічно у світі понад 130 млн пацієнтів звертаються по медичну допомогу зі скаргами на кістково-м’язовий біль, основною причиною якого є остеоартроз (ОА). За різними оцінками, поширеність ОА в популяції коливається від 5 до 18%, при цьому показники захворюваності неухильно зростають (Н.А. Шостак, 2016; О.Ю. Вакуленко, 2016).
Зона ризику
Раніше ОА традиційно визначався як хронічне прогресуюче незапальне захворювання суглобів невідомої етіології, що характеризується дегенерацією суглобового хряща та структурними змінами субхондральної кістки, а також явно чи приховано протікає помірно вираженим синовітом. Останніми роками стався справжній переворот у поглядах на ОА. Раніше захворювання розцінювали як неминучий наслідок процесу старіння організму в цілому та супутньої цьому процесу дегенерації суглобових структур. Сьогодні ОА сприймається як агресивний катаболізм суглобового хряща на тлі запалення, що протікає в суглобі, та потребує активного протизапального й хондропротективного лікування (L.G. Raisz, 1999; S. Laufer et al., 2003).
Загалом під ОА розуміють гетерогенну групу захворювань різної етіології з подібними біологічними, морфологічними, клінічними проявами й наслідками, в основі яких лежить ураження всіх компонентів суглоба, передусім хряща, а також субхондральної кістки, синовіальної оболонки, зв’язок, капсули, навколосуглобових м’язів. Перебіг ОА супроводжують вторинні запальні процеси й насамперед синовіт, що відіграють значну роль як у формуванні клініки захворювання, так і в подальшій деструкції суглобових структур (Н.А. Хитров, 2014; Н.А. Шостак, 2016).
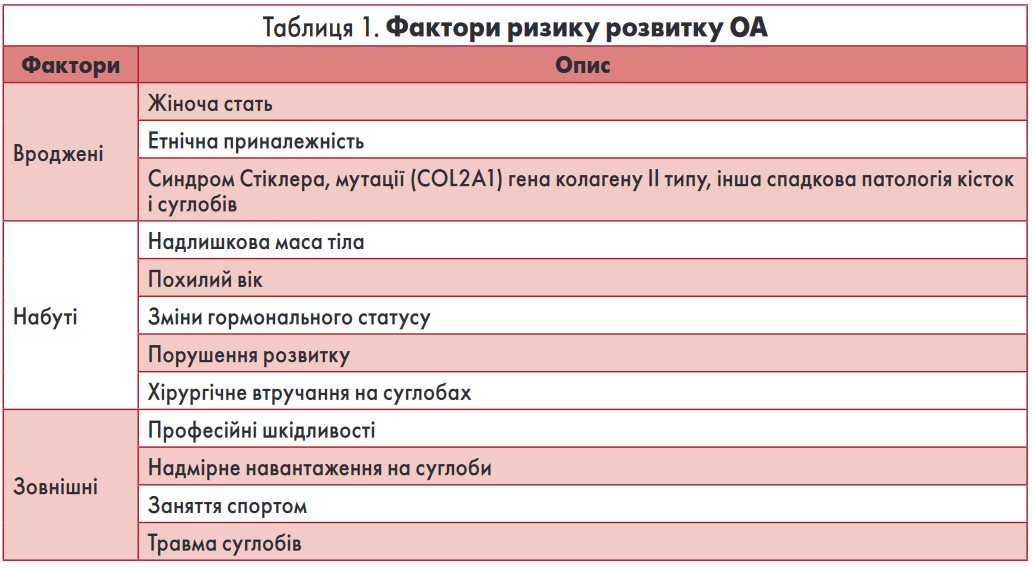
ОА з повним правом можна вважати мультифакторіальним захворюванням, розвитку якого сприяють генетичні фактори, ожиріння, надмірні фізичні навантаження, великі та малі травми суглобів тощо (табл. 1) (Н.А. Шостак, 2016). За впливом на стан здоров’я в західних країнах серед усіх захворювань ОА посідає четверте місце в жінок і восьме в чоловіків. Частота розвитку ОА істотно збільшується з віком (В.В. Поворознюк, Н.В. Григорьева, 2012; B. Kristjansson, S. Honsawek, 2014).
Особливу увагу слід звернути на фактори ризику виникнення та прогресування ОА, наявні в кожному конкретному випадку. Зокрема, ожиріння істотно збільшує навантаження на суглоби нижніх кінцівок (причому за значущістю навіть перевершує спадковість) і, відповідно, є вельми небезпечним фактором ризику розвитку такого вкрай інвалідизуючого дегенеративного захворювання суглобів, яким є ОА. У 2016 році понад 1,9 млрд дорослих старше 18 років мали надлишкову вагу (39% чоловіків і 40% жінок), із них понад 650 млн (11% чоловіків і 15% жінок) страждали на ожиріння (ВООЗ, 2017).
Показано, що ожиріння й надмірна вага визначають дебют больового синдрому при ОА колінного суглоба, тоді як втрата ваги зменшує біль і знижує ризик розвитку симптоматичного ОА. У перехресному дослідженні, проведеному серед хворих на ОА (середній вік – 58 років), ожиріння було пов’язано з підвищеним ризиком появи болю в кульшових, колінних, гомілковостопних суглобах (J. Adamson et al., 2006).
Якість життя
Слід зазначити, що ОА тривалий час вважався «попелюшкою» ревматології. Так сталося насамперед через те, що йому не приділяли належної уваги в питаннях, котрі стосуються як окремих етіопатогенетичних механізмів розвитку, так і загальномедичних поглядів на проблему в цілому (Н.А. Хитров, 2014). Але висока частота захворювання та несприятливі результати прогнозів щодо якості життя та професійної захворюваності пацієнтів з ОА кардинально змінили ситуацію. Дійсно, жодна інша хвороба так не ускладнює пересування, підйом сходами та інші рухи, що виконують за допомогою нижніх кінцівок, як це притаманно ОА. Пацієнти з ОА витрачають більше часу й сил на виконання своїх щоденних обов’язків, у них менше часу залишається на відпочинок. Вони дуже залежні від своїх родичів та оточення, а також змушені витрачати більше коштів на медичну допомогу та підтримку здоров’я, ніж люди тієї самої статі та віку із загальної популяції (E. Yelin, L.F. Callahan, 1995).
У пацієнтів з ОА тривалий час зберігається больовий синдром, порушення функції суглобів і обмеження рухової активності, небажані побічні реакції на лікарську терапію, соціальні обмеження. Отже, розвиток ОА призводить до значного погіршення якості життя.
Є.Ю. Алексенко і співавт. провели оцінку якості життя з використанням опитувальника SF 36® у 84 хворих на ОА (28 чоловіків і 56 жінок) у віці від 25 до 55 років, контрольну групу становили 24 здорові добровольці (9 чоловіків і 15 жінок). У хворих на ОА було виявлено зниження якості життя за всіма шкалами порівняно зі здоровими людьми. Цікаво, що в чоловіків з ОА психологічний компонент здоров’я був вищим, аніж у жінок. При цьому не було виявлено змін якості життя в різних вікових категоріях. При тривалості захворювання понад 5 років, а також при поєднанні ОА та метаболічного синдрому окремі показники якості життя погіршувалися. Також примітно, що показники якості життя в чоловіків були дещо вищими порівняно з жінками. Достовірні відмінності було отримано за трьома шкалами: життєва активність, соціальне функціонування та психологічне здоров’я (р<0,05). Чоловіки, які страждають на ОА, незалежно від віку мають більше позитивних емоцій, їхня соціальна активність вища за жіночу. Закономірним є також і менша схильність пацієнтів чоловічої статі до тривожних і депресивних переживань.
Найнижча якість життя в групі хворих на ОА та метаболічний синдром спостерігалася за такими шкалами, як рольове фізичне функціонування, рольове емоційне функціонування та фізичний біль (Є.Ю. Алексенко і співавт., 2009).
Нефармакологічні аспекти
Сучасні рекомендації наголошують на необхідності комбінації нефармакологічних і фармакологічних методів лікування пацієнтів з ОА.
У 2013 році Європейська протиревматична ліга (EULAR) оприлюднила розгорнуті рекомендації щодо нефармакологічного лікування ОА кульшових і колінних суглобів (L. Fernandes et al., 2013). Згідно з цими рекомендаціями всі пацієнти мають отримати індивідуальний план дій, який включає:
- інформацію та навчання з контролю ОА;
- індивідуальну програму фізичних вправ;
- інформацію щодо підтримки й темпів виконання навантажень;
- зниження маси тіла при надмірній вазі та ожирінні;
- зменшення впливу негативних механічних чинників (наприклад, носіння відповідного взуття);
- використання допоміжних пристроїв для ходьби та відповідних технологій.
Отже, немедикаментозні методи обов’язково мають включати освітні програми, що забезпечують хворого інформацією не тільки про природу захворювання та різні методи лікування. Вони повинні містити інформацію щодо зміни способу життя: корекції маси тіла, захисту та розвантаження суглобів. Немедикаментозні аспекти також включають навчання хворих у так званій ревмошколі, фізичні навантаження (як аеробні вправи, так і плавання), застосування спеціальних пристосувань (тростин), ортезів (наколінників, ортопедичних устілок тощо).
Як додаткові методи лікування та реабілітації використовують фізіотерапію, голкорефлексотерапію, масаж, бальнеотерапію (сульфідні, радонові ванни тощо) (Y. Liow et al., 2017).
Із цього приводу слід зазначити, що майже половина з 9 млн дорослого населення США, яка страждає на симптоматичний ОА колінного суглоба, користується тростиною для ходьби. Сучасне дослідження ефективності нової «розумної» тростини з вібротактильним біологічним зворотним зв’язком продемонструвало, що правильне навантаження тростини (наприклад, 15% маси тіла) сприяє зниженню навантаження на коліно, дає змогу зменшити біль і навіть уповільнити прогресування захворювання (R.L. Routson еt al., 2016).
Також наразі проводяться рандомізовані контрольовані дослідження впливу використання тростини на кісткову тканину, біль у коліні в цілому та при ходьбі, а також показники якості життя (A. Van Ginckel et al., 2017).
Медикаментозна терапія: хондроїтин і глюкозамін
Медикаментозні препарати, що використовують у терапії ОА, можна поділити на дві основні групи: симптом-модифікуючі, що мають швидкий знеболювальний ефект та усувають запалення в суглобах (аналгетики й нестероїдні протизапальні препарати – НПЗП), і симптом-модифікуючі уповільненої дії (глюкозамін, хондроїтин, гіалуронова кислота тощо).
На першому етапі лікування ОА колінного суглоба робоча група Європейського товариства з клінічних та економічних аспектів остеопорозу та ОА (ESCEO) рекомендує таку базисну терапію: нефармакологічні (фізіотерапія) й фармакологічні методи (глюкозамін та/або хондроїтин + парацетамол за необхідності). Другий етап: удосконалений фармакологічний контроль (за умови стійкої симптоматики), що має на меті застосування пероральних ЦОГ‑2-селективних або неселективних НПЗП (з урахуванням супутніх факторів ризику); глюкокортикоїдів або гіалуронової кислоти інтраартикулярно. Третій етап: останні фармакологічні спроби перед оперативним втручанням: короткі курси опіоїдів; дулоксетин. Четвертий етап: контроль пізнішої стадії захворювання, хірургічна корекція (O. Bruyere et al., 2014).
Отже, базисну терапію слід починати із симптом-модифікуючих препаратів уповільненої дії, до яких у разі потреби додається короткострокове застосування парацетамолу для екстреного знеболювання. Як відомо, парацетамол широко застосовують як знеболювальний препарат, незважаючи на наявні докази високого ризику розвитку ускладнень у верхніх відділах шлунково-кишкового тракту й можливого тяжкого ураження печінки. Відомо, що на тлі прийому високих доз парацетомолу (>3 г/добу) знижується ниркова функція (зниження швидкості гломерулярної фільтрації >30 мл/хв) (О.Ю. Вакуленко, 2016).
При цьому слід підкреслити: лікар має прагнути провести надійне знеболювання в пацієнта з ОА, що досить часто ускладнюється літнім віком цього контингенту хворих і наявністю в них великої кількості супутніх захворювань (A.G. White et al., 2008). Як відомо, основним недоліком НПЗП є наявність виражених побічних реакцій, особливо з боку шлунково-кишкового тракту та серцево-судинної системи; більше того, деякі з них можуть негативно впливати на метаболізм суглобового хряща. Таким чином, застосування препаратів, потенційно здатних модифікувати обмінні процеси в хрящі, привертає до себе увагу передусім через їхню безпечність при лікуванні ОА. Вони характеризуються, з одного боку, зіставним із НПЗП (хоча й більш сповільненим) впливом на біль і функцію суглобів, із другого – здатністю впливати на перебіг захворювання та його прогноз, сповільнюючи прогресування хвороби (Н.В. Чичасова, 2014).
Як відомо, отримані раніше докази симптом-модифікуючої (зменшення больового синдрому та, відповідно, потреби в прийомі НПЗП і поліпшення функціонального стану хворих) і хондропротективної дії глюкозаміну сульфату та хондроїтину сприяли створенню лікарських засобів на основі їх комбінації з метою отримання можливого сумарно більшого ефекту порівняно з монотерапією цими препаратами.
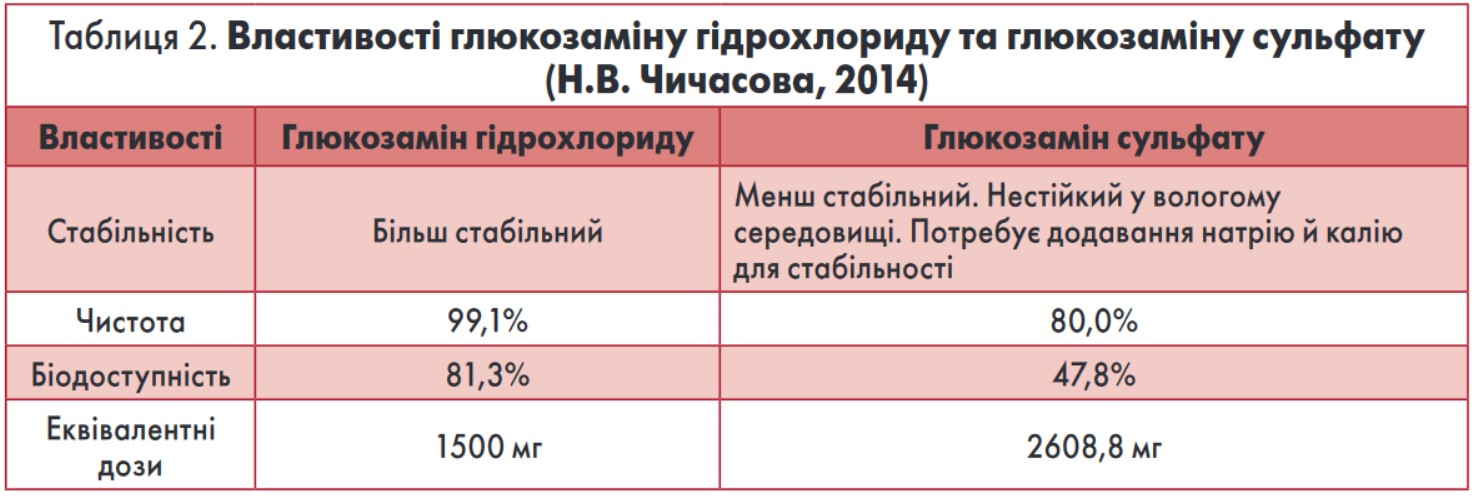
У свою чергу, спільне застосування хондроїтину та глюкозаміну гідрохлориду в експерименті збільшувало продукцію глюкозаміногліканів хондроцитами на 96,6% порівняно з 32% у разі монотерапії. Слід зазначити, що використання в комбінованих препаратах замість глюкозаміну сульфату іншої субстанції – глюкозаміну гідрохлориду пов’язано з її більш високою стабільністю та біодоступністю (табл. 2) (L. Lippielo et al., 1999).
Індивідуальний підхід
Вибір правильного алгоритму лікування для конкретного пацієнта залежить від ретельної оцінки даних обстеження, включаючи супутню патологію, нестабільність зв’язкового апарату, відхилення фізіологічної осі кінцівки, стану розгинального тракту (М.Л. Головаха і співавт., 2011).
Група Міжнародного товариства з вивчення ОА (OARSI) в складі тринадцяти фахівців різних медичних спеціальностей (первинна медико-санітарна допомога, ревматологія, ортопедія, фізіотерапія, фізична медицина та реабілітація, доказова медицина) з десяти країн світу (США, Велика Британія, Франція, Нідерланди, Бельгія, Швеція, Данія, Австралія, Японія й Канада), а також представники пацієнтських організацій розглянули методи лікування ОА з позицій доказової медицини, ґрунтуючись на систематичному огляді досліджень, представлених у базах даних Medline, EMBASE, Google Scholar, Web of Science, а також Кокранівському центральному реєстрі контрольованих випробувань. Ці консенсусні рекомендації, засновані на фактичних даних, інформують пацієнтів і лікарів-практиків щодо ефективності методів лікування, котрі застосовуються в усіх осіб з ОА коліна відповідно до індивідуальних потреб пацієнта, профілю здоров’я та стадії захворювання.
Відповідні методи лікування для всіх осіб з ОА коліна мають включати фізичні вправи, навчання контролю ОА та корекцію маси тіла. Лікування, доречне для конкретних клінічних субфенотипів, може включати ацетамінофен (парацетамол), НПЗП, бальнеотерапію, капсаїцин, тростину, дулоксетин, хондроїтин, глюкозамін, гіалуронову кислоту, опіоїди та ультразвук. Натомість, застосування ризедронату й електротерапії (нейром’язова електрична стимуляція) визнані недоречними (T.E. McAlindon еt al., 2014).
Що стосується НПЗП, то консенсусна група ESCEO рекомендує застосування НПЗП у найменшій ефективній дозі протягом найменшого можливого періоду часу, необхідного для контролю симптомів, періодично чи тривалими та переривчастими курсами. У разі недостатнього контролю симптомів не рекомендовано застосування комбінації НПЗП, оскільки відсутні дані про наявність додаткових переваг, а також у зв’язку з підвищеним ризиком розвитку небажаних реакцій і збільшенням вартості лікування (O. Bruyere et al., 2014).
У свою чергу, Кокранівський огляд 48 рандомізованих контрольованих досліджень (із загальною кількістю 4962 пацієнти, що отримували хондроїтин, та 4148 учасників із плацебо чи іншим контролем) показав, що учасники, котрі отримували хондроїтин, мали більш статистично та клінічно значущі бали порівняно з групою плацебо щодо зменшення болю при дослідженнях тривалістю менш як 6 міс.
Відмінності в індексі Лекена (сукупність болю, функціональної здатності та інвалідності) також статистично значуще вказували на переваги хондроїтину порівняно з плацебо протягом 6 міс. Втрата мінімальної ширини суглобового простору в групі хондроїтину була статистично достовірно меншою, ніж у групі плацебо. При цьому застосування хондроїтину не призводило до статистично значущого числа небажаних явищ. Також хондроїтин у поєднанні з глюкозаміном продемонстрували статистично значуще зменшення болю порівняно з плацебо (J.A. Singh et al., 2015).
Глюкозамін і хондроїтин є складовими комбінованого препарату з хондропротективною активністю Терафлекс («Байєр Консьюмер Кер АГ», Швейцарія), 1 капсула якого містить 500 мг D-глюкозаміну гідрохлориду та 400 мг натрію хондроїтін сульфату.
Терафлекс має достовірну симптом-модифікуючу дію (зменшення болю, скутості суглобів, поліпшення рухової активності, а також сповільнення процесів руйнування хряща та синовіальної оболонки, загальмування резорбції субхондральної кістки) у хворих на ОА великих суглобів і хребта.
Препарат приймають у перші 3 тиж по 1 капсулі 3 рази на добу, далі по 1 капсулі 2 рази на добу. Таким чином, саме при прийомі препарату Терафлекс досягаються добові дози хондропротекторів, ефективність яких підтверджена в незалежних міжнародних дослідженнях (О.Ю. Вакуленко, 2016).
Слід зазначити, що ефективність препарату Терафлекс наростає при тривалому прийомі (не менш як 6 міс). У довгостроковому дослідженні оцінювали ефективність препарату Терафлекс у 224 пацієнтів із клінічно вираженим гонартрозом (М.С. Свєтлова, 2010).
Пацієнти основної групи приймали Терафлекс протягом 3 років за загальноприйнятою схемою з інтервалом в 1 міс. Контрольна група отримувала диклофенак у дозі 100 мг на добу в поєднанні з різними видами фізіотерапії. Позитивний результат при застосуванні препарату Терафлекс протягом 6 міс сягав 96,8%, а наприкінці першого року спостереження визначалися достовірні зміни показників якості життя.
Відмінною рисою препарату Терафлекс є оптимальне співвідношення користь/ризик, що особливо важливо для пацієнтів похилого віку, котрі мають супутні захворювання, при яких не рекомендовано застосування НПЗП. Водночас застосування Терафлексу доцільне також для пацієнтів молодших вікових груп, оскільки на ранніх стадіях захворювання він здатний активно впливати на патогенетичні механізми розвитку ОА.
Ефективність препарату Терафлекс рівнозначна при безперервному прийомі протягом понад 6 міс та при переривчастому прийомі протягом 3 міс із перервою на 3 міс.
Послідовний прийом Терафлекс Адванс із переходом на Терафлекс дає змогу досягти більш швидкого знеболювального ефекту й тим самим покращити прихильність пацієнтів до курсового лікування.
Препарати Терафлекс і Терафлекс Адванс забезпечують знеболювальний ефект, зіставний із НПЗП, при цьому мають більш сприятливий профіль безпечності та добре переносяться при тривалому застосуванні. Тривале (2-3 роки) проведення повторних курсів терапії Терафлексом дає змогу домогтися довгострокового симптом-модифікуючого ефекту та покращити якість життя пацієнтів.
Список літератури знаходиться в редакції.
Підготувала Олександра Демецька
Тематичний номер «Кардіологія, Ревматологія, Кардіохірургія» № 1 (56) лютий 2018 р.