21 березня, 2018
Ще один крок на шляху вдосконалення функціональної діагностики серцево-судинних хвороб
На початку 2018 року з’явився новий національний підручник «Функціональна діагностика» за редакцією завідувача кафедри функціональної діагностики Національної медичної академії післядипломної освіти (НМАПО) ім. П.Л. Шупика (м. Київ), доктора медичних наук, професора Олега Йосиповича Жарінова; завідувача кафедри променевої діагностики факультету післядипломної освіти Львівського національного медичного університету (ЛНМУ) ім. Данила Галицького Юрія Андрійовича Іваніва; доцента кафедри функціональної діагностики НМАПО Віктора Олександровича Куця.
 Книга має чотири великі підрозділи («Електрокардіографія (ЕКГ)», «Функціональні проби. Амбулаторне моніторування ЕКГ і артеріального тиску», «Ехокардіографія (ЕхоКГ)», «Методи оцінки функції зовнішнього дихання. Електроенцефалографія»), що містять показання до застосування зазначених методів, принципи їх виконання, а також основи клінічної інтерпретації даних.
Книга має чотири великі підрозділи («Електрокардіографія (ЕКГ)», «Функціональні проби. Амбулаторне моніторування ЕКГ і артеріального тиску», «Ехокардіографія (ЕхоКГ)», «Методи оцінки функції зовнішнього дихання. Електроенцефалографія»), що містять показання до застосування зазначених методів, принципи їх виконання, а також основи клінічної інтерпретації даних.
Основними авторами підручника є співробітники кафедри функціональної діагностики НМАПО ім. П.Л. Шупика. Розділи з ЕхоКГ та ультразвукового дослідження судин підготовлені кафедрою променевої діагностики ЛНМУ ім. Данила Галицького. До підготовки інших розділів були залучені співробітники суміжних кафедр Харківської медичної академії післядипломної освіти (завідувач – професор В.Й. Целуйко) та Буковинського медичного університету (завідувач – професор В.К. Тащук). Матеріал підручника ґрунтується на узгоджених міжнародних рекомендаціях із використання окремих методів дослідження, нормативних документах Міністерства охорони здоров’я України, власному досвіді авторів, кафедр та їхніх клінічних баз.
Колектив авторів упевнений, що книга, котра включає не тільки текстову інформацію, а й велику кількість ілюстрацій (переважно оригінальних), стане у пригоді практикуючим лікарям-кардіологам, які знайдуть у ній багато цікавого.
Колектив газети вирішив ознайомити читачів з окремими главами підручника з функціональної діагностики.
ЕКГ при гіпертрофії камер серця
Гіпертрофія камер серця є поширеним наслідком системної чи легеневої гіпертензії, клапанних вад серця та інших серцевих хвороб. Її виникненню сприяють різні чинники: тривале перевантаження тиском, об’ємом, підвищення активності симпатоадреналової, ренін-ангіотензин-альдостеронової систем, похилий вік, етнічні й генетичні особливості. Виявлення гіпертрофії має важливе клінічне та прогностичне значення, оскільки ця структурна патологія серця призводить до діастолічної й систолічної дисфункції, аритмій серця, ішемії та, врешті-решт, серцевої недостатності (Сиренко Ю.Н., Жаринов О.И., 2009). Водночас зміни ЕКГ при гіпертрофії шлуночків серця можуть істотно ускладнювати диференційну діагностику ішемії міокарда.
ЕКГ-діагностика гіпертрофії різних відділів серця ґрунтується на оцінюванні змін амплітуди електричного потенціалу, швидкості проведення імпульсів і напрямку реполяризації, котрі спостерігаються внаслідок збільшення маси міокарда й розмірів камер серця. Збільшення вектора та тривалості деполяризації відображається зростанням амплітуди та тривалості зубців ЕКГ, які характеризують збудження відповідних камер серця. Крім того, порушення процесів деполяризації гіпертрофованого міокарда асоціюються зі вторинними змінами процесів реполяризації (Орлов В.Н., 2003). Але потрібно зважати на те, що зміни реполяризації можуть бути також наслідком ішемії гіпертрофованого міокарда. Диференційна діагностика вказаних змін має принципово важливе значення для ведення хворих.
Гіпертрофія передсердь. Зубець P формується внаслідок деполяризації правого й лівого передсердь. Збудження правого передсердя настає трохи раніше, ніж лівого, й тому початкові 0,03-0,04 с зубця Р відображають деполяризацію правого передсердя, а кінцеві 0,03 с – лівого передсердя (наприклад, у відведенні V1 позитивна фаза зубця Р відображає деполяризацію правого передсердя, а негативна – лівого передсердя). У нормі зубець Р позитивний у відведеннях I, II, aVF, V3-V6; його амплітуда становить від 0,5 до 2,5 мм, а тривалість не перевищує 0,11 с.
Гіпертрофія правого передсердя (ГПП) може формуватися при хронічних бронхолегеневих хворобах, легеневій гіпертензії, тромбоемболії в системі легеневої артерії, вроджених вадах серця з перевантаженням правих його відділів. При ГПП збільшуються вектор деполяризації та тривалість збудження правого передсердя, що виявляється зростанням амплітуди та тривалості початкової частини зубця Р. При цьому хід активації лівого передсердя істотно не змінюється. Кінцева частина деполяризації правого передсердя нашаровується на деполяризацію лівого передсердя. Тому загальна тривалість зубця Р не змінюється та становить 0,10-0,11 с.
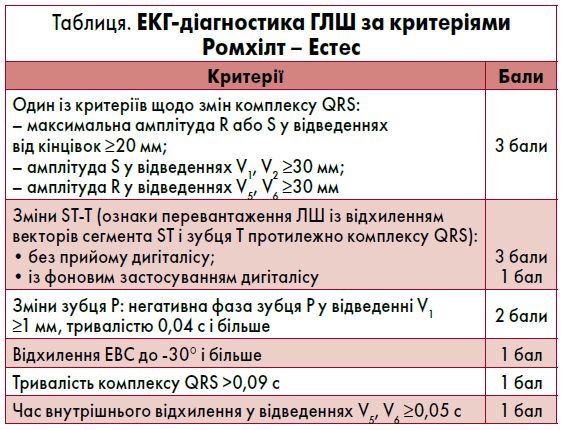
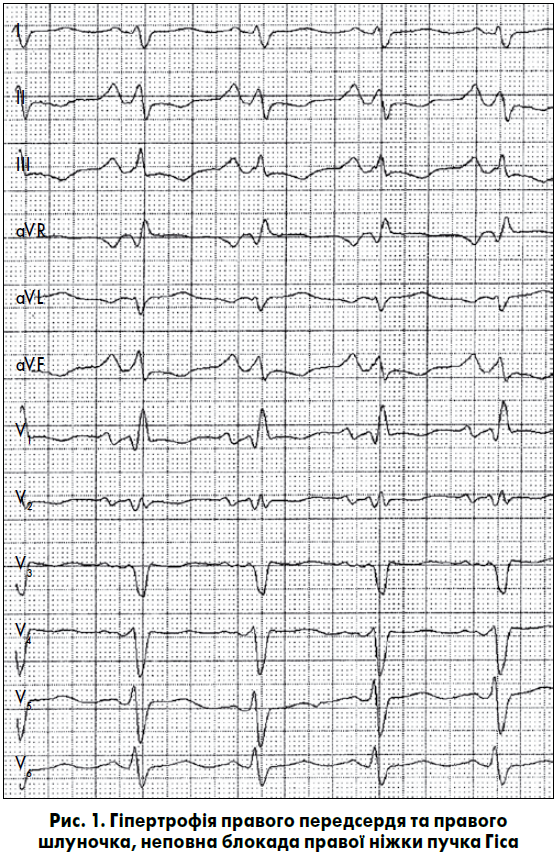 Найхарактерніші зміни форми й амплітуди зубця Р при ГПП спостерігаються у відведеннях II, III, aVF. Зубець Р у цих відведеннях стає високим, загостреним, симетричним, з амплітудою більш як 2,5 мм і нормальною тривалістю. Таку форму зубця Р позначають як P-pulmonale (рис. 1), оскільки найчастіше вказані зміни спостерігають при бронхолегеневих хворобах (Орлов В.Н., 2003). Електрична вісь зубця Р є вертикальною, РІІІ>PІІ>PІ, а в I, aVL і лівих грудних відведеннях зубець Р згладжений. У відведеннях V1 і V2 амплітуда правопередсердного компонента (позитивної фази) зубця Р становить більш як 1,5 мм. При вираженій ГПП класичні ознаки P-pulmonale можуть реєструватися майже в усіх грудних відведеннях. Час активації правого передсердя у відведеннях III, aVF, V1 подовжується до 0,04 с і більше. Індекс Макруза (відношення тривалості зубця Р до тривалості сегмента РQ) зазвичай менш як 1,1 (Орлов В.Н., 2003; Струтынский А.В. и соавт., 2008).
Найхарактерніші зміни форми й амплітуди зубця Р при ГПП спостерігаються у відведеннях II, III, aVF. Зубець Р у цих відведеннях стає високим, загостреним, симетричним, з амплітудою більш як 2,5 мм і нормальною тривалістю. Таку форму зубця Р позначають як P-pulmonale (рис. 1), оскільки найчастіше вказані зміни спостерігають при бронхолегеневих хворобах (Орлов В.Н., 2003). Електрична вісь зубця Р є вертикальною, РІІІ>PІІ>PІ, а в I, aVL і лівих грудних відведеннях зубець Р згладжений. У відведеннях V1 і V2 амплітуда правопередсердного компонента (позитивної фази) зубця Р становить більш як 1,5 мм. При вираженій ГПП класичні ознаки P-pulmonale можуть реєструватися майже в усіх грудних відведеннях. Час активації правого передсердя у відведеннях III, aVF, V1 подовжується до 0,04 с і більше. Індекс Макруза (відношення тривалості зубця Р до тривалості сегмента РQ) зазвичай менш як 1,1 (Орлов В.Н., 2003; Струтынский А.В. и соавт., 2008).
При дилатації правого передсердя зміни ЕКГ нагадують такі при ГПП, але нерідко збільшується тривалість зубця Р. Натомість, про перевантаження правого передсердя можна думати в разі раптової появи ознак P-pulmonale на ЕКГ на тлі чи одразу після гострого клінічного стану, такого як тромбоемболія легеневої артерії, інфаркт міокарда (ІМ), напад бронхіальної астми тощо (Орлов В.Н., 2003). Ці зміни можуть надалі поступово зникати. Наголосимо також, що P-pulmonalе є однією з ключових ознак хронічного легеневого серця, при цьому комплекс QRS може бути низькоамплітудним.
Гіпертрофія лівого передсердя (ГЛП) може формуватися при мітральних або аортальних вадах серця, гіпертонічній хворобі, ішемічній хворобі серця (ІХС), гіпертрофічній кардіоміопатії та інших станах, при яких спостерігаються механічна перешкода наповненню лівого шлуночка (ЛШ), об’ємне перевантаження чи діастолічна дисфункція міокарда (Жарінов О.Й. і співавт., 2012).
Збільшення вектора та тривалості деполяризації лівого передсердя призводить до збільшення амплітуди та тривалості другої фази зубця Р.
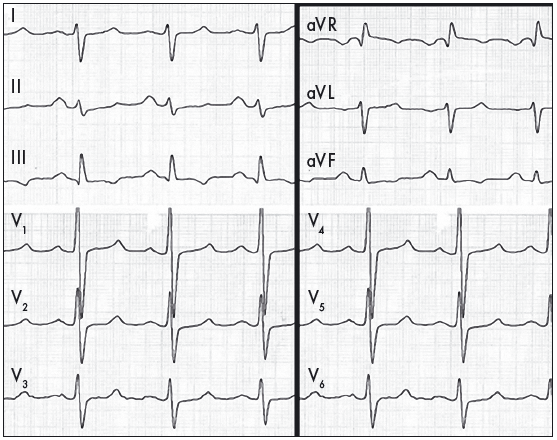
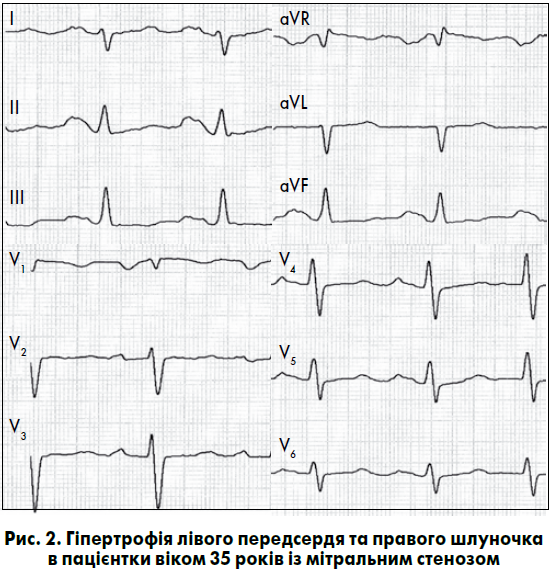 Зубець Р стає широким, двогорбим, у деяких відведеннях із переважанням амплітуди другої фази – тривалість зубця Р перевищує 0,11 с, нерідко досягає 0,12-0,16 с, а відстань між вершинами становить більш як 0,02-0,04 с. Зубець Р з характерними змінами, що відображають збільшення амплітуди та тривалості збудження лівого передсердя, називають P-mitrale (рис. 2). Вказані ознаки ГЛП найкраще відображаються у відведеннях I, aVL, V5, V6. Електрична вісь зубця Р переважно є горизонтальною, співвідношення амплітуд зубців Р у фронтальній площині PІ>PІІ>PІІІ, у лівих грудних відведеннях також збільшується амплітуда другої фази зубця Р. У відведенні V1 домінує негативна фаза зубця Р з амплітудою понад 1 мм і тривалістю 0,04 с і більше або зубець Р стає переважно негативним. Час активації лівого передсердя становить понад 0,06 с. Перевантаження лівого передсердя характеризується раптовою появою та подальшим поступовим зникненням ознак його гіпертрофії при ІМ, гострій лівошлуночковій недостатності, гіпертензивному кризі, інших гострих станах (Орлов В.Н., 2003; Струтынский А.В. и соавт., 2008).
Зубець Р стає широким, двогорбим, у деяких відведеннях із переважанням амплітуди другої фази – тривалість зубця Р перевищує 0,11 с, нерідко досягає 0,12-0,16 с, а відстань між вершинами становить більш як 0,02-0,04 с. Зубець Р з характерними змінами, що відображають збільшення амплітуди та тривалості збудження лівого передсердя, називають P-mitrale (рис. 2). Вказані ознаки ГЛП найкраще відображаються у відведеннях I, aVL, V5, V6. Електрична вісь зубця Р переважно є горизонтальною, співвідношення амплітуд зубців Р у фронтальній площині PІ>PІІ>PІІІ, у лівих грудних відведеннях також збільшується амплітуда другої фази зубця Р. У відведенні V1 домінує негативна фаза зубця Р з амплітудою понад 1 мм і тривалістю 0,04 с і більше або зубець Р стає переважно негативним. Час активації лівого передсердя становить понад 0,06 с. Перевантаження лівого передсердя характеризується раптовою появою та подальшим поступовим зникненням ознак його гіпертрофії при ІМ, гострій лівошлуночковій недостатності, гіпертензивному кризі, інших гострих станах (Орлов В.Н., 2003; Струтынский А.В. и соавт., 2008).
Гіпертрофія обох передсердь трапляється при поєднаних вадах серця, вроджених вадах із перевантаженням правих і лівих відділів, хронічних неспецифічних хворобах легень, що супроводжуються легеневим серцем, рідше – при гіпертонічній хворобі, вогнищевому чи дифузному кардіосклерозі.
При комбінованій гіпертрофії передсердь збільшуються амплітуди векторів деполяризації та тривалість збудження обох передсердь. На ЕКГ одночасно виявляють ознаки ГЛП і ГПП. Зокрема, високий, загострений зубець Р реєструється у відведеннях ІІ, III, aVF, двогорбий – у відведеннях I, aVL, V5, V6, тривалість зубця Р збільшена в усіх відведеннях. У відведеннях V1 і V2 реєструються двофазні зубці Р зі збільшеними за амплітудою обома фазами. Домінування відповідної фази зубця Р у відведенні V1 може вказувати на переважну гіпертрофію правого чи лівого передсердя (Орлов В.Н., 2003). Наголосимо також, що дилатація передсердь є анатомічною основою для виникнення надшлуночкових порушень ритму, зокрема передсердної тахікардії, фібриляції чи тріпотіння передсердь.
Гіпертрофія шлуночків серця. Гіпертрофія лівого шлуночка (ГЛШ) є незалежним предиктором серцево-судинних, цереброваскулярних ускладнень, шлуночкових порушень ритму та загальної смертності. Найчастіше ГЛШ діагностують у пацієнтів з артеріальною гіпертензією, ІХС, аортальною вадою серця (Сиренко Ю.Н., Жаринов О.И., 2009).
Еталонним неінвазивним критерієм ГЛШ є показник індексу маси міокарда ЛШ, який визначають за даними ЕхоКГ. У рекомендаціях Європейського товариства з гіпертензії та Європейського товариства кардіологів (2013) критеріями діагностики ГЛШ визнані показники індексу маси міокарда ЛШ понад 115 г/м2 у чоловіків і понад 95 г/м2 у жінок (ESH/ESC Guidelines, 2013).
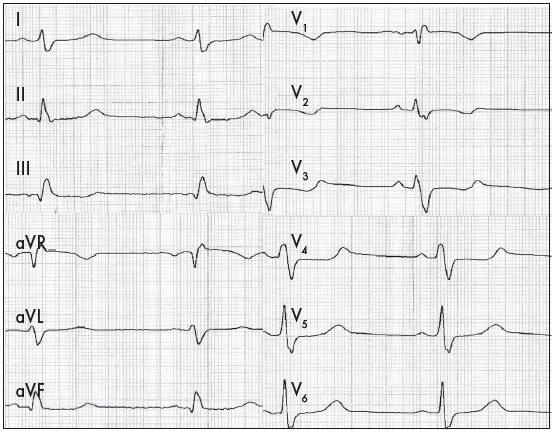
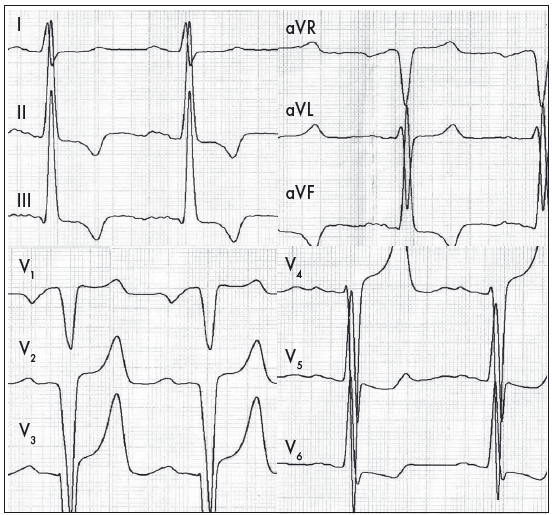
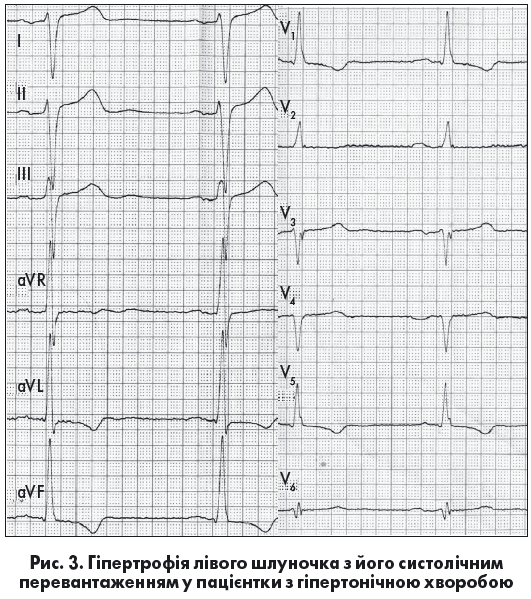 ЕКГ-діагностика ГЛШ ґрунтується на тому, що при гіпертрофії збільшуються величина електричного потенціалу ЛШ під час деполяризації та тривалість збудження потовщеної стінки. Водночас напрямок реполяризації ЛШ змінюється на протилежний, а її тривалість також збільшується (Орлов В.Н., 2003). Збільшення маси міокарда ЛШ призводить до зростання амплітуди комплексу QRS і зміщення ЕВС уліво. У лівих грудних відведеннях виявляють збільшення амплітуди та тривалості зубця R, а також зміни співвідношення амплітуд зубців R: RV6≥RV5≥RV4. У відведеннях V1-V2 реєструється глибокий, дещо розширений зубець S. У багатьох випадках виникають зміни реполяризації у вигляді косонизхідного зміщення сегмента ST нижче ізолінії у відведеннях V5-V6, із переходом в асиметричний зубець Т (рис. 3) (Орлов В.Н., 2003; Ройтберг Г.Е., Струтынский А.В., 1999; Струтынский А.В. и соавт., 2008).
ЕКГ-діагностика ГЛШ ґрунтується на тому, що при гіпертрофії збільшуються величина електричного потенціалу ЛШ під час деполяризації та тривалість збудження потовщеної стінки. Водночас напрямок реполяризації ЛШ змінюється на протилежний, а її тривалість також збільшується (Орлов В.Н., 2003). Збільшення маси міокарда ЛШ призводить до зростання амплітуди комплексу QRS і зміщення ЕВС уліво. У лівих грудних відведеннях виявляють збільшення амплітуди та тривалості зубця R, а також зміни співвідношення амплітуд зубців R: RV6≥RV5≥RV4. У відведеннях V1-V2 реєструється глибокий, дещо розширений зубець S. У багатьох випадках виникають зміни реполяризації у вигляді косонизхідного зміщення сегмента ST нижче ізолінії у відведеннях V5-V6, із переходом в асиметричний зубець Т (рис. 3) (Орлов В.Н., 2003; Ройтберг Г.Е., Струтынский А.В., 1999; Струтынский А.В. и соавт., 2008).
Основою ЕКГ-діагностики ГЛШ є амплітудні (вольтажні) критерії (Surawicz B., Knilans T.K., 2001; Сиренко Ю.Н., Жаринов О.И., 2009; Вагнер Г.С., 2010; Bayes de Luna A., 2010; ESH/ESC Guidelines, 2013; Бобрышев К.А. и соавт., 2013, 2014):
- зубець RV5 або RV6 ≥26 мм;
- RІ ≥15 мм, RaVL ≥11 мм (при горизонтальному положенні ЕВС);
- RaVF >20 мм (при вертикальному положенні ЕВС);
- SV1(V2)+RV5(V6) ≥35 мм для осіб віком понад 40 років і ≥45 мм для осіб віком менше 40 років (модифікований індекс Соколова – Лайона);
- індекс Левіса: RІ+SІІІ >25 мм;
- вольтажний індекс Корнелла: RаVL+SV3 >20 мм у жінок і >28 мм у чоловіків;
- добуток Корнелла: добуток вольтажного індексу Корнелла та тривалості комплексу QRS, який розраховують за формулою (RaVL+SV3)•QRS для чоловіків і (RaVL+SV3+8)•QRS для жінок. Критерієм ГЛШ є значення добутку Корнелла >2400 мм•мс.
Для підвищення чутливості методу ЕКГ використовують додаткові невольтажні критерії ГЛШ (Сиренко Ю.Н., Жаринов О.И., 2009; Bayes de Luna A., 2010):
- відхилення ЕВС уліво, співвідношення амплітуд зубців RІ>RІІ>RІІІ;
- час внутрішнього відхилення в лівих грудних відведеннях більш як 0,05-0,06 с;
- неповна блокада лівої ніжки пучка Гіса (ЛНПГ);
- недостатнє збільшення амплітуди зубця R у правих грудних відведеннях;
- наявність глибокого зубця Q у відведеннях V5, V6;
- розщеплення та збільшення тривалості комплексу QRS;
- подовження електричної систоли шлуночків.
Вольтажні критерії характеризуються високою специфічністю щодо діагностики ГЛШ, але є низькочутливими (Сиренко Ю.Н., Жаринов О.И., 2009; Bayes de Luna A., 2010). Вони дають змогу здійснювати скринінг щодо наявності вираженої ГЛШ, асоційованої з високим або дуже високим додатковим серцево-судинним ризиком. Водночас у пацієнтів із незначною чи помірною ГЛШ вольтажні ознаки з’являються нечасто. На амплітуду зубців ЕКГ можуть впливати вік обстежуваного, його конституція, розташування електродів на поверхні грудної клітки, наявність емфіземи легень, ожиріння тощо. З огляду на це, при ЕКГ-діагностиці ГЛШ необхідно брати до уваги поєднання вольтажних і невольтажних ознак, характерну для гіпертрофії з перевантаженням ЛШ «дискордантність» векторів деполяризації й реполяризації, протилежну спрямованість змін шлуночкового комплексу в лівих і правих грудних відведеннях (Орлов В.Н., 2003; Жарінов О.Й. і співавт., 2012).
З метою підвищення чутливості критеріїв ЕКГ-діагностики ГЛШ було запропоновано підрахунок балів за Ромхілт – Естес, який характеризується високою відтворюваністю результатів. Сума балів 5 і більше свідчить про ймовірну ГЛШ, 4 – про можливу ГЛШ (табл.) (Бобрышев К.А. и соавт., 2009; Сиренко Ю.Н., Жаринов О.И., 2009; Вагнер Г.С., 2010; Bayes de Luna A., 2010).
З метою підвищення чутливості вольтажних ЕКГ-критеріїв у діагностиці ГЛШ були запропоновані математичні моделі, які дають змогу передбачити наявність гіпертрофії міокарда на основі розрахунку маси міокарда ЛШ з урахуванням даних ЕКГ. Наприклад модель P. Rautaharju (1996) дає можливість оцінити масу міокарда ЛШ для представників європеоїдної раси за формулою:
0,026×(RaVL+SV3)+1,25 × маса тіла (кг) + 34,4 – для чоловіків, 0,020×(RaVL+SV3)+1,12 × маса тіла (кг) + 36,2 – для жінок.
Отриманий показник дає змогу розрахувати індекс маси міокарда ЛШ і цим самим кількісно оцінити ГЛШ (Бобрышев К.А. и соавт., 2013).
На початкових етапах формування ГЛШ змін реполяризації в лівих грудних відведеннях немає, в подальшому спостерігається сплощення зубця Т і він стає ізоелектричним. Потім зубець Т стає негативним у поєднанні з косонизхідним зниженням сегмента ST, що відображає виникнення та прогресування дистрофічних чи ішемічних змін у міокарді. Чим довше існує ГЛШ, тим більше виражені зміни сегмента ST і зубця Т (Орлов В.Н., 2003; Струтынский А.В. и соавт., 2008). Слід зазначити протилежну спрямованість основного зубця комплексу QRS і сегмента ST із зубцем Т.
Систолічне перевантаження ЛШ («перевантаження тиском») відображається на ЕКГ характерними змінами реполяризації у вигляді зниження сегмента ST і негативізації зубця Т у лівих грудних відведеннях, де амплітуда зубця R є найбільшою (Орлов В.Н., 2003; Вагнер Г.С., 2010).
У разі гострого перевантаження ЛШ унаслідок різкого підвищення артеріального тиску, гіпертонічного кризу, при фізичному перенапруженні на ЕКГ реєструються минущі зміни реполяризації.
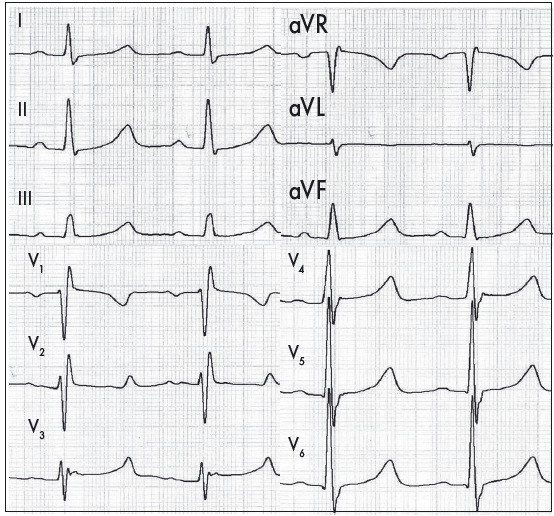
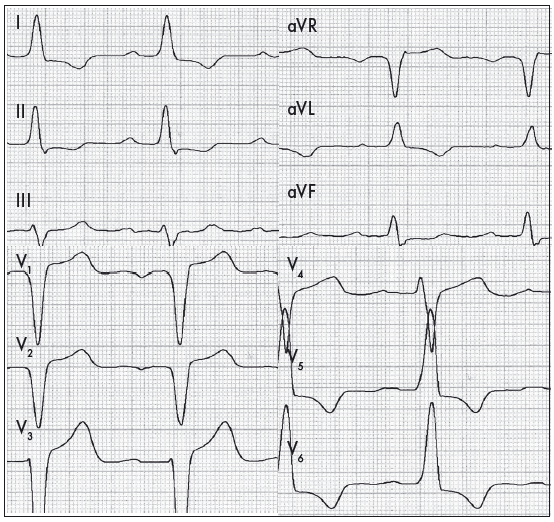
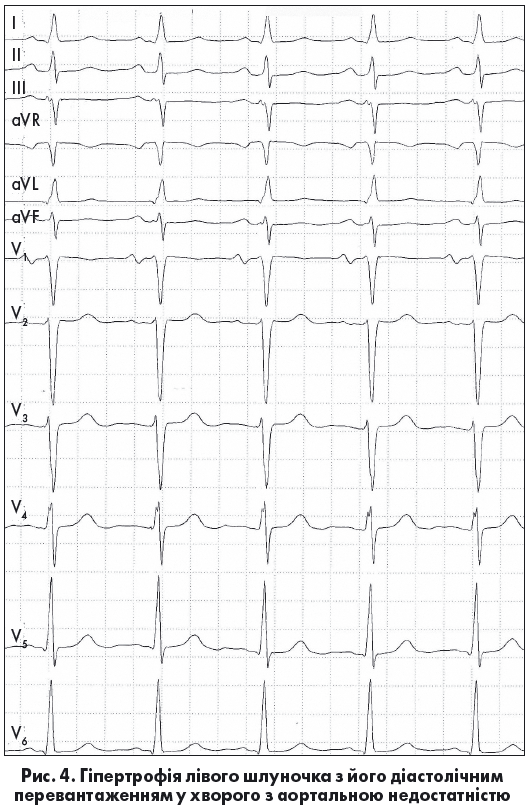 Ознаками діастолічного перевантаження ЛШ («перевантаження об’ємом») є збільшення амплітуди зубців R із глибокими, але не патологічними зубцями q, у поєднанні з позитивними, часто високими, загостреними зубцями Т у лівих грудних відведеннях. З огляду на відносно помірне збільшення товщини стінки ЛШ вектор реполяризації при діастолічному перевантаженні зберігає свій нормальний напрямок (рис. 4) (Орлов В.Н., 2003). Виражена ГЛШ із його дилатацією чи перевантаженням може ускладнюватися також порушеннями внутрішньошлуночкової провідності у формі неповної чи повної блокади ЛНПГ (Сиренко Ю.Н., Жаринов О.И., 2009; Bayes de Luna A., 2010). Наголосимо, що в пацієнтів із повною блокадою ЛНПГ є істотні обмеження щодо коректної ЕКГ-діагностики ГЛШ.
Ознаками діастолічного перевантаження ЛШ («перевантаження об’ємом») є збільшення амплітуди зубців R із глибокими, але не патологічними зубцями q, у поєднанні з позитивними, часто високими, загостреними зубцями Т у лівих грудних відведеннях. З огляду на відносно помірне збільшення товщини стінки ЛШ вектор реполяризації при діастолічному перевантаженні зберігає свій нормальний напрямок (рис. 4) (Орлов В.Н., 2003). Виражена ГЛШ із його дилатацією чи перевантаженням може ускладнюватися також порушеннями внутрішньошлуночкової провідності у формі неповної чи повної блокади ЛНПГ (Сиренко Ю.Н., Жаринов О.И., 2009; Bayes de Luna A., 2010). Наголосимо, що в пацієнтів із повною блокадою ЛНПГ є істотні обмеження щодо коректної ЕКГ-діагностики ГЛШ.
Гіпертрофія правого шлуночка (ГПШ). Діагностувати ГПШ завжди складніше, ніж ГЛШ. Оскільки маса міокарда ПШ значно менша за таку ЛШ, відповідні зміни ЕКГ можуть з’являтися лише при значній ГПШ (Орлов В.Н., 2003). Таку картину можна спостерігати при вроджених вадах серця зі значним збільшенням навантаження на ПШ, таких як тетрада Фалло, дефекти міжпередсердної чи міжшлуночкової перегородок, стеноз легеневої артерії, а також при стенозі мітрального клапана, первинній легеневій гіпертензії, хронічній тромбоемболії дрібних гілок легеневої артерії.
Різко виражена ГПШ діагностується в тому випадку, якщо маса міокарда ПШ стає більшою за таку ЛШ. Збільшується амплітуда вектора деполяризації правої половини міжшлуночкової перегородки та ПШ. Водночас сумарний вектор реполяризації обох шлуночків має протилежну спрямованість.
Ознаки вираженої ГПШ (Орлов В.Н., 2003; Bayes de Luna A., 2010):
- збільшення амплітуди зубця R у правих грудних відведеннях (RV1 ≥7 мм), графіка комплексу QRS у відведеннях V1-V2 за типом Rs, R або qR;
- співвідношення R/S у відведенні V1 ≥1;
- збільшення амплітуди зубця S у лівих грудних відведеннях до 5 мм і більше, причому S≥R, комплекс QRS у відведеннях V5-V6 за типом qRS або RS/rS;
- сума амплітуд RV1 i SV5 ≥10,5 мм;
- амплітуда зубця S у відведеннях V1-V2 ≥2 мм;
- косонизхідне зміщення нижче від ізолінії сегмента ST, який переходить у негативний асиметричний зубець Т у відведеннях V1-V2, рідше також у V3-V4; вираженість змін процесів реполяризації зменшується від правих грудних відведень до лівих.
Вказані зміни ЕКГ позначають як «R-тип» ГПШ, який характерний для гіпертрофії із систолічним перевантаженням і найчастіше трапляється при ізольованому мітральному стенозі, первинній легеневій гіпертензії та вроджених вадах серця (рис. 5) (Орлов В.Н., 2003).
Рис. 5. Гіпертрофія правого передсердя та правого шлуночка з його систолічним перевантаженням у пацієнтки з тетрадою Фалло
При помірно вираженій ГПШ за відсутності вольтажних критеріїв найбільше значення мають непрямі ознаки, котрі дають змогу запідозрити наявність ГПШ. Зокрема, збільшення маси ПШ може асоціюватися зі сповільненим проведенням імпульсів правою ніжкою пучка Гіса (ПНПГ). Такий тип ГПШ частіше спостерігається при діастолічному перевантаженні ПШ (Орлов В.Н., 2003).
Сумарний вектор деполяризації шлуночків спрямований до ЛШ, однак його амплітуда істотно не змінюється, оскільки існує значна протидія з боку гіпертрофованого ПШ. Через сповільнене проведення імпульсів у системі ПНПГ збудження ПШ триває й після завершення деполяризації ЛШ. Тому при значному перевантаженні об’ємом (дефект міжшлуночкової чи міжпередсердної перегородки, виражена недостатність тристулкового клапана) може з’явитися повна чи неповна блокада ПНПГ (рис. 6).
Рис. 6. Неповна блокада ПНПГ. Ознаки гіпертрофії та перевантаження правого шлуночка в пацієнтки віком 42 роки із вродженим дефектом міжпередсердної перегородки
Основні ЕКГ-критерії діагностики помірної ГПШ (Орлов В.Н., 2003; Вагнер Г.С., 2010; Bayes de Luna A., 2010; Жарінов О.Й. і співавт., 2012):
- графіка комплексу QRS типу rSr’, rsR’ або rSR’ у відведенні V1;
- відхилення ЕВС управо (кут α ≥110°);
- збільшення амплітуди та тривалості зубця S у відведеннях V5, V6;
- зменшення амплітуди зубця S у відведенні V1 і R у відведенні V6;
- вторинні зміни реполяризації у правих грудних відведеннях.
Окремо виділяють S-тип ГПШ, який переважно трапляється при хронічній легеневій патології (зокрема, внаслідок емфіземи легень, зміщення діафрагми донизу та збільшення правих відділів серця) (Орлов В.Н., 2003). Хід збудження міокарда правого й лівого шлуночків не змінюється, але відзначається домінування впливу вектора деполяризації гіпертрофованого ПШ. Отже, змінюється співвідношення амплітуд зубців R і S у грудних відведеннях.
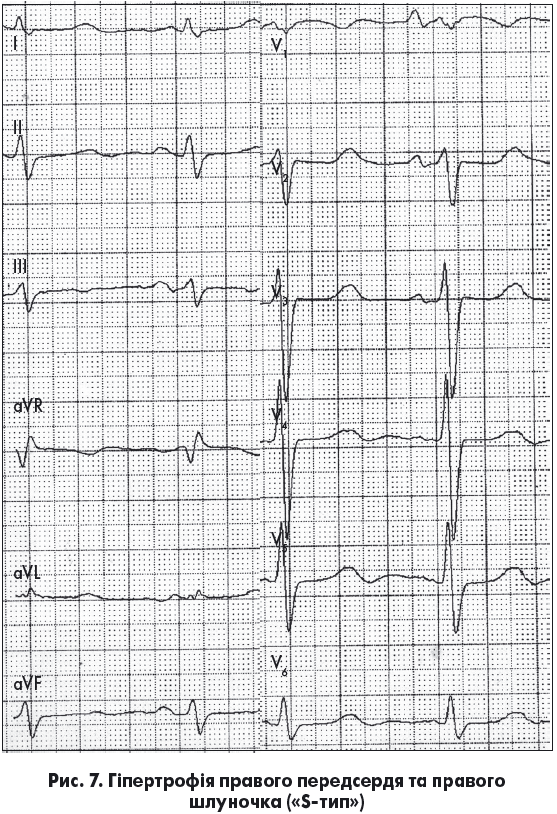 Основними критеріями S-типу ГПШ на ЕКГ є поворот серця верхівкою назад навколо поперечної осі – вісь SІ-SІІ-SІІІ (глибокі зубці S у стандартних відведеннях із найбільшою амплітудою у ІІ відведенні), а також глибокий зубець S у всіх грудних відведеннях (Орлов В.Н., 2003). Комплекс QRS характеризується графікою rS, а перехідна зона зміщена ліворуч. При цьому зубець S найменший у відведенні V1, найбільший – у V5-V6. У підсумку комплекс QRS у грудних відведеннях стає наближеним до еквіфазного. У більшості випадків реєструється P-pulmonale, а в частини пацієнтів також наявні зміни реполяризації (рис. 7).
Основними критеріями S-типу ГПШ на ЕКГ є поворот серця верхівкою назад навколо поперечної осі – вісь SІ-SІІ-SІІІ (глибокі зубці S у стандартних відведеннях із найбільшою амплітудою у ІІ відведенні), а також глибокий зубець S у всіх грудних відведеннях (Орлов В.Н., 2003). Комплекс QRS характеризується графікою rS, а перехідна зона зміщена ліворуч. При цьому зубець S найменший у відведенні V1, найбільший – у V5-V6. У підсумку комплекс QRS у грудних відведеннях стає наближеним до еквіфазного. У більшості випадків реєструється P-pulmonale, а в частини пацієнтів також наявні зміни реполяризації (рис. 7).
При діагностиці ГПШ дуже важливо враховувати також додаткові ЕКГ-ознаки (Орлов В.Н., 2003):
- P-pulmonale;
- співвідношення зубців R у стандартних відведеннях RІІІ-RІІ-RІ;
- відхилення ЕВС управо, кут α >+90°;
- поворот серця навколо поздовжньої осі за годинниковою стрілкою;
- наявність двох перехідних зон у грудних відведеннях;
- високий, пізній зубець R у відведенні aVR (амплітуда R у відведенні aVR ≥4 мм, RaVR≥Q(S)aVR – ознака різко вираженої ГПШ).
Наголосимо, що ЕКГ-критерії ГПШ мають обмежену специфічність. З огляду на це зміни на ЕКГ необхідно зіставляти з клінічною картиною й обов’язково з результатами ЕхоКГ-дослідження (Surawicz B., Knilans T.K., 2001; Bayes de Luna A., 2010).
Ознаки перевантаження ПШ можуть з’являтися при станах, які супроводжуються раптовим збільшенням гемодинамічного навантаження на ПШ, наприклад при тромбоемболії легеневої артерії, набряку легень, астматичному статусі. При гострому перевантаженні ПШ може спостерігатися минуще зміщення сегмента ST, згладженість або інверсія зубця Т у правих грудних відведеннях, нерідко – у відведеннях V3-V4, зміщення перехідної зони до V5. Вказані зміни відносно швидко зникають після нормалізації стану хворого.
Комбінована гіпертрофія шлуночків серця трапляється при комбінованих і поєднаних вадах серця (рис. 8). Ознаки перевантаження й дилатації обох шлуночків нерідко виявляються в пацієнтів із дилатаційною кардіоміопатією, вираженою бівентрикулярною серцевою недостатністю.
Рис. 8. Комбінована гіпертрофія шлуночків у пацієнта з тетрадою Фалло та субаортальним стенозом
ЕКГ-діагностика гіпертрофії обох шлуночків проблематична, інколи неможлива. Електрорушійні сили гіпертрофованих шлуночків мають протилежний напрямок. Отже, може спостерігатися взаємне нівелювання ознак гіпертрофії ЛШ і ПШ. Висновок про комбіновану гіпертрофію шлуночків серця ґрунтується на поєднанні окремих ознак ГПШ і ГЛШ, з урахуванням клінічного контексту (рис. 9). У цих випадках завжди рекомендується уточнення діагнозу за допомогою ЕхоКГ.
Рис. 9. Комбінована гіпертрофія шлуночків із перевагою гіпертрофії лівого шлуночка та його систолічним перевантаженням. Збільшення лівого передсердя
Про переважну гіпертрофію ПШ або ЛШ судять:
- за домінуванням ознак гіпертрофії одного зі шлуночків;
- за змінами реполяризації, що відображають перевантаження певного шлуночка;
- за сумарним вектором ЕВС (Орлов В.Н., 2003).
Наприклад, у пацієнтів з ознаками ГЛШ супутню ГПШ можна припустити за наявності таких змін:
- амплітуда зубця R у відведеннях V1-V2 >7 мм;
- повна чи неповна блокада ПНПГ;
- відхилення ЕВС праворуч;
- поворот серця навколо поздовжньої осі за годинниковою стрілкою чи наявність «розтягнутої» перехідної зони від V3 до V5-V6;
- P-pulmonale у відведеннях II, III, aVF;
- зменшення амплітуди зубців S у відведеннях V1-V2;
- зміни реполяризації у відведеннях V1-V2, зумовлені перевантаженням ПШ.
У разі вираженої ГПШ про супутню ГЛШ свідчать такі ознаки (Орлов В.Н., 2003):
- збільшення амплітуди зубця R у відведеннях V5-V6 або співвідношення амплітуд зубців RV6≥RV5>RV4 або RV4≤RV5>RV6;
- збільшення амплітуди зубців S у відведеннях V1-V2;
- відсутність або неглибокі зубці S у відведеннях V5-V6 при «R-типі» ГПШ;
- горизонтальне положення ЕВС;
- поворот серця навколо поздовжньої осі проти годинникової стрілки.
Поєднання гіпертрофії шлуночків із порушеннями внутрішньошлуночкової провідності. Одним із наслідків гіпертрофії міокарда може бути сповільнення проведення імпульсів. За наявності постійної блокади ПНПГ про ГПШ можна думати, якщо реєструється графіка rSR’ не лише у відведенні V1, а й у V2 (Bayes de Luna A., 2010), зубець R’ високоамплітудний у відведенні V1, причому амплітуда R’ у відведеннях V1-V2 ≥12 мм при неповній блокаді ПНПГ і ≥15 мм при повній блокаді ПНПГ. Інколи виявляють монофазний комплекс QRS – високоамплітудний зубець R у відведенні V1. Час активації ПШ у відведенні V1 становить не менш як 0,07 с. Зубець S у відведеннях V5-V6 амплітудою ≥7 мм, широкий (Bayes de Luna A., 2010). Графіка комплексу QRS у відведеннях V5-V6 у вигляді qRS також може свідчити на користь ГПШ разом із блокадою ПНПГ. Нерідко виявляють ознаки повороту серця навколо поздовжньої осі за годинниковою стрілкою. Наявність графіки Р-pulmonale є непрямою ознакою супутньої ГПШ (Орлов В.Н., 2003). Наголосимо, що високоамплітудний зубець R’ у відведенні V1 може спостерігатися також при повній блокаді ПНПГ без ГПШ, а монофазний комплекс QRS у вигляді зубця R у відведенні V1 може бути низькоамплітудним у пацієнтів із ГПШ через емфізему легень (Bayes de Luna A., 2010).
Діагностика ГЛШ за наявності блокади ЛНПГ має істотні обмеження. Чутливість ЕКГ-критеріїв ГЛШ у цих ситуаціях нижча, ніж у разі ГЛШ без порушень внутрішньошлуночкової провідності. Про можливу ГЛШ може свідчити незвично висока амплітуда зубця R у відведеннях I, aVL, V5, V6 і зубця S у відведеннях III, aVF, V1, V2, значне збільшення тривалості цих зубців, а також виражене відхилення ЕВС ліворуч (рис. 10). У 80% пацієнтів із блокадою ЛНПГ і вольтажними критеріями ГЛШ (за показником індексу Соколова – Лайона) збільшення маси міокарда ЛШ підтверджується за даними ЕхоКГ (Bayes de Luna A., 2010). Сума SV1 i RV6 ≥45 мм дає змогу діагностувати ГЛШ у пацієнтів із блокадою ЛНПГ із чутливістю 86% і специфічністю 100%. Амплітуда зубця R у відведенні aVL ≥16 мм на тлі блокади передньої гілки ЛНПГ також свідчить про високу ймовірність ГЛШ (Bayes de Luna A., 2010), але чутливість цього критерію невисока. Вищу чутливість і специфічність у кореляції з ЕхоКГ-показниками має індекс SIII + (R+S максимальної амплітуди в прекордіальних відведеннях >30 мм для чоловіків і >28 мм для жінок) (Bayes de Luna A., 2010).
Рис. 10. Гіпертрофія лівого шлуночка та лівого передсердя в пацієнта з аортальним стенозом. Неповна блокада ЛНПГ
Інші розділи книги читайте в наступних номерах тематичного випуску газети.
За інформацією щодо підручника «Функціональна діагностика» прохання звертатися до співробітників кафедри функціональної діагностики НМАПО ім. П.Л. Шупика.
Тематичний номер «Кардіологія, Ревматологія, Кардіохірургія» № 1 (56) лютий 2018 р.