6 травня, 2018
Функціональна діагностика XXI століття: можливості технологій, помножені на клінічне мислення

15-16 березня ДУ «Інститут серця МОЗ України» (м. Київ) приймав учасників VI Науково-практичної конференції «Функціональна діагностика серцево-судинних хвороб». Організаторами заходу традиційно виступили кафедра функціональної діагностики Національної медичної академії післядипломної освіти (НМАПО) ім. П.Л. Шупика (м. Київ) та ДУ «Інститут серця МОЗ України». Цьогорічну конференцію приурочено до 100-річчя заснування НМАПО ім. П.Л. Шупика. Організатори доклали чимало зусиль, щоб матеріали конференції були цікавими та корисними як досвідченим лікарям функціональної діагностики, так і широкому колу кардіологів, терапевтів і сімейних лікарів.У рамках першого наукового засідання обговорювали питання ведення хворих зі шлуночковими, суправентрикулярними аритміями, профілактики раптової серцевої смерті (РСС), діагностичну роль ультразвукових методів і різних модальностей електрокардіографії (ЕКГ).
 Завідувач кафедри променевої діагностики факультету післядипломної освіти Львівського національного медичного університету ім. Данила Галицького, доктор медичних наук, професор Юрій Андрійович Іванів розпочав засідання лекцією «Некомпактність міокарда лівого шлуночка: тромбоемболічні ускладнення й аритмії».
Завідувач кафедри променевої діагностики факультету післядипломної освіти Львівського національного медичного університету ім. Данила Галицького, доктор медичних наук, професор Юрій Андрійович Іванів розпочав засідання лекцією «Некомпактність міокарда лівого шлуночка: тромбоемболічні ускладнення й аритмії».
Некомпактна кардіоміопатія лівого шлуночка (НКЛШ), або «губчатий міокард» – відносно рідкісна первинна генетична патологія міокарда, для якої характерні надмірна трабекулярність стінок і глибокі міжтрабекулярні кишеньки, сполучені з порожниною шлуночка. Такий міокард за будовою наближається до ембріонального, є структурно неповноцінним і під впливом інших факторів стає основою для формування дилатації, систолічної дисфункції ЛШ, аритмій і тромбоемболій.
Перший випадок НКЛШ описаний 1984 року. Частота патології становить від 0,014 дo 0,24% залежно від досліджуваної популяції. Вона трапляється в різних вікових групах, частіше в чоловіків і характеризується великою різноманітністю генетичних форм, фенотипічних проявів і клінічних симптомів. Одні особи можуть не мати жодних скарг довгі роки життя, а інші потерпають від серйозних проявів патології з дитинства.
Основним методом діагностики є ехокардіографія (ЕхоКГ). Виділяють чотири ЕхоКГ-ознаки некомпактної кардіоміопатії за R. Jenni (2001):
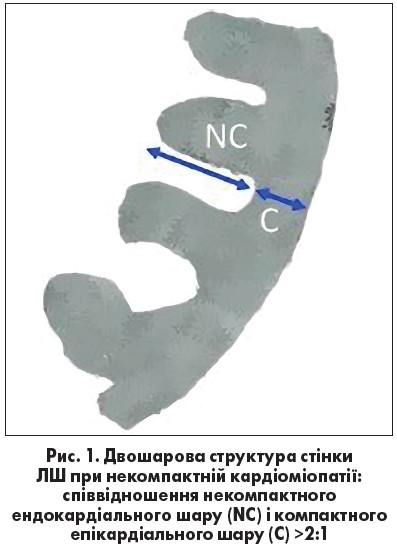 1) двошарова структура стінки ЛШ: некомпактний потовщений ендокардіальний шар і компактний стоншений епікардіальний шар;
1) двошарова структура стінки ЛШ: некомпактний потовщений ендокардіальний шар і компактний стоншений епікардіальний шар;
2) співвідношення між ними 2:1 та більше (рис. 1);
3) глибокі міжтрабекулярні шпари (простори), в яких за допомогою доплерівського обстеження можна виявити кровоплин;
4) відсутність інших аномалій серця.
Доповідач застеріг від «діагностичних пасток», тобто некоректного трактування трабекулярної будови міокарда. Доведено, що 68% здорових сердець мають виразну трабекулярність ЛШ як варіант норми. Посилену трабекулярність можна виявити в гіпертрофованих серцях у разі дилатаційної кардіоміопатії, клапанних вад або гіпертензії. Її також виявляють в атлетів і чорношкірих осіб (понад 20%). Той факт, що компактний шар міокарда має товщину менш ніж 8 мм, допомагає відрізнити НКЛШ від посиленої трабекулярності в здоровому серці та при гіпертрофії ЛШ. Магнітно-резонансна томографія (МРТ) допомагає в тих випадках, коли трансторакальна ЕхоКГ дає недостатньо якісні зображення.
Спектр клінічних проявів НКЛШ може включати систолічну й діастолічну дисфункцію ЛШ, застійну серцеву недостатність (СН), аритмії, тромбоемболії, РСС. Порушення насосної функції серця та стаз крові в міжтрабекулярних кишеньках зумовлюють підвищений ризик тромбоутворення. З метою запобігання тромбоемболічним ускладненням призначається антикоагулянтна терапія, показана таким хворим за наявності:
– значної систолічної дисфункції ЛШ із фракцією викиду (ФВ) <40%;
– супутньої фібриляції передсердь (ФП);
– тромбоемболії в анамнезі;
– тромбів у шлуночку за даними ЕхоКГ або МРТ серця.
Перевагу слід віддавати новим оральним антикоагулянтам (ривароксабан, дабігатран, апіксабан).
НКЛШ асоціюється з порушеннями ритму серця, серед яких найчастіші – це шлуночкова тахікардія (ШТ) і ФП. Глибокі міжтрабекулярні кишеньки є електрофізіологічним субстратом механізму re-entry. Нещодавно опублікований аналіз 557 випадків НКЛШ за даними літератури показав такий розподіл аритмій: часті шлуночкові екстрасистоли (ШЕ) – 17; мономорфна ШТ – 66; двонаправлена ШТ – 2; поліморфна ШТ – 8; фібриляція шлуночків (ФШ) – 5 (A.Z. Tumolo, D.T. Nguyen, 2017). Отже, приблизно кожен 5-й пацієнт із НКЛШ має загрозливі порушення ритму серця.
Зважаючи на високу частоту ШТ, яка несе ризик РСС, у таких пацієнтів слід розглядати можливість встановлення імплантованого кардіовертера-дефібрилятора (IКД). Переважно IКД встановлюють, якщо в пацієнта вже було зареєстровано симптомні напади ШТ. У разі нормальної систолічної функції – якщо є додаткові фактори ризику (родинна історія РСС, нестійка ШТ або виникали синкопальні стани).
Стандартом антиаритмічної терапії для хворих із систолічною дисфункцією ЛШ і порушеннями серцевого ритму є аміодарон (Кордарон®). Метааналіз 13 рандомізованих досліджень ефективності аміодарону в запобіганні РСС за участю 6553 пацієнтів (ATMІA) підтвердив достовірне зниження аритмічної смертності у хворих на хронічну СН (ХСН) або після перенесеного інфаркту міокарда (ІМ) на 29%, а також достовірне зниження загальної смертності на 13%. Цей результат можна вважати унікальним: Кордарон® запобігає одній смерті в кожних 43 лікованих ним хворих протягом 2 років і більше. Інший метааналіз 15 досліджень застосування аміодарону в дозі 200-400 мг/добу за участю 5864 пацієнтів високого ризику РСС із ФВ ЛШ 18-44% виявив зниження частоти РСС на 30%, зниження серцевої смертності на 23%, загальної смертності – на 19% (I. Sim, K.M. McDonald, P.W. Lavori, 1997).
У пацієнтів з ІКД аміодарон, особливо в поєднанні з β-блокаторами, значно знижує частоту дефібриляційних розрядів, що покращує якість життя хворих і подовжує термін функціонування батареї високовартісного пристрою.
Лікування НКЛШ у разі розвитку застійної СН проводиться за загальними стандартами лікування СН зі зниженою ФВ ЛШ і включає діуретики, β-блокатори, інгібітори ангіотензинперетворювального ферменту (АПФ), антагоністи альдостерону. За показаннями терапію доповнюють дигоксином. Серцева ресинхронізаційна терапія показана симптомним пацієнтам із II-IV функціональними класами (ФК) за NYHA та ФВ ЛШ <35%, яка залишається низькою, незважаючи на оптимальне медикаментозне лікування, якщо тривалість комплексу QRS із морфологією блокади лівої ніжки пучка Гіса (ЛНПГ) більша за 120 мс або 150 мс чи довше без графіки блокади ЛНПГ.
НКЛШ вважається рідкісною патологією, але в разі виявлення потребує організації регулярного (не рідше ніж раз на півроку) та тривалого медичного нагляду за пацієнтом, а також обстеження всіх найближчих родичів для запобігання можливим випадкам РСС.
 Доцент кафедри функціональної діагностики НМАПО ім. П.Л. Шупика, кандидат медичних наук Віктор Олександрович Куць висвітлив питання стратифікації ризику в пацієнтів із ШТ. Медико-соціальна значущість цієї проблеми зумовлена тим, що ШТ є «винуватцями» в більшості випадків РСС. Першими кроками при визначенні ризику розвитку ШТ має бути оцінювання тягаря симптомів і причини, яка призвела до розвитку аритмії.
Доцент кафедри функціональної діагностики НМАПО ім. П.Л. Шупика, кандидат медичних наук Віктор Олександрович Куць висвітлив питання стратифікації ризику в пацієнтів із ШТ. Медико-соціальна значущість цієї проблеми зумовлена тим, що ШТ є «винуватцями» в більшості випадків РСС. Першими кроками при визначенні ризику розвитку ШТ має бути оцінювання тягаря симптомів і причини, яка призвела до розвитку аритмії.
За причиною 70-90% ШТ є коронарогенними й найчастіше пов’язані з ІМ та постінфарктним ремоделюванням ЛШ. Лише 10-30% ШТ мають інші причини крім ішемічної хвороби серця (ІХС), такі як вроджені каналопатії (синдром короткого/довгого QT, синдром Бругада, ідіопатична ФШ), саркоїдоз серця, постміокардитичний фіброз, рубцеві зміни після хірургічних втручань. Виділяють також групу ідіопатичних мономорфних ШТ (із вихідного тракту ЛШ або правого шлуночка (ПШ), з кореня аорти тощо).
Основними методами діагностики є збір анамнезу, клінічне обстеження (оцінка симптомів та їх впливу на якість життя), звичайна ЕКГ і моніторування ЕКГ. За окремими показаннями та в сумнівних випадках проводять візуалізаційні дослідження серця й інвазивні тести – коронаровентрикулографію, електрофізіологічне дослідження.
Доповідач нагадав, що жоден із запропонованих неінвазивних маркерів РСС, таких як варіабельність серцевого ритму, дисперсія інтервалу QT, барорефлекторна чутливість, не вплинув на клінічну практику. Поки що єдиний прогностично значущий показник, який постійно демонструє зв’язок із ризиком РСС – це ФВ ЛШ. На РСС припадає близько 50% усіх смертей у пацієнтів із гострим ІМ (ГІМ) в анамнезі та зниженою ФВ ЛШ. Якщо в загальній популяції ймовірність РСС становить 0,01% за рік, то в пацієнтів, які раніше перенесли гострий коронарний синдром (ГКС), – 5%, а в пацієнтів із ФВ ЛШ ≤35% та/або СН – 20%. Особливо високий ризик РСС – 25% за рік – мають пацієнти, котрі вже перенесли зупинку серця чи життєво небезпечну аритмію й були реанімовані.
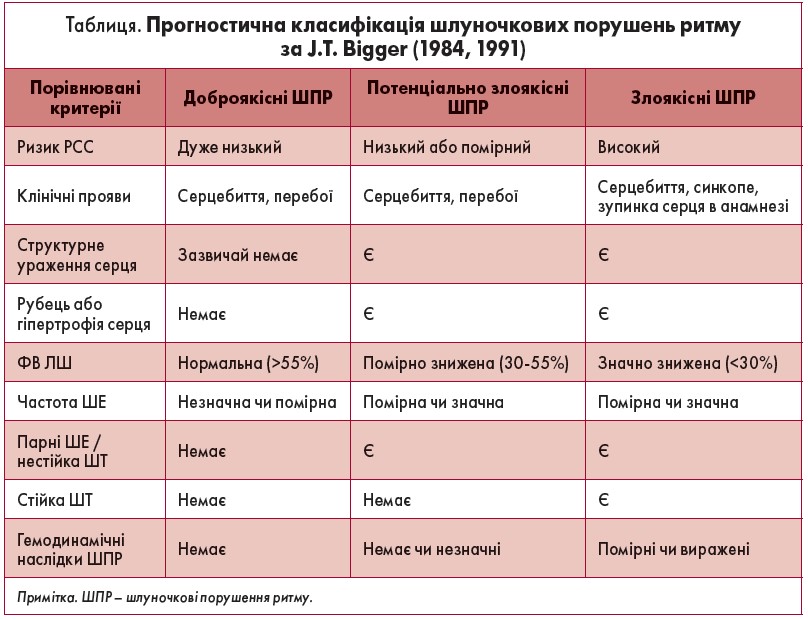
В основу прогностичної класифікації шлуночкових порушень ритму за J.T. Bigger (1984, 1991) покладено три головні ознаки: наявність структурної патології серця, величина ФВ і вплив аритмії на гемодинаміку та самопочуття. За ними ШТ поділяють на доброякісні, потенційно злоякісні та злоякісні щодо розвитку РСС (табл.).
Доповідач прокоментував доказово обґрунтовані підходи до вибору медикаментозного, апаратного чи катетерного лікування ШТ і профілактики РСС за рекомендаціями Європейського товариства кардіологів (2015).
Найбільше практичне значення, що зумовлено високою частотою та тяжкими наслідками, мають ШТ у пацієнтів із ГКС, після перенесеного ІМ та із систолічною дисфункцією ЛШ. У 20-22% пацієнтів з ІХС РСС стає першим проявом хвороби. У пацієнтів, які перенесли ГІМ, ризик РСС у 4-6 разів вищий, аніж у середньому в популяції.
Рекомендації із запобігання та лікування ШТ, пов’язаної з ГКС, на госпітальному етапі:
Для лікування рецидивної поліморфної ШТ рекомендовано застосовувати β-блокатори (клас рекомендації І, рівень доказів В).
Для лікування поліморфної ШТ рекомендовано внутрішньовенне введення аміодарону (І, В).
Пацієнтам зі стійкою ШТ або ФШ рекомендовано негайне проведення електричної кардіоверсії чи дефібриляції (І, С).
У пацієнтів із рецидивною ШТ, ФШ або електричним штормом слід розглянути можливість виконання радіочастотної абляції з подальшим встановленням ІКД (ІІа, С).
У разі рецидивної стійкої ШТ або ФШ, яка не реагує на β-блокатор чи аміодарон, або за наявності протипоказань до аміодарону слід розглянути можливість внутрішньовенного застосування лідокаїну (ІІb, С).
Рекомендації щодо ведення пацієнтів зі стабільною ІХС, які перенесли ГІМ, зі збереженою ФВ ЛШ:
Слід розглянути можливість програмованої стимуляції шлуночків у пацієнтів, які перенесли ГІМ та мають синкопе, котрі не можна пояснити іншими причинами (ІІа, С).
Застосування аміодарону можна розглядати з метою полегшення симптомів ШТ у пацієнтів, які вижили після ІМ, хоча він не впливає на рівень смертності (ІІb, С).
Терапія блокаторами натрієвих каналів (клас ІС антиаритмічних препаратів, ААП) не рекомендована для запобігання РСС у пацієнтів з ІХС або тих, що вижили після ІМ (ІІІ, В).
Пацієнти з діагностованою ХСН мають ризик РСС у 6-9 разів вищий, аніж у середньому в популяції. Найефективнішим способом запобігання РСС у пацієнтів зі зниженою ФВ ЛШ або клінічно маніфестною СН є встановлення ІКД. У рекомендаціях Європейського товариства кардіологів воно показано хворим із симптомною СН (ІІ-ІІІ ФК за NYHA) та ФВ ЛШ ≤35% і очікуваною тривалістю життя понад 1 рік через ≥3 міс оптимальної медикаментозної терапії; при ішемічній етіології СН – щонайменше через 6 тиж після ІМ (найвищі клас рекомендації та рівень доказів: І, А). Під оптимальною медикаментозною терапією слід розуміти призначення інгібітора АПФ або блокатора рецепторів ангіотензину, β-блокатора й антагоніста мінералокортикоїдних рецепторів у адекватних дозах.
У разі симптомної ШТ у пацієнтів із СН (наприклад, якщо пацієнт страждає від частих розрядів ІКД або нестійкої ШТ, яка спричиняє симптоми) аміодарон є засобом вибору. За даними дослідження OPTIC, аміодарон у комбінації з β-блокатором значно знижує частоту розрядів ІКД порівняно з монотерапією β-блокатором або соталолом. Інші ААП не рекомендовані пацієнтам із СН із міркувань безпеки.
Таким чином, добре відомий кардіологам аміодарон у сучасних рекомендаціях зберігає позицію оптимального ААП при симптомних ШТ у пацієнтів з ІХС, СН і кардіоміопатіями, в тому числі для запобігання частим розрядам у пацієнтів з ІКД.
У лекції також були розглянуті інші типи ШТ із підвищеним ризиком РСС: у пацієнтів із гіпертрофічною кардіоміопатією, аритмогенною дисплазією ПШ, синдром подовженого QT, синдром Бругада. Загалом найдієвішим способом профілактики РСС є встановлення ІКД, особливо в пацієнтів, які були реанімовані після епізоду ФШ. Катетерна абляція є методом вибору при неефективності медикаментозної терапії.
Отже, сучасна стратегія лікування ШТ передбачає підбір оптимальної антиаритмічної терапії на тлі лікування основного захворювання серця, встановлення ІКД за показаннями для профілактики РСС і розгляд питання щодо виконання радіочастотної деструкції субстрату аритмії.
 Завідувач кафедри функціональної діагностики НМАПО ім. П.Л. Шупика, доктор медичних наук, професор Олег Йосипович Жарінов прокоментував особливості діагностики та стандарти ведення хворих із суправентрикулярними тахіаритміями (СВТ).
Завідувач кафедри функціональної діагностики НМАПО ім. П.Л. Шупика, доктор медичних наук, професор Олег Йосипович Жарінов прокоментував особливості діагностики та стандарти ведення хворих із суправентрикулярними тахіаритміями (СВТ).
СВТ – велика група порушень ритму серця, що характеризуються підвищеною частотою формування та проведення імпульсів у синусовому вузлі, тканині передсердь, атріовентрикулярному (АВ) вузлі й додаткових шляхах. Відповідно, першим критерієм класифікації СВТ є джерело аритмії. За ним виділяють синоатріальні, передсердні, атріовентрикулярні та СВТ із додатковими шляхами проведення. За електрофізіологічними механізмами СВТ можуть бути автоматичними (ектопічними) та реципрокними (re-entry).
СВТ відрізняються за своїм перебігом: від пароксизмальної до постійно-зворотної й постійної. За тривалістю виділяють короткочасні пробіжки аритмії, нестійку та стійку СВТ.
Зазвичай СВТ виникають у пацієнтів без структурної хвороби серця, але постійна СВТ за відсутності лікування сама може призводити до дилатації й систолічної дисфункції ЛШ – розвитку «тахікардіоміопатії».
Оскільки ЕКГ є основним і в більшості випадків єдиним доступним методом діагностики аритмій, доповідач нагадав пріоритети в інтерпретації ЕКГ для диференційної діагностики СВТ:
1) частота серцевих скорочень (ЧСС);
2) регулярність R-R;
3) співвідношення частоти Р та QRS;
4) розташування зубців Р відносно комплексів QRS (якщо є Р’, то обов’язково оцінити тривалість інтервалу RP’);
5) вісь (вектор) зубця Р.
ЧСС під час СВТ переважно перебуває в діапазоні 100-250 уд/хв. Регулярними вважають тахікардії, при яких коливання тривалості сусідніх інтервалів RR не перевищують 10%. До СВТ із регулярними RR належать синусова тахікардія (СТ) із фіксованим АВ-проведенням (майже завжди 1:1), синоатріальна реципрокна тахікардія, передсердна тахікардія (ПТ) із фіксованим АВ-проведенням (переважно 1:1), атріовентрикулярна вузлова реципрокна тахікардія (АВВРТ), атріовентрикулярна реципрокна тахікардія (АВРТ), тріпотіння передсердь (ТП) із фіксованим АВ-проведенням (переважно 2:1). Нерегулярні інтервали RR характерні для ФП, ТП зі змінним АВ-проведенням, багатофокусної ПТ, мономорфної ПТ зі змінним АВ-проведенням, передсердної ектопічної тахікардії, атріовентрикулярної вузлової ектопічної тахікардії.
Зубці P передують шлуночковим комплексам при СТ, ПТ, багатофокусній ПТ, а також групових передсердних екстрасистолах. Натомість вони реєструються після комплексів QRS або збігаються з ними при АВВРТ та АВРТ. У разі тахікардій із дуже високою ЧСС (зокрема, ПТ, АВВРТ, АВРТ) зубців Р може бути не видно, оскільки вони нашаровуються на зубець Т.
Часто виникає необхідність диференціювати ПТ від ФП, і це дуже важливо, оскільки кардинально відрізняються стратегії лікування, зокрема підходи до антитромботичної терапії. Ключовим критерієм ФП вважають тривалість епізоду мінімум 30 с.
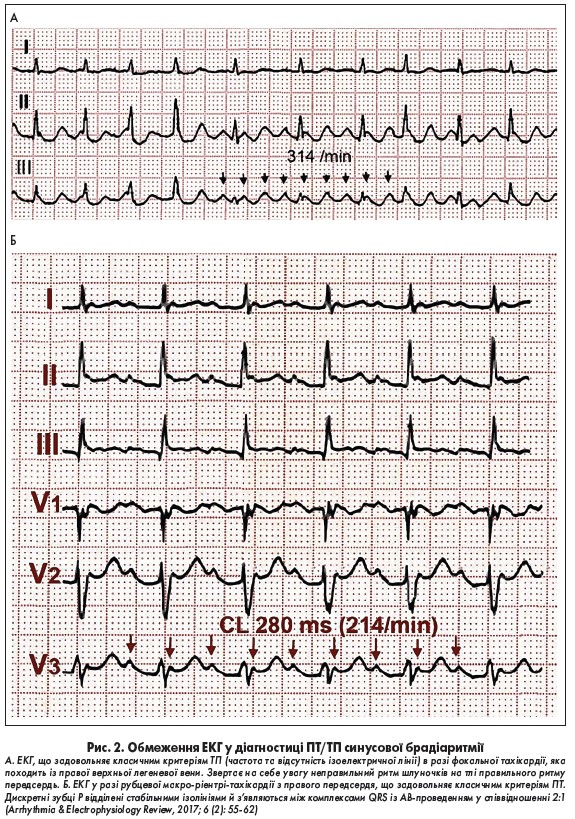 Для ефективної корекції субстрату СВТ необхідно точно визначити її джерело, електрофізіологічний механізм і перебіг. У багатьох випадках для вирішення цих завдань достатньо аналізу звичайної ЕКГ або даних амбулаторного моніторування ЕКГ. Водночас диференційна діагностика СВТ може викликати труднощі. Наприклад, ТП із проведенням 2:1 можна помилково розцінити як СТ або ПТ, оскільки кожна друга хвиля тріпотіння часто збігається із зубцем Т. Доповідач представив клінічні приклади, коли за даними ЕКГ важко встановити правильний діагноз (рис. 2.). Останньою інстанцією є електрофізіологічне дослідження, що дає змогу встановити істинний субстрат і механізм аритмії.
Для ефективної корекції субстрату СВТ необхідно точно визначити її джерело, електрофізіологічний механізм і перебіг. У багатьох випадках для вирішення цих завдань достатньо аналізу звичайної ЕКГ або даних амбулаторного моніторування ЕКГ. Водночас диференційна діагностика СВТ може викликати труднощі. Наприклад, ТП із проведенням 2:1 можна помилково розцінити як СТ або ПТ, оскільки кожна друга хвиля тріпотіння часто збігається із зубцем Т. Доповідач представив клінічні приклади, коли за даними ЕКГ важко встановити правильний діагноз (рис. 2.). Останньою інстанцією є електрофізіологічне дослідження, що дає змогу встановити істинний субстрат і механізм аритмії.
Доповідач розглянув особливості лікування різних видів СВТ за рекомендаціями Американської колегії кардіологів / Американської асоціації серця / Товариства ритму серця (2015).
Американські експерти окремо характеризують у лікуванні СВТ невідкладну допомогу та тривалу стратегію ведення хворих. Для припинення пароксизмів АВВРТ насамперед застосовують вагусні проби (масаж каротидного синуса) та внутрішньовенне введення аденозину (чи АТФ). Якщо це не допомагає, в гемодинамічно стабільних пацієнтів рекомендовано внутрішньовенне введення β-блокатора чи недигідропіридинового блокатора кальцієвих каналів (верапаміл або дилтіазем). Аміодарон є препаратом резерву в разі неефективності перерахованих засобів. У пацієнтів із порушеннями гемодинаміки методом відновлення ритму є електрична кардіоверсія.
У рамках тривалої стратегії радикальним методом лікування пацієнтів із СВТ є катетерні втручання, що в більшості випадків забезпечують усунення субстрату аритмії. Проте американські експерти наголошують на участі пацієнта у виборі методу лікування – катетерного чи консервативного. Консервативне лікування полягає в підтримувальній антиаритмічній терапії. Для контролю ЧСС застосовують β-блокатори чи недигідропіридинові блокатори кальцієвих каналів. Препаратами вибору за відсутності структурної патології серця є пропафенон і флекаїнід. Аміодарон є препаратом резерву в більшості випадків СВТ за відсутності структурної патології серця як для припинення нападу, так і в рамках довготривалої стратегії. У пацієнтів із систолічною дисфункцією ЛШ або іншою структурною патологією серця аміодарон є препаратом вибору, оскільки ААП І класу протипоказані.
У пацієнтів із СТ лікування слід починати з усунення причин і пускових факторів тахікардії (наприклад, заняття спортом). Американські експерти рекомендують розглянути призначення івабрадину симптомним пацієнтам із СТ, причому з вищим класом рекомендації, ніж для β-блокаторів.
У підсумку доповідач наголосив на необхідності формулювати діагноз з урахуванням джерела, механізмів, перебігу та тривалості аритмії, а не лише констатувати наявність СВТ. ЕКГ, безумовно, є основним методом діагностики СВТ, але має певні обмеження. Медикаментозна терапія має суттєві відмінності залежно від виду СВТ і наявності фонової хвороби серця. Катетерне лікування є пріоритетним, але в пацієнта завжди має бути вибір.
 Завідувач кафедри внутрішньої медицини, фізичної реабілітації та спортивної медицини Буковинського державного медичного університету (м. Чернівці), доктор медичних наук, професор Віктор Корнійович Тащук розповів про перспективи кількісної оцінки ЕКГ у визначенні показань до антиаритмічної терапії з метою профілактики РСС. Сучасні методи комп’ютерного статистичного та геометричного аналізу ЕКГ істотно розширюють можливості цього традиційного методу діагностики, підвищуючи чутливість до виявлення небезпечних порушень ритму. Зокрема, в доповіді були докладно проаналізовані причини виникнення синдрому ранньої реполяризації шлуночків та її вплив на ризик ФШ і РСС.
Завідувач кафедри внутрішньої медицини, фізичної реабілітації та спортивної медицини Буковинського державного медичного університету (м. Чернівці), доктор медичних наук, професор Віктор Корнійович Тащук розповів про перспективи кількісної оцінки ЕКГ у визначенні показань до антиаритмічної терапії з метою профілактики РСС. Сучасні методи комп’ютерного статистичного та геометричного аналізу ЕКГ істотно розширюють можливості цього традиційного методу діагностики, підвищуючи чутливість до виявлення небезпечних порушень ритму. Зокрема, в доповіді були докладно проаналізовані причини виникнення синдрому ранньої реполяризації шлуночків та її вплив на ризик ФШ і РСС.
Ознаками синдрому ранньої реполяризації є горизонтальна чи низхідна форма сегмента ST після точки J. Встановлено, що пацієнти з косонизхідною депресією сегмента ST мають приблизно у 3,14 раза (95% довірчий інтервал, ДІ 1,56-6,30) підвищений ризик розвитку аритмічної смерті. Висхідна форма сегмента ST після точки J, у свою чергу, є сприятливим прогностичним маркером, що не асоціюється зі зростанням імовірності аритмічної смерті (відношення ризиків 0,89; 95% ДІ 0,52-1,55) (J.T. Tikkanen et al., 2011).
Аміодарон є потужним ААП, який, за даними рандомізованих клінічних досліджень і метааналізів, достовірно знижує рівень аритмічної смертності. Проте відносно мало відомо про його вплив на варіабельність серцевого ритму й інші кількісні показники. Встановлено, що на тлі прийому аміодарону достовірно зменшується показник рNN50 (частка інтервалів NN, що перевищують 50 мс), і зменшення рNN50 корелювало зі зменшенням кількості ШЕ (L.E. Rohde et al., 1998). Іншими авторами показано, що застосування аміодарону дає змогу зменшити нахил сегмента ST і знизити ризик аритмічної смерті (Milliez et al., 2004).
Доповідач представив дані власного дослідження з кількісним аналізом ЕКГ у пацієнтів із ГІМ, в якому було виявлено, що аміодарон (Кордарон®) позитивно впливає на варіабельність серцевого ритму відповідно до аналізу як статистичних, так і геометричних методів дослідження ЕКГ. Виявлені зміни вказують на здатність аміодарону активувати парасимпатичний контур регуляції ритму серця, знижувати дисперсію інтервалу QT, зменшувати нахил сегмента ST. Отримані дані в сукупності з раніше опублікованими додатково обґрунтовують призначення препарату Кордарон® для запобігання раптовій аритмічній смерті в пацієнтів, яким показаний цей ААП.
 Асистент кафедри променевої діагностики факультету післядипломної освіти Львівського національного медичного університету ім. Данила Галицького, кандидат медичних наук Михайло Степанович Сороківський розповів, як оцінювати ЕКГ пацієнта з електрокардіостимулятором (ЕКС) і яку інформацію може надати імплантований пристрій. Кардіологи та терапевти дедалі частіше мають справу з пацієнтами, котрим у закладах вищого рівня медичної допомоги були імплантовані ЕКС. Звичайно, ЕКГ таких пацієнтів може істотно відрізнятися й потребує певних навичок для її коректної інтерпретації.
Асистент кафедри променевої діагностики факультету післядипломної освіти Львівського національного медичного університету ім. Данила Галицького, кандидат медичних наук Михайло Степанович Сороківський розповів, як оцінювати ЕКГ пацієнта з електрокардіостимулятором (ЕКС) і яку інформацію може надати імплантований пристрій. Кардіологи та терапевти дедалі частіше мають справу з пацієнтами, котрим у закладах вищого рівня медичної допомоги були імплантовані ЕКС. Звичайно, ЕКГ таких пацієнтів може істотно відрізнятися й потребує певних навичок для її коректної інтерпретації.
Для аналізу стандартної 12-канальної ЕКГ у пацієнта з імплантованим пристроєм бажано знати такі характеристики:
– тип стимуляції (камера серця, що стимулюється, й камера, з якої зчитується імпульс);
– полярність стимуляції (монополярна, біполярна);
– базову ЧСС (мінімальна ЧСС, яку підтримує стимулятор, зазвичай близька до 60 уд/хв);
– чи є функція адаптації ЧСС до фізичної активності пацієнта.
Звичайно, необхідно знати й причину (показання) встановлення ЕКС. Цю інформацію можна знайти у виписці пацієнта після встановлення ЕКС, спеціальній картці пацієнта з ЕКС, протоколі останнього програмування пристрою. Проте буває так, що немає жодної документації. Зрозуміти, що ритмом керує штучний водій, допомагають три основні ознаки:
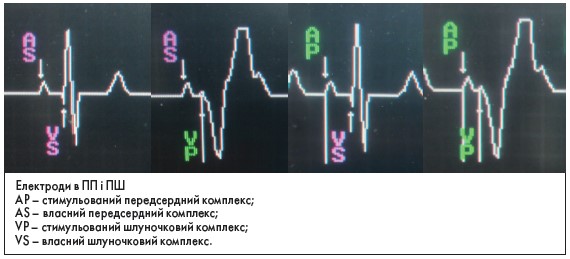
1. Періодична поява комплексів QRS із графікою блокади ЛНПГ (тому що стимуляція відбувається з ПШ). Зубець R значно менший за S у відведенні V5, якщо стимуляція йде з верхівки.
2. У спокої, коли працює стимулятор, ЕКГ дуже ритмічна, ЧСС найчастіше 60 уд/хв, рідше 50 або 70.
3. Наявність імпульсів (спайків) від ЕКС. Їх не завжди видно при біполярній стимуляції, коли імпульс циркулює між двома полюсами на дистальному кінці електрода. При монополярній стимуляції коло циркуляції імпульсу велике (між електродом і корпусом ЕКС), тому спайки високоамплітудні й зазвичай їх добре видно.
За звичайною ЕКГ, на якій видно роботу ЕКС, у більшості випадків можна встановити тип імплантованого пристрою та запрограмований режим стимуляції.
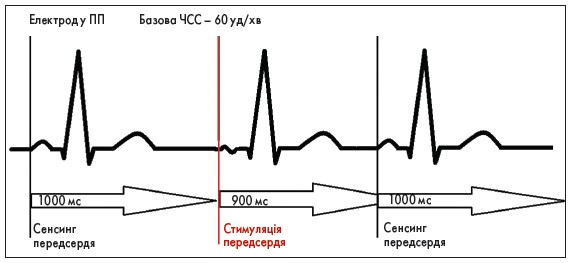
Режим ААI: стимуляція правого передсердя (ПП), сенсинг із ПП. Можна побачити атиповий, змінений зубець Р під час нанесення імпульсу, рівні інтервали між зубцями Р (рис. 3).
Рис. 3. Особливості ЕКГ у пацієнта з ЕКС, що працює в режимі ААІ
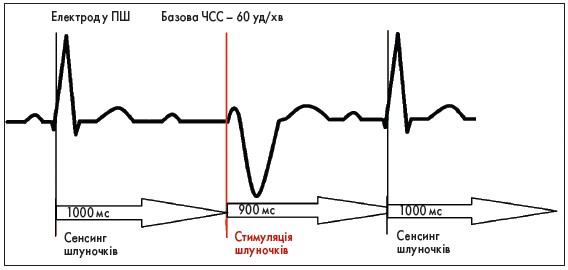
Режим VVI: стимуляція ПШ, сенсинг ПШ. ЕКС керується лише активністю ПШ і не реагує на ритм передсердь. Для ЕКГ характерна графіка блокади ЛНПГ стимульованого комплексу QRS (рис. 4).
Рис. 4. Особливості ЕКГ у пацієнта з ЕКС, що працює в режимі VVІ
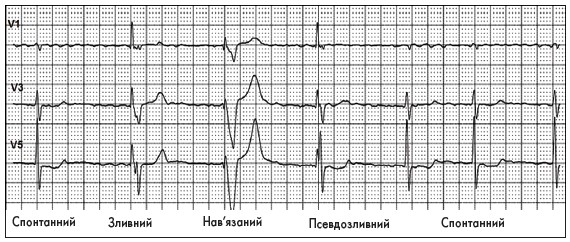
Крім того, можна розрізнити чотири типи комплексу QRS під час роботи ЕКС (рис. 5):
Рис. 5. Комплекси QRS під час роботи ЕКС
– спонтанний: власний QRS без впливу ЕКС;
– нав’язаний: комплекс від імпульсу ЕКС (широкий, із графікою блокади ЛНПГ);
– зливний: перехідний від спонтанного до нав’язаного;
– псевдозливний: коли на власний QRS звичайної форми накладається спайк стимулятора одномоментно з початком спонтанного збудження.
Режим DDD: сенсинг із двох камер і стимуляція двох камер (ПП і ПШ). Для цього типу ЕКС можливі чотири варіанти стимуляції, які спонтанно можуть переходити один в інший залежно від функції автоматизму синусового та провідності АВ вузла (рис. 6).
Рис. 6. Варіанти стимуляції в режимі DDD (дані з програматора ЕКС)
Під час обстеження пацієнта з ЕКС обов’язковою є клінічна оцінка роботи пристрою для вирішення питання, чи такий тип і частота стимуляції є оптимальними для пацієнта. Та в деяких випадках звичайний запис ЕКГ («погляд зовні») не дає змоги оцінити роботу ЕКС. Тому докладніше визначити, як працює ЕКС, можна зчитавши дані з програматора пристрою («погляд ізсередини»). Отже, зіставлення даних про роботу кардіостимулятора, отриманих з ЕКГ і програматора, допомагає найбільш точно оцінити роботу ЕКС.
Окрім того, ЕКС надає багато цінної діагностичної інформації. Пристрій може зафіксувати пароксизми ФП, їх почастішання за останній час, що прискорює прийняття рішення про застосування стратегії контролю ритму (абляція, антиаритмічна терапія) й допомагає вчасно призначити профілактичне лікування антикоагулянтами. Також ЕКС може зареєструвати пароксизми ШТ, допомагає контролювати ефективність ААП.
У підсумку доповідач зазначив, що кількість і складність імплантованих пристроїв неухильно зростають. Обізнаність лікарів первинної ланки з їхніми можливостями та принципами роботи теж мусить зростати. Кардіостимулятор є потужним діагностичним пристроєм, який може суттєво допомогти покращити ведення пацієнта. Це можливо лише за умови співпраці та взаємопорозуміння між кардіологами, кардіохірургами, електрофізіологами, терапевтами й сімейними лікарями.
***
Друге наукове засідання почалося з навчального семінару «Сучасні технології моніторингу ЕКГ».
Лікар функціональної діагностики Т.М. Гавронська поділилася досвідом роботи з різними алгоритмами та інструментами комп’ютерного аналізу холтерівських ЕКГ. На наочному матеріалі доповідач розглянула можливості фільтрації артефактів, особливості діагностики пароксизмальних аритмій, епізодів ішемії, підрахунку кількості екстрасистол та інші тонкощі роботи з цим потужним діагностичним методом.
Асистент кафедри функціональної діагностики НМАПО ім. П.Л. Шупика Н.О. Ліфантьєва нагадала про значення апаратного моніторингу подій у діагностиці синкопальних станів. Як відомо, аритмії посідають близько 10% у структурі причин синкопе. Аритмогенні синкопе можуть бути пов’язані з брадикардією, дисфункцією синусового вузла, АВ-блокадою, стійкою чи симптомною ШТ, симптомною СВТ, а також порушеннями функціонування штучного водія ритму. 2017 року були опубліковані рекомендації Американської колегії кардіологів / Американської асоціації серця / Товариства ритму серця щодо ведення пацієнтів із синкопе. У рекомендаціях надано покроковий алгоритм обстеження пацієнта із синкопальними станами – від збору анамнезу до проведення інструментальних методів і застосування різних типів пристроїв для моніторування ЕКГ. Залежно від клінічної частоти подій можуть бути застосовані 24-годинне холтерівське моніторування (при щоденних синкопе), 48-72-годинне холтерівське моніторування (якщо події трапляються не щодня), 7-денне моніторування, реєстратор подій у межах 14-30 днів, імплантований петльовий монітор для реєстрації подій, які трапляються рідше ніж щомісяця. Загальний принцип зводиться до підбору такого метода та тривалості реєстрації, який забезпечить надійну фіксацію подій.
Фахівець Українського науково-практичного центру ендокринної хірургії, трансплантації ендокринних органів та тканин МОЗ України О.А. Ковалевська представила кілька цікавих клінічних випадків виявлення субклінічного атеросклерозу у відносно молодих пацієнтів із низьким і помірним серцево-судинним ризиком під час дуплексного сканування артерій голови, шиї, нижніх кінцівок. На підставі досвіду фахівець пропонує виконувати дуплексне сканування сонних артерій усім чоловікам старше 46 років і жінкам старше 51 року з низьким і помірним ризиком за шкалою SCORE, а також чоловікам молодше 45 років і жінкам молодше 50 років за наявності артеріальної гіпертензії (АГ) або концентрації загального холестерину крові >5 ммоль/л.
Доповідь асистента кафедри функціональної діагностики НМАПО ім. П.Л. Шупика Н.Ю. Васильєвої також стосувалася структурних змін брахіоцефальних артерій у пацієнтів з АГ. Діагностика уражень органів-мішеней при АГ – одна з ключових складових оцінки загального серцево-судинного ризику. На практиці найбільш проблематичним є раннє виявлення безсимптомних уражень судинного русла мозку, які можуть призводити до інвалідизуючих наслідків – інсульту та деменції. Доповідач докладно розглянула характерні структурні зміни (ремоделювання) артерій при АГ та їх ультразвукові ознаки, особливості вимірювання товщини комплексу інтима-медіа сонних артерій, методи оцінки ступеня їх звуження, виявлення деформацій та анатомічних аномалій судин.
Ю.І. Галій (Інститут травматології та ортопедії НАМН України) нагадала про роль електронейроміографії в діагностиці міопатії та значення цієї знахідки для кардіологічної практики. Атрофічний процес при прогресуючій міопатії Дюшена вражає як скелетні м’язи, так і міокард. У результаті до 94% хворих страждають на патологію серцево-судинної системи. Незважаючи на те що проблема залучення серця в патологічний процес при міопатії Дюшена вивчається з 1980-х років, раннє виявлення серцево-судинної патології залишається проблематичним. А причиною летального кінця при більшості форм прогресуючої міопатії стає дилатаційна кардіоміопатія. Електронейроміографія є одним із основних методів оцінки структурно-функціонального стану м’язів і діагностики нейром’язових захворювань. Пацієнт зі встановленим діагнозом міопатії Дюшена/Бекера потребує негайної консультації кардіолога та розширеного кардіологічного обстеження (ЕКГ, ЕхоКГ, добове моніторування).
Насамкінець про плід науково-педагогічної роботи провідних кафедр України, де здійснюється післядипломне навчання лікарів із функціональної діагностики. У рамках конференції відбулася презентація національного підручника «Функціональна діагностика» (редактори: О.Й. Жарінов, Ю.А. Іванів, В.О. Куць). Колектив авторів ставив перед собою амбітну мету – створити всеохопне джерело знань, доступне для початківців і цікаве для досвідчених лікарів, яке зберігало б актуальність протягом багатьох років. Сподіваємося, що новий підручник стане корисним і гідним знаряддям у повсякденній підготовці лікарів різних спеціальностей.
Підготував Дмитро Молчанов
Тематичний номер «Кардіологія, Ревматологія, Кардіохірургія» № 2 (56) Квітень 2018 р