4 червня, 2018
Противогрибковая терапия у детей c онкогематологической патологией
Инвазивные грибковые инфекции (ИГИ) являются одной из основных причин заболеваемости и смертности у детей с гематологической или онкологической патологией, а также при проведении трансплантации гемопоэтических стволовых клеток (ТГСК), и повышают финансовые затраты на ведение таких пациентов. Несмотря на своевременную диагностику и применение новых противогрибковых препаратов, уровень смертности от ИГИ остается достаточно высоким – >20%.
Потенциально патогенными для человека считаются свыше 100 видов грибов. Причиной нозокомиальных инфекций являются не более 20 из них, среди которых превалируют дрожжеподобные грибы рода Candida. Реже встречаются другие дрожжеподобные (Geotrichum spp., Saccharomyces spp.) и плесневые (Aspergillus spp., Mucor spp., Fusarium sрр.) грибы, а также грибы рода Zygomycete.
Большинство грибов рода Candida существуют как сапрофиты на коже, в желудочно-кишечном тракте и в области гениталий. Они обычно слабо агрессивны и не способны вызывать микозы у пациентов без нарушения защитных барьерных функций организма. Немаловажную роль в развитии микозов играет предшествующая колонизация слизистых оболочек. В условиях воздействия факторов риска у онкологических пациентов слизистые оболочки полости рта, желудочно-кишечного и мочевыводящего трактов, колонизированные грибами, могут стать источником диссеминации инфекции [1]. Частота ИГИ варьируется от 5 до 10% или более в зависимости от состояния пациента и наличия неблагоприятных факторов.
В зависимости от частоты встречаемости инфекционных осложнений, наличия факторов риска и протоколов терапии онкологических пациентов детского возраста Европейской организацией по исследованию и лечению рака, группой по изучению микозов (EORTC-MSG) выделены следующие когорты риска развития ИГИ:
- высокого риска (≥10%) – включает пациентов с острым миелоидным лейкозом, рецидивом острого лейкоза и реципиентов после аллогенной ТГСК;
- низкого риска (≤5%) – входят пациенты с острым лимфобластным лейкозом, неходжкинской лимфомой и реципиенты после аутологичной ТГСК;
- спорадически возникающих ИГИ – включает пациентов детского возраста с солидными опухолями, опухолями мозга и лимфомой Ходжкина [2].
Грибковые клетки сильно отличаются от клеток млекопитающих. Уникальные особенности клеточной стенки и плазматической мембраны учитываются при разработке новых лекарственных агентов и являются многообещающими мишенями для таргетной терапии.
Противогрибковые средства, действие которых направлено на стенки грибковых клеток, обладают широким спектром активности, этот класс включает эхинокандины и ингибиторы хитинсинтетазы.
Основным структурным компонентом мембраны грибковых клеток являются сложные липидные частицы – эргостеролы. Противогрибковое действие азолов и полиеновых антибиотиков обусловлено нарушением целостности мембраны клетки гриба, но механизм действия различается. В основе действия полиенов лежит связывание с эргостеролом, в результате этого в оболочке образуются гидрофильные поры, через которые из клетки выходят ионы и низкомолекулярные вещества, что приводит к ее гибели.
Азольные агенты ингибируют синтез эргостерола путем блокирования D1-деметилирования С14 ланостерола. Изначально соединения азола имели ограниченную активность, однако препараты более позднего поколения – триазолы, начиная с флуконазола, обладают хорошей абсорбцией, меньшим количеством побочных эффектов и высокой активностью против многих грибковых патогенов. Следует отметить, что флуконазол не обладает активностью против многих форм и не должен рассматриваться в режиме лечения инвазивного поражения плесневыми грибами. Триазолы второго поколения – вориконазол и посаконазол – демонстрируют расширенный спектр активности против дрожжей и большинства форм ИГИ. Вориконазол – первый препарат этого класса, который был одобрен Управлением по контролю качества пищевых продуктов и лекарственных препаратов (FDA) США для лечения инвазивной грибковой инфекции и при резистентности или непереносимости обычной противогрибковой терапии. Однако вориконазол обладает ограниченной активностью против зигомикозов. Согласно европейским рекомендациям, вориконазол следует назначать в дозе 7 мг/кг дважды в день. В ходе проведенных исследований было выявлено, что азольные агенты обладают значительным взаимодействием с другими лекарственными средствами, поэтому следует опасаться возможного потенцирования токсичности.
Посаконазол – триазол широкого спектра действия, эффективен против Candida spp., Aspergillus spp., Cryptococcus spp., в отличие от других препаратов этого класса обладает значительной активностью против Zygomycota и является достижением последнего десятилетия в профилактике и терапии грибковой инфекции.
Посаконазол имеет высокий уровень рекомендаций для использования в профилактике ИГИ у пациентов высокого риска и умеренный уровень рекомендаций – в терапии второй линии инвазивного аспергиллеза и зигомикоза [2, 3]. Основными ограничениями его использования являются фармакокинетическая вариабельность и сниженная биодоступность при пероральном приеме. Низкий уровень активного вещества в плазме крови может быть следствием повышения рН и/или моторики желудка, голодания, мукозита и диареи, что в свою очередь выражается в недостаточном терапевтическом эффекте и развитии прорывных инфекций. В связи с этим определение концентрации посаконазола в плазме крови (терапевтический лекарственный мониторинг – ТЛМ) имеет важное значение при использовании данного препарата.
В ретроспективном исследовании оценивали активность посаконазола в качестве терапии спасения у 91 пациента (средний возраст 47 лет) с доказанным или предполагаемым зигомикозом, резистентностью к ранее проведенной противогрибковой терапии (n=81) либо непереносимостью такого лечения (n=10). Посаконазол в дозе 800 мг в день обеспечивал частичный или полный ответ у 60% пациентов на 12-й неделе лечения и стабилизацию болезни у 21% пациентов. В общей сложности у 73% пациентов с зигомикозом мозга лечение было успешным, это свидетельствует о том, что посаконазол после перорального применения способен проникать в паренхиму головного мозга.
В большом сравнительном исследовании (n=600) при проведении трансплантации у пациентов с острым миелоидным лейкозом посаконазол показал большую эффективность по сравнению с флуконазолом в профилактике прорывного аспергиллеза (6 против 1%, p=0,001) и был столь же эффективен, как и флуконазол, в предотвращении других прорывных ИГИ. У пациентов с ИГИ, резистентной к ранее проводимому лечению, включая вориконазол, посаконазол обеспечил полный ответ в 7 из 8 случаев [4].
Посаконазол с самого начала применялся у детей старшего возраста и подростков в качестве терапии спасения, затем показания были расширены и включали профилактическое использование у детей младшего возраста при высоком риске развития ИГИ. Хороший профиль безопасности посаконазола, наблюдаемый у взрослых пациентов, а также недостаточная эффективность доступных вариантов для противогрибковой пероральной профилактики в педиатрической гематологии и онкологии (флуконазол или итраконазол) послужили основанием для выбора посаконазола в педиатрической практике. Предварительные данные о фармакокинетических характеристиках посаконазола у подростков были сходны с таковыми, полученными у взрослых.
Изначально посаконазол был выпущен в форме суспензии для перорального приема, что требовало осторожности при одновременном назначении других лекарственных средств или употреблении жирной пищи. В связи с этим была разработана гастрорезистентная таблетированная форма. Замедленное высвобождение и лучшая желудочно-кишечная абсорбция этой формы позволили достичь стабильной минимальной концентрации при однократном ежедневном приеме. Ретроспективное исследование, проводившееся с 1 января 2010 г. по 31 мая 2017 г. на базе 5 детских онкогематологических центров, принадлежащих Итальянской ассоциации детской онкологии и гематологии (AIEOP), дало возможность проанализировать данные об использовании пероральной суспензии посаконазола с одновременным ТЛМ. Основной целью была оценка корреляции между дозой посаконазола и достижением оптимальной минимальной концентрации посаконазола в плазме крови как для профилактических, так и для терапевтических целей. Мониторинг концентрации выполнялся с помощью высокоэффективной жидкостной хроматографии.
Это исследование представляет собой самый большой ретроспективный анализ данных по применению посаконазола у педиатрических пациентов, в том числе в возрасте до 13 лет. Регулярный ТЛМ позволил сравнить дозу, эмпирически выбранную врачом, концентрацию посаконазола в плазме крови, достигнутую при ее применении, и желаемую концентрацию, рекомендованную для оптимальной эффективности посаконазола. Учитывая ретроспективный характер исследования, данные по дозам и концентрации посаконазола в плазме крови были сгруппированы в зависимости от количества дней от начала терапии посаконазолом следующим образом: 1-я группа – ТЛМ проводился на 7-й день (диапазон ±5), 2-я группа – на 15-й день (диапазон ±3 дня) и 3-я группа – на 30-й день (диапазон ±10 дней) от начала терапии посаконазолом.
В исследовании приняли участие 97 пациентов, средний возраст которых составил 10,7 года. Посаконазол применялся в профилактических целях у 86% пациентов и для лечения ИГИ у 13% пациентов. Группа ТГСК включала 35 пациентов; источником стволовых клеток у 77% пациентов был костный мозг, у 20% – периферическая кровь, а у 3% – пуповинная кровь. Семь пациентов с ТГСК получали трансплантацию ex vivo (T-истощение). Что касается профилактики, то средняя продолжительность терапии посаконазолом составляла 147,5 дня (диапазон 11-1117 дней).
В целом были зарегистрированы 17 эпизодов ИГИ. Наиболее распространенным возбудителем были Aspergillus spp., также диагностировались Zygomycetes; у 2 пациентов был гистологически определен рост нитевидных гиф без идентификации видов в культуре. Наиболее часто ИГИ развивалась в легких, реже – в печени, почках, щитовидной железе, селезенке, глазах, ЦНС и придаточных пазухах носа. Тяжелая нейтропения была диагностирована в 71% случаев. Лечение кортикостероидами в средней эквивалентной по преднизолону дозе 2,3 мг/кг получали 35% пациентов.
При медиане наблюдения 1,7 года (95% доверительный интервал 1,5-2,0) умерли 13% пациентов; 90-дневная общая выживаемость составляла 94,9% (95% доверительный интервал 88,1-97,8). Среднее время от начала лечения посаконазолом до смерти составляло 189 дней. Причиной смерти было прогрессирование заболевания у 8 пациентов, инфекция – у 4 и внутричерепное кровоизлияние у 1 больного. Смерть от инфекции была вызвана сепсисом и вирусными заболеваниями, но только 1 пациент (который получал посаконазол в качестве профилактики) умер вследствие ИГИ через 53 дня после начала лечения посаконазолом. Смертность в группе профилактики вследствие резистентной ИГИ составила 1,2%.
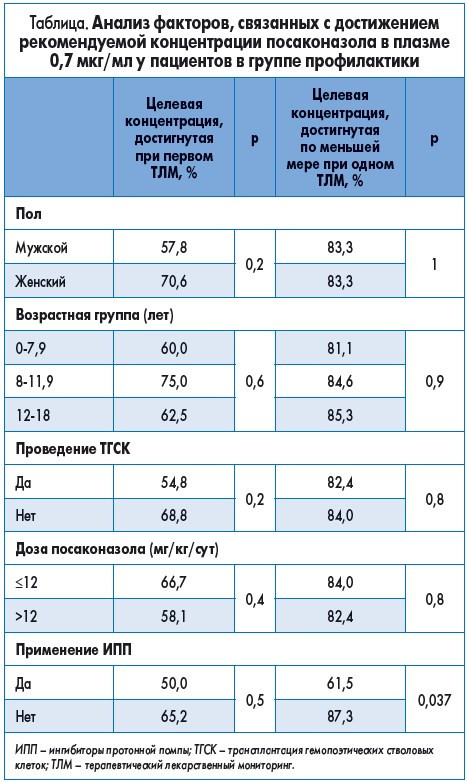 При профилактическом применении посаконазола было обнаружено, что средняя суточная доза 12 мг/кг (диапазон 4-35 мг/кг/сут) пероральной суспензии позволила достичь пороговых значений концентрации посаконазола в плазме крови ≥0,7 мкг/мл в 63% случаев на 7-й день от начала лечения. Во время второго и третьего определения концентрации посаконазола на 15-й и 30-й день средняя доза была ниже (10 и 10,5 мг/кг), несмотря на это ее пороговые значения были достигнуты у 66 и 69% пациентов соответственно. Примечательно, что уровень достижения оптимальной концентрации посаконазола в плазме крови в группе профилактики во время второго и третьего измерения существенно не изменился. Это открытие можно объяснить кинетикой насыщаемого поглощения посаконазола.
При профилактическом применении посаконазола было обнаружено, что средняя суточная доза 12 мг/кг (диапазон 4-35 мг/кг/сут) пероральной суспензии позволила достичь пороговых значений концентрации посаконазола в плазме крови ≥0,7 мкг/мл в 63% случаев на 7-й день от начала лечения. Во время второго и третьего определения концентрации посаконазола на 15-й и 30-й день средняя доза была ниже (10 и 10,5 мг/кг), несмотря на это ее пороговые значения были достигнуты у 66 и 69% пациентов соответственно. Примечательно, что уровень достижения оптимальной концентрации посаконазола в плазме крови в группе профилактики во время второго и третьего измерения существенно не изменился. Это открытие можно объяснить кинетикой насыщаемого поглощения посаконазола.
Единственным фактором, влияющим на достижение рекомендуемой концентрации посаконазола в плазме крови, было использование ингибиторов протонной помпы, в то время как другие факторы, такие как пол, возраст и тип лечения (химиотерапия или ТГСК), не имели никакого влияния (табл.).
Вопрос о точной дозировке в педиатрической практике по-прежнему остается предметом исследования. Dоring и соавт. сообщали, что при суточной дозе 12 мг/кг, разделенной на 3 введения у педиатрических пациентов после ТГСК, средний уровень посаконазола в плазме крови был выше, чем при суточной дозе 10 мг/кг, 0,3 и 0,1 мкг/мл соответственно, хотя в обеих группах уровень не достиг оптимальных значений. В отличие от пациентов с онкологической патологией или после аутологичной ТГСК, профилактический прием посаконазола в дозе 8,4-21,2 мг/кг, разделенной на 2 приема, был эффективен для достижения минимального порогового уровня ≥0,7 мкг/мл у 12 пациентов с хронической гранулематозной болезнью. Бернардо и соавт. также сообщили о достижении пороговых значений (≥0,7 мкг/мл) в 63% случаев при более высокой средней суточной дозе посаконазола – 20 мг/кг.
У 77% пациентов, получавших посаконазол в качестве терапии спасения, прием средней суточной дозы 15 мг/кг (диапазон 5-30 мг/кг) позволил достичь плазменной концентрации >1 мкг/мл. Более того, этот показатель оставался >60% при втором и третьем измерении концентрации посаконазола в плазме крови, несмотря на снижение средней дозы препарата.
У пациентов, применявших посаконазол с целью профилактики, частота прорывной инфекции составляла 5%, притом что почти в 40% случаев концентрация посаконазола в плазме была ниже желаемого порога. Это может быть объяснено длительным накоплением препарата в тканях, несмотря на субоптимальные концентрации в плазме крови <0,7 мкг/мл. Хотя легкие чаще всего поражаются при ИГИ, экспериментальные данные показывают, что посаконазол накапливается в эндоплазматическом ретикулуме альвеолярных макрофагов, которые, в свою очередь, имеют фундаментальное значение для разрушения ингаляционных конидий [5].
При прорывных инфекциях частота полного ответа на лечение была высокой (3 из 4 пациентов). Согласно данным нескольких исследований, предшествующая профилактика грибковой инфекции, в том числе путем введения посаконазола, не изменяет восприимчивость к лечению неазольными препаратами. Посаконазол хорошо переносился, и частота побочных эффектов, возможно связанных с его приемом, составила 6% [6].
В случае использования посаконазола настоятельно рекомендуется проведение ТЛМ из-за наличия корреляции между ТЛМ и эффективностью. Кроме того, многие переменные, которые могут влиять на абсорбцию (частота введения, наличие в рационе продуктов с высоким содержанием жиров, целостность слизистой оболочки, рH желудка, желудочная и кишечная моторика), трудно контролировать. Это обусловило разработку гастрорезистентных таблеток с замедленным высвобождением действующего вещества, которые у взрослых пациентов оказались эффективными в достижении желаемой минимальной концентрации препарата в плазме крови независимо от таких факторов, как тип пищи, моторика желудка и прием антацидов. Dоring и соавт. проанализировали безопасность и эффективность разных форм посаконазола у 63 пациентов, 31 из которых принимал пероральную суспензию и 32 – таблетки (адаптированная доза от 100 до 300 мг в день в зависимости от массы тела) в течение 200 дней после ТГСК. Таблетированная форма оказалась безопасной и эффективной, при этом обеспечивала более быстрое достижение рекомендуемых концентраций по сравнению с суспензией [7].
Несмотря на своевременную диагностику и внедрение новых противогрибковых препаратов, уровень смертности от ИГИ превышает 20%. В связи с этим группой EORTC-MSG были разработаны меры по их первичной и вторичной профилактике.
Первичную противогрибковую профилактику следует назначать педиатрическим пациентам, подверженным высокому риску развития ИГИ. Необходимо также учитывать локальные эпидемиологические данные и индивидуальные факторы риска. У пациентов, подвергающихся аллогенной ТГСК, профилактика ИГИ рекомендуется во время фазы гранулоцитопении до приживления трансплантата (уровень доказательств В, клас II). Терапевтические опции включают:
- флуконазол (A, I);
- итраконазол или вориконазол (B, I, рекомендован также ТЛМ);
- микафунгин (C, I);
- липосомальный амфотерицин B (C, III).
Другие варианты могут включать аэрозолизированный липосомальный амфотерицин B и посаконазол с ТЛМ у пациентов в возрасте ≥13 лет. В случае отсутствия реакции трансплантат против хозяина противогрибковая профилактика может быть продлена до прекращения иммуносупрессии и восстановления иммунитета.
При наличии реакции трансплантат против хозяина пациентам, которым была назначена расширенная иммуносупрессивная терапия (включая глюкокортикоиды в терапевтических дозах ≥0,3 мг/кг в день эквивалентно преднизолону или использование противовоспалительных антител), рекомендуется профилактика плесневых и дрожжевых инфекций (A, II).
Доступны следующие варианты:
- посаконазол с ТЛМ для пациентов в возрасте ≥13 лет (B, I);
- вориконазол с ТЛМ для пациентов в возрасте ≥2 лет (B, I);
- итраконазол с ТЛМ (C, II).
Другие варианты могут включать внутривенное введение липосомального амфотерицина В и микафунгина.
У пациентов группы высокого риска с впервые выявленным острым лейкозом или рецидивом заболевания следует учитывать первичную противогрибковую профилактику (B, II). Варианты включают:
- итраконазол + ТЛМ (B, I);
- посаконазол + ТЛМ у пациентов в возрасте ≥13 лет (B, I);
- внутривенное введение липосомального амфотерицина B (B, II);
- флуконазол (C, I, активный только против дрожжей).
Другие возможные варианты включают применение аэрозолированного липосомального амфотерицина B, микафунгина и вориконазола с ТЛМ. Следует проявлять особую осторожность при одновременном применении итраконазола, посаконазола и вориконазола с винкристином и другими противоопухолевыми агентами.
Термин «вторичная химиопрофилактика» подразумевает продолжение терапии достоверно выявленных или предполагаемых ИГИ, возникших во время предыдущего курса лечения лейкоза или присутствующих при аллогенной ТГСК. Риск рецидива ИГИ при этом достигает 30-50%. Рекомендуется использовать вторичную профилактику грибковой инфекции или продлить противогрибковую терапию до тех пор, пока у пациента сохраняется гранулоцитопения или иммуносупрессия (A, II) [2].
Таким образом, инвазивная грибковая инфекция остается жизнеугрожающим состоянием у детей с гематологическими и онкологическими заболеваниями. В группе высокого риска, а именно у пациентов с острым миелоидным лейкозом, рецидивом острого лейкоза и у реципиентов после аллогенной ТГСК, следует проводить первичную противогрибковую профилактику. В рамках вторичной профилактики группой EORTC-MSG рекомендовано продолжение терапии достоверно выявленных или предполагаемых ИГИ.
Посаконазол характеризуется безопасностью, хорошей переносимостью, обнадеживающей профилактической и терапевтической активностью, в том числе против резистентных форм инвазивной грибковой инфекции.
Литература
- Epidemiology of Invasive Fungal Disease in Children Zoi Dorothea Pana, Emmanuel Roilides, Adilia Warris, Andreas H. Groll, and Theoklis Zaoutis. Journal of the Pediatric Infectious Diseases Society 2017; 6 (S1): S3-11.
- Fourth European Conference on Infections in Leukaemia (ECIL‑4): guidelines for diagnosis, prevention, and treatment of invasive fungal diseases in paediatric patients with cancer or allogeneic haemopoietic stem-cell transplantation 2014.
- Tissot F., Agrawal S., Pagona L. et al. ECIL‑6 guidelines for the treatment of invasive candidiasis, aspergillosis and mucormycosis in leukemia and hematopoietic stem cell transplant patients. Haematologica 2017; 102: 433-444.
- Fungal Infections in Pediatric Immunocompromised Patients: Epidemiology, Principles of Treatment, and Promising Antifungal Agents Joseph M. Wiley. MD J Pediatr 2010; 156: S74-82.
- Campoli P., Perlin D.S., Kristof A.S. et al. Pharmacokinetics of posaconazole within epithelial cells and fungi: insights into potential mechanisms of action during treatment and prophylaxis. J Infect Dis. 2013; 208: 1717-1728.
- Vicenzi E.B., Calore E., Decembrino N. et al. Posaconazole oral dose and plasma levels in pediatric hematology-oncology patients. Eur J Haematol. 2018; 100: 315-322.
- Doring M., Stanchi K.M., Queudeville M. et al. Efficacy, safety and feasibility of antifungal prophylaxis with posaconazole tablet in paediatric patients after haematopoietic stem cell transplantation. J Cancer Res Clin Oncol. 2017; 143: 1281-1292.
Подготовила Екатерина Марушко
Тематичний номер «Онкологія» № 2 (53), травень 2018 р.


