14 червня, 2018
Саркопения при заболеваниях печени: от механизма развития к диагностике и лечению
Саркопения (от греч. sarx – тело, плоть + penia – снижение) представляет собой атрофическое дегенеративное изменение скелетных мышц, ассоциированное с возрастом и приводящее к постепенному уменьшению мышечной массы и ее силы. Саркопению длительное время рассматривали в качестве основного компонента недостаточного питания, который является частым осложнением цирроза печени (ЦП), оказывающим неблагоприятное влияние на клиническое течение заболевания и его исходы, включая выживаемость, качество жизни и развитие других осложнений.
В настоящее время для диагностики саркопении при ЦП используют рентгенологический анализ изображений. Коррекция пищевого рациона и физическая активность с целью профилактики изменений скелетных мышц у пациентов с ЦП, к сожалению, не являются постоянно эффективными. Это связано с тем, что лежащие в ее основе молекулярные и метаболические нарушения персистируют или не подвергаются влиянию этих способов коррекции. Однако изменения в пищевых привычках, усиленный метаболизм, изменения в профиле аминокислот, эндотоксинемия, усиленное голодание и сниженная физическая активность могут вносить свой самостоятельный вклад в развитие саркопении при ЦП.
Гипераммониемию с недавнего времени стали рассматривать в качестве возможного медиатора в оси печень – мышцы. Повышенный уровень аммиака в мышцах приводит к катаплерозу α-кетоглутарата, усиленному транспорту лейцина в обмен на глутамин, нарушению передачи сигналов лейцином, усиленной экспрессии миостатина (относящегося к надсемейству трансформирующего фактора роста-β – TGF-β) и усиленному фосфорилированию эукариотического фактора инициации 2-α. Особая роль принадлежит митохондриальной дисфункции, увеличению количества активных форм кислорода, которые уменьшают синтез белка и увеличивают протеолиз, опосредованный аутофагией. Эти молекулярные и метаболические изменения могут вносить свой вклад в развитие анаболической устойчивости и неадекватного ответа на изменения пищевого рациона при ЦП. Слабость скелетных мышц способствует нарушению выносливости к нагрузкам и ответных реакций.
В связи с этим пришло время переоценить значение эндотоксинемии и микробиома кишечника у пациентов с ЦП [1]. На протяжении десятилетий недостаточное питание при заболеваниях печени использовали для описания фенотипа уменьшения массы скелетных мышц с потерей жировой массы или без нее.
Большинство пациентов с ЦП имеют атрофию скелетных мышц, или саркопению, которая является главным предиктором неблагоприятных клинических исходов (событий). Результаты последних исследований свидетельствуют о высокой распространенности саркопении у пациентов с ЦП: от 30 до 70% [2-4].
Клиническая значимость саркопении при заболеваниях печени, преимущественно ЦП, обусловлена этиологией, тяжестью и длительностью заболевания, возрастом и коморбидностью, каждый из этих факторов вносит свой вклад в развитие саркопении. Несмотря на широкое признание саркопении в качестве одного из осложнений ЦП, большинство подходов к терапии основываются на принципе замещения дефицита вместо целенаправленного лечения и, в основном, оказываются неэффективными. Пищевые добавки в последние годы находились в центре терапевтического вмешательства, так как уменьшенное употребление пищи считалось основной причиной недостаточного питания и саркопении при ЦП. Однако эти подходы часто были неэффективными и не влияли на выживаемость пациентов [5, 6].
Интегрированный молекулярно-метаболический подход показал, что гипераммониемия является медиатором в цепи печень – мышцы. Предполагалось, что физическая активность улучшает функциональную выносливость, но все еще остается не ясным ее влияние на массу скелетных мышц. В последние годы все больший интерес в аспекте изучения саркопении и ожирения проявляется к неалкогольной жировой болезни печени (НАЖБП) и ее исходам после трансплантации печени. Главной проблемой является недостаток понимания механизмов, вовлеченных в формирование саркопении при ЦП [7-9].
Диагностика саркопении при ЦП
Для идентификации уменьшения мышечной массы, прежде всего скелетных мышц, в большинстве исследований ранее использовали термин «недостаточное питание». Он был основан на одном или более критериев, которые не всегда являются однородными и точными, и изменениях в энергетическом метаболизме и потенциальном истощении жировой массы. Диагностика уменьшения мышечной массы требует анализа состава тела с использованием доступных методов – абдоминальной компьютерной томографии (КТ), магнитно-резонансной томографии (МРТ) – и применения оценочных контрольных значений для определения границ показателей, отражающих наличие саркопении. Эти методы оценки мышечной массы в настоящее время экономически неоправданы из-за их стоимости и радиационной нагрузки [4, 10, 11].
Ввиду того, что мышечная масса зависит от пола (меньше у женщин) и возраста (уменьшается с возрастом), были изучены границы показателей для пола и возраста. У больных ЦП в рутинной практике в качестве оценочного теста можно использовать силу рукопожатия (мера мышечной функции), но этот показатель может быть неточным при нормировании его относительно индекса массы тела при ЦП за счет содержания в организме флюктуирующей жидкости [12].
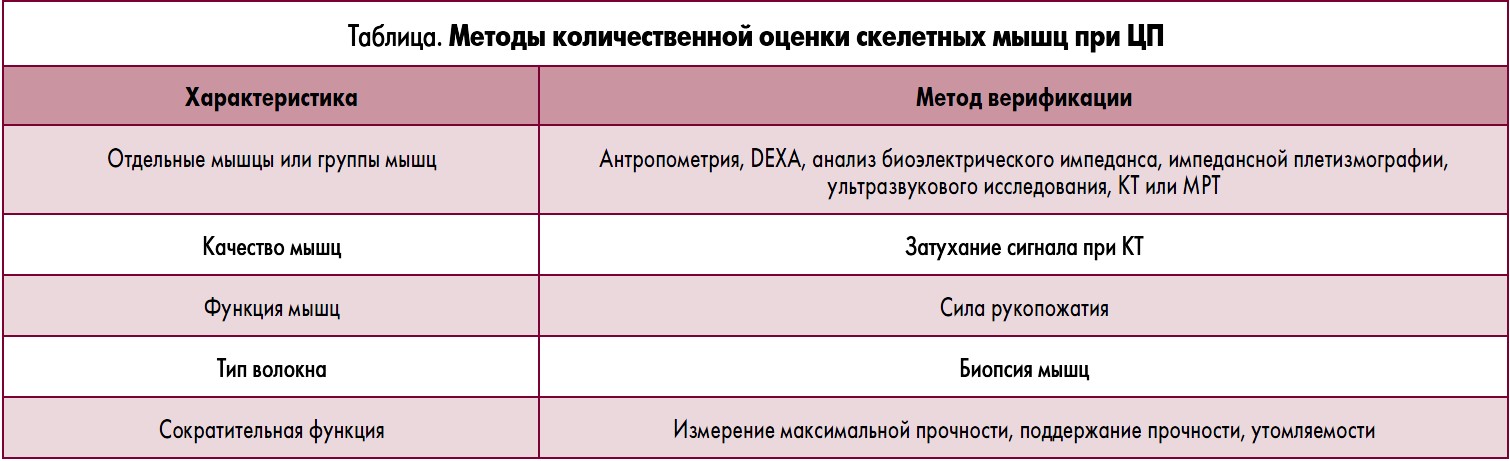
Подтверждение уменьшения мышечной массы у пациентов с ЦП требует анализа состава тела с использованием одного или нескольких доступных методов (табл.).
Клиническое влияние саркопении при ЦП
Учитывая, что средняя выживаемость и вероятность выживаемости ниже у пациентов с ЦП в комбинации с саркопенией, чем без нее, предполагают, что саркопения должна входить в оценочную систему прогностических показателей для терминальной стадии заболевания печени. Это обусловлено тем, что наличие саркопении повышает риск развития инфекции и энцефалопатии у пациентов с ЦП. Саркопения может вызывать нарушения функции диафрагмы, а это в свою очередь – способствовать развитию легочных осложнений [3, 4, 11].
Показано, что смертность, связанная с сепсисом, выше у больных с саркопенией, чем без нее [4, 13]. Для соответствующего ответа со стороны антител и цитокинов необходимо адекватное потребление аминокислот, чего не наблюдается при уменьшении массы скелетных мышц. Предполагается, что факторы, вызывающие саркопению, в частности гормональные и биохимические расстройства, а также циркулирующие эндотоксины, могут способствовать нарушению иммунной функции и повышению риска инфекции. Могут также играть роль снижение физической активности и эмоциональная неустойчивость при саркопении у пациентов с ЦП. Примечательно, что больные ЦП с рефрактерным асцитом оказываются особенно склонными к недостаточному питанию и саркопении [14, 15]. Известно, что асцит увеличивает расход энергии покоя, тогда как потребление пищи снижено из-за повышенного абдоминального давления и раннего насыщения. Показано, что лечение рефрактерного асцита при помощи трансъюгулярного внутрипеченочного портосистемного шунтирования улучшает качественный состав тела у хронических больных с недостаточным питанием [16, 17].
Качество жизни пациентов с ЦП и саркопений существенно ниже, чем без нее. Первопричина этого продолжает обсуждаться. Ряд исследователей ссылаются на уменьшение мышечной массы, другие утверждают, что в основе снижения качества жизни таких пациентов является нарушение контрактильной функции и последующее ограничение подвижности в сочетании с повышенным риском развития других осложнений. Эта проблема все еще требует проведения хорошо организованных исследований. Все аспекты качества жизни у больных с недостаточным питанием хуже, если используются показатели для первоначальной количественной оценки массы скелетных мышц [2, 5].
Гепатоцеллюлярная карцинома является частым осложнением обычного течения хронических заболеваний печени, и в недавних исследованиях было показано, что саркопения является независимым прогностическим фактором, снижающим выживаемость и повышающим смертность больных с гепатоцеллюлярной карциномой [15, 18, 19].
В настоящее время трансплантация печени является методом выбора в лечении заболеваний печени в терминальной стадии, и саркопения неблагоприятно влияет на исходы у больных в предтрансплантационный, трансплантационный и посттрансплантационный период. У пациентов с ЦП и наличием саркопении перед трансплантацией выживаемость ниже; после трансплантации отмечается увеличение времени госпитализации, пребывания в палате интенсивной терапии и затяжной период интубации по сравнению с таковыми у пациентов без саркопении [20].
Важно подчеркнуть, что клинические исходы у пациентов с ЦП также зависят от множества факторов, но саркопения признана главным «виновником» неблагоприятных исходов после трансплантации печени у таких больных.
Механизмы уменьшения скелетных мышц при ЦП
Нарушения метаболизма белка, утилизации энергии и другие метаболические нарушения вызывают истощение у больных ЦП
Скелетные мышцы – основное хранилище белка в человеческом организме. Масса скелетных мышц поддерживается за счет баланса между синтезом белка, его распадом и регенеративными процессами, которые регулируются функцией мышечных клеток-сателлитов [2-4, 21]. Два направления в исследованиях внесли свой вклад в понимание патогенеза саркопении при ЦП: кинетика исследования метаболизма и изучение молекулярного сигнального пути. Интегрированный подход, основанный на обеих стратегиях, объясняющих, как метаболические расстройства изменяют молекулярные сигналы и наоборот, позволил идентифицировать новые потенциальные терапевтические цели [22].
Противоречивые сведения о процессах распада и синтеза белка у пациентов с ЦП объясняются гетерогенностью методов определения белкового метаболизма, различиями в этиологии и длительности заболевания, а также в возрасте пациентов с ЦП, включенных в исследования по количественной оценке синтеза и распада белка в скелетных мышцах.
Очевидно одно: согласно результатам непрямой калориметрии, ЦП является состоянием повышенного голодания из-за того, что окисление жирных кислот и глюконеогенез рано повышаются в постабсорбционном состоянии и натощак, так как глюкоза является предпочтительным субстратом для многих тканей и углерод жирных кислот не может использоваться для глюконеогенеза, для его осуществления используются аминокислоты [23-26].
Первичным источником аминокислот для глюконеогенеза является протеолиз в скелетных мышцах, в процессе которого образуются ароматические аминокислоты с разветвленными цепями (ААРЦ). Только такие аминокислоты подвергаются катаболизму в скелетных мышцах благодаря расположению разветвленной кетодегидрогеназы и окислению углерода скелета в качестве источника энергии. Как следствие, концентрация ароматических аминокислот с разветвленными цепями в плазме крови ниже у больных ЦП. В противовес этому ароматические аминокислоты с разветвленными цепями первично метаболизируются в печени, но вследствие портосистемного шунтирования и гепатоцеллюлярной дисфункции их концентрация в плазме крови при хронических заболеваниях печени возрастает. Таким образом, повышенное голодание и усиление глюконеогенеза являются биоэнергетическими нарушениями у пациентов с ЦП и явлениями саркопении, что поддерживается низким дыхательным коэффициентом [22, 24, 27]. Заметим, что в настоящее время большинство подходов к терапии фокусируется на устранении дисбаланса аминокислот, а не на прицельном влиянии на механизмы, которые способствуют таким нарушениям, что в результате может приводить к развитию саркопении [26].
Потенциальные медиаторы в цепи печень – мышцы при ЦП
Одной из основных причин ограниченного понимания саркопении при ЦП остается сложность определения медиаторов оси печень – мышцы. Был предложен ряд потенциальных медиаторов, включающий повышенный уровень аммиака, сниженный уровень тестостерона, гормона роста и эндотоксемия [29-33]. Несмотря на существование доказательств в пользу каждого из потенциальных медиаторов, гипераммониемия изучалась наиболее широко.
Одной из важных метаболических функций печени является преобразование аммиака в мочевину. Гепатоцеллюлярная дисфункция и портосистемное шунтирование как компоненты патофизиологических изменений при ЦП способствуют нарушению образования мочевины [34]. Аммиак образуется при помощи ряда механизмов, включающих метаболизм аминокислот, пуринов, активацию глутаминазы энтероцитов и уреализиса в кишечнике. Наиболее хорошо изученным цитотоксическим эффектом аммиака является нейротоксичность [29]. Независимые исследователи сообщают о повышенном поглощении аммиака скелетными мышцами и преобразовании его в глутамат и глутамин у пациентов с заболеваниями печени. Несмотря на признанное цитотоксическое влияние аммиака на нейроны и астроциты, эффекты, производимые на скелетные мышцы, только недавно попали в фокус заинтересованности исследователей. Исследования на человеческих скелетных мышцах, гипераммониемических портокавальных анастомозах у крыс, мышей, имеющих гипераммониемию, и исследования на культуре мышечных трубочек in vitro дают возможность предположить, что аммиак накапливается в скелетных мышцах и активирует программу молекулярных изменений, способствующих развитию саркопении. Несмотря на недостаточную изученность механизмов входа аммиака в скелетные мышцы, на лабораторных моделях показано, что в мышцах экспрессируются переносчики аммиака – белки Rh B и C. Их посредством происходит проникновение аммиака в мышечную ткань, где он активирует ряд сигнальных реакций, точные механизмы которых до конца не изучены [28, 32].
Гипераммониемия – фактор истощения мышечной ткани: внутриклеточные сигналы
Показано, что реакцией на опосредованную гипераммониемией активацию p65-NF-kB в мышечных трубочках лабораторных животных и культурах клеток является экпрессия миостатина, входящего в надсемейство TGF-β [28, 35, 36]. Сообщается о повышенной экспрессии миостатина в скелетных мышцах и плазме крови у больных ЦП.
Миостатин – известный ингибитор синтеза белка и потенциальный активатор протеасом убиниктина и протеолиза, опосредованного аутофагией. Убиниктин-опосредованный протеолиз не активируется, но аутофагия усиливается в мышцах экспериментальных моделей и при гипераммониемии. Другие потенциальные механизмы активации аутофагии включают аммиак-опосредованную митохондриальную дисфункцию и образование активных форм кислорода. Хотя подобные молекулярные сигнальные реакции отмечались только в нервной ткани, похожие нарушения могут иметь место и в скелетных мышцах [28, 34, 36].
Примечательно, что в предварительных данных все больше признают метаболический ответ скелетных мышц на гипераммониемию. Физиологически глутамин и глутамат служат в качестве субстратов при образовании α-кетоглутарата (α-КГ) и аммиака в большинстве тканей для поддержания достаточных концентраций промежуточных соединений в цикле трикарбоновых кислот (ЦТК). Эта реакция катализируется двунаправленным ферментом глутаматдегидрогеназой и преимущественно протекает в направлении образования α-КГ [31].
Однако при ЦП в связи с нарушением образования мочевины и снижением выделения аммиака печенью скелетные мышцы функционируют в качестве метаболического партнера печени, и концентрация аммиака в скелетных мышцах намного выше, что потенциально способствует катаплерозу или потере промежуточного соединения ЦТК α-КГ. Это обусловливает ряд потенциальных последствий, включающих замедленное течение ЦТК, нарушение митохондриальной функции и снижение синтеза аденозинтрифосфата (АТФ). Так как синтез белка, особенно трансляция и инициация, является энергоемким процессом, низкие концентрации АТФ также могут вызвать замедление синтеза белка [28].
Другое последствие гипераммониемии, которое может объяснить ряд клинических наблюдений, включает подавление аммиаком в тканях оксодегидрогеназ (пируватдегидрогеназы, которая катализирует превращение пирувата в ацетил-коэнзим А (СоА), и α-КГ дегидрогеназы, катализирующей превращение α-КГ в сукцинил-СоА [22]).
В ряде клинических исследований и метаанализов не удалось показать значительную пользу коррекции пищевого рациона пациентов с ЦП и саркопенией посредством использования пищевых добавок. Возможно, это обусловлено нарушением образования ацетил-СоА, которое делает необходимым образование ацетил-СоА из непируватных источников, включающих аминокислоты и жирные кислоты. Продолжительная митохондриальная дисфункция, образование активных форм кислорода и нарушенная биоэнергетика в скелетных мышцах способствуют нарушению синтеза белка и активируют адаптивный метаболический ответ и аутофагию [37-39].
Снижение уровня АТФ в мышцах, нарушенная митохондриальная функция, низкие концентрации промежуточных соединений ЦТК, усиление глюконеогенеза и окисления жирных кислот в скелетных мышцах при гипераммониемии создают условия для биоэнергетического кризиса с последующим истощением реакций. Уменьшение количества клеточной АТФ ассоциируется с активацией 5-аденозинмонофосфат-активированной белковой киназы и нарушением сигнализирования mTORC1 [22].
Усиление катаплероза и мышечного катаболизма аминокислот с разветвленной цепью в качестве источника энергии может быть ответственным за уменьшение циркулирующих аминокислот с разветвленной цепью при сниженных концентрациях ААРЦ в мышцах больных ЦП из-за усиленного их использования. Снижение концентрации клеточных аминокислот активирует адаптивные реакции, которые включают усиление аутофагии скелетных мышц, наблюдающейся в мышечных трубочках при ЦП и гипераммониемии. Еще одной реакцией на недостаток внутриклеточных аминокислот является интегрированный стрессовый ответ, опосредованный активацией дефицита аминокислот. Удивительно, что в большинстве исследований сообщалось о том, что концентрации ААРЦ в скелетных мышцах не изменяются, кроме одного исследования, в котором отмечались сниженные концентрации ААРЦ в мышцах [40, 41].
Предполагается, что L-цитруллин, который является предшественником L-аргинина, стимулирует mTORC1 и синтез белка. Полезные эффекты цитруллина, как полагают, обусловлены его потенциальной возможностью снижать образование мочевины. Однако не известно, насколько нарушение образования мочевины может влиять на гипераммониемию у пациентов с ЦП и саркопенией [6, 28].
Предполагают, что гипераммониемия является медиатором в оси печень – мышцы, и скелетные мышцы не функционируют только как метаболический резервуар для аммиака [28]. При ЦП с явлениями саркопении поглощение и удаление аммиака происходит при помощи синтеза глутамина в мышцах и его транспорта в циркулирующую кровь. В то же время если масса мышц низка, нарушается внепеченочное удаление аммиака, что может привести к дальнейшим неблагоприятным эффектам/событиям. Все больше исследователей сообщают о том, что энцефалопатия у больных ЦП с саркопенией встречается чаще, чем при ее отсутствии [6].
Другие потенциальные медиаторы оси печень – мышцы при ЦП: тестостерон, гормон роста
Другие медиаторы оси печень – мышцы включают низкий уровень тестостерона из-за повышения активности ароматазы при заболеваниях печени, в том числе ЦП. Вероятно, факторами, способствующими возникновению саркопении при ЦП, также являются снижение концентрации гормона роста и нарушение реакции гормона роста на мышечный ответ [33]. Известно, что оба гормона – гормон роста и тестостерон – подавляют экспрессию миостатина и сигнальные реакции, но продолжается изучение их вклада в нарушение синтеза белка и снижение экспрессии миостатина при ЦП [36]. В одном из рандомизированных контролируемых исследований было показано, что применение тестостерона у мужчин с ЦП привело к увеличению массы тела, но не к увеличению выживаемости [33].
Гепатоцеллюлярная и иммунная дисфункция, так же как и портосистемное шунтирование, усугубляют эндотоксемию за счет нарушения функции кишечного барьера и потенциально изменяют микробиом кишечника при ЦП. Эндотоксемия также может нарушать синтез белка через пути метаболизма, связанные и потенциально не зависящие от фактора некроза опухоли, и активировать аутофагию.
Интересные факты получены в одном из исследований о так называемом саркопеническом ожирении у пациентов с НАЖБП и после трансплантации печени. Возможно, что сочетание уменьшения скелетной мышечной ткани и увеличения жировой массы может способствовать развитию метаболических нарушений, включающих инсулинорезистентность, сахарный диабет, гиперлипидемию и вероятную НАЖБП. Но существуют ли общие механизмы, лежащие в основе саркопении и ожирения, пока не известно [42-44].
Стратегии лечения
Накоплено достаточно доказательств о том, что саркопения связана с неблагоприятными исходами ЦП. При этом остается ограниченное количество данных в пользу того, что увеличение массы скелетных мышц улучшает выживаемость у пациентов с ЦП после трансплантации и у тех, которые не подвергались трансплантации. В связи с этим приоритетной целью терапевтических вмешательств у больных ЦП является возвращение первоначальной мышечной массы [45-47].
Вмешательства, которые фокусировались только на возмещении дефицита, в общем оказались неэффективными, тогда как целенаправленные методы терапии имели потенциал восстановления мышечной массы. Основные стратегии, которые используются для увеличения мышечной массы, включают употребление дополнительных калорий и белка, усиление физической активности, дополнительную гормонотерапию и таргетные методы лечения [2, 21, 37, 38].
Используя совокупные эффекты терапии, направленные на возвратное развитие саркопении, важно понимать физиологию скелетных мышц, которая включает максимальную контрактильную (сократительную) силу, поддержание сокращения и мышечную слабость в ответ на длительное и повторяющееся сокращение. Поэтому разработка таргетной терапии может существенно повлиять на конечные точки оценки такого осложнения, как саркопения, у пациентов с ЦП [27].
Дополнительное питание
Так как потребление калорий и белка при ЦП часто снижено, имеющиеся руководства и консенсусы рекомендуют обеспечивать достаточное количество калорий и белка за счет частого приема пищи, соответствия потребления белка с пищей потребностям в нем или, при необходимости, энтерального и парентерального питания. Широко изучались режимы, обеспечивающие поступление дополнительных калорий за счет высококалорийного и/или энтерального питания. К сожалению, пока не получены достоверные данные о влиянии адекватного пищевого обеспечения на клинические исходы пациентов с ЦП и саркопенией [48-51].
Еще одной точкой приложения в терапии данной категории пациентов явилось влияние на сокращение длительности постабсорбционного периода или состояния голода при ЦП из-за усиленного голодания, в результате чего возникает протеолиз (после приема пищи восстановление мышечной массы происходит не полностью) [52]. Были оценены эффекты приема пищи в течение дня и в ночное время. Оказалось, что поздний вечерний прием пищи обеспечивает наиболее полезные эффекты, и в настоящее время считается, что употребление белка поздно вечером и рано утром наиболее эффективно в предотвращении уменьшения мышечной ткани у пациентов с ЦП. К сожалению, недавно проведенные метаанализы не демонстрируют улучшение выживаемости пациентов с ЦП и саркопенией, у которых анализировали влияние пищевых добавок в качестве дополнительного источника питания. Объяснением этому может служить тот факт, что на этапе формирования ЦП организм приобретает свойства анаболической резистентности, и употребление только лишь калорий оказывается недостаточным. Несмотря на обеспечение калориями, потенциальными причинами недостаточного эффекта пищевых добавок становятся нарушенная митохондриальная функция и биоэнергетика в сочетании с нарушением молекулярных реакций на введение нутриентов в мышцы [26, 53, 54].
Обеспечение белком является еще одной альтернативой для улучшения доступности эссенциальных аминокислот. Однако ЦП и гипераммониемия могут увеличивать катаболизм аминокислот с последующим образованием аммиака в скелетных мышцах. Последний может нарушать синтез белка и увеличивать аутофагию при слабом эффекте в отношении обратного развития саркопении либо вообще при отсутствии такового.
Животные белки употреблять не рекомендуется из-за того, что они богаты ароматическими аминокислотами, которые не метаболизируются скелетными мышцами и могут усугубить энцефалопатию. Растительные белки богаты ААРЦ и могут оказывать полезный эффект: удаление 1 моля аммиака на 1 моль ААРЦ посредством метаболизма α-KG→глутамат→глутамин. В недавнем обзоре Кокрановской базы данных высказывается предположение о пользе ААРЦ в профилактике печеночной энцефалопатии, но не в отношении выживаемости, качества жизни и состава тела [23-25].
Еще один механизм, посредством которого могут действовать ААРЦ, – это подавление дефицита аминокислот, GCN2 и обратного фосфорилирования eIF2-α, нарушения синтеза белка и увеличение мышечной массы. При этом лейцин непосредственно активирует mTORC1, который стимулирует синтез белка и снижает аутофагию; оба последних фактора имеют потенциал в восстановлении мышечной массы [22].
В недавних исследованиях, посвященных ЦП, сообщается, что комбинация ААРЦ, обогащенная лейцином, способна обратно влиять на молекулярные расстройства потока миостатина в скелетных мышцах у больных ЦП. Кинетические исследования с прямым количественным подсчетом синтеза белка в мышцах показали, что схожие коэффициенты синтеза белка в ответ на введение одной дозы комбинации ААРЦ, обогащенной лейцином, обратимо влияют на нарушенный синтез белка, опосредованный GCN2-eIF2-α, и увеличивает активацию сигнальных путей mTORC1. Эти данные подтверждают молекулярные расстройства в скелетных мышцах при ЦП и совместно с данными, полученными у лабораторных животных и культурах клеток in vitro, демонстрируют роль гипераммониемии в качестве медиатора оси печень – мышцы.
Упражнения и физическая активность
Тип упражнений определяет ответ со стороны скелетных мышц [54]. Упражнения на сопротивление увеличивают массу скелетных мышц путем стимуляции их повреждения и регенерации, а также синтеза белка. Упражнения на выносливость улучшают функциональную способность, но не обязательно влияют на саркопению [52]. Комбинация упражнений на выносливость и сопротивление имеет потенциал в отношении увеличения мышечной массы и ее функциональной способности (имеются немногочисленные данные о краткосрочном улучшении в ответ на применение упражнений), но необходимо проведение посвященных этому вопросу масштабных рандомизированных контролируемых исследований. Учитывая отсутствие сравнительных исследований по эффективности физической нагрузки у здоровых лиц и у больных ЦП, невозможно определить, наблюдается ли анаболическая резистентность к пищевым продуктам при выполнении физических упражнений. Существует доказательство того, что протеинкиназа Cf-фосфатидиновой кислоты опосредует преобразование сигнала механической активности в сигнальный ответ путем активации сигнализирования mTORC1 и синтеза белка. Однако не известно, угнетаются ли эти физиологические реакции при ЦП и является ли аммиак медиатором «сниженных ответов» [27].
Анаболические гормоны
Тестостерон и гормон роста ранее использовали для улучшения нутритивного статуса и увеличения мышечной массы при ЦП, но они не были эффективными в течение длительного времени. Повышение активности ароматазы вносит свой вклад в превращение тестостерона в эстрадиол, что снижает его эффект. Следовательно, андрогены, устойчивые к ароматазе, такие как оксандролон, могут быть полезными, но в клинической практике это пока не нашло подтверждения. Недостаточность терапевтического эффекта при гормональном замещении, вероятно, обусловливается нарушением сигнальных реакций, включающих поток андрогенов в ответ на mTORC1. Могут вносить свой вклад в недостаточную эффективность такой терапии и рецепторы гормона роста [33]. Понимание молекулярных и метаболических нарушений в скелетных мышцах не только помогает объяснить недостаточную эффективность возможных методов терапии, но также, вероятно, может помочь определить новые специфические терапевтические цели для предотвращения развития саркопении.
Стратегии, направленные на снижение уровня аммиака
Существующие методы снижения уровня аммиака включают введение неабсорбируемых дисахаридаз и антибиотиков для предотвращения образования аммиака в кишечнике [55]. Приоритетная цель этих видов терапии – это устранение энцефалопатии и снижение уровня аммиака в крови. Однако хорошо известно, что концентрация аммиака в крови не всегда коррелирует с тяжестью энцефалопатии, наиболее изученной реакции на гипераммониемию [56]. Временное снижение уровня аммиака необязательно быстро снизит уровень аммиака в мышцах или будет способствовать обратному развитию метаболических и молекулярных нарушений. Необходимы исследования стратегий долгосрочного снижения уровня аммиака, определения концентрации аммиака в мышцах и сигнальных реакций на эти вмешательства, прежде чем такой подход будет использован для обратимого влияния на уменьшение мышечной ткани и нарушение сократительной функции. Новые потенциально полезные методы снижения уровня аммиака в мышцах включают использование проникающих в клетку сложных эфиров α-KG, которые способствуют удалению аммиака в виде глутамина. Однако удаление глутамина в таком случае будет ограниченным, и необходима разработка способов терапии, направленных на долгосрочное удаление аммиака для защиты скелетных мышц [30, 31].
К новым таргетным стратегиям лечения саркопении при ЦП следует отнести применение антагонистов миостатина, прямых активаторов mTORC1, антиоксидантов, молекул, защищающих митохондрии, которые имеют большой потенциал, влияющий на функциональную активность в скелетных мышцах [22, 26].
В заключение следует отметить: существуют неоспоримые доказательства того, что саркопения является основным осложнением ЦП и неблагоприятно влияет на исход этого заболевания. Подтверждения того, что саркопения может быть обратимой, очень ограничены, и не ясно, действительно ли обратное развитие саркопении улучшает исход и прогноз. Пищевые добавки не обеспечивают стойкий эффект в улучшении выживаемости пациентов, но длительное применение ААРЦ с лейцином является многообещающим видом терапии для профилактики и лечения саркопении при ЦП. Долгосрочное снижение уровня аммиака в мышцах, новые подходы к повышению эффективности нейтрализации аммиака мышцами, стратегии, направленные на блокаду миостатина, имеют хороший потенциал. Идентификация молекулярных и метаболических расстройств в скелетных мышцах при ЦП позволит развивать таргетные виды терапии, которые, несомненно, позволят противостоять анаболической резистентности у этих пациентов.
Литература
1. Bajaj J.S., Heuman D.M., Hylemon P.B., Sanyal A.J., White M.B., Monteith P. et al. Altered profile of human gut microbiome is associated with cirrhosis and its Complications // J Hepatol. – 2014. – Vol. 60. – P. 940-947.
2. Periyalwar P., Dasarathy S. Malnutrition in cirrhosis: contribution and consequences of sarcopenia on metabolic and clinical responses // Clin Liver Dis. – 2012. – Vol. 16. – P. 95-131.
3. Tandon P., Ney M., Irwin I. et al. Severe muscle depletion in patients on the liver transplant wait list: its prevalence and independent prognostic value // Liver Transpl. – 2012. – Vol. 18. – P. 1209-1216.
4. Montano-Loza A.J., Meza-Junco J., Prado C.M. et al. Muscle wasting is associated with mortality in patients with cirrhosis // Clin Gastroenterol Hepatol. – 2012. – Vol. 10. – P. 166-173.
5. Shiraki M., Nishiguchi S., Saito M. et al. Nutritional status and quality of life in current patients with liver cirrhosis as assessed in 2007-2011 // Hepatol Res. – 2013. – Vol. 43. – P. 106-112.
6. Merli M., Giusto M., Lucidi C. et al. Muscle depletion increases the risk of overt and minimal hepatic encephalopathy: results of a prospective study // Metab Brain Dis. – 2013. – Vol. 28. – P. 281-284.
7. Jones J.C., Coombes J.S., Macdonald G.A. Exercise capacity and muscle strength in patients with cirrhosis // Liver Transpl. – 2012. – Vol. 18. – P. 146-151.
8. Hong H.C., Hwang S.Y., Choi H.Y. et al. Relationship between sarcopenia and nonalcoholic fatty liver disease: the Korean Sarcopenic Obesity Study // Hepatology. – 2014. – Vol. 59. – P. 1772-1778.
9. Choudhary N.S., Saigal S., Saraf N. et al. Sarcopenic obesity with metabolic syndrome: a newly recognized entity following living donor liver transplantation // Clin Transplant. – 2015. – Vol. 29. – P. 211-215.
10. Giusto M., Lattanzi B., Albanese C. et al. Sarcopenia in liver cirrhosis: the role of computed tomography scan for the assessment of muscle mass compared with dual-energy X-ray absorptiometry and anthropometry // Eur J Gastroenterol Hepatol. – 2015. – Vol. 27. – P. 328-334.
11. Cruz-Jentoft A.J., Baeyens J.P., Bauer J.M. et al. Sarcopenia: European consensus on definition and diagnosis: Report of the European Working Group on Sarcopenia in Older People // Age Ageing. – 2010. – Vol. 39. – P. 412-423.
12. Schiaffino S., Reggiani C. Fiber types in mammalian skeletal muscles // Physiol Rev. – 2011. – Vol. 91. – 1447-1531.
13. Dasarathy S. Consilience in sarcopenia of cirrhosis // J Cachexia Sarcopenia Muscle. – 2012. – Vol. 3. P. 225-237.
14. Yende S., Iwashyna T.J., Angus D.C. Interplay between sepsis and chronic Health // Trends Mol Med. – 2014. – Vol. 20. – P. 234-238.
15. Meza-Junco J., Montano-Loza A.J., Baracos V.E. et al. Sarcopenia as a prognostic index of nutritional status in concurrent cirrhosis and hepatocellular carcinoma // J Clin Gastroenterol. – 2013. – Vol. 47. – P. 861-870.
…
56. Okuda H., Shiratori K. Long-term nutritional assessment and quality of life in patients with cirrhosis taking a late evening snack // J Gastroenterol. – 2007. – Vol. 42. – P. 186-187.
Полный список литературы находится в редакции.
Тематичний номер «Гастроентерологія. Гепатологія. Колопроктологія» № 2 (48), травень 2018 р.