22 червня, 2018
XXII Международная конференция Украинской противоэпилептической лиги «Эпилепсия – окно для познания головного мозга: что нового»
17-19 мая в г. Днепре состоялась XXII Международная конференция Украинской противоэпилептической лиги (УПЭЛ) «Эпилепсия – окно для познания головного мозга: что нового». Мероприятие собрало неврологов, психиатров, нейрофизиологов, нейрохирургов, детских неврологов и психиатров из Украины и из-за рубежа для обсуждения наиболее актуальных проблем эпилепсии и других пароксизмальных состояний, их диагностики и лечения. Большой интерес слушателей вызвала секция, на которой были представлены видеодоклады c президентского симпозиума Международной противоэпилептической лиги (ILAE).
Участников конференции приветствовали президент УПЭЛ, ведущий научный сотрудник ГУ «Институт неврологии, психиатрии и наркологии НАМН Украины» (г. Харьков), доктор, медицинских наук профессор Андрей Евгеньевич Дубенко; член-корреспондент НАМН Украины, заведующая кафедрой нервных болезней и нейрохирургии ГУ «Днепропетровская медицинская академия МЗ Украины» (г. Днепр), доктор медицинских наук, профессор Людмила Антоновна Дзяк, а также вице-президент УПЭЛ, заведующий лечебно-диагностическим центром «Эпилепсия» Территориального медицинского объединения (ТМО) «Психиатрия» в г. Киеве департамента здравоохранения Киевской городской государственной администрации (ДЗ КГГА), кандидат медицинских наук Сергей Михайлович Харчук. Они отметили участие в конференции коллег не только из Украины, но и из США, Израиля, Канады, Польши, Финляндии, Казахстана, Беларуси, и выразили уверенность, что мероприятие традиционно станет площадкой плодотворного общения профессионалов.
.jpg) С лекцией «Коморбидные профили эпилепсии» перед участниками конференции выступила профессор Л.А. Дзяк.
С лекцией «Коморбидные профили эпилепсии» перед участниками конференции выступила профессор Л.А. Дзяк.
Докладчик охарактеризовала эпилепсию как заболевание с разнообразными индивидуальными клиническими проявлениями, что в значительной степени объясняется различными вариантами коморбидности. Коморбидные расстройства при эпилепсии включают нейропсихиатрические и кардиальные нарушения, инфекции, неопластические процессы, цереброваскулярные и нейродегенеративные заболевания.
Установлено, что у пациентов с когнитивными нарушениями, судорожными приступами и болезнью Альцгеймера аберрантная активность возбуждающих нейронов является первичным механизмом формирования причинной коморбидности (J.J. Palop, L. Mucke, 2009).
Коморбидные состояния усложняют диагностику и лечение эпилепсии; кроме того, противоэпилептические препараты (ПЭП) могут негативно влиять на сопутствующие заболевания, и наоборот: препараты, используемые для терапии сопутствующих состояний, способны ухудшать течение эпилепсии.
Известно, что у лиц с хроническим течением эпилепсии и некупируемыми эпилептическими приступами (ЭП) увеличивается выраженность когнитивного дефицита; в частности, фокальные ЭП влияют на память. Помимо этого, некоторые ПЭП оказывают неблагоприятный эффект на поведенческую и когнитивную сферы.
Лектор привела данные исследования SANAD (2009), согласно которым пациенты с манифестацией эпилепсии имели более низкие показатели при выполнении нейропсихологических тестов до начала лечения ПЭП, в том числе в тех случаях, когда тестированию предшествовали всего несколько ЭП. При этом в 54% случаев нарушения памяти, обработки информации, исполнительных функций и функций организации носили прогрессирующий характер.
Наиболее часто встречаемое сопутствующее состояние у пациентов с эпилепсией – депрессия (32,5% пациентов) (C. Helmstaedter et al., 2014). Данное состояние требует обязательной коррекции и правильного выбора препаратов – как противоэпилептических, так и антидепрессантов.
В ассоциации с эпилепсией описаны три вида головной боли: эпилептическая гемикрания, мигрень с аурой, постиктальная головная боль. Мигрень среди пациентов с эпилепсией встречается вдвое чаще (12,4%), чем в общей популяции (6%). Имеются данные об общих патофизиологических механизмах мигрени и эпилепсии, в частности дисфункции ионных каналов (Na+/K+-АТФаза) (Dong Wook Kim, Sang Kun Lee, 2017).
Л.А. Дзяк сообщила, что на основе современных данных выдвинута гипотеза «эссенциальной коморбидности», согласно которой эпилепсия и коморбидные расстройства – нейроповеденческие, когнитивные, психиатрические, социальные – имеют общие механизмы развития (M.R. Keezer et al., 2015). Так, лица с когнитивным дефицитом относятся к группе риска манифестации эпилепсии (риск – 15%).
Доказана взаимосвязь между эпилепсией и аутизмом: более чем в 50% случаев аутизм наблюдался до манифестации эпилепсии (M.Z. Megdad, 2014). Обнаружена генетическая общность эпилепсии, шизофрении, аутизма, интеллектуального дефицита.
 При обсуждении современных возможностей лечения эпилепсии группа авторов под руководством президента УПЭЛ А.Е. Дубенко (авторы: А.Е. Дубенко, С.А. Сазонов, Ю.А. Бабкина, В.И. Смоланка, М.М. Орос, В.В. Грабар) представила отчет о применении ПЭП в Украине по данным электронного регистра.
При обсуждении современных возможностей лечения эпилепсии группа авторов под руководством президента УПЭЛ А.Е. Дубенко (авторы: А.Е. Дубенко, С.А. Сазонов, Ю.А. Бабкина, В.И. Смоланка, М.М. Орос, В.В. Грабар) представила отчет о применении ПЭП в Украине по данным электронного регистра.
А.Е. Дубенко сообщил, что в 2015 г. в Украине разработан электронный регистр больных эпилепсией. Компьютерная программа «Регистрационная карта пациента с эпилептическими приступами» разработана для сбора, накопления и обработки данных о пациентах с эпилепсией с сохранением анонимности последних.
Регистр содержит данные о медико-социальном статусе пациента, клинических особенностях заболевания, форме эпилепсии, причинах болезни (при симптоматической форме), типе ЭП в соответствии с классификацией ILAE (запланирован переход на классификацию ILAE‑2017), общей частоте ЭП.
Фиксируются также результаты инструментальных исследований (электроэнцефалография – ЭЭГ, томография) и особенности лечения: фармакотерапия с указанием дозировок ПЭП, при отмене ПЭП – ее причины, сведения о хирургическом лечении.
В работе регистра уже приняли участие специалисты-неврологи из двух «пилотных» регионов. К концу 2017 г. среди взрослых пациентов были собраны данные о 1142 пациентах в Харьковской и 743 пациентах в Закарпатской области.
Лектор отметил, что и в Закарпатской, и в Харьковской областях среди ЭП превалируют первично-генерализованные – 35,2 и 45,5% соответственно; на втором месте по распространенности – фокальные ЭП с вторичной генерализацией – 32,3 и 21,8%; на третьем – фокальные приступы – 27,7 и 16,8% соответственно. В Харьковском регионе преобладают симптоматическая и криптогенная формы эпилепсии, на последней позиции – идиопатическая.
В Закарпатье доминирует криптогенная форма эпилепсии, затем – идиопатическая, на третьем месте – симптоматическая. Среди причин симптоматической эпилепсии в Харьковской области чаще всего регистрируются черепно-мозговые травмы (ЧМТ) и инфекции центральной нервной системы. В Закарпатском регионе наиболее частыми причинами являются инсульты.
А.Е. Дубенко отметил существенные различия в назначении ПЭП: в Харьковском регионе первое место по частоте назначений занимает карбамазепин (46%), далее – препараты вальпроевой кислоты (18%), затем – бензобарбитал (12%), тогда как в Закарпатье доминируют назначения бензобарбитала (46%) и карбамазепина (40%).
Это означает, что значительная доля больных лечится карбамазепином, тогда как доля назначений «новых» ПЭП незначительна и, очевидно, в большинстве случаев врачи не используют дифференцированный подход при выборе ПЭП.
Частое назначение карбамазепина в Украине выглядит еще более показательным при сравнении с другими странами Европы. В развитых европейских странах специалисты активно назначают ПЭП нового поколения, в частности леветирацетам – современный препарат с выраженным противосудорожным эффектом, который не метаболизируется печенью, подавляет вспышки эпилептиформной активности, не оказывает влияние на нормальную нейрональную возбудимость и нейротрансмиссию.
 Анализ фармакологического лечения эпилепсий и применения ПЭП у взрослых провел вице-президент УПЭЛ С.М. Харчук.
Анализ фармакологического лечения эпилепсий и применения ПЭП у взрослых провел вице-президент УПЭЛ С.М. Харчук.
Докладчик акцентировал внимание на том, что до 75% больных эпилепсией достигают контроля над ЭП (A.G. Marson et al., 2007), при этом особенно важен адекватной выбор стартовой терапии. Так, известно, что у пациентов с выявленной впервые эпилепсией и отсутствием замены ПЭП уровень достижения контроля ЭП составлял 48%, после однократной замены ПЭП – 35%, после 2-5 замен ПЭП – 18%, а после 6-7 замен ПЭП свободы от ЭП не наблюдалось (Y. Schiller et al., 2008).
С.М. Харчук перечислил основные принципы успешной стартовой терапии эпилепсии: назначение ПЭП в соответствии с типом ЭП и формой эпилепсии; принятие во внимание возможности аггравации ЭП под влиянием ПЭП; назначение адекватных доз ПЭП; учет побочных эффектов ПЭП; регулярность приема ПЭП; необходимость длительного непрерывного приема эффективного ПЭП; приоритет в использовании брендов и качественных генериков; внимание к социально-экономическим факторам.
Эти принципы отражены в Унифицированном клиническом протоколе «Эпилепсии у взрослых» (приказ МЗ Украины от 17.04.2014 г. № 276) и руководстве ILAE. Указывается, в частности, что карбамазепин, окскарбазепин, фенитоин и ГАМК-таргетные препараты (габапентин, вигабатрин, прегабалин, тиагабин, ретигабин) противопоказаны при эпилепсиях с абсансами и миоклониями, так как аггравируют эти типы ЭП.
Выбор ПЭП основывается прежде всего на особенностях его влияния на звенья эпилептогенеза (воздействие на калиевые каналы, кальциевые каналы, рецепторы глутамина или гамма-аминомасляной кислоты (ГАМК), на ГАМК-синапсы). При невозможности установления типа ЭП назначают ПЭП «широкого спектра».
Анализируя рекомендации по стартовой монотерапии фокальной эпилепсии у взрослых, лектор указал на важность применения не только «старых» ПЭП (карбамазепин – уровень доказательств А, вальпроатов – уровень доказательств В), но и «новых» ПЭП (леветирацетам – уровень доказательств А).
При сравнении различных ПЭП отмечается сопоставимая эффективность средств «новой» и «старой» генерации, однако, например, у карбамазепина следует отметить более узкий спектр терапевтической активности, худшую переносимость, менее благоприятную фармакокинетику, чем у леветирацетама (C.P. Panayiotopoulos, 2007; P.N. Patsalos, 2000).
С.М. Харчук указал также на ряд особенностей применения карбамазепина: данный препарат следует с осторожностью назначать пациентам с сердечно-сосудистыми заболеваниями; в связи с его влиянием на гемостаз необходимо контролировать свертываемость крови; перед назначением следует проверить функции печени.
Карбамазепин неэффективен при абсансах и миоклониях, возможна аггравация приступов. Метаболизм карбамазепина (как и многих других ПЭП) проходит с участием цитохрома Р450, что означает высокий риск взаимодействия с другими лекарственными средствами и, соответственно, обусловливает снижение эффективности и повышение риска развития побочных эффектов.
Лектор отметил, что карбамазепин остается в Украине наиболее назначаемым препаратом в лечении эпилепсии. Однако отмечается постепенное увеличение доли назначений ламотриджина и вальпроатов в силу их широкого спектра действия и высокой эффективности.
ПЭП новой генерации (леветирацетам) пока назначают редко, но есть тенденция к росту доли назначений. При выборе стартовой терапии важно учитывать не только показатели эффективности ПЭП, но также профиль переносимости препарата и его влияние на качество жизни больного.
 На первой секции конференции, посвященной новой классификации эпилепсии и ЭП, с докладом выступила профессор кафедры неврологии Львовского национального медицинского университета им. Данила Галицкого, руководитель Львовского областного противоэпилептического центра, доктор медицинских наук Лидия Борисовна Марьенко.
На первой секции конференции, посвященной новой классификации эпилепсии и ЭП, с докладом выступила профессор кафедры неврологии Львовского национального медицинского университета им. Данила Галицкого, руководитель Львовского областного противоэпилептического центра, доктор медицинских наук Лидия Борисовна Марьенко.
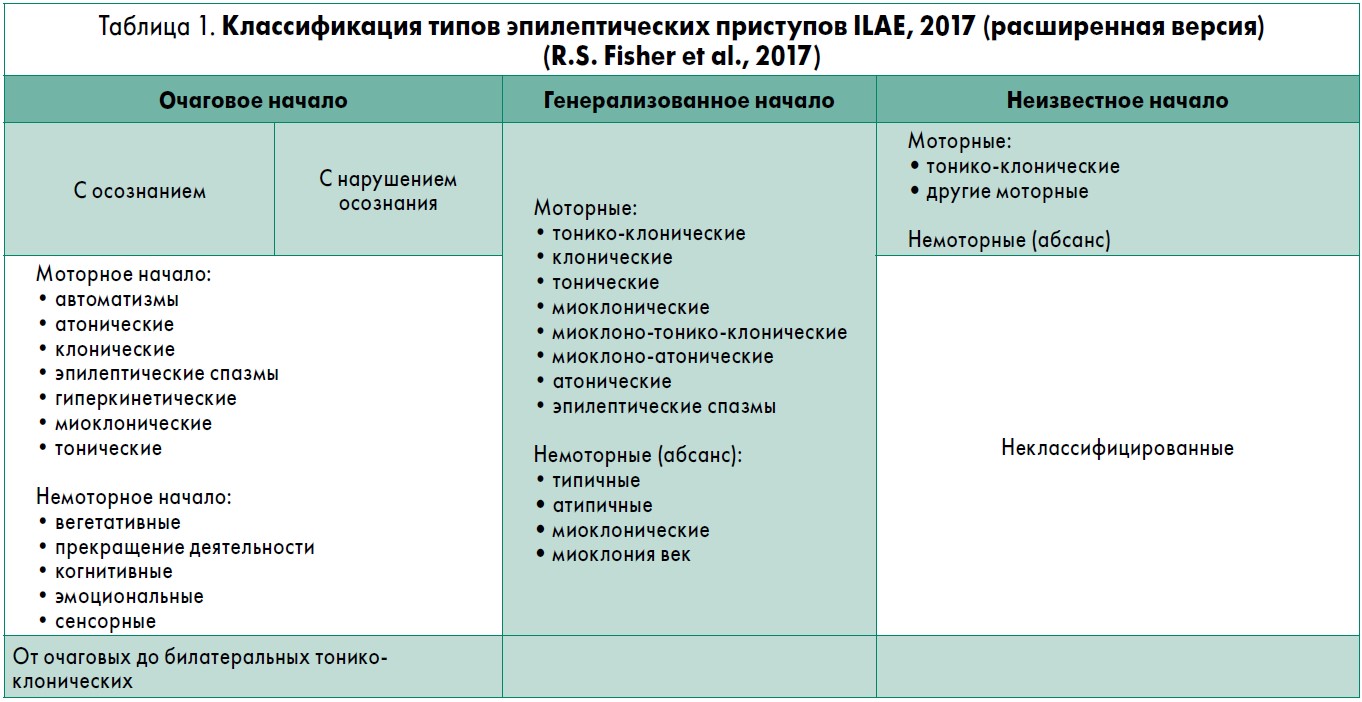
Профессор Л.Б. Марьенко напомнила, что в 2017 г. ILAE опубликовала новую классификацию эпилепсии и ЭП (I.E. Scheffer et al., 2017; R.S. Fisher et al., 2017). Постоянное совершенствование классификации связано с быстрым расширением знаний о молекулярной биологии и генетике эпилепсии, внедрением революционных методов диагностики, введением в клиническую практику новых ПЭП, расширением возможностей нейрохирургического лечения.
ЭП – это временное проявление признаков и/или симптомов из-за аномальной чрезмерной или синхронной активности нейронов головного мозга (ГМ). Предыдущие классификации ЭП базировались преимущественно на анатомии с разделением ЭП на височные, лобные, теменные и т.д. Однако взгляды на патофизиологические механизмы развития заболевания изменились, поскольку были получены данные, позволяющие рассматривать эпилепсию как заболевание нейрональной сети, а не только как симптом локальной патологии ГМ.
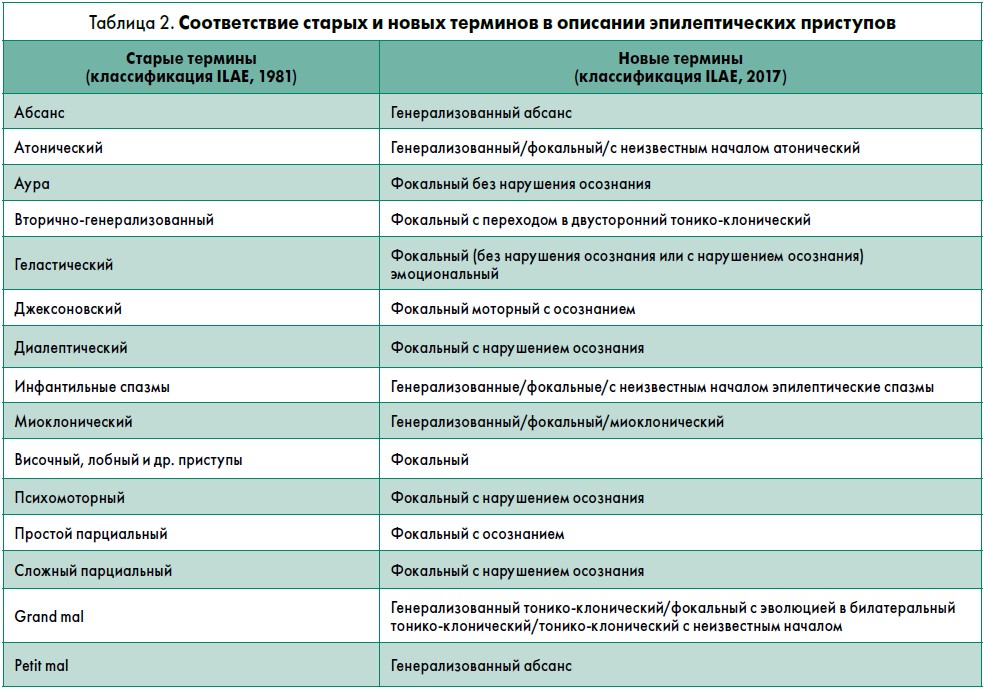
Лектор обратила внимание слушателей, что в новой классификации ЭП (табл. 1) термин «парциальный» окончательно заменен на «фокальный». Сохранение осознания (awareness), то есть восприятие и понимание событий, происходивших во время ЭП, используют как классификатор только очаговых ЭП. И очаговые, и генерализованные ЭП разделяют на моторные и немоторные; термин «судорожный» или «развернутый» не используют, вместо этого отмечают конкретный тип ЭП: тонический, клонический, тонико-клонический, эпилептический спазм и т.п. (табл. 2).
Для корректной классификации эпилепсии клиницист должен начинать с классификации типа ЭП. Следующий шаг – определить тип эпилепсии: очаговая, генерализованная, комбинированная генерализованная и очаговая, неизвестная. Последний вариант используют, когда диагноз эпилепсии не вызывает сомнений, но для окончательного установления не хватает информации. На третьем уровне необходимо установить синдром эпилепсии – совокупность проявлений, включающих типы ЭП, результаты ЭЭГ и особенности нейровизуализации.
ЭЭГ, нейровизуализацию и другие обследования применяют для определения этиологии эпилепсии: структурные поражения мозга, генетические дефекты, инфекции (менингит, энцефалит, малярия и т.д.), метаболические расстройства, иммунные заболевания и др.
В заключение выступления профессор Л.Б. Марьенко сделала акцент на необходимости оперативно внедрять новую классификацию эпилепсии и ЭП в клиническую практику в Украине.
 Об особенностях лечения эпилепсии у женщин детородного возраста рассказала заведующая кафедрой неврологии и детской неврологии Харьковской медицинской академии последипломного образования (ХМАПО), доктор медицинских наук, профессор Татьяна Анатольевна Литовченко.
Об особенностях лечения эпилепсии у женщин детородного возраста рассказала заведующая кафедрой неврологии и детской неврологии Харьковской медицинской академии последипломного образования (ХМАПО), доктор медицинских наук, профессор Татьяна Анатольевна Литовченко.
Докладчик обратила внимание слушателей на то, что особенную сложность представляет лечение эпилепсии у женщин в периоды физиологических гормональных изменений: пубертатный период, беременность, роды и лактация, климакс.
Для женщин с эпилепсией характерны менструальные нарушения, снижение фертильности, в период беременности для них характерен более высокий по сравнению с общей популяцией риск преэклампсии, кесарева сечения, артериальной гипертензии, кровотечений, спонтанных абортов, развития эпилептического статуса.
ЭП оказывают значительное влияние на здоровье матери и могут привести к ее смерти (Cantwell et al., 2011). В период беременности и в родах ЭП приводят к нарушению сердечного ритма плода, к гипоксии и длительному спазму матки, кровотечениям, разрывам матки и смерти плода (Saho, Klein, 2005). Отслойка плаценты описана в 50% случаев при серьезных травмах вследствие ЭП у беременных.
Частые генерализованные тонико-клонические ЭП являются независимым фактором риска постнатального когнитивного снижения у детей (Cummings et al., 2011). В связи с этим эпилепсия требует непрерывного длительного лечения во время беременности, несмотря на риск осложнений при приеме ПЭП (UK Epilepsy and Pregnancy Register, 2009). Отказ от грудного вскармливания при приеме ПЭП необоснован.
Профессор Т.А. Литовченко отметила, что беременность у женщин с эпилепсией по возможности должна быть плановой, поскольку требует коррекции доз ПЭП, в некоторых случаях – перехода на монотерапию. Не следует проводить замену ПЭП, если пациентка находится в ремиссии.
Что касается выбора ПЭП, то девочкам и женщинам фертильного возраста нежелательно назначать вальпроаты, фенитоин, карбамазепин: вальпроаты в период полового созревания вызывают поликистоз яичников, нарушения менструального цикла, мастопатию, прибавку веса; длительное применение фенитоина приводит к косметическим дефектам; карбамазепин снижает эффективность гормональных контрацептивов и заместительной гормональной терапии.
Для фенобарбитала, фенитоина и вальпроатов характерен значительно более высокий риск тератогенных эффектов по сравнению с ламотриджином, леветирацетамом, клоназепамом и габапентином (S. Banguar et al., 2016). У таких пациенток преимущества имеют «новые» ПЭП (ламотриджин и леветирацетам), которые в исследованиях продемонстрировали гораздо меньший риск тератогенных эффектов по сравнению с контролем (Veroniki et al., 2017).
Накоплена достаточная доказательная база в области применения ламотриджина у женщин фертильного возраста и беременных. Наименьший риск мальформаций наблюдается при приеме ламотриджина в дозировке <300 мг/сут (по данным UK Registry, <200 мг/сут) (T. Tomson et al., 2010).
Ламотриджин так же эффективен, как вальпроаты и карбамазепин, при лечении фокальных, вторично-генерализованных и первично-генерализованных ЭП (за исключением абсансов и миоклонических приступов), но при этом обладает наименьшим негативным влиянием на женскую половую сферу и метаболизм. Прием ламотриджина у беременных требует мониторинга концентрации препарата в плазме крови и в 20-30% случаев – коррекции дозировки.
Лектор сообщила, что согласно результатам многочисленных исследований, в которых принимали участие сотрудники кафедры неврологии и детской неврологии ХМАПО (2008-2012 гг.), было установлено отсутствие влияния ламотриджина и леветирацетама на гормональный фон у девочек-подростков и женщин; эти препараты также не повышали риск развития остеопороза, не приводили к увеличению веса и возникновению косметических дефектов.
 Проблеме диагностики и лечения психогенных неэпилептических судорог (ПНС) был посвящен доклад заведующего отделением детской психиатрии и неврологии ТМО «Психиатрия» в г. Киеве ДЗ КГГА Владимира Игоревича Харитонова.
Проблеме диагностики и лечения психогенных неэпилептических судорог (ПНС) был посвящен доклад заведующего отделением детской психиатрии и неврологии ТМО «Психиатрия» в г. Киеве ДЗ КГГА Владимира Игоревича Харитонова.
В.И. Харитонов напомнил слушателям, что ПНС – это состояния, напоминающие ЭП, но без характерных электрических изменений в ГМ, указывающих на эпилептическую природу феномена. ПНС могут быть спровоцированы различными факторами: сексуальным или физическим насилием, коморбидными психиатрическими состояниями, легкой ЧМТ, стрессом. ПНС могут впервые появляться в возрасте 5 лет, но чаще наблюдаются у подростков, преимущественно у девочек.
Средняя продолжительность ПНС – 4,5 мин (в отличие от ЭП – 1,5 мин). В 80% случаев ПНС внезапно начинаются, в 67% – внезапно заканчиваются. Треть пациентов во время события не отвечает на раздражители. У четверти пациентов отмечается тремор в руках (L. Szabo et al., 2012), у 43% – эмоциональные проявления, включая хныканье и плач (H. Patel et al., 2007).
Лектор привел несколько клинических примеров ПНС и указал на важность видеофиксации приступов: ПНС можно предположить, основываясь на кинематике движений больного. Для диагностики также используют MMPI-тестирование (Minnesota Multiphasic Personality Inventory), анализ уровня пролактина, оценку симптомов в иктальной и постиктальной фазах.
Золотым стандартом диагностики ПНС является видео-ЭЭГ-мониторинг (F.M. Cuthill, C.A. Espie, 2005). Оптимальным подходом к лечению ПНС сегодня считается адекватная фармакотерапия коморбидных психиатрических состояний в сочетании с психотерапией.
 Об особенностях антиконвульсантной терапии при фокальных (лобных) эпилепсиях рассказала заведующая кафедрой внутренней медицины с курсом нейродисциплин Днепровского медицинского института традиционной и нетрадиционной медицины, доктор медицинских наук Алла Григорьевна Кириченко.
Об особенностях антиконвульсантной терапии при фокальных (лобных) эпилепсиях рассказала заведующая кафедрой внутренней медицины с курсом нейродисциплин Днепровского медицинского института традиционной и нетрадиционной медицины, доктор медицинских наук Алла Григорьевна Кириченко.
Лектор напомнила об особенностях лобной эпилепсии: манифестация в любом возрасте, полиморфизм и серийность ЭП, которые чаще всего возникают в ночное время (эту форму еще называют «сонной эпилепсией»), частая резистентность к терапии (до 40% пациентов не отвечают на терапию ПЭП).
Лобные эпилепсии делятся на генетические (1/3 случаев), симптоматические (2/3 случаев) и неясной этиологии. Среди ведущих причин симптоматической эпилепсии следует отметить корковые мальформации, воспалительные заболевания, ЧМТ, опухоли, цереброваскулярную и перинатальную патологию и т.д. Среди генетических дефектов, ведущих к развитию эпилепсии, лектор назвала различные каналопатии и мембранопатии, а также расстройства созревания коры.
А.Г. Кириченко охарактеризовала формы симптоматической лобной эпилепсии, выделяемые на основе зоны поражения лобного мозга: моторная; оперкулярная; дорсолатеральная; орбитофронтальная; передняя фронтополярная; цингулярная; из дополнительной моторной зоны.
Для моторной формы характерны приступы (марш) Джексона; постприпадочный паралич (паралич Тодда) продолжительностью до 1 сут; речевые расстройства; генерализованная эпилептическая активность. При поражении премоторной зоны (дорсолатеральная форма) возможны головокружения, нистагм, постуральные нарушения, адверсия глаз и головы, нарушения речи.
При оперкулярной форме лобной эпилепсии возможны ЭП как с нарушением сознания, так и без, они могут сопровождаться оральными и ларингеальными автоматизмами, страхом, слюнотечением.
При фронтополярной форме лобной эпилепсии ЭП могут быть гипомоторными (застывание, замирание, падение), гипермоторными (педалирование, боксирование, катание, ползание, причудливые движения), мнестическими и гелластическими (кратковременные навязчивые мысли, насильственный смех или плач). При орбитофронтальной форме ЭП проявляются обонятельными галлюцинациями и иллюзиями, жестикуляциями, глоточно-оральными автоматизмами, соматическими приступами.
Цингулярная форма отмечается при поражении поясной извилины, участвующей в формировании эмоций, поэтому ЭП сопровождаются дисфорией, злобой, агрессией, страхом, нарушением поведения с психомоторным возбуждением и вегетативными нарушениями.
Дополнительная моторная форма лобной эпилепсии характеризуется ночными ЭП с архаическими движениями, тоническими судорогами, гримасами, внезапным пробуждением, двигательной «бурей».
Докладчик отметила особенности ЭП при лобной эпилепсии: стереотипность и кратковременность (от нескольких секунд до 1,5 мин); выраженные моторные проявления; быстрая вторичная генерализация и частые падения; минимальность или отсутствие постприпадочной спутанности; возникновение в ночное время, в фазу медленного сна. Для диагностики лобной эпилепсии рекомендовано ночное мониторирование ЭЭГ.
Лектор указала на преимущества и недостатки различных ПЭП – карбамазепина, ламотриджина, топирамата, вальпроатов, леветирацетама – в лечении лобной эпилепсии, а также рекомендовала в тех случаях, когда точно не установлена форма эпилепсии или тип ЭП, начинать лечение с вальпроевой кислоты или леветирацетама (Л.Р. Зенков, 2011).
 В рамках секции «Эпилепсия детского возраста» об аутоиммунных энцефалитах с эпилепсией у детей рассказала детский невролог, кандидат медицинских наук Елена Петровна Шестова (г. Днепр).
В рамках секции «Эпилепсия детского возраста» об аутоиммунных энцефалитах с эпилепсией у детей рассказала детский невролог, кандидат медицинских наук Елена Петровна Шестова (г. Днепр).
Докладчик отметила, что в последнее десятилетие расширился клинический спектр аутоиммунных энцефалитов, расшифрованы механизмы их развития и определены эффективные подходы к лечению.
Е.П. Шестова указала на основные симптомы аутоиммунного энцефалита: поведенческие проблемы, изменение личности, депрессия, тревога, галлюцинации, психоз, обсессии, компульсии, потеря памяти, двигательные расстройства и дистония, эпилепсия, мутизм, эхолалия, персеверации, нистагм, атаксия, расстройства сна, снижение уровня сознания, потеря сознания, вегетативные нарушения, гастроинтестинальные (диарея), почечные (гипонатриемия).
У детей с судорогами на наличие аутоиммунного энцефалита могут указывать: фокальные ЭП, особенно моторные и с нарушением осознания, вторичные генерализованные ЭП; эпилептический статус; судороги и эпилепсия «неясной» этиологии; рефрактерные ЭП; двигательные нарушения, нейропсихиатрические симптомы, когнитивные расстройства, аутоиммунные заболевания в анамнезе или в семье; резистентность к традиционным ПЭП; «положительный» клинический ответ на иммунотерапию (J. Suleiman, R.C. Dale, 2015).
Для установления диагноза проводят исследование цереброспинальной жидкости для выявления лимфоцитарного плеоцитоза, повышенного содержания белка и иммуноглобулинов G, специфических олигоклональных иммуноглобулинов. Также проводят анализ крови и ликвора на наличие специфических аутоантител к нейрональным рецепторам.
«Аутоиммунные судороги» часто не реагируют на традиционные ПЭП, но могут отвечать на иммунотерапию и поэтому важны для распознавания. При подозрении на аутоиммунную эпилепсию назначают кортикостероиды в дополнение к внутривенному иммуноглобулину или плазмаферезу. При тяжелом течении – алкилирующие средства, моноклональные антитела, иммунодепрессанты.
Докладчик привела примеры собственного наблюдения и лечения больных с аутоиммунными энцефалитами-эпилепсиями (опсоклонус-миоклонус-атаксия, CLIPPERS-синдром).
 Опытом реализации бюджетных программ в обеспечении детей с эпилепсией ПЭП поделилась доцент Национальной медицинской академии последипломного образования им. П.Л. Шупика (г. Киев), эксперт ДЗ КГГА по специальности «Детская неврология», кандидат медицинских наук Людмила Афанасьевна Панасюк.
Опытом реализации бюджетных программ в обеспечении детей с эпилепсией ПЭП поделилась доцент Национальной медицинской академии последипломного образования им. П.Л. Шупика (г. Киев), эксперт ДЗ КГГА по специальности «Детская неврология», кандидат медицинских наук Людмила Афанасьевна Панасюк.
Л.А. Панасюк отметила, что с учетом сложности диагностики эпилепсии в мире отмечается тенденция включения в протоколы лечения в качестве препаратов первой линии ПЭП с максимально широким спектром действия и влиянием на все известные механизмы развития эпилепсии.
В Украине медикаментозное лечение проводят согласно «Унифицированному клиническому протоколу первичной, экстренной, вторичной (специализированной) и третичной (высокоспециализированной) медицинской помощи: Эпилепсии у детей» (приказ МЗ Украины от 17.04.2014 г. № 276).
Рекомендовано начинать и длительно продолжать терапию эпилепсии у детей оригинальными препаратами или генериками, изготовленными в соответствии со стандартами Надлежащей производственной практики (GMP), с доказанной биоэквивалентностью оригинальному препарату, с прогнозируемой эффективностью и переносимостью. При достижении стойкой ремиссии ЭП замена ПЭП у детей противопоказана.
Докладчик сделала акцент на том, что социальная адаптация детей с эпилепсией зависит от соблюдения принципов лечения, среди которых – индивидуальный подход, комплексность, непрерывность, адекватная продолжительность лечения и преемственность ведения пациентов. Однако высокая стоимость ПЭП не всегда позволяет придерживаться этих принципов. Помочь в решении этой задачи призваны бюджетные программы закупок ПЭП – как государственные, так и региональные.
Планирование программ закупок ПЭП осуществляется на основании Унифицированного клинического протокола (приказ МЗ Украины от 17.04.2014 г. № 276), Закона Украины «О публичных закупках», мониторинга диспансерной группы детей с эпилепсией, сотрудничества специалистов и ассоциаций пациентов, а также информации о ПЭП, представленных на рынке Украины.
Л.А. Панасюк привела результаты мониторинга диспансерной группы детей с эпилепсией, состоящих под наблюдением детских неврологов г. Киева. Из 954 детей, получавших ПЭП, вальпроаты получали 43%, топирамат – 21%, карбамазепин – 18%, ламотриджин – 10%, леветирацетам – 7%, бензодиазепины – 3%, барбитураты – 2%.
Проанализировав ситуацию с поставками и расходованием препаратов вальпроата натрия (сироп) и вальпроата натрия 300 мг пролонгированного действия (таблетки) в различных районах г. Киева, докладчик сделала акцент на необходимости постоянно проводить мониторинг текущей ситуации для своевременного обеспечения пациентов ПЭП.
 В рамках секции, посвященной психическим расстройствам и другим осложнениям эпилепсии, о постиктальных психических расстройствах и современных подходах к их лечению рассказал доцент кафедры психиатрии факультета последипломного образования ГУ «Днепропетровская медицинская академия МЗ Украины», кандидат медицинских наук Сергей Григорьевич Носов.
В рамках секции, посвященной психическим расстройствам и другим осложнениям эпилепсии, о постиктальных психических расстройствах и современных подходах к их лечению рассказал доцент кафедры психиатрии факультета последипломного образования ГУ «Днепропетровская медицинская академия МЗ Украины», кандидат медицинских наук Сергей Григорьевич Носов.
С.Г. Носов напомнил, что постиктальная психопатология (ПП) может классифицироваться по типу течения: транзиторная (до 7 сут), затяжная (7 сут – 3 мес) и хроническая (интериктальная психопатология с постиктальными особенностями проявления). В зависимости от уровня поражения психических функций говорят о непсихотической ПП (с сохранностью адекватности психического функционирования, критики своих действий) и психотической ПП (с неадекватностью функционирования, снижением критики, неспособностью отдавать отчет своим действиям и руководить ими).
Типичная ПП может возникать в первой фазе постиктального периода (немедленно после ЭП) и длиться до 2 ч, редко – до 72 ч либо во второй фазе – с задержкой, после бессимптомного периода продолжительностью 8 ч – 7 сут. Атипичная ПП развивается без связи с фазами постиктального периода.
Лектор указал, что типичная непсихотическая ПП первой фазы (транзиторные неврозоподобные и психогенные расстройства) может быть представлена такими симптомами, как инсомния, повышенный аппетит, тревога. Возможно развитие симптомов депрессии или гипоманиакальных симптомов продолжительностью до 2 ч (приподнятое настроение, повышенная двигательная активность, ускорение темпа мышления). Типичные психотические ПП первой фазы могут проходить с нарушением сознания или без него, длиться от 30 мин до 36 ч.
Типичная непсихотическая ПП второй фазы (аффективные расстройства) проявляется постиктальной депрессией, перед которой возможен краткий эпизод гипомании. Типичные психотические ПП второй фазы чаще протекают без нарушения сознания. Во второй фазе постиктального периода могут возникать смешанные расстройства, в частности затяжные возвратные депрессивные и бредовые эпизоды.
Тактика лечения ПП зависит от того, какие симптомы преобладают. При депрессиях и тревоге с вегетативными проявлениями (первая фаза) назначают бензодиазепины; ПЭП (Вальпроком хроно 500-1000 мг/сут, Ламотрин 100-200 мг/сут, Карбамазепин ретард 400-600 мг/сут, Неогабин 150 мг/сут); антидепрессанты; психотерапию.
При гипомании показан Вальпроком хроно 1000-1500 мг/сут. При первичной постиктальной депрессии в виде очерченных депрессивных эпизодов (вторая фаза) повышают дозы ПЭП (Ламотрин – до 400 мг/сут, Вальпроком хроно – до 1500 мг/сут), назначают антидепрессанты. При возвратной постиктальной депрессии и бредовых психозах (вторая фаза, затяжное течение) назначения аналогичны, при этом добавляют нейролептики для купирования бредовых расстройств.
При постиктальных психозах с нарушением сознания (первая фаза) применяют бензодиазепины парентерально; ПЭП парентерально (вальпроаты); однократно – нейролептики парентерально для купирования психомоторного возбуждения.
При транзиторных психозах без нарушения сознания назначают бензодиазепины; ПЭП перорально (Ламотрин 100-200 мг/сут, Вальпроком хроно 1000-1500 мг/сут, Левицитам 1500 мг/сут, Топиромакс 100-200 мг/сут); невысокие дозы нейролептиков; антидепрессанты. При затяжных психозах без нарушения сознания назначения аналогичны, но дозы нейролептиков выше.
При атипичной ПП устраняют любые факторы провокации эпилептогенеза, а также назначают бензодиазепины до 7 сут; клоназепам; ПЭП с противотревожным эффектом (Неогабин 150 мг/сут или более).
Подготовила Екатерина Ткаченко
UA-CNSP-PUB-062018-013