28 серпня, 2018
Современные подходы к выбору антикоагулянтной терапии у больных с различными формами ОКС: баланс эффективности и безопасности
.jpg) Последние годы ознаменовались разработкой не только новых международных рекомендаций в области ведения больных с различными формами острого коронарного синдрома – ОКС (ESC, 2015, 2017), но и украинских унифицированных клинических проколов по лечению ОКС с подъемом и без подъема сегмента ST (приказы МЗ Украины от 02.07.2014 г. № 455 и от 03.03.2016 г. № 164 соответственно). Национальные протоколы полностью гармонизированы и отвечают духу международных документов, и, кроме того, мы получили рекомендацию от МЗ Украины свободно руководствоваться в практической деятельности существующими международными протоколами. Весомый вклад в реальное сближение мировой и украинской клинической практики обеспечило создание системы реперфузионных центров во всех областях Украины с возможностью бесплатного осуществления первичных чрескожных коронарных вмешательств (ПЧКВ) у пациентов с ОКС с элевацией сегмента ST.
Последние годы ознаменовались разработкой не только новых международных рекомендаций в области ведения больных с различными формами острого коронарного синдрома – ОКС (ESC, 2015, 2017), но и украинских унифицированных клинических проколов по лечению ОКС с подъемом и без подъема сегмента ST (приказы МЗ Украины от 02.07.2014 г. № 455 и от 03.03.2016 г. № 164 соответственно). Национальные протоколы полностью гармонизированы и отвечают духу международных документов, и, кроме того, мы получили рекомендацию от МЗ Украины свободно руководствоваться в практической деятельности существующими международными протоколами. Весомый вклад в реальное сближение мировой и украинской клинической практики обеспечило создание системы реперфузионных центров во всех областях Украины с возможностью бесплатного осуществления первичных чрескожных коронарных вмешательств (ПЧКВ) у пациентов с ОКС с элевацией сегмента ST.
Однако, несмотря на значительные достижения, остается ряд вопросов из области клинической практики ведения ОКС, требующих обсуждения. Прежде всего, речь идет о достаточно многочисленной когорте больных с острым инфарктом миокарда (ОИМ), которые поздно обращаются за медицинской помощью и уже не подлежат немедленной реваскуляризации.
Кроме того, существует широкий круг больных с ОКС без подъема сегмента ST (non-STEMI), не подвергающихся процедуре реваскуляризации, поскольку на больных высокого и среднего риска (2-3-я группы) пока не распространяется действие государственных программ по бесплатной установке стентов. Все эти больные нуждаются в эффективной и современной антитромботической терапии.
В настоящее время адъювантная антитромботическая терапия представлена несколькими высокоэффективными антитромбоцитарными препаратами (клопидогрель, тикагрелор), которые назначаются в дополнение к ацетилсалициловой кислоте (АСК), и антикоагулянтами (нефракционированный гепарин (НФГ), низкомолекулярные гепарины (эноксапарин) и селективный ингибитор Ха фактора фондапаринукс). Таким образом, возможны минимум шесть комбинаций антиагрегант + антикоагулянт, а при включении/невключении АСК их число увеличивается еще больше.
Определяющим для правильного выбора схемы антитромботической терапии в этих случаях является сохранение баланса ее эффективности и безопасности, основанное на индивидуальной оценке тромботических и геморрагических рисков больного. Согласно последним европейским рекомендациям по ведению пациентов со STEMI (2017) стратификация риска у этих больных должна проводиться с использованием валидированных шкал (АВС, CHA2DS2-VASc, HAS-BLED) с фокусом на модифицируемые факторы риска.
В новом специальном руководстве Европейского общества кардиологов (ЕОК, 2017) по двойной антитромбоцитарной терапии (ДАТ) также предусмотрена специальная шкала PRECISE-DAPT, предназначенная для выбора длительности ДАТ (3-6 или 12-24 мес).
Что касается шкал CHA2DS2-VASc и HAS-BLED, для которых характерен тщательный клинический подход к оценке риска, то они разработаны для ведения больных с фибрилляцией предсердий и предназначены для выбора и назначения антикоагулянта в условиях хронического заболевания. Поэтому любая дополнительно назначенная антитромбоцитарная терапия рассматривается в данных шкалах только как фактор геморрагического риска.
Однако хорошо известно, что развитие ОКС на фоне постоянного приема АСК не менее недели является также фактором тромботического риска, который в данной ситуации может быть даже более весомым, чем геморрагический риск. Это в еще большей степени справедливо по отношению к пациентам, у которых ОКС развился на фоне широко распространенной сегодня терапии клопидогрелем или комбинацией АСК с клопидогрелем. Все это требует поиска дальнейших возможностей клинической оценки соотношения геморрагического и тромботического рисков у пациентов с ОКС с последующей индивидуализацией антитромботической терапии. Кроме того, часть больных часто или длительно принимают нестероидные противовоспалительные препараты (НПВП), которые значительно и независимо увеличивают тромботический риск (в среднем в 2-3 раза). Продолжение приема НПВП в острой фазе ОКС ведет к возрастанию риска повторного атеротромботического события в течение 7 дней (до 45%). К сожалению, данный фактор – прием НПВП – не включен в шкалы для стратификации рисков, а количество таких больных весьма значительно, особенно в возрастной категории >65 лет.
По результатам клинического регистра, организованного нами в 2015 году [1], с включением более 100 последовательно поступивших больных с ОКС, средний возраст таких пациентов увеличился до 68 лет, а доля женщин – до 50%. Также изменился структурный состав поступающих пациентов: стали преобладать больные с ОКС без элевации сегмента ST (74,3%), тогда как по данным регистра SNAPSHOT (2009) таких больных было 42%. Характеристики поступающих пациентов с ОКС свидетельствуют об актуальности сохранения баланса между эффективностью и безопасностью антитромботической терапии.
Еще в 2003 году данные регистра GRACE продемонстрировали трехкратное повышение госпитальной смертности у больных с большими кровотечениями [2, 3]. Это было высокодостоверно (р=0,001) как для общей популяции больных (5,1-18,6%), так и для всех форм ОКС: нестабильной стенокардии (3-16,1%), non-STEMI (5,3-6,3%) и STEMI (7-22,8%) [3].
В связи с этим во всех рекомендациях ЕОК начиная с 2007 года указывается, что эффекты антикоагулянтной терапии у пациентов с ОКС должны оцениваться с учетом не только снижения риска повторных ишемических/тромботических событий, но и риска кровотечений. Такая тактика является основой современной стратификации риска для индивидуального выбора оптимальной антикоагулянтной терапии с учетом формы ОКС и вида предполагаемой реваскуляризации.
В наших реалиях правильная стратификация риска и назначение адекватной антикоагулянтной терапии имеют особое значение вследствие того, что доля тромболизиса в структуре реперфузий при STEMI остается значительной, а при non-STEMI консервативная медикаментозная стратегия, предполагающая длительную (до 8 суток) антикоагуляцию, однозначно преобладает, хотя она безусловно показана лишь пациентам низкого риска (4-я группа), а остальные (1-3-я группы) должны подвергаться немедленному (2 ч от поступления) или умеренно отложенному (72 ч после поступления) ПЧКВ.
Кроме того, вопрос не теряет актуальности и для пациентов с инвазивной стратегией реперфузии, которая также предполагает применение антикоагулянтной терапии.
В связи с этим сегодня предпринимаются активные попытки определить чувствительные, достаточно специфичные, но доступные в широкой практике критерии риска развития кровотечений для гармонизации антитромботической терапии. Так, мультивариантный анализ данных регистра GRACE [1, 2] позволил определить, что наиболее значимыми факторами риска кровотечений, которые можно использовать при поступлении больного, являются: возраст – 1,22 (на каждые 10 лет), женский пол – 1,36, хроническая почечная недостаточность (ХПН) – 1,53 и кровотечения в анамнезе – 2,18.
Все вышеизложенное заставило нас предпринять практическое исследование, направленное на сравнительную оценку тромботических и геморрагических рисков в реальной популяции пациентов с ОКС (все формы) в условиях крупного (около 2000 поступлений в год) специализированного коронарного центра в г. Днепр при применении консервативной стратегии ведения [4].
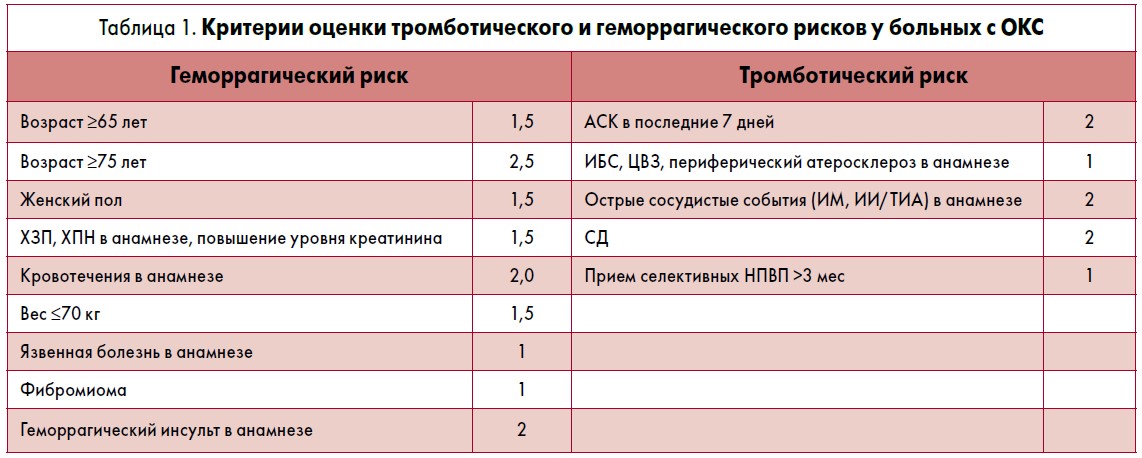
Были оценены данные 507 больных с ОКС, последовательно госпитализированных в инфарктные отделения центра, путем заполнения (в течение первых суток при поступлении) дополнительной формы, отражающей тромботические и геморрагические риски с расчетом суммы отдельных рисков согласно предложенной нами схеме градации (табл. 1). Также осуществляли бивалентную (одновременную) стратификацию больных в группы высокого, среднего и низкого тромботического и геморрагического рисков для подбора антитромботической терапии.
Предложенная градация рисков была разработана на основе анализа международных рекомендаций по оценке тромботического и геморрагического рисков и предшествующего анализа собственных многолетних клинических данных. Она включила все значимые и легко определяемые при поступлении клинические переменные: женский пол, возраст ≥65 лет, возраст ≥75 лет, хроническое заболевание почек (ХЗП), ХПН в анамнезе, повышенный уровень креатинина, кровотечения в анамнезе, вес ≤70 кг, язвенную болезнь в анамнезе, фибромиому, геморрагический инсульт в анамнезе. Данные 8 критериев были предложены для расчета уровня геморрагического риска.
Для одновременной оценки тромботического риска были предложены следующие 5 переменных: постоянный прием АСК в последние 7 дней, наличие ишемической болезни сердца (ИБС), цереброваскулярного заболевания (ЦВЗ), периферический атеросклероз в анамнезе, острые сосудистые события (ИМ, ишемический инсульт (ИИ) / транзиторная ишемическая атака – ТИА) в анамнезе, сахарный диабет (СД), прием селективных НПВП более 3 мес. Суммацию и деление рисков осуществляли аналогично делению больных по шкале TIMI. Естественно, что у пациентов с ОКС преобладали тромботические риски: только 32% из них имели низкий уровень тромботического риска, а 68% – высокий и средний.
В то же время уровень геморрагического риска был значительно ниже: высокий риск отмечен лишь у 13% больных, а низкий – почти у половины (49%).
Как показало традиционное деление больных по шкале TIMI, предложенные нами уровни риска соответствовали общей тяжести больных всех клинических форм ОКС. Так, высокий и средний риск при non-STEMI зафиксирован в 82% случаев, а в группе больных со STEMI низкому уровню риска соответствовали лишь 7% из них.
Среди критериев тромботического риска фигурировали с убывающей частотой нестабильное течение атеросклероза многих сосудистых бассейнов (79%), осложненные ЦВЗ (45%), прием АСК (43%), наличие СД (15%), регулярный прием НПВП в течение последних 3 мес (4%). Для повышенного геморрагического риска наиболее частыми детерминантами были возраст (69%), женский пол (52%), затем следовали вес (17%), язвенная болезнь в анамнезе (13%), ХЗП (13%); незначительной была частота предшествующих кровотечений и геморрагического инсульта в анамнезе.
Сопоставление уровней тромботических и геморрагических рисков у каждого больного для оптимизации индивидуальной антитромботической стратегии показало, что почти в половине случаев определение дальнейшей терапевтической стратегии затруднено, поскольку конкретно не прописано в рекомендациях и остается на усмотрение врача. Это, прежде всего, пациенты с сочетанием высоких геморрагического и тромботического рисков, а также больные со средним геморрагическим риском и всеми уровнями тромботического риска (43%).
На втором этапе исследования была проведена ретроспективная валидация критериев риска, особенно геморрагического, на основе клинических данных, успешности процедуры и госпитальных исходов у 153 больных, получивших тромболитическую терапию (ТЛТ) в двух независимых центрах лечения больных с ОКС (Клиническое объединение скорой медицинской помощи, г. Днепр и Городская больница № 8, г. Каменское). Течение госпитального периода в этой популяции пациентов осложнилось двумя большими кровотечениями (TIMI major).
В обоих случаях рассчитанный согласно нашим критериям исходный геморрагический риск был средним (женский пол, возраст ≥65 лет, ХЗП в анамнезе – 4,5 бала) и высоким (то же + вес ≤70 кг, то есть + 1,5 = 6 баллов) при высоком тромботическом риске (5 и 6 баллов). Еще одно малое кровотечение наблюдалось у больного со средними тромботическим и геморрагическим рисками.
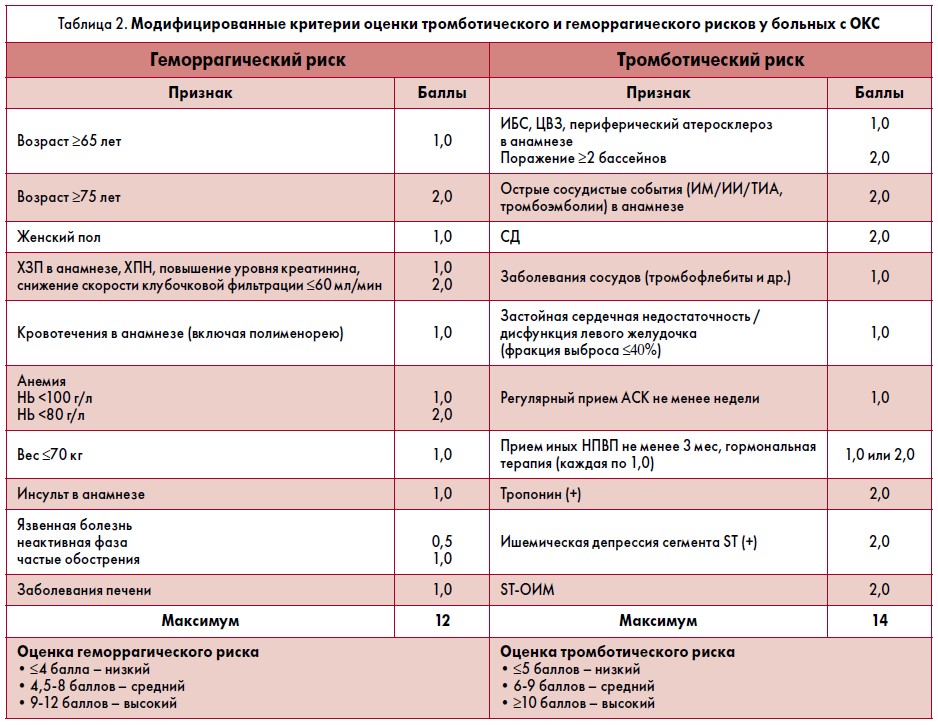
К ограничениям проведенного исследования следует отнести открытый характер, одноцентровость, меньший объем выборки по сравнению с крупномасштабными регистрами ОКС. В настоящее время в связи с накоплением данных клинических исследований, получением результатов нескольких международных регистров пациентов с ОКС, изменением их клинических характеристик, а также благодаря уточнению ряда критериев ишемического и геморрагического рисков мы модифицировали шкалы оценки риска (табл. 2), однако общий принцип – моментальная клиническая доступность оценки – сохранился.
 Переходя к вопросу о выборе антикоагулянта для лечения пациентов с ОКС, следует констатировать несколько важных фактов:
Переходя к вопросу о выборе антикоагулянта для лечения пациентов с ОКС, следует констатировать несколько важных фактов:
1) широкое внедрение нового мощного антитромбоцитарного препарата – тикагрелора в украинскую клиническую практику;
2) реальную отсроченность или отсутствие в Украине инвазивной стратегии реваскуляризации у большинства больных с non-STEMI, особенно пожилого возраста, число которых растет;
3) неуклонное снижение доли ТЛТ в структуре реваскуляризаций, но сохранение большого числа ТЛТ с использованием стрептокиназы, особенно в районах.
Исходя из этого, рассмотрим, каковы сегодня перспективы фондапаринукса в антитромботической терапии ОКС. Не лишним будет вспомнить, что доказательная база применения этого препарата при ОКС охватывает все вышеперечисленные категории пациентов, и препарат был изучен в ставших классическими мегаисследованиях в области антитромботической терапии ОКС: OASIS‑5 (n=20 078), OASIS‑6 (n=12 092), PENTALYSE (n=333), охвативших в общей сложности почти 33 тыс. больных.
Так, в исследовании OASIS‑5 эффективность и безопасность фондапаринукса сравнивали с эноксапарином в течение 8 дней терапии у больных с ОКС без элевации сегмента ST. Сразу по окончании терапии (9-й день) эффективность препаратов в отношении влияния на тромботические события (смерть + ИМ/ИИ) достоверно не отличалась (5,7-5,8%), и в обеих группах наблюдалась четкая тенденция к улучшению исходов к 90-му и 180-му дням. Однако больные, получавшие фондапаринукс, показали достоверное и значительное снижение смертности (2,9-3,5%, р=0,02) за счет высокодостоверного снижения частоты больших кровотечений на 46% (р<0,00001).
Благодаря этому впервые ученые и врачи обратили внимание на то, что значительное улучшение качества антикоагулянтной терапии может быть достигнуто за счет не усиления ее прямого действия, а сбалансированного и безопасного влияния на гемостаз со снижением числа кровотечений.
После успешного, но небольшого по объему проекта PENTALYSE, показавшего эффективность и безопасность сочетанного применения пентасахарида и тромболитика альтеплазы, фондапаринукс был детально изучен в приближенном к реальной практике исследовании. В нем сравнивали эффекты фондапаринукса и НФГ/плацебо у пациентов со STEMI, у которых применяли стратегию реваскуляризации методом ТЛТ с использованием стрептокиназы или фибрин-специфического тромболитика.
Первичная точка (смерть + реИМ) наступала достоверно реже в группе фондапаринукса на 17% (р=0,003) по сравнению с группой плацебо после окончания терапии (9-й день) и на 18% – по сравнению с группой НФГ на 30-й день. Дальнейшее улучшение выживания больных без тромботических событий на 23% (р=0,008) наблюдалось в группе фондапаринукса через 3 и 6 мес. Как и в предыдущем исследовании, применение фондапаринукса приводило к меньшему числу клинически значимых кровотечений.
Фондапаринуксу отдается безусловное предпочтение в медикаментозном ведении пациентов с non-STEMI в рекомендациях ЕОК 2015 года (класс рекомендации І, уровень доказательств А). С учетом этого актуализируется вопрос о подходе к антитромботической терапии у больных, которых мы отнесли к категории смешанных рисков (почти половина – 43%!), помимо безусловных показаний к его применению (13% – однозначное предпочтение у больных с низким тромботическим и высоким геморрагическим рисками).
Наиболее рациональным выбором при среднем геморрагическом и высоком/среднем тромботическом рисках теперь является комбинация тикагрелора и фондапаринукса у больных, ранее принимавших АСК, и безусловно – у принимавших клопидогрель и перенесших повторный ОКС на фоне такой терапии; у больных с non-STEMI с планируемым ЧКВ в более поздние сроки, чем окончание терапии фондапаринуксом в госпитальном периоде (после 5 суток).
Внезапная дестабилизация этих больных с необходимостью немедленного осуществления ЧКВ также предусмотрена международными и украинскими рекомендациями, которые включают дополнительный болюс НФГ непосредственно перед процедурой.
Назначение фондапаринукса рационально и для больных, получающих ТЛТ со стрептокиназой (что остается вариантом терапии для большого числа районных центров с невозможностью ПЧКВ в условиях широкой доступности стрептокиназы). В связи с вышесказанным на фоне повышения частоты и мощности ДАТ совершенно объясним факт сохранения и увеличения частоты применения фондапаринукса в качестве антикоагулянта (42,7-45,5%) у больных с ОКС, включенных нами в регистр 2015 года, в сравнении с регистром 2009 года, что свидетельствует о большом потенциале фондапаринукса в составе новых современных комбинаций антитромботической терапии у пациентов с ОКС.
Список литературы находится в редакции.
UA-FON-0718-0060
Тематичний номер «Кардіологія, Ревматологія, Кардіохірургія» № 3 (58) червень 2018 р.