30 серпня, 2018
Перспективные направления медикаментозного лечения острой и хронической сердечной недостаточности
 Сердечная недостаточность (СН) остается потенциально фатальной стадией прогрессирования кардиоваскулярных заболеваний и отличается увеличивающейся распространенностью, высокой социальной значимостью и огромной финансовой нагрузкой на ресурсы системы здравоохранения [82]. Масштаб проблемы СН в развитых странах мира настолько велик, что в последние десятилетия о ней говорят как об эпидемии, поглощающей как минимум половину всех экономических ресурсов, затраченных на первичное обращение и госпитализацию [16].
Сердечная недостаточность (СН) остается потенциально фатальной стадией прогрессирования кардиоваскулярных заболеваний и отличается увеличивающейся распространенностью, высокой социальной значимостью и огромной финансовой нагрузкой на ресурсы системы здравоохранения [82]. Масштаб проблемы СН в развитых странах мира настолько велик, что в последние десятилетия о ней говорят как об эпидемии, поглощающей как минимум половину всех экономических ресурсов, затраченных на первичное обращение и госпитализацию [16].
Несмотря на то что в развитых странах мира не менее 3% всех госпитализаций непосредственно связаны с впервые выявленной или прогрессирующей острой СН [12], ежегодный показатель смерти от острой СН и острой декомпенсации хронической СН (ХСН), по данным EuroHeart Failure Survey II, колеблется в пределах 16-23% [35]. С учетом смерти от кардиогенного шока этот показатель возрастает до 53% [55]. Около 50-57% всех пациентов с ХСН погибают в течение первых 5 лет после верификации диагноза [37]. При этом среди пациентов в возрасте старше 75 лет этот показатель превышает 10% и продолжает прогрессивно увеличиваться [47, 64].
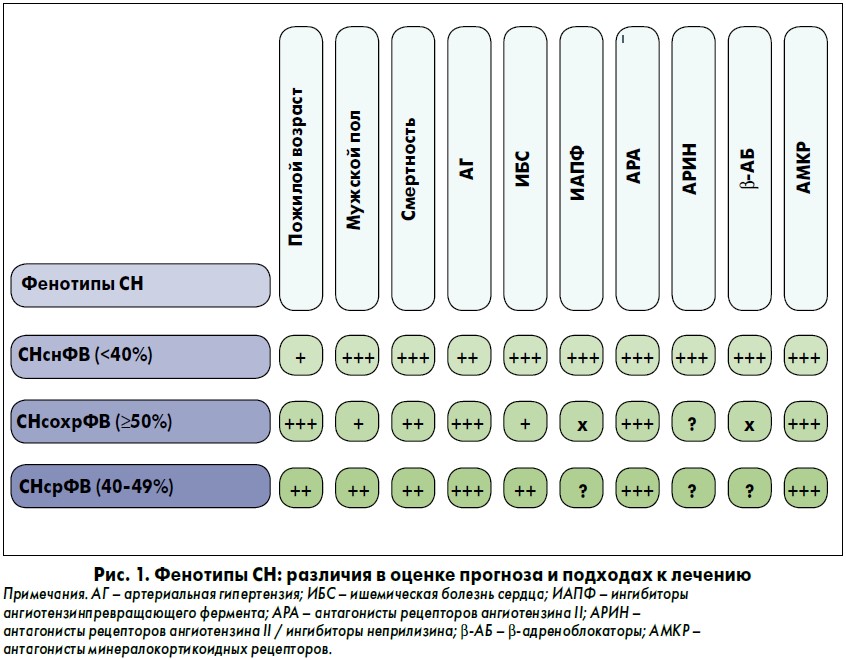
Несмотря на достаточно подробно разработанную концепцию профилактики, диагностики и лечения острой и хронической СН, большинство рекомендаций, созданных национальными медицинскими обществами с высокой научной репутацией, посвящены именно ХСН со сниженной фракцией выброса левого желудочка (ФВ ЛЖ <40%) (СНснФВ), тогда как возможности различных фармакологических стратегий для СН со средней ФВ ЛЖ (40-49%) (СНсрФВ) и сохраненной ФВ ЛЖ (50-59%) (СНсохрФВ) продолжают уточняться и широко дискутируются [72, 93]. Более того, различные фенотипы СН отличаются друг от друга не только этиологическим спектром, особенностями клинического статуса, скоростью естественной эволюции, показателями смертности/летальности, но и подходами к стратификации риска, диагностике и лечению (рис. 1).
Действующие клинические рекомендации рассматривают инициальное стандартное симптоматическое лечение острой и хронической СН с помощью диуретиков, вазодилататоров и инотропных агентов как временную меру для реверсии клинических симптомов СН (утомляемость, одышка, отеки, другие признаки ретенции жидкости) и достижения клинической/гемодинамической стабилизации и эуволемического состояния [72]. Однако подобный подход, основанный на улучшении клинического статуса пациентов с СН, мало влияет на выживаемость и риск повторной госпитализации [40]. Улучшение клинических исходов достигается путем дополнительного назначения адекватных доз ИАПФ, АРА, β-АБ и АМКР [17, 39, 40].
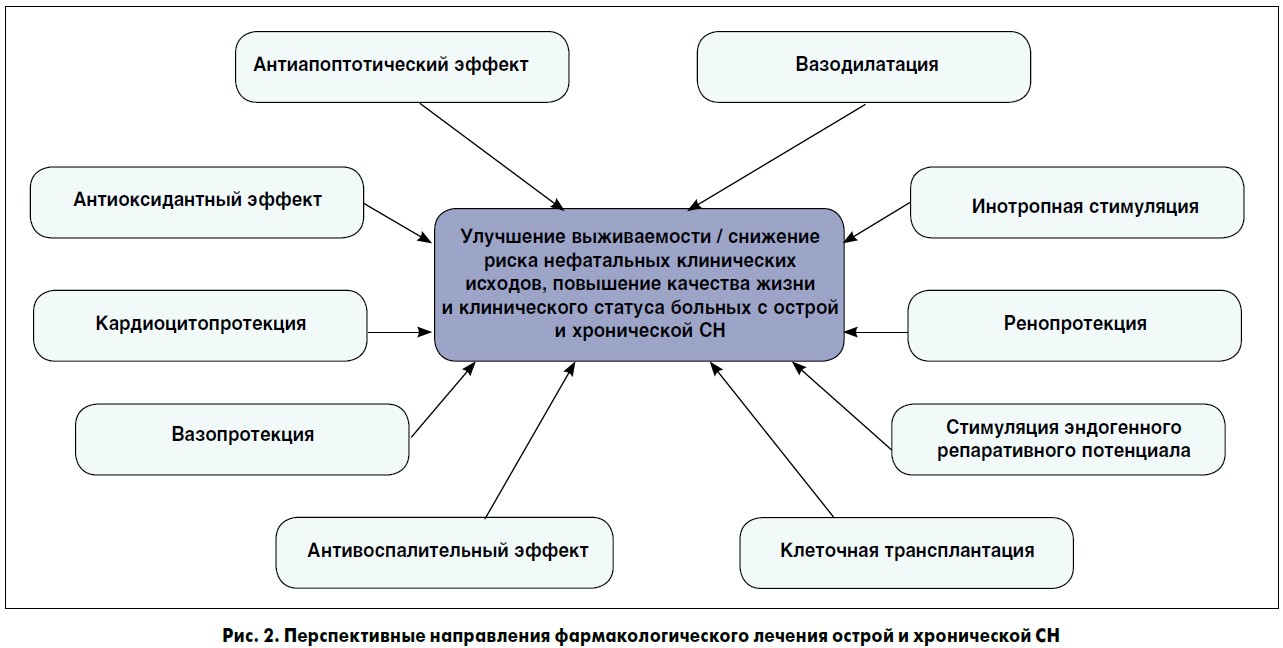
Тем не менее для многих клинических ситуаций, связанных с прогрессированием СН, именно коморбидные состояния, включая сахарный диабет (СД), хроническую болезнь почек, ожирение, гиперурикемию, гипотиреоз, АГ, в значительной мере определяют эффективность фармакологического лечения различных фенотипов СН [10, 79]. Все это создает необходимость поиска новых путей эффективного лечения острой и хронической СН, принципы которых представлены на рисунке 2.
Настоящий обзор литературы посвящен обсуждению перспективных направлений медикаментозного лечения различных фенотипов СН.
Нестероидные АМКР
Активация ренин-ангиотензиновой системы (РАС) посредством альдостеронового сигнального механизма осуществляется через специфические МКР. Последние широко представлены в различных эпителиальных, эндотелиальных и мезенхимальных тканях, а также кардиомиоцитах, эндотелиальных и гладкомышечных клетках, клетках эпителия канальцев нефрона, нейронах, макрофагах и адипоцитах. МКР опосредуют огромное количество специфических эффектов клеточного типа, многие из которых не связаны с векторным переносом ионов солей и воды [54]. МКР, как и другие стероидные рецепторы, представляют собой активируемый лигандом ядерный фактор транскрипции, который регулирует экспрессию генов, кодирующих белки, опосредующие его функцию через универсальные клеточные сигнальные пути (Akt/PIP3/STAT).
Несмотря на то что последние установлены, механизмы, с помощью которых МКР активируются стероидами, не вполне ясны. Неактивные МКР, предназначенные для транскрипционной функции, связаны с белками-шаперонами, которые удерживают рецептор в конформации, подходящей для связывания лиганда, и находятся в неактивном состоянии, в основном в цитоплазме [28].
После активации МКР транслоцируются в ядро, где образуют димеры и рекрутируют транскрипционные кофакторы с образованием комплекса транскрипции с элементами ответа ДНК-гормона с целью инициировать транскрипцию специфичных эффекторных белков [96]. Эта сигнальная система играет фундаментальную роль в ремоделировании сердца и сосудов при различных кардиоваскулярных заболеваниях, включая СН [8].
Доказательства роли хронической блокады МКР при ХСН представлены только для первой (спиронолактон) и второй (эплеренон) генерации этого класса веществ и касаются их способности снижать смертность и потребность в повторных госпитализациях у пациентов с СНснФВ. Это нашло свое отражение в действующих рекомендациях по профилактике и лечению СН (класс рекомендаций IА), в то время как роль представителей третьей генерации АМКР (финеренон) в лечении СН не установлена и требует детального изучения.
В отличие от стероидных АМКР (спиронолактон, эплеренон), финеренон представляет собой дигидропиридиновый дериват с крайне высокой специфичностью к МКР и низкой аффинностью к прогестероновым, глюкокортикоидным и андрогенным рецепторам. В этом контексте предполагается, что большая селективность финеренона может благоприятно сказаться на частоте ожидаемых нежелательных эффектов, свойственных всему классу АМКР: гинекомастии, гиперкалиемии и снижении почечной функции.
По крайней мере, в экспериментальных исследованиях финеренон превосходил эплеренон по способности повышать диурез, уменьшать гипертрофию миокарда, снижать циркулирующий уровень мозгового натрийуретического пептида (МНУП) и степень протеинурии [7]. Более того, в анимационной модели финеренон намного лучше, чем эплеренон, предотвращал ремоделирование сердца после инфаркта миокарда (ИМ) [43].
В клинических условиях получены доказательства достаточно высокой безопасности и хорошей переносимости финеренона у пациентов с хронической СНснФВ [70]. В последующем в плацебо-контролируемом рандомизированном клиническом исследовании (РКИ) ARTS-HF (MinerAlocorticoid Receptor antagonist Tolerability Study – Heart Failure) финеренон в дозе 5-10 мг/сут оказался эффективнее спиронолактона в дозе 25-50 мг/сут по способности снижать концентрацию NT-proМНУП у больных с хронической СНснФВ (n=392).
Необходимо отметить, что частота возникновения гиперкалиемии и снижения скорости клубочковой фильтрации (СКФ) была ниже в группе финеренона, чем в группе спиронолактона [69]. Таким образом, если оценивать только суррогатные конечные точки, можно предположить, что финеренон имеет существенные преимущества перед АМКР первой (спиронолактон) и второй (эплеренон) генерации, что требует подтверждения в условиях более крупных РКИ.
Уродилатин
Уродилатин является одним из представителей семейства эндогенных НУП, широко представленных в различных биологических жидкостях [9]. К настоящему времени идентифицированы несколько типов НУП, а именно: предсердный (тип А – ПНУП), мозговой (тип В – МНУП), васкулярный (тип C – СНУП), D-тип НУП и уродилатин. МНУП, ПНУП и уродилатин проявляют свой биологический эффект путем кооперации со специфическим ПНУП-рецептором 1 типа [9].
Последний активируется гуанилатциклазным сигнальным механизмом и обеспечивает вазодилатацию, стимуляцию диуреза, снижение продукции ренина, катехоламинов, а также люситропный (улучшение релаксации миокарда. – Прим. ред.), антипролиферативный и антимитотический эффекты [9].
Уродилатин синтезируется в эпителии тубулярного аппарата нефрона в ответ на повышение локальной концентрации натрия, оказывая непосредственное диуретическое действие через ингибирование резорбции соли и воды в проксимальном отделе нефрона, дилатацию приводящей артериолы и констрикцию отводящей артериолы, что оказывает регулирующее влияние в отношении СКФ.
Циркулирующий уровень уродилатина, как и других представителей семейства НУП, находится под контролем эндопептидаз, а клиренс зависит от экспрессии ПНУП-рецепторов 1 и 3 типов. Таким образом, эндогенные эффекты уродилатина выглядят достаточно привлекательно с точки зрения их модуляции у пациентов с острой и хронической СН, поскольку затрагивают ключевые аспекты патогенеза этого заболевания.
Действительно, в экспериментальных и клинических условиях получены доказательства кардио- и ренопротекторных качеств уродилатина [4]. Так, в ранних исследованиях II фазы внутривенное введение синтетического уродилатина (уларитид) как здоровым лицам, так и пациентам с острой декомпенсацией СН способствовало существенному снижению системного артериального давления (АД), легочного капиллярного давления и периферического сосудистого сопротивления на фоне повышения ударного объема и сердечного индекса, диуреза и натрийуреза [19, 22, 41].
В исследованиях SIRIUS (Safety and efficacy of an Intravenous placebo-controlled Randomized Infusion of Ularitide in a prospective double-blind Study in patients with symptomatic, decompensated chronic heart failure) I и II в широком диапазоне доз (от 7,5 до 30 нг/кг/мин) при 24-часовой внутривенной инфузии синтетический аналог уродилатина не только способствовал снижению легочного капиллярного давления, но и достоверно чаще по сравнению с плацебо приводил к улучшению клинического состояния, реверсии диспноэ, снижению потребности в дополнительной диуретической терапии, повышению сердечного индекса и реверсии циркулирующего уровня ПНУП и тропонина Т [58-60].
Тем не менее при проведении специально спланированного РКИ III фазы TRUE-AHF (TRial of Ularitide’s Efficacy and safety in patients with Acute Heart Failure) не было получено доказательств, касающихся существования преимуществ длительной 48-часовой инфузии синтетического аналога уродилатина в дозе 15 нг/кг/мин у пациентов с острой декомпенсацией СН (n=2152) в отношении кардиоваскулярной смертности и смерти от СН [67].
Результаты РКИ TRUE-AHF близки к таковым РКИ ASCEND-HF, которые также не продемонстрировали преимуществ рекомбинантного человеческого МНУП несеретида при острой СН в краткосрочной перспективе, хотя фармакотерапевтический профиль обоих препаратов позволял надеяться на благоприятные изменения в выживаемости больных при длительном наблюдении [53].
Цендеритид
Ранее в ряде РКИ рекомбинантный человеческий МНУП несеретид продемонстрировал противоречивые результаты в лечении пациентов с острой декомпенсацией ХСН [66, 77]. Многие исследователи отмечали, что широкий спектр нежелательных побочных эффектов препарата существенно превосходит его терапевтический потенциал [74, 90]. Начиная с 2001 года, когда Управление по контролю качества продуктов питания и лекарственных средств США (FDA) одобрило использование несеретида для лечения острой СН и острой декомпенсации ХСН, продолжают накапливаться данные о нефротоксичности этого препарата на фоне тенденции к повышению смертности. Они нашли свое подтверждение в результатах РКИ ASCEND-HF [71]. В целом эти данные привели к высокой доле скептицизма, касающейся потенциала рекомбинантных НУП в лечении пациентов с острой СН.
Новые возможности появились после синтезирования цендеритида – человеческого СНУП, который обладал способностью реализовывать свой фармакологический эффект через активацию гуанилатциклазных рецепторов двух типов – А и В [18]. Кроме того, препарат проявлял чрезвычайно высокую аффинность к рецептору ПНУП 2 типа, благодаря чему в меньшей мере, чем несеритид, индуцировал системную вазодилатацию и гипотензию, негативно влияющую на почечный кровоток и диурез. В экспериментальных условиях цендеритид продемонстрировал антифибротический и ренопротекторный эффекты. В клинических исследованиях I фазы была обнаружена способность препарата улучшать системную гемодинамику и почечный кровоток.
В последующем у пациентов с ишемической острой СН и острой декомпенсацией ХСН цендеритид уменьшал потребность в механической инотропной поддержке существенно лучше, чем плацебо. Вместе с тем снижения риска наступления смертельного исхода на фоне использования препарата в первые 48 ч острой СН получено не было.
Комбинация сакубитрил + валсартан (LCZ696)
Сегодня на рынке присутствует фиксированная комбинация ингибитора неприлизина сакубитрила и АРА валсартана. Неприлизин представляет собой эндогенный энзим, основная биологическая роль которого сводится к деградации широкого спектра биологических пептидов, включая НУП и амилоидозависимые протеины. Результатом этого эффекта является повышение циркулирующего уровня вазоактивных НУП в крови.
Фиксированная комбинация сакубитрила и валсартана – первый представитель нового класса лекарственных средств, созданных для лечения ХСН. Препарат получил одобрение FDA после досрочного завершения РКИ PARADIGM-HF, в котором оценивалась эффективность и безопасность его применения у пациентов (n=8442) с хронической СНснФВ (первоначально <40%, а затем в ходе проведения рандомизации эта величина была снижена до ≤35%) и повышенной концентрацией МНУП.
В качестве препарата сравнения использовался ИАПФ эналаприл. Согласно полученным данным применение комбинации сакубитрил + валсартан позволило снизить риск внезапной смерти на 20%, вероятность первичной и повторной госпитализации – на 21 и 23% соответственно по сравнению с эналаприлом [80].
При этом профиль безопасности комбинации был сходным с таковым эналаприла. Исследователи полагают, что улучшение клинических исходов при терапии ХСН, основанной на двойной блокаде РАС и неприлизина, может быть связано с реверсией кардиального фиброза и гипертрофии миокарда, улучшением функции эндотелия и уменьшением биомеханического миокардиального стресса. Кроме того, сакубитрил, вероятно, обладает самостоятельным кардио- и ренопротекторным эффектом.
Еще одним предметом обсуждения в научных дискуссиях стали опасения о возможно высокой ожидаемой частоте ангионевротического отека вследствие двойной блокады РАС и неприлизина. Действительно, в РКИ наблюдался достоверно более высокий риск возникновения этого потенциально фатального осложнения на фоне применения ингибиторов АПФ и неприлизина, чем при приеме ИАПФ.
Вместе с тем предварительные данные позволяли считать, что комбинация сакубитрила и валсартана может быть существенно безопаснее омапатрилата. Хотя номинально частота возникновения ангионевротического отека в группе пациентов, получавших данную комбинацию в РКИ PARADIGM-HF, была выше, чем в группе ИАПФ эналаприла (19 случаев по сравнению с 10 случаями соответственно), эти побочные явления не были угрожающими для жизни и не требовали специального лечения, кроме отмены терапии.
На этапе включения в исследование около 20% пациентов были исключены из групп эналаприла или комбинации сакубитрила и валсартана вследствие различных причин, среди которых >50% (n=1138) были связанны именно с возникновением нежелательных эффектов лекарственных средств [93].
Поскольку неприлизин является одним из энзимов, вовлекаемых в деградацию и последующий клиренс протеинов амилоида, существовала гипотетическая опасность повышения риска системного амилоидоза. Для пациентов с ХСН одним из компонентов амилоида могут стать концевые фрагменты НУП. Формирующийся в этом случае амилоид проявляет тропность к мозговой ткани, локализуясь преимущественно в префронтальной коре и ядрах промежуточного мозга.
Насколько этот процесс ответственен за возникновение когнитивных нарушений, ослабление функции запоминания и прогрессирования деменции, не вполне понятно. Однако в РКИ PARADIGM-HF не было обнаружено каких-либо негативных эффектов длительной двойной блокады РАС и неприлизина у пожилых лиц с ХСН [93].
В целом оказалось, что комбинация сакубитрил + валсартан может заменить терапию на основе ИАПФ эналаприла в качестве золотого стандарта лечения СНснФВ. Данных о клинической эффективности нового препарата у пациентов с другими фенотипами ХСН пока не получено.
Однако согласно результатам РКИ II фазы PARAMOUNT-HF у больных с ХСН (n=301) и сохраненной ФВ ЛЖ 12-недельное использование комбинации сакубитрил + валсартан способствовало большему снижению концентрации NT-proМНУП, чем применение валсартана.
В отличие от МНУП, NT-proМНУП не является субстратом для неприлизина, и в этом контексте полученные данные свидетельствуют о благоприятном влиянии сакубитрила + валсартана в отношении миокардиального биомеханического стресса и кардиоваскулярного ремоделирования [80]. Клиническая значимость полученных данных в настоящее время оценивается в РКИ PARAGON-HF, основанном на анализе клинических исходов 4300 больных с хронической СНсохрФВ [83].
Стимуляция солюбилизированной гуанилатциклазы
Модулирование биологических эффектов оксида азота (NO) выглядит достаточно привлекательно с точки зрения превенции возникновения и прогрессирования дисфункции эндотелия, которая, в свою очередь, рассматривается в качестве важнейшего механизма формирования кардиоваскулярных заболеваний и их осложнений, включая СН. Установлено, что биодоступность NO при СН зависит от снижения синтеза последнего, повышения его деградации вследствие оксидативного стресса и нарушений в системе регуляции его синтеза [2, 3]. Принимая во внимание эти факты, традиционные подходы, касающиеся использования доноров NO в виде нитратов или производных сиднонимина, не затрагивающие основные причины снижения биодоступности NO, выглядят малопривлекательно и отличаются низкой клинической эффективностью.
Альтернативным подходом является модулирование активности NO-зависимой солюбилизированной (растворимой) гуанилатциклазы [84]. Действительно, прогрессирование СН тесно ассоциируется со снижением активности солюбилизированной гуанилатциклазы, уменьшением тканевой перфузии и увеличением периферического сосудистого сопротивления на фоне дефицита циркулирующего NO и оксидативного стресса.
Предполагают, что поддержка активности солюбилизированной гуанилатциклазы может стать достаточно эффективным методом предотвращения кардиального и васкулярного ремоделирования, развивающегося вследствие аккумуляции внеклеточного матрикса, фиброза, ишемического/реперфузионного миокардиального повреждения, биомеханического стресса, а также апоптоза кардиомиоцитов и митохондриальной дисфункции [44]. Вероятно, эти эффекты могли бы быть потенцированы ИАПФ или АРА, учитывая потенциальную синергичность фармакологического действия в отношении принципиальных молекулярных мишеней [33].
Синтезированная к настоящему времени группа лекарственных препаратов (цинацигуат, риоцигуат, верицигуат), молекулярной мишенью которых является солюбилизированная гуанилатциклаза, демонстрирует широкий спектр прямых и непрямых кардиоваскулярных и ренальных эффектов (стимуляция диуреза, снижение пред- и постнагрузки, легочного капиллярного давления, повышение насосной функции миокарда), которые могли бы быть полезны при лечении различных фенотипов СН [62].
Один из них – риоцигуат – уже одобрен для лечения легочной АГ в ряде стран [34]. Тем не менее наиболее серьезным ограничением для их широкого применения по показанию СН является системная постуральная гипотензия, иногда крайне выраженная [33]. В раннем неконтролируемом исследовании цинацигуат (известный также как BAY58-2667) способствовал достоверному снижению давления наполнения ЛЖ и регрессии диспноэ у пациентов с острой СН [62].
Системная гипотензия отмечалась исследователями как наиболее частый нежелательный побочный эффект. В последующем в программе COMPOSE, включающей в себя три РКИ с различными вариантами дозирования цинацигуата пациентам с острой СН, не было подтверждено благоприятного эффекта препарата в отношении тяжести и реверсии диспноэ, улучшения клинического статуса больных и повышения контрактильной способности миокарда ЛЖ. В связи с этим все три РКИ были преждевременно завершены [32].
В двойном слепом РКИ IIb фазы LEPHT (Left Ventricular Systolic Dysfunction Associated With Pulmonary Hypertension Riociguat Trial) риоцигуат продемонстрировал свою способность увеличивать контрактильные качества миокарда и снижать легочное сосудистое сопротивление у больных с легочной АГ (n=201), индуцированной систолической дисфункцией ЛЖ [76].
При этом препарат не оказывал существенного влияния на легочное АД. Учитывая, что легочная АГ является более частой находкой у пациентов с ХСН и сохраненной ФВ, представляет клинический интерес перспектива улучшения результативности лечения именно этого фенотипа заболевания. В РКИ VICTORIA (Vericiguat Global Study in Subjects With Heart Failure With Reduced Ejection Fraction) и SOCRATES-PRESERVED (SOluble guanylate Cyclase stimulatoR in heArT failurE patientS with PRESERVED ejection fraction) тестировалась гипотеза о возможности улучшения клинических исходов у пациентов с хронической СНсохрФВ при добавлении к стандартной терапии верицигуата [6, 24]. Анализ полученных данных показал, что в группе верицигуата имело место более существенное снижение циркулирующего уровня NT-proМНУП и объема левого предсердия, чем в группе традиционного лечения.
При этом частота возникновения системной постуральной гипотензии оказалась невысокой [27]. В этом контексте, вероятно, требуются более масштабные РКИ с оценкой твердой клинической конечной точки, чтобы более детально оценить перспективы нового класса веществ в лечении различных фенотипов СН.
Серелаксин
Серелаксин представляет собой рекомбинантный аналог эндогенного человеческого пептида релаксина‑2, относящегося к семейству релаксинов RXFP1 (Relaxin Family Peptide Receptor 1), оказывающих непосредственный вазодилатирующий эффект через стимуляцию мембран-ассоциированных G-протеин-кооперированных рецепторов [91]. Последние широко представлены в эндотелии, миокарде, тубулярном аппарате нефрона и мозге. Релаксины играют важную роль в гемодинамической адаптации организма женщины к беременности [21].
Повышение концентрации релаксинов в крови обеспечивает повышение гломерулярной фильтрации как за счет увеличения эффективного кровотока через гломерулярный аппарат, так и вследствие потенцирования локального вазопрессорного эффекта ангиотензина II в отношении отводящей артериолы. Кроме того, релаксины способствуют увеличению минутного объема кровообращения, непосредственно влияя на повышение частоты сердечных сокращений (ЧСС) и ударного объема.
Установлено, что эти пептиды способны активировать быстрые сигнальные пути (AMPK-AKT), приводящие к экспрессии NO-синтазы, а также ряд сигнальных путей замедленного типа (ALK‑5/Smad2/3), способствующих стимуляции рецептора эндотелина типа В и экспрессии проангиогенных факторов роста и матриксных металлопротеиназ (стромелизина и желатиназ) [5, 48, 95].
Таким образом, модулируя эндогенные вазодилатирующие эффекты, релаксины способны потенцировать диурез и предотвращать кардиоваскулярное ремоделирование без негативного влияния в отношении системного АД. Эти качества релаксинов выглядели вполне привлекательно и укладывались в концепцию лечения острой СН, что и привело к созданию рекомбинатного аналога эндогенного человеческого пептида релаксина‑2 – серелаксина [63].
В клинических условиях серелаксин изучался в специально спланированном двойном слепом РКИ Pre-RELAX-AHF, в которое были включены 92 234 пациента с острой СН. Больные получали 48-часовую внутривенную инфузию серелаксина в диапазоне четырех доз (10-250 мкг/кг/сут) или плацебо. В качестве критериев включения использовались наличие клинических признаков острой СН, уровень систолического АД >125 мм рт. ст., СКФ 30-75 мл/мин/1,73 м2.
Анализ полученных данных показал, что на фоне инфузии серелаксина имела место реверсия выраженности одышки и других признаков прогрессирования дисфункции ЛЖ, что способствовало сокращению времени пребывания пациентов в отделении неотложной помощи, уменьшению частоты смертельных исходов вследствие кардиоваскулярных причин и СН, а также частоты повторной госпитализации через 60 сут после выписки из стационара [88].
Результаты выглядели оптимистично, что повлекло за собой проведение нового РКИ III фазы RELAX-AHF. В исследовании участвовали 1161 пациент с острой СН, которые получали серелаксин (30 мг/кг/сут в виде 48-часовой инфузии) или плацебо [86]. Пациенты рандомизировались в одну из двух групп наблюдения в пределах 18 ч после возникновения первых признаков острой СН или острой декомпенсации ХСН. Критериями включения были систолическое АД >125 мм рт. ст., СКФ 30-75 мл/мин/1,73 м2, наличие одышки в состоянии покоя, признаки «перегрузки» малого круга на рентгенограмме, а также увеличение концентрации МНУП в крови.
Серелаксин подтвердил свою способность существенно уменьшать выраженность одышки у пациентов с острой СН, однако препарат не влиял на показатели смертности и потребность в повторных госпитализациях в краткосрочной перспективе (в пределах 60 сут) [86].
Тем не менее показатель общей смертности через 180 сут после выписки из стационара был достоверно меньше в группе серелаксина, чем в группе плацебо (отношение шансов, ОШ 0,63; 95% доверительный интервал, ДИ 0,43-0,93; p=0,02). Снижение частоты кардиоваскулярной смерти через 180 сут после выписки также было обнаружено в группе серелаксина. Интересно, что улучшение клинических исходов не зависело от фенотипа СН и регистрировалось у пациентов с СНснФВ и СНсохрФВ [25].
При этом инфузия серелаксина приводила к выраженному снижению содержания в плазме крови МНУП, тропонина Т и креатинина на фоне уменьшения величины легочного капиллярного давления и увеличения суточного диуреза [56, 73]. Кроме того, оказалось, что серелаксин одинаково эффективен как у пациентов с фибрилляцией предсердий, так и у больных с синусовым ритмом [23]. Однако исследователи обнаружили снижение частоты мозгового инсульта в группе пациентов с фибрилляцией предсердий и острой СН, получавших лечение серелаксином [23].
Можно согласиться с тем, что ученые расценили результаты Pre-RELAX-AHF и RELAX-AHF как впечатляющие и обнадеживающие, поэтому следующее РКИ RELAX-AHF‑2 было встречено с высокой долей оптимизма [89]. В это РКИ планируется включить 6800 больных с острой СН, распределив их в группы 48-часовой внутривенной инфузии серелаксина (30 мкг/кг/сут) или плацебо.
Первичными конечными точками РКИ заявлены кардиоваскулярная смерть через 180 сут после начала терапии или клинические признаки прогрессирования СН. В качестве вторичных конечных точек будут проанализированы показатели общей смерти, комбинированный показатель общей + кардиоваскулярной смерти, частота повторной госпитализации через 180 сут и общая продолжительность нахождения в стационаре. Исследование планируется завершить в 2018 году. Кроме RELAX-AHF‑2, запланированы и выполняются RELAX-AHF-EU и RELAX-AHF-ASIA.
Первое представляет собой открытую ветвь РКИ RELAX-AHF, в которой продолжается наблюдение за пациентами с острой СН (n=2685), получающими лечение серелаксином дополнительно к стандартной терапии. Первичной конечной точкой исследования является кардиоваскулярная смерть через 180 сут после начала терапии.
РКИ RELAX-AHF-ASIA основано на наблюдении за 1520 больными с острой СН, получающими терапию серелаксином или плацебо дополнительно к стандартному лечению на протяжении 48 ч. Первичной конечной точкой РКИ служит реверсия симптомов острой СН, которая оценивается по динамике тяжести одышки на протяжении 48 ч наблюдения. Результаты обоих исследований будут доступны к концу 2018 года.
Алискирен
Первые прямые ингибиторы ренина (ПИР: эналкирен, ремикирен, занкирен) были синтезированы в середине 70-х годов прошлого века, а клинические результаты, касающиеся их использования у здоровых добровольцев и пациентов с АГ, стали доступны с конца 1980-х годов.
Ученые столкнулись с рядом трудностей, связанных с чрезвычайно низкой биодоступностью ПИР в желудочно-кишечном тракте (<2%), коротким периодом полужизни и низкой стабильностью компонентов в таблетированной форме, что существенно ограничивало терапевтический потенциал ПИР вообще [1]. Прорыв произошел после синтезирования алискирена, представляющего собой непептидный низкомолекулярный ПИР для перорального приема.
Препарат не оказывает дополнительного ингибирующего влияния на другие аспартатные пептидазы, такие как катепсин D и пепсин, ни в экспериментальных, ни в клинических условиях [94]. К тому же алискирен в значительной степени блокирует секрецию ренина даже в относительно низких дозах и в условиях ограниченной биодоступности. Алискирен способен аккумулироваться в секреторных гранулах, которые содержат ренин, снижая активность последнего, а также приводить к дозозависимому связыванию плазменного проренина [46].
Алискирен препятствует связыванию ренина и проренина на специфических рецепторах [78], тормозит продукцию ангиотензина II за счет ренин-зависимых и ренин-независимых механизмов [29]. Таким образом он предотвращает реализацию феномена «ускользания», характерного для остальных препаратов, блокирующих РАС, включая ИАПФ и АРА [2].
Ранние исследования первой и второй фазы показали, что препарат способствует эффективной блокаде РАС и дозозависимому предотвращению повышения уровня системного АД и периферического сосудистого сопротивления, приводя почти к 80% редукции исходной концентрации ренина и ангиотензина II [65].
Для участия в РКИ ALOFT (Aliskiren Observation of Heart Failure Treatment) были отобраны 320 пациентов с манифестной СН, получавших алискирен или плацебо дополнительно к традиционной терапии. Анализ результатов показал, что плазменное содержание МНУП в группе алискирена снизилось в большей степени, чем в группе плацебо.
Это ассоциировалось с более существенной редукцией выраженности митральной регургитации, улучшением профиля трансмитрального кровотока и снижением конечно-диастолического объема ЛЖ у пациентов, получавших алискирен. Учитывая благоприятные результаты РКИ ALOFT, решение вопроса о влиянии препарата на твердые конечные точки у пациентов с СН было адресовано РКИ ATMOSPHERE (Aliskiren Trial to Minimise OutcomeS in Patients with HEart FailurE) и ASTRONAUT (Aliskiren Trial on Acute Heart Failure Outcomes).
В РКИ III фазы ALTITUDE принимали участие 8561 пациент с СД 2 типа в сочетании с кардиоваскулярным заболеванием или хронической болезнью почек. Участники получали алискирен или плацебо дополнительно к ИАПФ или АРА. РКИ было остановлено преждевременно из-за проблем с безопасностью (повышение частоты гиперкалиемии, гипотензии и терминальной почечной дисфункции) и отсутствия существенного клинического эффекта [68]. Следует отметить, что среди участников этого РКИ отмечалась очень небольшая доля лиц с документированной ХСН. В РКИ III фазы ASTRONAUT приняли участие пациенты с острой декомпенсацией ХСН (n=1639), получавшие лечение алискиреном или плацебо дополнительно к стандартной терапии [31].
Авторы исследования пришли к заключению, что алискирен по сравнению с плацебо способствовал незначительному снижению относительного риска кардиоваскулярной смерти и повторной госпитализации вследствие СН на протяжении 6 мес (первичная конечная точка) и 12 мес (вторичная конечная точка) после выписки из стационара. Анализ в подгруппах показал наличие дополнительных преимуществ у пациентов с СД 2 типа, получавших лечение алискиреном, по сравнению с плацебо [50].
В РКИ II фазы ATMOSPHERE было проведено прямое сопоставление эффективности монотерапии алискиреном (300 мг/сут) и ИАПФ эналаприлом (10 мг 2 р/сут), а также их комбинации в когорте 7016 больных с ХСН II-IV функциональных классов по NYHA и ФВ ЛЖ <35%. У всех пациентов имела место существенная элевация циркулирующего МНУП. Первичной конечной точкой являлся комбинированный показатель кардиоваскулярной смерти и госпитализации вследствие СН.
Поскольку РКИ ALTITUDE было уже остановлено ранее намеченного срока, комитет по этике ограничил рандомизацию больных с СД в РКИ ATMOSPHERE. Тем не менее среди рандомизированных лиц 1944 пациента (27,7%) имели СД 2 типа [45]. Анализ результатов РКИ ATMOSPHERE показал, что первичная конечная точка (кардиоваскулярная смерть или госпитализация вследствие СН) была зарегистрирована у 216 пациентов (33,1%) из группы эналаприла, у 172 больных (27,4%) в группе алискирена (ОШ 0,82; 95% ДИ 0,67-1,00; p=0,053) и у 196 больных (29,5%) в группе комбинированного лечения (ОШ 0,86; 95% ДИ 0,71-1,04; p=0,13).
Таким образом, у пациентов с хронической СНснФВ и СД 2 типа не было преимуществ при использовании алискирена перед монотерапией ИАПФ эналаприлом или их комбинации. Авторы отметили низкий риск системной гипотензии в группе алискирена по сравнению с группой эналаприла (42 случая (6,7%) против 65 случаев (10,0%); p=0,04), несмотря на то что комбинированная терапия сопровождалась большим количеством побочных эффектов, не затрагивающих твердые клинические конечные точки. В целом можно заключить, что алискирен не продемонстрировал преимуществ перед стандартной терапией ХСН.
Инотропные агенты
Инотропные лекарственные средства, такие как милринон, веснаринон и добутамин, находят широкое применение в лечении кардиогенного шока и острой СН, особенно на этапе развития органной гипоперфузии [42]. Действительно, стимуляция β1-рецепторов или непосредственная активация аденилатциклазного механизма через ингибирование фосфодиэстеразы‑3 (ФДЭ‑3) сопровождается повышением инотропной активности, увеличением ЧСС, а также дозозависимым влиянием на периферическое сосудистое сопротивление и СКФ [75].
Вместе с тем представлены доказательства негативного влияния инотропной поддержки с помощью β1-агонистов (добутамин) и многих представителей класса ингибиторов ФДЭ‑3 (милринон) на риск смертельного исхода вследствие проаритмического эффекта, индукции ИМ и почечной дисфункции [52]. Напротив, в РКИ ESSENTIAL (The Studies of Oral Enoximone Therapy in Advanced HF) ингибитор ФДЭ‑3 эноксимон не приводил к увеличению частоты смертельного исхода при длительном назначении пациентам с острой СН [57].
Одним из наиболее успешных представителей группы ингибиторов ФДЭ‑3 («сенситайзеров») оказался левосимендан, продемонстрировавший преимущества перед добутамином в отношении выраженности инотропного эффекта без существенного повышения потребления кислорода миокардом [26]. Однако в клинических условиях эти преимущества не были реализованы в виде улучшения выживаемости и снижения смертности по отношению к добутамину [38].
Новые перспективы открылись после успешной апробации омекамтива мекарбила – низкомолекулярного активатора сердечного миозина [61]. Благодаря связыванию с каталитическим доменом АТФазы миозина кардиомиоцита омекамтив мекарбил увеличивает скорость перехода миозина в связанное с актином состояние, что приводит к увеличению времени контакта актомиозинового комплекса.
По сравнению с β1-агонистами препарат не способствует увеличению поступления кальция из саркоплазматического ретикулума. В анимационной модели СН омекамтив мекарбил способствовал существенному увеличению величины ударного и минутного объемов на фоне снижения ЧСС [51, 81].
В ранних исследованиях I фазы у здоровых добровольцев препарат не оказывал неожиданных эффектов, кроме позитивного дозозависимого инотропного действия, сопряженного со снижением ЧСС [85]. В раннем двойном слепом РКИ II фазы применение омекамтива мекарбила у пациентов с хронической СНснФВ приводило к повышению ударного объема, ФВ ЛЖ, снижению ЧСС без негативного эффекта в отношении величины системного АД [15].
В плацебо-контролируемом РКИ IIb фазы ATOMIC-AHF изучалось влияние омекамтива мекарбила на выраженность одышки у 613 пациентов с острой декомпенсацией хронической СНснФВ. Оказалось, что при объединенном анализе эффекта всех использованных доз влияние омекамтива мекарбила на одышку не отличалось от такового плацебо. Только экстремально высокая доза препарата привела к значительному улучшению клинического состояния пациентов и реверсии одышки [92]. Кроме того, авторы РКИ сообщили о небольшом увеличении циркулирующего уровня тропонина I без четкого отношения к плазменным концентрациям омекамтива мекарбила.
При этом не было зарегистрировано увеличения атеротромботических событий или аритмии. В двойном слепом рандомизированном плацебо-контролируемом РКИ II фазы COSMIC-HF оценивали эффективность, безопасность и фармакокинетические характеристики омекамтива мекарбила при 20-недельном назначении 544 пациентам с хронической СНснФВ [87]. Полученные данные показали, что препарат обладает дозозависимым эффектом в отношении уменьшения размеров полостей сердца, повышения ФВ ЛЖ и реверсии циркулирующего пула МНУП. При этом не было отмечено эпизодов ишемии миокарда.
Таким образом, омекамтив мекарбил, вероятно, представляет собой достаточно эффективный препарат с выраженным инотропным потенциалом, заслуживающим более детального изучения в условиях широкомасштабных РКИ у пациентов с острой и хронической СН.
Рекомбинантный человеческий нейрегулин‑1
Нейрегулин является кардиальным фактором роста, который выделяется эндотелием сосудов и принимает активное участие в регуляции роста, дифференцировки тканей через систему рецепторов ErbB [14]. Ранее было установлено, что у мышей с нарушением экспрессии ErbB2 или ErbB4 возникает дилатационная кардиомиопатия с СНснФВ [20].
Система ErbB – нейрегулин является сигнальным механизмом, необходимым для предотвращения кардиотоксичности при проведении полихимиотерапии, включая применение доксирубицина и трастулизумаба. Эти сведения привлекли внимание исследователей с точки зрения использования эндогенного репаративного потенциала системы ErbB – нейрегулин при СН. В серии экспериментов на животных с различными моделями СН удалось установить возможность устойчивого улучшения контрактильных качеств миокарда, релаксационной функции и выживаемости после использования рекомбинантного человеческого нейрегулина‑1 [49].
В клинических исследованиях II фазы были протестированы различные дозы препарата у пациентов с хронической СНснФВ (ФВ <40%) [30]. Этим пациентам случайным образом был назначен рекомбинантный человеческий нейрегулин‑1 в диапазоне доз 0,3; 0,6 или 1,2 мкг/кг или плацебо внутривенно в течение 10 ч на протяжении 10 последовательных дней. По сравнению с плацебо лечение рекомбинантным человеческим нейрегулином‑1 приводило к большему увеличению ФВ ЛЖ по сравнению с исходным уровнем на фоне сокращения размеров полостей ЛЖ.
Эти результаты свидетельствуют о потенциальной обратимости кардиального ремоделирования при СН. Для альтернативной стратегии модулирования активности эндогенной системы ErbB – нейрегулин использовался глиальный фактор роста‑2, который представляет собой изоформу нейрегулин‑1β. У крыс внутривенное введение глиального фактора роста‑2 после экспериментального ИМ на протяжении 4 нед улучшало контрактильную функцию миокарда по сравнению с плацебо [36]. Тем не менее ограниченность клинических данных не позволяет делать серьезные выводы, касающиеся возможной эффективности нового медикаментозного подхода у пациентов с СН.
В заключение необходимо отметить, что среди новых медикаментозных стратегий лечения, появившихся в последние 10 лет, несомненный успех сопутствовал только двойной блокаде РАС и неприлизина с помощью АРА валсартана + сакубитрила и АМКР. Также большие ожидания сохраняются для омекамтива мекарбила, серелаксина и потенциаторов системы НУП. Насколько они действительно оправданы, покажет недалекое будущее. Во всяком случае, крупные РКИ уже запланированы и результаты значительной части из них будут доступны для анализа в течение текущего года.
Список литературы находится в редакции.
Статья напечатана в журнале
«Сердечная недостаточность
и коморбидные состояния», № 1, 2018.
Тематичний номер «Кардіологія, Ревматологія, Кардіохірургія» № 3 (58) червень 2018 р.