5 жовтня, 2018
Руководство EASL по лечению и диагностике алкогольной болезни печени и ассоциированных заболеваний
Ежегодно 3,3 млн человек умирают по причинам, связанным со злоупотреблением алкоголем, что составляет 6% от общей смертности. Этот показатель отражает глобальные тенденции, однако в Европейском регионе он достигает своего максимума. Среднее потребление чистого алкоголя на душу населения в Европе составляет 10,9 л/год, в то время как в мире – 6,2 л/год.
Злоупотребление алкоголем влияет на развитие ряда злокачественных заболеваний и патологий со стороны желудочно-кишечного тракта (ЖКТ), сердечно-сосудистой и других систем, являющихся частыми причинами смертности. Однако основная причина смертности у таких пациентов – заболевания печени, в особенности цирроз.
По данным Всемирной организации здравоохранения, 41% смертей по причине заболеваний печени приходится на алкогольную этиологию.
В связи с высокой актуальностью проблемы EASL было разработано и одобрено данное руководство по диагностике и лечению алкогольной болезни печени (АБП) и состояний, ассоциированных с ней. В разработке принимали участие клиницисты, каждый из которых в итоге дал независимую оценку материалов; был учтен конфликт интересов, а также уровни доказательности приведенных данных.
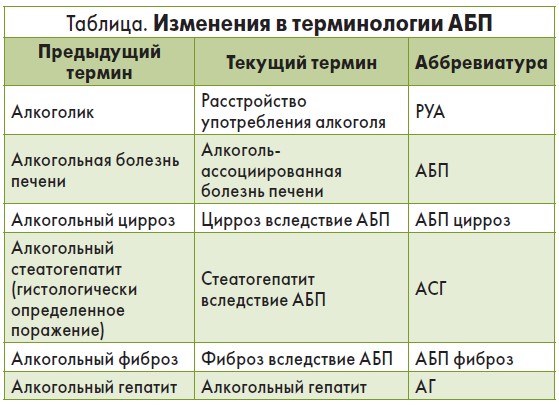
Терминология
Чтобы избежать стигматизации, некоторые термины были изменены (табл.).
 Согласно МКБ‑10, вредным считается употребление алкоголя, которое наносит ущерб физическому либо умственному здоровью. Тяжелое эпизодическое употребление алкоголя было определено как потребление более 60 г чистого алкоголя за 1 раз. Неумеренное употребление алкоголя определяется как потребление в течение примерно 2 ч ≥4 напитков (за стандартный «напиток» принимается 10 г чистого алкоголя) для женщин и ≥5 напитков для мужчин.
Согласно МКБ‑10, вредным считается употребление алкоголя, которое наносит ущерб физическому либо умственному здоровью. Тяжелое эпизодическое употребление алкоголя было определено как потребление более 60 г чистого алкоголя за 1 раз. Неумеренное употребление алкоголя определяется как потребление в течение примерно 2 ч ≥4 напитков (за стандартный «напиток» принимается 10 г чистого алкоголя) для женщин и ≥5 напитков для мужчин.
DSM-V определяет АБП как проблемную схему употребления алкоголя, приводящую к клинически значимым нарушениям физического либо психического здоровья и предлагает 11 критериев для оценки ее тяжести.
Присутствие по меньшей мере 2 из этих критериев указывает на наличие АБП. Тяжесть АБП определяется как:
- легкая: наличие от 2 до 3 критериев;
- умеренная: наличие от 4 до 5 критериев;
- тяжелая: наличие 6 или более критериев.
Зависимость между количеством потребляемого алкоголя и риском смертности можно представить в виде j-образной функции.
В частности, было отмечено, что смертность от цирроза печени существенно увеличивается при потреблении 12-24 г этанола в день.
Высокая смертность от цирроза обусловлена поздним его выявлением, уже на стадии декомпенсации. В связи с этим есть большая потребность в скрининговых программах для АБП.
Подобный скрининг осуществляется врачами общей практики во время первичной медицинской помощи, профилактических осмотров, особенно среди лиц, входящих в группу риска (лица, прошедшие реабилитацию, и те, у кого ранее были зарегистрированы случаи злоупотребления алкоголем).
Кроме того, скрининг АБП следует проводить у пациентов с клиническими симптомами, указывающими на злоупотребление алкоголем или цирроз печени, то есть пациентов с двусторонней гипертрофией околоушной железы, гипотрофией мышц, сниженным питанием, контрактурой Дюпюитрена, гинекомастией или обширными паукообразными гемангиомами.
На данный момент вопрос о наиболее эффективном скрининговом методе остается открытым. С этой целью используются тесты для определения функции печени (сывороточные уровни гамма-глутамилтрансферазы (ГГТ), аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ), общий билирубин и его фракции; альбумин, протромбиновое время или международное нормализованное отношение (МНО), количество лейкоцитов – при подозрении на прогрессирующий фиброз или цирроз). Широко применяется транзиентная эластография (ТЭ), которая особенно эффективна в диагностике фибротических изменений печени.
В случае наличия изменений при ТЭ используют ультразвуковое исследование (УЗИ). С целью исключения иных этиологических причин поражения печени определяют антитела к HBV, HBC, аутоиммунные маркеры, уровень трансферрина и его насыщение, альфа‑1-антитрипсин, в случае необходимости церулоплазмин.
Из инвазивных методик применяется биопсия печени. Ее можно использовать для установления диагноза АБП, оценки стадии, прогноза заболевания печени и исключения альтернативных или дополнительных причин поражения печени. Морфологический спектр АБП включает в себя 4 группы поражений, которые в предцирротической стадии преобладают в центральных областях печеночных долей:
а) макровезикулярный стеатоз, неоднородная комбинация макро- и микровезикул (стеатоз смешанного типа);
b) гепатоцеллюлярное повреждение с баллонированием, потенциальным некрозом;
в) долевое воспаление;
d) фиброз или цирроз.
У пациентов с противопоказаниями к биопсии (например, с АГ) уместно использование неинвазивных диагностических методик, таких как ELF-test (тест на обширный фиброз печени), FibroTest, FIB‑4, PGAA index, Fibrometer, основанных на определении уровней сывороточных маркеров фиброза.
Визуализационные методики – магнитно-резонансная томография (МРТ), компьютерная томография (КТ) и УЗИ – могут дать количественную оценку стеатоза, помочь исключить другие причины хронического заболевания печени, в частности первичный склерозирующий холангит, и способствуют оценке прогрессирования патологии и ее осложнений, независимо от этиологии, однако не играют роли в определении алкоголя как специфического этиологического фактора.
Существует ряд тестов в виде вопросников и анкет для выявления факта злоупотребления алкоголем. Подобные тесты очень популярны благодаря доступности и простоте в использовании. Например, AUDIT (тест риска расстройств употребления алкоголя) – один из классических примеров таких тестов. AUDIT состоит из 10 вопросов, которые исследуют потребление (1-3), зависимость (4-6) и проблемы, связанные с алкоголем (7-10). Есть 2 отправные точки: 1 – для зависимости и 1 – для риска злоупотребления. Были разработаны более короткие версии.
Скажем, AUDIT-C включает только первые 3 вопроса AUDIT и подходит для скрининга «рискованного употребления алкоголя». Фактически это стандартизированный способ быстрого применения количественно-частотной анкеты, которая включает «эпизодическое употребление». NIAAA (Национальный институт злоупотребления алкоголем и алкоголизма) рекомендует использовать только 3-й вопрос AUDIT (Как часто вы употребляете 6 или более напитков (10 г этанола) по одному случаю?), за которым следует весь AUDIT в случае, если ответ положительный.
По сравнению с непрямыми маркерами АБП прямые маркеры потребления этилового спирта, такие как этилглюкуронид (EtG), этилсульфат (EtS), фосфатидилэтанол (PEth), и этиловые эфиры жирных кислот (FAEE) имеют гораздо более высокую специфичность, поскольку являются прямыми продуктами неокислительного метаболизма этанола.
Кроме того, по сравнению с прямым определением этанола в крови или выдыхаемом воздухе у них гораздо более широкое окно обнаружения, которого обычно достаточно для того, чтобы установить факт потребления алкоголя. Эти маркеры, как правило, выявляются в моче либо в волосах с головы пациента.
С целью наибольшей достоверности диагностики злоупотребления алкоголем рекомендуется комбинировать прямые и непрямые методики.
Алкогольный гепатит – это клинический синдром, который характеризуется прогрессирующей желтухой (обычно сопровождается лихорадкой, потерей веса и лихорадкой) с или без наличия других признаков печеночной декомпенсации (например, энцефалопатии), у лиц, злоупотребляющих алкоголем. В основе этого состояния лежит стеатогепатит – патология, гистологически характеризующаяся стеатозом, гепатоцеллюлярным баллонированием, воспалительным инфильтрированием полиморфонуклеарными нейтрофилами.
Клинически может сопровождаться сепсисом, медикаментозно индуцированным поражением печени, миграцией желчных камней и т. д. Лабораторно отмечаются нейтрофилия, гипербилирубинемия (<50 ммоль/л), повышение уровня АСТ более чем в 2 раза. При этом соотношение АСТ/АЛТ составляет более 1,5-2. При тяжелом течении могут наблюдаться увеличение протромбинового времени, гипоальбуминемия, тромбоцитопения.
Диагноз, как правило, устанавливается на основании клинических данных и лабораторных показателей, реже применяется биопсия печени, которая повышает точность диагностики и прогнозирования, но имеет ряд противопоказаний.
Для прогнозирования течения и риска смертности при АГ используют ряд шкал и методик. Первой шкалой, которую применяли для кратковременного определения прогноза, была дискриминантная функция Маддрея. В настоящее время используют модифицированную версию (показатель >32 свидетельствует о месячной выживаемости <10%).
В последнее время было разработано несколько прогностических методов, таких как шкала модели терминальной стадии заболевания печени (MELD), шкала алкогольного гепатита Глазго (GAHS) и показатель ABIC (возраст, сывороточный билирубин, МНО и сывороточный креатинин).
Шкала MELD уже признана хорошо обоснованным методом прогностической оценки при циррозе. Ее эффективность при оценке краткосрочного прогноза АГ была изучена в ретроспективных исследованиях, которые показывают, что пациенты с оценкой MELD выше 20 подвергаются высокому риску смертности в течение 90 дней.
Общие принципы лечения АГ
Учитывая потенциальный риск энцефалопатии Вернике, рекомендуется назначение витаминов группы В. Другие общие подходы включают профилактику печеночной энцефалопатии (лактулоза, рифаксимин) и лечение асцита (ограничение потребления соли). Пациенты с тяжелым АГ подвергаются риску развития острого повреждения почек (ОПП), что отрицательно влияет на выживаемость. Меры, направленные на предотвращение развития ОПП, включают избегание применения диуретиков и нефротоксических препаратов, а также увеличение объема циркулирующей крови, если это необходимо.
Питание
Недостаточное питание обычно связано с развитием цирроза. В нескольких исследованиях подчеркивается, что недоедание присутствует почти у каждого пациента с тяжелым течением АГ и связано с плохим прогнозом. Европейское общество по клиническому питанию и метаболизму (ESPEN) рекомендует ежедневное потребление 35-40 ккал/кг массы тела и ежедневное потребление белка 1,2-1,5 г/кг у пациентов с АГ. Зондовое питание настоятельно рекомендуется, если больные не могут получать адекватное пероральное питание.
Кортикостероиды
Применение кортикостероидов в лечении АГ было спорным из-за несовпадений в результатах отдельных исследований и метаанализов. С 2011 по 2014 год проводилось большое многоцентровое рандомизированное исследование (STOPAH) среди больных с клиническим диагнозом тяжелой формы АГ с целью разрешить противоречия в отношении использования кортикостероидов или пентоксифиллина (ПТКС). В этом наблюдении сообщается о пограничном снижении смертности в течение 28 дней для пациентов, принимавших преднизолон в дозе 40 мг/сут, по сравнению с контрольной группой.
Терапия кортикостероидами ограничена из-за опасений повышенного риска сепсиса и желудочно-кишечного кровотечения. Шкала Lille позволяет врачам прогнозировать плохую реакцию на кортикостероиды в течение 7 дней лечения. В случае плохого ответа рекомендуется прерывать прием кортикостероидов, особенно у «нулевых респондентов» (с оценкой по шкале Lille ≥0,56).
На практике преднизолон в дозе 40 мг/день или метилпреднизолон в дозе 32 мг/день назначают на протяжении 28 дней. В конце курса лечения прием преднизолона или метилпреднизолона можно прекратить сразу, или постепенно снижать дозу в течение 3 нед.
N-ацетилцистеин
Антиоксидантная терапия вызывает теоретический интерес из-за увеличения количества доказательств того, что оксидативный стресс является ключевым механизмом опосредованной алкоголем гепатотоксичности. В многоцентровом исследовании сравнивались эффекты от соединения N-ацетилцистеина(N-АЦ) и преднизолона с комбинацией преднизолона и плацебо. N-АЦ вводили внутривенно в течение 5 дней.
Смертность на протяжении месяца была значительно ниже в группе N-АЦ плюс преднизолон по сравнению с группой преднизолон плюс плацебо. Важно отметить, что N-АЦ в сочетании с преднизолоном также значительно уменьшал частоту возникновения гепаторенального синдрома и инфекций. Следовательно, комбинация N-АЦ и преднизолона, по-видимому, улучшает прогноз пациентов с тяжелым АГ.
Гранулоцитарный колониестимулирующий фактор
Гранулоцитарный колониестимулирующий фактор (ГКСФ) представляет собой гликопротеин, который стимулирует производство и высвобождение в кровоток нейтрофилов и стволовых клеток (CD34+) костным мозгом. Неэффективная регенерация печени была постулирована как один из ключевых факторов, ведущих к прогрессирующей печеночной недостаточности и снижению клеточной регенерации печени у пациентов с АГ.
Пентоксифиллин
Пентоксифиллин, ингибитор фосфодиэстеразы, применяется у больных АГ из-за его способности ингибировать продукцию фактора некроза опухоли. В рандомизированном исследовании, в котором сравнивали ПТКС с плацебо у пациентов с тяжелой формой АГ, у больных, получавших ПТКС, выживаемость на протяжении 6 мес была выше.
Комбинация кортикостероидов с ПТКС также оценивалась в разных исследованиях. В исследовании Corpentox 28-дневное лечение ПТКС (1200 мг/сут) плюс преднизолон по сравнению с преднизолоном плюс плацебо у пациентов с тяжелой формой АГ не привело к увеличению краткосрочной выживаемости. Несмотря на то что заболеваемость гепаторенальным синдромом незначительна, у больных, принимавших комбинацию ПТКС и преднизолона, она наблюдалась реже.
Экстракорпоральная поддержка печени
Экстракорпоральные процедуры поддержки печени помогают элиминировать некоторые потенциально опасные циркулирующие молекулы и, следовательно, представляют интерес у пациентов с тяжелой формой АГ. Альбуминовый диализ является перспективным методом у таких больных.
Инфекция – частое и серьезное осложнение у пациентов с тяжелой формой АГ, она является одной из ведущих причин смерти. Среди основных противоречий последних лет является то, что кортикостероиды, используемые для лечения АГ, повышают риск инфекционных заболеваний. Недавний метаанализ показал, что у больных, употреблявших кортикостероиды, не отмечено повышенного риска заражения или более высокой смертности от инфекций, чем у пациентов, получавших плацебо.
АБП фиброз
Потребление больших доз алкоголя может привести к развитию ряда повреждений, включая простой алкогольный стеатоз, стеатогепатит, прогрессирующий фиброз печени, цирроз и гепатоцеллюлярную карциному.
При потреблении более 100 г алкоголя в день относительный риск развития этих осложнений достигает 26.
В среднем у 10-35% лиц, хронически употребляющих алкоголь, развивается прогрессирующее поражение печени, включая фиброз, которое достигает стадии цирроза. Наличие смешанного макро- и микровезикулярного стеатоза увеличивает скорость прогрессирования АБП.
На прогрессирование АБП (развитие обширного фиброза печени и цирроза) могут влиять внешние и внутренние факторы. Экзогенные факторы включают количество, тип и характер потребления алкоголя, а также курение сигарет и употребление кофе. В популяционном исследовании с 20-летним наблюдением выкуривание ≥1 упаковки сигарет в день утроило риск АБП по сравнению с некурящими, независимо от потребления алкоголя.
В то же время употребление кофе, по-видимому, оказывает благоприятное влияние на риск развития цирроза (по данным новейших метаанализов употребление до 2 чашек кофе в день снижает риск развития цирроза примерно вдвое).
Из эндогенных факторов на прогрессирование патологии могут влиять пол, этническая принадлежность, сопутствующие заболевания, такие как диабет и ожирение, дисбактериоз, хроническая инфекция HBV и HCV244 и/или вирус иммунодефицита человека (ВИЧ), дефицит альфа-антитрипсина, перенасыщение железом и генетические факторы.
Важным моментом в лечении АБП фиброза является его своевременная диагностика, когда он еще неполный и потенциально обратимый. Поскольку у большинства пациентов заболевание протекает бессимптомно на ранних стадиях, такая диагностика представляет сложность и требует особого внимания. Скрининг должен проводиться у всех индивидуумов с зарегистрированным чрезмерным потреблением алкоголя.
Обязательным является лечение сопутствующих заболеваний, которые могут осложнять течение и прогноз фиброза печени.
Несомненно, принципиальным моментом в терапии фиброза печени является воздержание от употребления алкоголя, что само по себе вызывает его постепенный регресс на обратимых стадиях.
Перспективное направление в лечении фиброза – ремоделирование внеклеточного матрикса. Некоторые молекулярные агенты с антифибротическим действием, в частности ангиотензин-блокирующий агент кандесартан, находятся в стадии клинических испытаний и демонстрируют обнадеживающие результаты. Мониторинг фибротических изменений проводится с помощью TЭ с использованием Fibroscan как наиболее надежного неинвазивного метода при АБП.
АБП цирроз
Прогрессирующий фиброз печени может развиться в цирроз, который характеризуется выраженным изменением печеночной архитектоники, обширным фиброзом, образованием ложных долек и аномальным синусоидальным кровотоком.
У лиц, которые продолжают употреблять алкоголь при наличии цирроза, отмечается выраженный стеатоз, в отличие от больных со стойкой абсистенцией, у которых может отмечаться слабо выраженный стеатоз или незначительная лимфоцитарная инфильтрация либо вообще не быть этих явлений. Наличие выраженного стеатоза может также свидетельствовать о сопутствующем жировом перерождении печени у больных, не употребляющих алкоголь.
Нарушенный метаболизм железа, который иногда наблюдается у пациентов с АБП циррозом, проявляется либо небольшим накоплением железа, которое выявляется при биопсии печени (относительный риск 2,27; 95% доверительный интервал (ДИ) 1,2-4,19), либо низким уровнем сывороточного гепсидина (ОР 1,63; 95% ДИ 1,07-2,44), и является неблагоприятным показателем для смертности.
Пациенты с алкогольным циррозом могут не иметь симптоматических проявлений в компенсированной стадии или иметь проявления в виде желтухи, асцита, варикозного кровотечения, сопутствующих инфекций, гепаторенального синдрома, печеночной энцефалопатии и кахексии при декомпенсации.
Данные осложнения сильно ухудшают прогноз заболевания и выживаемости.
Пациенты с циррозом также часто страдают от внепеченочных патологий, включая сердечные (алкогольная кардиомиопатия), заболевания поджелудочной железы (острый и хронический панкреатит), почечные (IgA-индуцированная нефропатия) и нервной системы (центральной и периферической). Изменения в сознании и когнитивные нарушения могут быть связаны с печеночной энцефалопатией, но энцефалопатия Вернике, синдром отмены или другие симптомы, обусловленные повреждением мозга из-за потребления алкоголя, следует рассматривать как сопутствующие диагнозы у пациента с циррозом печени и неврологическими нарушениями.
У лиц с АБП циррозом не следует применять препараты (например, парацетамол), которые могут вызывать медикаментозно-индуцированное поражение печени и осложнять течение заболевания. Рекомендуется использовать N-АЦ при подозрении на парацетамолассоциированное поражение печени после обязательной отмены препарата.
Лечение пациентов с АБП циррозом фокусируется на воздержании от алкоголя, питательной поддержке, включая достаточную калорийность, витамины и микроэлементы, а также первичной и вторичной профилактике цирротических осложнений. Следует также исследовать больного на наличие повреждений других органов, включая раковые заболевания ЖКТ.
С клинической точки зрения АБП нужно рассматривать как двойную патологию, включающую как поражение печени, так и болезнь зависимости. Поэтому важным аспектом являются медикаментозное лечение зависимости и психологическая поддержка.
Назначение эритропоэтина и ГКСФ помогает увеличить годичную выживаемость при циррозе с преимущественно алкогольной этиологией.
Трансплантация печени (ТП) является наиболее эффективным методом лечения для пациентов с конечной стадией заболевания, причем после трансплантации годичная выживаемость составляет около 80-85%. Несмотря на то что меньшинство пациентов с АБП отвечает строгим критериям, необходимым для кандидатов на ТП, число таких трансплантаций увеличилось за последние два десятилетия на 45%.
При этом количество доноров органов является недостаточным и продолжает уменьшаться. Невзирая на то что АБП находится среди 3 основных показаний к ТП, кандидатуры таких больных считаются самыми спорными. Психосоциальная оценка для определения вероятности долгосрочного воздержания после ТП должна проводиться у всех пациентов с АБП.
Поскольку злоупотребление алкоголем и зависимость могут быть связаны с расстройствами личности, депрессией, беспокойством, злоупотреблением психотропными веществами и другими психическими расстройствами, может потребоваться консультация психиатра.
Большинство трансплантационных центров выдвигают условие о минимальной 6-месячной подтвержденной абсистенции. Исследование перед трансплантацией должно включать оценку функции поджелудочной железы, почек и качества питания пациента, а также выявление центральной и периферической невропатии, миопатии и кардиомиопатии.
Высокая распространенность сопутствующего злоупотребления табачными изделиями оправдывает дополнительный скрининг на атеросклероз и ишемическую болезнь сердца. Крайне важно исключить любые неопластические или преднеопластические заболевания.
Пациенты с АБП также должны быть в стадии компенсации. АГ не является противопоказанием к ТП, однако большинство трансплантационных центров рассматривают его как относительное противопоказание.
Все пациенты подлежат посттрансплантационному наблюдению, включающему скрининговые тесты, опросники и интервью с больным либо членами семьи, и любое употребление алкоголя после трансплантации расценивается как «срыв».
Существует риск посттрансплантационных осложнений со стороны других органов и систем, таких как хроническая болезнь почек, сахарный диабет, гипертензия, метаболический синдром, увеличение риска злокачественных заболеваний.
Хотя сама по себе АБП не ухудшает посттрансплантационный прогноз сравнительно с другими этиологиями, смертность от психосоциальных причин, включая суицид, в этой категории пациентов в 2 раза выше.
Качество жизни после ТП улучшается, однако такая тенденция остается ниже ожидаемой и снижается со временем.
Перевела с англ. Дарья Мазепина
Медична газета «Здоров’я України 21 сторіччя» № 17 (438), вересень 2018 р.


