8 жовтня, 2018
Диуретическая терапия при сердечной недостаточности
Наиболее известные способы фармакотерапии сердечной недостаточности (СН) основываются на результатах широкомасштабных клинических исследований. В противоположность этому доказательства, полученные в ходе масштабных контролированных исследований и регламентирующие применение диуретиков, одних из наиболее часто используемых препаратов в лечении СН, достаточно ограничены.
Задержка жидкости и застой крови являются основными признаками СН, они ассоциированы с наличием значимой клинической симптоматики и неблагоприятным прогнозом. Учитывая основополагающую роль застоя крови как в возникновении клинических проявлений, так и в неблагоприятном прогнозе, диуретики остаются основополагающими элементами в лечении СН.
Несмотря на то что рутинная диуретическая терапия при СН достаточно проста, часто возникает множество вопросов в отношении того, как правильно применять диуретики, особенно у пациентов с острой декомпенсированной СН и диуретикорезистентностью. В данном обзоре мы рассматриваем современные фармакологические принципы диуретической терапии, обсуждаем результаты нескольких последних исследований и предлагаем подходы к проведению диуретической терапии при СН, основываясь на данных доказательной медицины.
Фармакологическая характеристика петлевых диуретиков
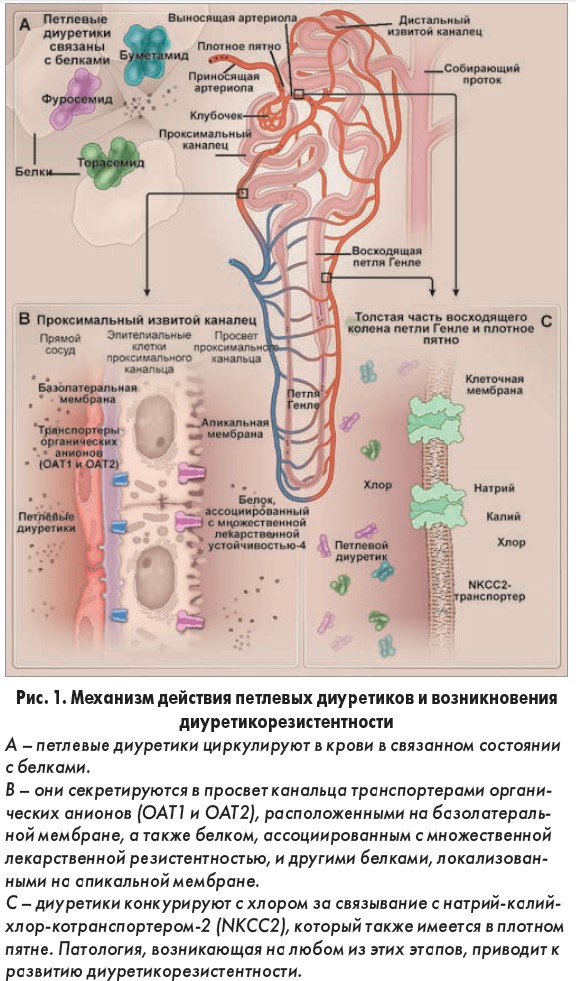 Фуросемид, буметанид и торасемид являются классическими петлевыми диуретиками; эти препараты связываются с транслокационным карманом на внеклеточной поверхности натрий-калий-хлор-котранспортера (NKCC), непосредственно блокируя транспорт ионов (рис. 1). Петлевые диуретики ингибируют NKCC2 на апикальной поверхности клеток, составляющих толстую часть восходящего колена петли Генле (ген, кодирующий этот транспортер, – SLC12A1). Благодаря указанному транспортеру реабсорбируется (непосредственно или косвенно) до 25% отфильтрованного натрия и хлора; его блокада объясняет появление большинства натрийуретических эффектов петлевых диуретиков.
Фуросемид, буметанид и торасемид являются классическими петлевыми диуретиками; эти препараты связываются с транслокационным карманом на внеклеточной поверхности натрий-калий-хлор-котранспортера (NKCC), непосредственно блокируя транспорт ионов (рис. 1). Петлевые диуретики ингибируют NKCC2 на апикальной поверхности клеток, составляющих толстую часть восходящего колена петли Генле (ген, кодирующий этот транспортер, – SLC12A1). Благодаря указанному транспортеру реабсорбируется (непосредственно или косвенно) до 25% отфильтрованного натрия и хлора; его блокада объясняет появление большинства натрийуретических эффектов петлевых диуретиков.
Петлевые диуретики также ингибируют один и тот же симпортер (транспортный белок), располагающийся на апикальной поверхности клеток плотного пятна, стимулируя тем самым секрецию ренина и ингибируя механизм обратной канальцево-клубочковой связи, благодаря которому, как правило, подавляется клубочковая фильтрация при увеличенном поступлении соли в зону плотного пятна (рис. 1).
Эти два дополнительных механизма могут оказывать как благотворное, так и пагубное влияние, потому что повышение активности ренина в плазме крови приводит к возрастанию уровня ангиотензиногена II, тогда как блокада обратной канальцево-клубочковой связи помогает поддерживать скорость клубочковой фильтрации.
Данные препараты также ингибируют вторую изоформу натрий-калий-хлор симпортера (ген SLC12A2), который экспрессируется во многих органах, в т. ч. в ухе; этот факт, вероятно, объясняет ототоксичность петлевых диуретиков. При внутривенном введении петлевые диуретики вызывают вазодилатацию частично путем ингибирования NKCC1 в гладкомышечных клетках сосудов. NKCC1 также экспрессируется клетками афферентной артериолы и в экстрагломерулярном мезангии (клетках, расположенных возле плотного пятна), где он подавляет базальную секрецию ренина; таким образом блокада NKCC1 может способствовать повышению секреции ренина и синтезу ангиотензиногена II.
Петлевые диуретики оказывают комплексное воздействие на почечную и системную гемодинамику, выраженность которого зависит от дозы и способа введения препаратов, наличия сопутствующих заболеваний и проводимого лечения, длительности применения мочегонных. Эти диуретические средства активируют ренин-ангиотензин-альдостероновую систему (РААС) и непосредственно расширяют кровеносные сосуды, а также увеличивают концентрацию вазодилатирующих простагландинов и давление в проксимальном канальце. Некоторые из указанных эффектов противодействуют друг другу; внутривенное (в/в) введение высоких доз петлевых диуретиков может сопровождаться снижением или повышением артериального давления, увеличением или уменьшением ударного объема, сокращением почечного кровотока соответственно. Достаточно сложно прогнозировать, какой из этих эффектов разовьется у пациентов, получающих петлевые диуретики.
 Последние представляют собой органические анионы, которые циркулируют в крови в связанном состоянии с белками (>90%), что ограничивает их объем распределения. Таким образом, петлевые диуретики не поступают в канальцевую жидкость путем клубочковой фильтрации, но, скорее всего, они секретируются в клетки проксимального канальца посредством взаимодействия с транспортерами органических анионов и белком, ассоциированным с множественной лекарственной резистентностью (рис. 1). Генетическая делеция транспортеров органических анионов у мышей приводит к развитию диуретикорезистентности; подобный феномен наблюдается у людей: нестероидные противовоспалительные препараты или эндогенные уремические анионы конкурируют с петлевыми диуретиками за связывание с указанными транспортерами (табл. 1).
Последние представляют собой органические анионы, которые циркулируют в крови в связанном состоянии с белками (>90%), что ограничивает их объем распределения. Таким образом, петлевые диуретики не поступают в канальцевую жидкость путем клубочковой фильтрации, но, скорее всего, они секретируются в клетки проксимального канальца посредством взаимодействия с транспортерами органических анионов и белком, ассоциированным с множественной лекарственной резистентностью (рис. 1). Генетическая делеция транспортеров органических анионов у мышей приводит к развитию диуретикорезистентности; подобный феномен наблюдается у людей: нестероидные противовоспалительные препараты или эндогенные уремические анионы конкурируют с петлевыми диуретиками за связывание с указанными транспортерами (табл. 1).
Применение петлевых диуретиков у пациентов с острой декомпенсированной СН
Существующие данные доказательной медицины, регламентирующие применение мочегонных средств у больных СН, приводятся в современных практических руководствах, которые присвоили диуретикам I класс рекомендаций, основываясь при этом на уровне доказательств В или С. Кроме того, использование высоких доз мочегонных препаратов, стимулирующих РААС и симпатическую нервную систему, ассоциируется с неблагоприятным прогнозом, что подтверждает нежелательность их применения.
В исследовании Diuretic Optimization Strategies Evaluation (DOSE) анализировалась эффективность различных доз диуретиков и способов их введения у пациентов с острой декомпенсированной СН. Применив факториальный дизайн (2×2), исследователи рандомизировали пациентов с острой декомпенсированной СН (n=308) для в/в терапии фуросемидом посредством болюсного введения (2 р/сут) или длительной инфузии, а также для использования «низких доз» (эквивалентных той дозе мочегонного препарата, которую пациент принимал ранее перорально) или «высоких доз» (дозировка диуретика в 2,5 раза превышала ранее использовавшуюся пероральную дозу).
Всем участникам проводили также в/в болюсное введение препарата каждые 12 ч и длительную инфузию, одна из которых содержала фуросемид, а другая – плацебо в физиологическом растворе (в соответствии с факториальным двойным слепым дизайном исследования).
Несмотря на отсутствие достоверных отличий в глобальной оценке симптомов пациентами (комбинированная конечная точка), больные, получавшие высокие дозы диуретиков, имели более благоприятные исходы с учетом различных предварительно заданных второстепенных параметров, в т. ч. уменьшение одышки, изменение массы тела, потеря жидкости. Ухудшение функции почек (другая комбинированная конечная точка), определенное как повышение уровня сывороточного креатинина более чем на 0,3 мг/дл (26,5 мкмоль/л) на протяжении 72 ч после рандомизации, чаще регистрировали при использовании высоких доз диуретиков по сравнению с низкими дозами; однако результаты ретроспективного анализа, опубликованного немного позже, подтвердили, что первоначальное увеличение сывороточной концентрации креатинина в этом исследовании ассоциировалось с более благоприятным, а не худшим долгосрочным клиническим исходом.
Результаты других исследований также показали, что ухудшение функции почек во время лечения СН может не являться признаком неблагоприятного прогноза, если почечная дисфункция развивается у пациентов, хорошо отвечающих на противоотечную терапию. Хотя активация РААС рассматривается в качестве неблагоприятного последствия применения высоких доз мочегонных препаратов, рандомизация к высокодозовой терапии в исследовании DOSE не привела к чрезмерной активации РААС по сравнению с распределением в группы низкодозового лечения, несмотря на то что анализ был ограничен отсутствием времени для проведения стандартизации и естественной вариабельностью определения активности ренина в плазме крови.
Следовательно, невзирая на то что результаты обсервационных исследований свидетельствуют об увеличении летальности среди больных СН, получающих высокие дозы диуретиков, исследование DOSE поддерживает такой подход в лечении СН, считая его оправданным. Стоит отметить, что данное наблюдение являлось крупнейшим рандомизированным исследованием, изучавшим различные стратегии применения мочегонных средств у пациентов с СН, при этом оно было единственным, в котором не удалось проанализировать клинические исходы.
В исследовании DOSE не зафиксированы достоверные различия между болюсным введением и продолжительной инфузией в достижении первичных конечных точек (глобальной оценке симптомов и изменении сывороточной концентрации креатинина в течение 72 ч); несколько позже эти результаты подтвердились в другом небольшом исследовании. Таким образом, приведенные данные сами по себе не поддерживают целесообразность длительной инфузии диуретиков при острой декомпенсированной СН.
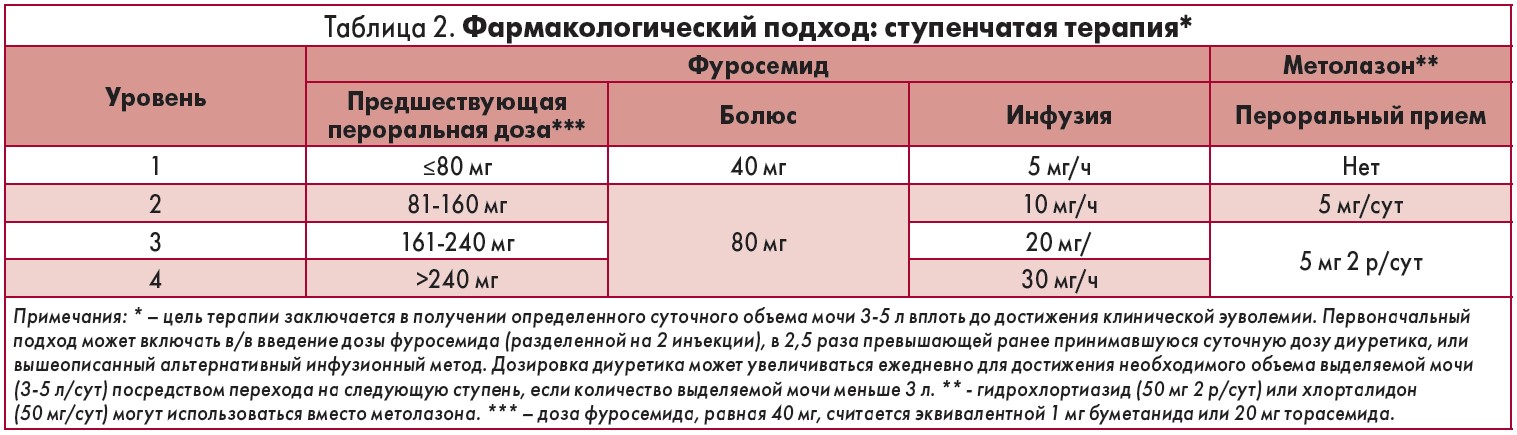
Однако следует сделать несколько пояснений. В исследовании DOSE длительные инфузии проводились без использования нагрузочных доз, которые ускоряют достижение стабильного состояния. Кроме того, исходные дозы фуросемида, применявшиеся для длительной инфузии, составляли в среднем 5 мг/ч (низкодозовый режим) и 10 мг/ч (высокодозовый режим), что значительно ниже обычно используемых дозировок (табл. 2).
При этом сформированная популяция не исследовалась на наличие резистентности к диуретикам, а средняя концентрация креатинина составила 1,5 мг/дл (132,6 мкмоль/л); таким образом, обследованные пациенты не имели значимой дисфункции почек. Итак, несмотря на то что первоначальная терапия фуросемидом с использованием суточной дозировки, в 2,5 раза превышающей ранее применявшуюся пероральную дозу, и 2-кратным болюсным введением препарата является целесообразной инициальной стратегией у большинства больных, непрерывная оценка клинического ответа остается обязательной; пациенты со специфическими клиническими состояниями (диуретикорезистентность, кардиоренальный синдром, выраженная дисфункция правого желудочка) могут лучше реагировать на длительные инфузии, чем на болюсные введения мочегонных средств.
Вспомогательные средства диуретической терапии
Несмотря на то что задержка хлорида натрия в почках является основным показателем застоя при СН, гипонатриемия, свидетельствующая о накоплении жидкости, также достаточно характерна и ассоциируется с неблагоприятным прогнозом. Пероральный антагонист рецепторов вазопрессина‑2 толваптан ингибирует действие антидиуретического гормона и увеличивает экскрецию свободной жидкости (акваурез).
Исследование EVEREST, которое проводилось с участием госпитализированных больных СН (с/без гипонатриемии), не продемонстрировало превосходства толваптана над плацебо в отношении долгосрочных клинических исходов, хотя зафиксировало потенциальные благоприятные эффекты касательно объемного статуса и симптомов, имевших место в первые дни лечения.
Впоследствии результаты других небольших исследований, в рамках которых толваптан назначался пациентам с более низкой концентрацией натрия в плазме крови, чем в исследовании EVEREST, для максимально быстрого нивелирования застойных явлений, не зафиксировали значимого уменьшения выраженности симптомов или улучшения клинических исходов, несмотря на то что эти больные имели большую массу тела и выделяли в среднем больший объем мочи.
Преодоление диуретикорезистентности
Под диуретикорезистентностью понимают неспособность мочегонных препаратов нивелировать застойные явления, что проявляется низкой концентрацией натрия в моче, несмотря на использование максимальных рекомендованных доз диуретиков. Длительные инфузии мочегонных средств часто применяются у таких пациентов. Результаты ретроспективного анализа свидетельствуют, что ступенчатый фармакологический подход (табл. 2), который заключается в агрессивной диуретической терапии и направлен на поддержание определенного объема мочи (3-5 л/сут), может превосходить стандартную «противоотечную терапию», предполагающую применение стандартных высоких доз петлевых диуретиков у пациентов с кардиоренальным синдромом. Вопреки немногочисленности данных доказательной медицины, такой подход может быть целесообразным при развитии диуретикорезистентности.
 Активация РААС способствует смещению кривой диуретического ответа, наблюдаемой при острой декомпенсации СН (рис. 2), что делает ее весьма соблазнительной терапевтической целью. Тем не менее механизмы действия ингибиторов ангиотензинпревращающего фермента и блокаторов рецепторов ангиотензиногена являются достаточно сложными; эти лекарственные средства оказывают прямое натрийуретическое действие за счет способности ингибировать реабсорбцию натрия в нефроне, также они могут блокировать натрийурез, поскольку снижают артериальное давление.
Активация РААС способствует смещению кривой диуретического ответа, наблюдаемой при острой декомпенсации СН (рис. 2), что делает ее весьма соблазнительной терапевтической целью. Тем не менее механизмы действия ингибиторов ангиотензинпревращающего фермента и блокаторов рецепторов ангиотензиногена являются достаточно сложными; эти лекарственные средства оказывают прямое натрийуретическое действие за счет способности ингибировать реабсорбцию натрия в нефроне, также они могут блокировать натрийурез, поскольку снижают артериальное давление.
При СН уменьшается фракция выброса, однако указанные препараты чрезвычайно эффективны в увеличении сердечного выброса, поэтому их прием, как правило, продолжается. Блокада РААС, напротив, может навредить больным СН с сохраненной фракцией выброса, у которых уменьшение постнагрузки не сопровождается увеличением сердечного выброса.
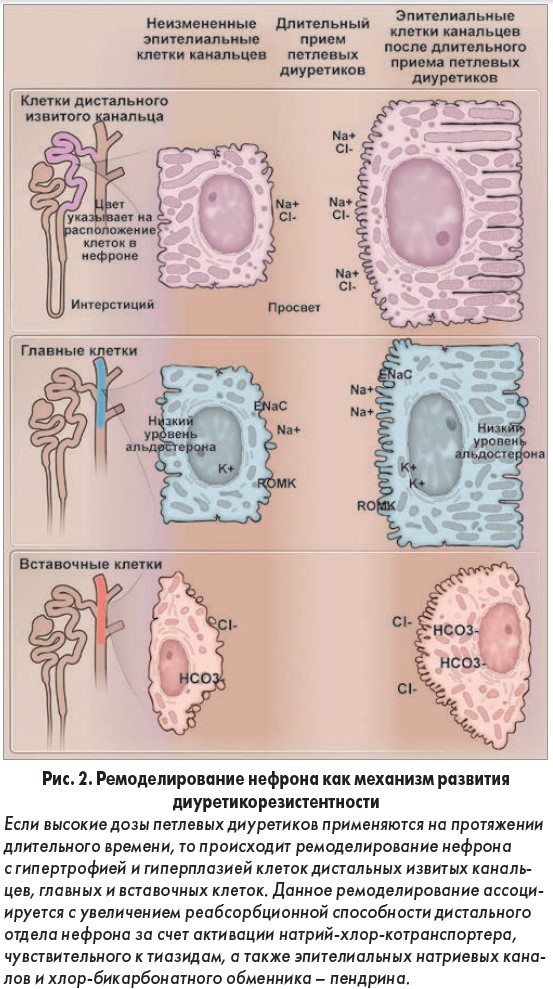
Ремоделирование нефрона также может являться целесообразной терапевтической целью. Ter Maaten и коллеги, использовав фракционный клиренс натрия и лития, продемонстрировали, что 75% случаев диуретикорезистентности при острой декомпенсированной СН может объясняться активацией транспорта хлорида натрия в дистальном отделе нефрона.
Учитывая эти данные, следует применять препараты, блокирующие реабсорбцию хлорида натрия в указанном отделе (метолазон или другие тиазидоподобные диуретики), хотя эффективность и безопасность данного подхода (получившего название «последовательная блокада нефрона») еще не изучалась в адекватных клинических исследованиях. Комбинация петлевого и тиазидного диуретика в ряде случаев может привести к массивному натрий- и калийурезу, поэтому тщательный длительный мониторинг является полностью оправданным.
Результаты небольших исследований свидетельствуют, что пероральный метолазон при условии его комбинации с петлевым диуретиком также эффективен в нивелировании застойных явлений, как и в/в введение хлортиазида. Амилорид тоже может оказаться полезным в блокировании активированных натриевых каналов, как это отмечалось выше, а ингибиторы карбоангидразы, ингибирующие хлорид-бикарбонатный обменник пендрин, – стать наиболее эффективными препаратами при развитии метаболического алкалоза.
Длительность последовательной блокады нефрона при СН точно не определена. Традиционно диуретики резерва вводятся после развития резистентности к наиболее часто использующимся мочегонным препаратам, однако к этому времени дистальный отдел нефрона уже подвергнется значительному ремоделированию.
Альтернативные походы и дальнейшие перспективы
Теоретически экстракорпоральная ультрафильтрация является чрезвычайно привлекательным методом лечения, с ее помощью можно удалить избыток хлорида натрия и лишнюю жидкость с минимальной стимуляцией РААС и низким риском повторных госпитализаций по сравнению с таковым при использовании диуретиков.
Исследование, сравнивавшее эффективность ультрафильтрации с пошаговым фармакологическим подходом (табл. 2) у пациентов с СН и кардиоренальным синдромом, продемонстрировало сопоставимую результативность этих методов в удалении жидкости, при этом значимая дисфункция почек и побочные эффекты чаще возникали в случае использования ультрафильтрации.
Еще одно масштабное исследование было досрочно прекращено спонсором по причине чрезвычайно медленного набора пациентов. В настоящее время основным показанием для проведения ультрафильтрации больным СН является необходимость использования диализной терапии у пациентов с комбинированной сердечной и почечной недостаточностью.
С целью уменьшения почечной дисфункции и усиления натрийуреза предлагается комбинированное применение гипертонического раствора хлорида натрия и высоких доз петлевых диуретиков, однако эффективность этого подхода еще не изучена в надежных исследованиях. Появилась также новая форма выпуска фуросемида, предназначенная для подкожного введения, эта мера сможет облегчить использование «внутривенноподобных» диуретиков в амбулаторных условиях, что будет иметь особо важное значение как в оказании медицинской помощи, так и в ее стоимости. В настоящее время данная методика изучается в многоцентровом рандомизированном контролированном исследовании.
Таким образом, умелое применение диуретической терапии является основополагающим в успешном лечении СН. Понимание физиологических эффектов, а также фармакокинетических и фармакодинамических свойств мочегонных препаратов необходимо для их безопасного и эффективного использования. Несмотря на длительный опыт применения петлевых диуретиков, продолжающиеся фундаментальные и клинические исследования предоставляют уникальную информацию, необходимую для более результативного использования мочегонных средств и улучшения оказания медицинской помощи больным СН.
Статья печатается в сокращении.
Ellison D. H., Felker G. M. Diuretic Treatment in Heart Failure. N Engl J Med 2017; 377: 1964-75. DOI: 10.1056/NEJMra1703100
Перевела с англ. Татьяна Можина
Медична газета «Здоров’я України 21 сторіччя» № 17 (438), вересень 2018 р.