1 листопада, 2018
Антибиотикорезистентность – вызов XXI века: современные тенденции и пути решения
 Проблема антибиотикорезистентности (АБР) крайне актуальна сегодня во всем мире. Рост устойчивости возбудителей к большинству групп современных антибактериальных препаратов (АБП) приводит к увеличению сроков стационарного лечения, заболеваемости и смертности, серьезно ограничивает возможности клиницистов в борьбе с бактериальными инфекциями, значительно повышает социальные и экономические издержки общества. Поэтому вопросы, касающиеся стратегии и тактики борьбы с АБР, всегда находятся в фокусе внимания специалистов.
Проблема антибиотикорезистентности (АБР) крайне актуальна сегодня во всем мире. Рост устойчивости возбудителей к большинству групп современных антибактериальных препаратов (АБП) приводит к увеличению сроков стационарного лечения, заболеваемости и смертности, серьезно ограничивает возможности клиницистов в борьбе с бактериальными инфекциями, значительно повышает социальные и экономические издержки общества. Поэтому вопросы, касающиеся стратегии и тактики борьбы с АБР, всегда находятся в фокусе внимания специалистов.
12 июля в Киеве состоялась научно-практическая конференция «Международный телемост “Антимикробная резистентность – вызов XXI века. Современные тенденции и пути решения”», в которой приняли участие ведущие специалисты из разных стран мира.
О согласовании адекватной терапии с рациональным использованием АБП в лечении тяжелых инфекций рассказал глава отделения инфекционных болезней университетской клиники «Санта Мария Мизерикордия» профессор Маттео Бассетти (г. Удине, Италия).
– В современном мире социально-экономические издержки, связанные с АБР, чрезвычайно высоки. Например, по данным аналитики Rand Europe и KPMG, в 2014 г. число смертей от инфекций, связанных с АБР, составило 700 тыс, что значительно превысило число летальных исходов от таких опасных инфекций, как: корь (130 тыс), холера (120 тыс) и столбняк (60 тыс), вместе взятых. Более того, эксперты считают, что если ситуация не изменится, то к 2050 году от последствий АБР ежегодно будут умирать 10 млн человек.
Следует отметить, что сейчас мы живем в постантибиотическую эру. Что это означает? В 2015 г. на Всемирной ассамблее здравоохранения ее Генеральный секретарь Маргарет Чен заявила, что мир сейчас входит в постантибиотическую эру, когда обычные инфекции могут стать смертельными, и призвала международное сообщество к немедленным действиям. При этом разработка новых антибиотиков (АБ) длится долгие годы, а мультирезистентность микроорганизмов к ним возникает быстро.
С другой стороны, потребление АБ в мире постоянно растет, даже несмотря на жесткие меры, предпринимаемые для ограничения этой тенденции в некоторых странах. По данным исследования E.Y. Klein и соавт. (2018), глобальное потребление АБ за период с 2000 по 2015 год выросло более чем в 2 раза. Рост происходит за счет увеличения спроса в странах с низким и средним уровнем доходов, где АБ можно купить без рецепта.
В свое время было установлено, что большинство (62%) тяжелых инфекций в мире вызываются грамотрицательными микроорганизмами (Vincent et al., 2009). Ранее L.B. Rice и соавт. (2008) выделили и идентифицировали группу так называемых супермикроорганизмов (Super Bugs), известную под аббревиатурой ESCAPE: Enterococcus faecium VR, Staphylococcus aureus MRS, Klebsiella pneumoniae CRE, Acinetobacter baumannii MDR, XDR, PDR, Pseudomonas aeruginosa MDR, XDR, PDR, Enterobacteriaceae БЛРС (β-лактамазы расширенного спектра). В настоящее время эта группа становится причиной развития большинства госпитальных инфекций и практически не подвержена действию многих известных АБ.
Широкая лекарственная резистентность вызвана также эволюцией самих патогенов и выработкой биохимических механизмов в ответ на действие АБ. Различным патогенам свойственны собственные механизмы развития резистентности. Например, в 1960-х годах к ампициллину было чувствительно большинство грамнегативных микроорганизмов, а устойчивость проявляла Esсherichia coli, продуцирующая сериновые β-лактамазы TEM- и SHV-типа, которая, в свою очередь, до 1980-х годов оставалась чувствительной к цефалоспоринам III поколения (например, цефтазидим и цефотаксим).
Однако со временем к цефалоспоринам выработали устойчивость не только Escherichia coli, но и Pseudomonas aeruginosa, а также Klebsiella spp., которые также стали продуцировать различные типы β-лактамаз (AcrAB, AmpC, TEM, SHV). Эти микроорганизмы еще оставались чувствительными к карбапенемам (например, меропенем, имипенем), однако в 1990-х и позднее начали появляться штаммы Escherichia coli, Pseudomonas aeruginosa, Klebsiella spp., Enterobacteriaceae spp., вырабатывающие новые типы карбапенемаз и β-лактамаз, способствующих развитию мультирезистентности.
Эпидемиологическая ситуация по распространению патогенов с АБР, вызывающих тяжелые нозокомиальные инфекции, в различных странах во многом зависит от состояния национальных систем здравоохранения, наличия или отсутствия мер по контролю за приемом АБП, а также от уровня доходов населения.
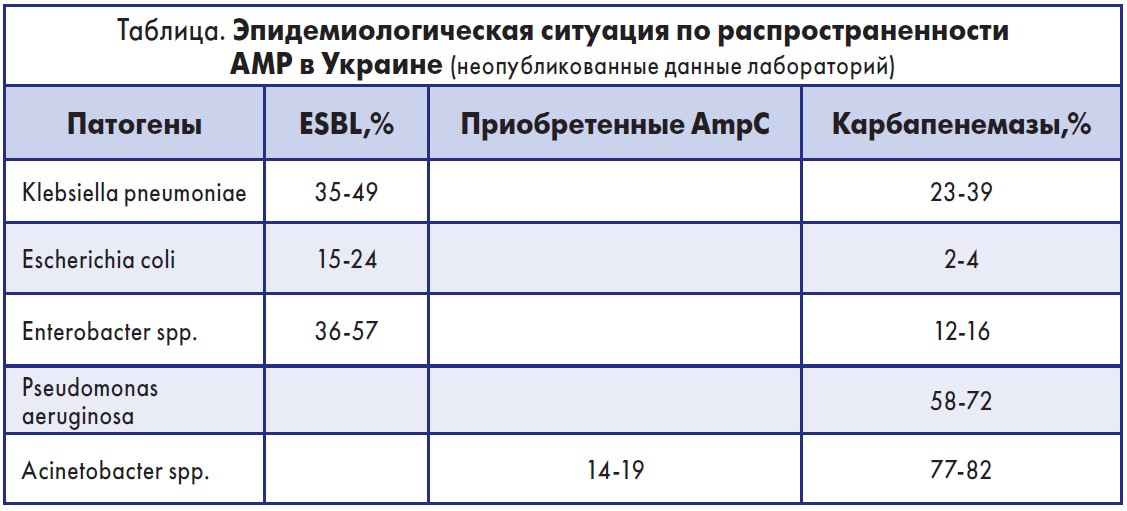
Например, в Украине данные по распространенности возбудителей тяжелых госпитальных инфекций, резистентных к АБ, свидетельствуют о преобладании Pseudomonas aeruginosa и Acinetobacter spp., проявляющих устойчивость к карбапенемам, а также Klebsiella pneumoniae и Enterobacter spp., продуцирующих β-лактамазы расширенного спектра действия (табл.).
Учитывая ситуацию, сложившуюся с АБР в мире, Всемирная организация здравоохранения (ВОЗ) в 2017 г. разработала и представила глобальный список приоритетных антибиотикорезистентных бактерий для научных исследований и разработки новых АБП. Глобальный список патогенов (ГСП) ВОЗ помогает фармацевтическим компаниям и правительствам государств определить приоритетные для финансирования направления исследований с учетом общественной необходимости и координации в борьбе против АБР.
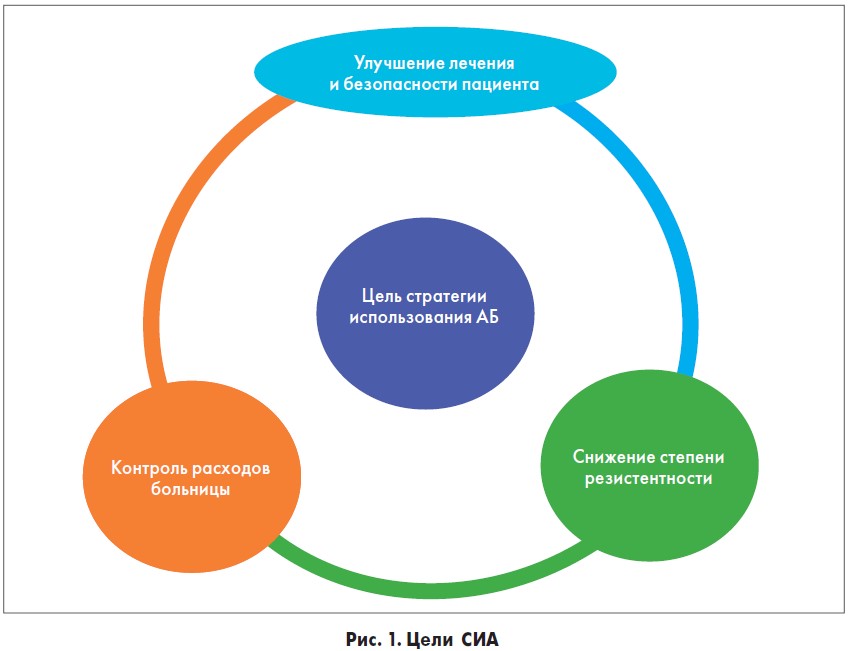
Наряду с ГСП ВОЗ во многих странах разработаны и внедрены рекомендации по стратегии использования АБ (Antimicrobial Stuardship Programs) на всех уровнях систем здравоохранения (национальных, региональных, локальных). Эти рекомендации являются системным организационным подходом к мониторингу разумного использования АБП для сохранения их будущей эффективности. Стратегия использования антибиотиков (СИА) призвана сохранить баланс между потребностями пациента и эффективностью АБ для общества (Lawrence K.L. et al., 2009) (рис. 1).
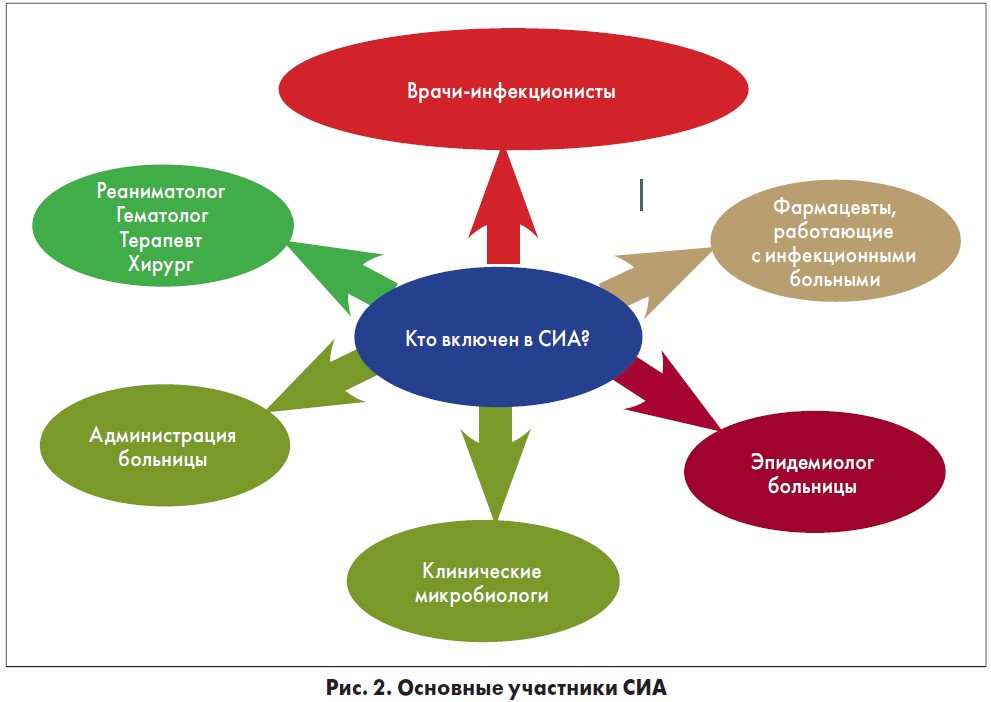
Успешная СИА предполагает мультидисциплинарный подход, который заключается в координации и сотрудничестве основных участников стратегии (Moody J. et al., 2012) (рис. 2).
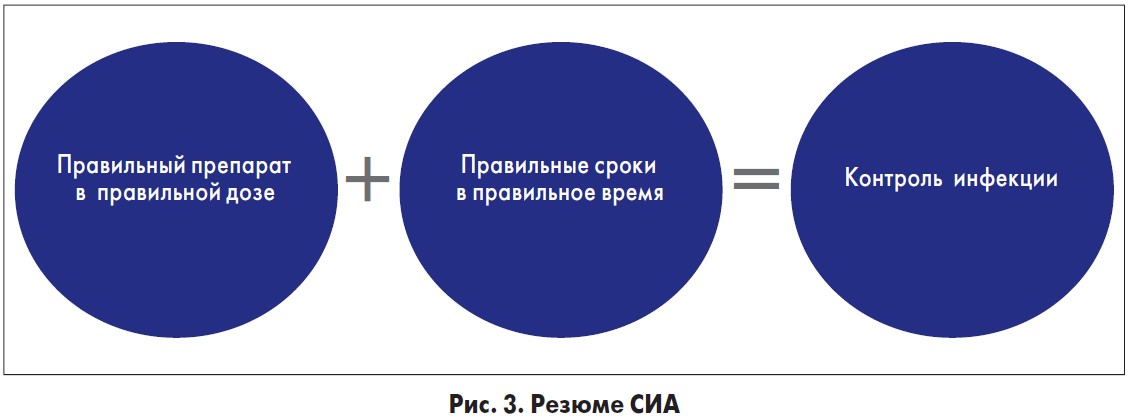
Работающие программы СИА показали, что надлежащее первоначальное использование АБ приводит к снижению смертности (Shorr A.F. et al., 2011), уменьшению длительности лечения, снижению АБР (Davey Р. et al., 2013) и доли хирургических инфекций (Fishman N., 2006). Краткое резюме СИА выглядит следующим образом (рис. 3).
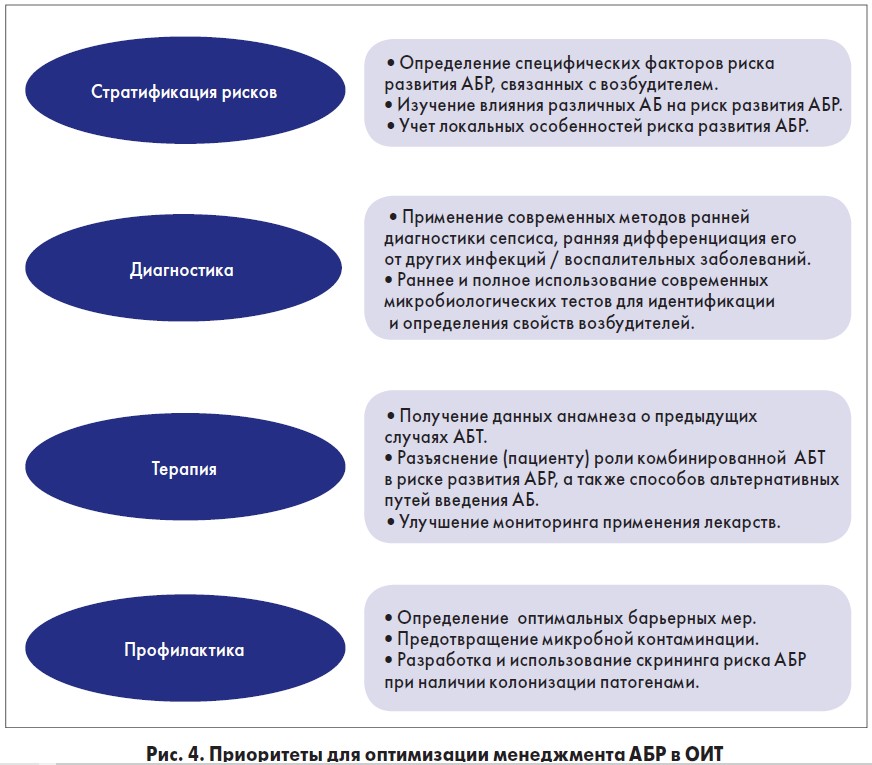
Следует особо отметить важность надлежащего применения СИА в отделениях интенсивной терапии (ОИТ) и реанимации. Рекомендации ESICM/ESCMID выделяют основные приоритеты для оптимизации менеджмента АБР в ОИТ (De Waele J.J. et al., 2018) (рис. 4).
 Еще одним важным аспектом, который стоит учитывать при выборе АБ, является выбор между возможным развитием побочных эффектов и широтой спектра антимикробной активности того или иного препарата.
Еще одним важным аспектом, который стоит учитывать при выборе АБ, является выбор между возможным развитием побочных эффектов и широтой спектра антимикробной активности того или иного препарата.
Отдельного обсуждения заслуживает вопрос комбинированной антибиотикотерапии (АБР). Разделяют эмпирическую и таргетную комбинированную терапию. Эмпирическая терапия показана в следующих клинических ситуациях:
- госпитальная и вентилятор-ассоциированная пневмония;
- септический шок;
- если у пациентов существует риск развития АБР;
- если имеется высокий риск контаминации Pseudomonas aeruginosa.
Параметры выбора комбинации для эмпирической АБТ инфекции, вызванной Pseudomonas aeruginosa, в странах с высокой АБР базируются на сочетании основного (например, меропенем, имипенем, пиперациллин-тазобактам, цефтазидим) и дополнительного (второго) препарата (ципрофлоксацин, левофлоксацин, колистин, гентамицин, амикацин, фосфомицин).
Таргетная АБТ применяется в случае идентификации возбудителя (кроме Pseudomonas aeruginosa, когда изначально показана эмпирическая терапия).
При достижении клинической стабильности и подтвержденных результатах чувствительности возбудителя спектр комбинированной АБТ сужают или прекращают (Bassetti М., Righi Е., 2015; Bassetti М.et al., 2017).
Относительно продолжительности АБТ рекомендуется ее оптимизация β-лактамными АБ путем продолжительной инфузии, непрерывной или длительной. При непрерывной инфузии назначается нагрузочная доза, а затем с помощью инфузионной помпы в течение 24 ч вводится общая суточная доза. При длительной инфузии дозы и интервал между ними не меняются, а время введения препарата сокращается до 0,5-3 часов.
Таким образом, у пациентов в критическом состоянии приняты 7 основных концепций использования АБ:
- Воздействие на микробную резистентность.
- Стратификация рисков.
- Улучшение диагностики.
- Комбинирование.
- Лекарственная оптимизация.
- Деэскалация.
- Продолжительность.
Что касается антибактериальной монотерапии, то сегодня широко используются новые АБ, к которым у грамнегативных патогенов еще не развилась мультирезистентность. Одним из таких АБ является тайгециклин. В Европе с 2006 по 2011 год был проведен целый ряд масштабных обсервационных исследований (с участием 1782 пациентов хирургических стационаров и ОИТ), направленных на изучение показаний к применению нового АБ тайгециклина.
В результате было установлено, что тайгециклин в качестве монопрепарата показан в следующих клинических ситуациях (Bassetti М. et al., 2013):
- осложненные инфекции хирургической раны;
- осложненные инфекции кожи у пациентов с факторами риска развития АБР;
- осложненные интраабдоминальные инфекции у пациентов высокого риска (нозокомиальный перитонит);
- таргетная терапия мультирезистентных штаммов (Acinetobacter, CRE, S. malthophilia, VRE) при этих нозологиях.
Препарат эффективен для широкого спектра возбудителей, среди которых особого внимания заслуживают представители ESCAPE: Enterococcus faecium, Staphylococcus aureus, Acinetobacter baumannii, Enterobacteriaceae, в том числе продуцирующие БЛРС и карбапенемазы (Rice L.B., 2008; Boucher H.W. et al., 2009; Peterson L.R., 2009).
Препарат следует применять, когда к нему установлена чувствительность и другие АБ неприемлемы. В конце своего выступления спикер ответил на ряд практических вопросов, поступивших от специалистов.
? Когда целесообразно использовать меропенем?
Меропенем целесообразно использовать как в эмпирической терапии, так и в качестве препарата второй линии. Эмпирически меропенем назначают в следующих клинических ситуациях:
- нозокомиальная пневмония с поздним началом;
- подтвержденное или предполагаемое инфицирование мультирезистентными патогенами, включая БЛРС-продуцирующие штаммы (например, пациенты, перенесшие недавнюю госпитализацию, проживающие в доме престарелых или недавно получившие курс АБТ) в рамках утвержденных показаний.
В качестве препарата второй линии согласно рекомендациям меропенем назначают при неэффективности предыдущего лечения пиперациллином /тазобактамом, цефалоспоринами, аминогликозидами и фторхинолонами.
? Существуют ли различия между имипенемом и меропенемом?
Меропенем более активен, чем имипенем/циластатин, в отношении грамнегативных патогенов. В свою очередь, имипенем/циластатин более активен, чем меропенем, в отношении стафилококков и энтерококков. Доза меропенема при некоторых показаниях может быть повышена из-за его благоприятного профиля переносимости (включая низкую нейротоксичность), в то время как имипенем вызывает большее количество нежелательных эффектов, включая судороги (особенно у пожилых, при почечной недостаточности, травме головы, наличии судорог в анамнезе) и рвоту (особенно у детей).
? Какие подходы применяются при назначении тайгециклина в клинической практике?
Клиницистами практикуется следующий подход при назначении тайгециклина в зависимости от конкретной эпидемиологической ситуации: монотерапия в случае внебольничных и госпитальных осложненных интраабдоминальных инфекций при наличии чувствительности. Кроме того, тайгециклин может использоваться как часть стратегии комбинирования (после определения чувствительности к нему) в карбапенем-сберегающих схемах терапии, когда другие АБП неприемлемы для применения.
 О проблеме АБР и возможностях ее решения в Украине рассказал профессор кафедры анестезиологии и интенсивной терапии Национального медицинского университета им. А.А. Богомольца (г. Киев), президент Ассоциации анестезиологов Украины, доктор медицинских наук Сергей Александрович Дубров.
О проблеме АБР и возможностях ее решения в Украине рассказал профессор кафедры анестезиологии и интенсивной терапии Национального медицинского университета им. А.А. Богомольца (г. Киев), президент Ассоциации анестезиологов Украины, доктор медицинских наук Сергей Александрович Дубров.
– Сегодня, по данным ВОЗ, АБР является глобальной проблемой, которая наблюдается не только в стационарах, но и за их пределами. Эта проблема способствует росту заболеваемости и смертности, приводит к повышению социально-экономических затрат и существенно ограничивает возможности врачей в терапии инфекций.
Небольшой экскурс в историю создания АБ показывает, что буквально сразу, наряду с массовым производством и использованием пенициллина в 1943 г., уже в 1946 г. появились первые официальные данные о резистентности бактерийк нему. А в своей нобелевской речи Александр Флемминг впервые упомянул о проблеме роста, доступности и неправильного применения АБ в мире, что приведет к появлению новых штаммов возбудителей с мультирезистентностью.
Сегодня темпы развития устойчивости патогенов существенно ускорились: от момента появления в производстве нового АБ до момента возникновения новых устойчивых штаммов возбудителей может пройти всего несколько месяцев, а сами возбудители вырабатывают механизмы поли- и панрезистентности ко многим группам АБП.
О масштабах проблемы АБР в мире, в частности, свидетельствуют данные, представленные ВОЗ в 2011 г., который был объявлен Годом борьбы с АБР:
- в США зарегистрировано 40 млн случаев необоснованного назначения АБП;
- около 50% мяса, которое продается в торговых сетях, контаминировано мультирезистентными микроорганизмами;
- 60% случаев назначений АБП без показаний взрослым, 30% – детям.
Еще одной проблемой, о которой практически не говорят в Украине, является инфекционный контроль и отсутствие клинических микробиологов или эпидемиологов в подавляющем большинстве наших лечебных учреждений.
Многолетнее применение АБ в современном животноводстве и пищевой промышленности также способствует вмешательству в геном бактерий, появлению и распространению лекарственно устойчивых патогенов как среди животных, так и среди людей. Было установлено, что в мировом сельском хозяйстве используется 76% всех АБ; из них только 6% – для лечения заболеваний у животных, а 94% – для профилактики.
В исследовании Van Boeckel и соавт. (2015) впервые представили глобальную карту потребления АБ в животноводстве в 288 странах за 2010 г. – оно составило 63 151 тонну. Исследователи прогнозируют, что к 2030 г. общее потребление АБП вырастет на 67% и почти удвоится в Китае, США, Бразилии, Индии и других крупных странах на всех континентах.
Этот рост будет обусловлен повышением потребительского спроса на продукты животноводства в странах со средним уровнем дохода и переходом к крупным фермам, где регулярно используются антимикробные средства. К сожалению, данных по ситуации в Украине нет, и эта проблема у нас в широком информационном пространстве также практически не освещается, хотя АБ в животноводстве используются не менее широко, чем в других странах.
В целом ВОЗ выделяет ряд факторов, которые способствуют чрезмерному назначению и употреблению АБ в мире:
- Недостаточное обучение студентов медицинских вузов вопросам инфекционного контроля и АБТ.
- Низкая информированность среди врачей относительно этиологии различных видов инфекций.
- Позиция пациентов и/или их родственников: во время визита к врачу более 90% пациентов ожидают назначения АБ, считая их панацеей.
- Недооценка нежелательных эффектов при использовании АБ.
- Роль провизоров и фармацевтов, «провоцирующих» использование АБ пациентами.
- Неудовлетворительная информированность населения и вовлеченность общества в проблему АБР.
- Переоценка эффективности АБ при острых вирусных инфекциях.
О последнем факторе необходимо упомянуть отдельно вследствие того, что в рутинной клинической практике принято широко назначать АБ «при повышенной температуре», в том числе и с «целью профилактики», хотя известно, что при вирусных инфекциях, для которых гипертермия является характерным симптомом, АБ не показаны.
В контексте проблемы развития АБР необходимо уточнить, какие клинические ситуации и патогены являются значимыми в рутинной практике. Известно, что наиболее частым инфекционным осложнением является внебольничная пневмония.
Среди возбудителей этого заболевания преобладают Streptococcus pneumoniae, метициллинчувствительные (MSSA) штаммы Staphylococcus aureus, Haemophilus influenzaе, Moraxella catarrhalis, а также атипичные микроорганизмы (Mycoplasma pneumoniae, Clamydophila pneumoniae, Legionella pneumophila). Также известно, что в Европе у 5-25% пациентов, госпитализированных по поводу этого заболевания, эмпирическая АБТ неээффективна / недостаточно эффективна. При этом частота модификаций начальной АБТ у таких пациентов составляет до 37%.
В последние годы в Европе отмечается существенный рост АБР некоторых возбудителей внебольничной пневмонии. По данным TESSy (The European Surveillance System), опубликованным в 2013 г., наивысший уровень резистентности (25-50%) к пенициллинам и макролидам Streptococcus pneumoniaе и метициллинрезистентных (MRSA) штаммов Staphylococcus aureus был отмечен в странах Юго-
Восточной Европы. Схожая картина наблюдается в случае выявления Pseudomonas aeruginosa, в частности инвазивных изолятов, резистентных к ≥3 классам АБП, а также Acinetobacter baumannii, резистентной к карбапеменам.
В целом факторами риска внебольничных инфекций, вызванных продуцентами БЛРС, считаются: терапия цефалоспоринами II и III поколений, хинолонами, пенициллинами, госпитализация и АБТ в предыдущие 3 мес, возраст пациента ≥60 лет, наличие сахарного диабета.
Однако самым большим вызовом для клиницистов является нозокомиальная инфекция в ОИТ. В 2009 г. были опубликованы результаты масштабного международного исследования по распространенности и исходам инфекционных осложнений в ОИТ (Vincent J.L. и соавт.) с участием 13 796 пациентов, 71% (n=9084) из которых получали АБ. У 7087 (51%) из 13 796 пациентов были констатированы инфекционные осложнения, при этом преобладали инфекции нижних дыхательных путей (70%).
Также было установлено, что у пациентов, длительное время пребывавших в ОИТ, отмечалась более высокая частота инфекционных осложнений; среди возбудителей превалировали мультирезистентные стафилококки, Acinetobacter spp., Pseudomonas aeruginosa и грибы рода Candida. Показатель летальности в ОИТ у больных с нозокомиальными инфекционными осложнениями по сравнению с неинфицированными пациентами был выше почти в 2,5 раза (25 vs 11% соответственно), а госпитальная летальность – в 2,2 раза (33 vs 15% соответственно).
В Украине, по данным масштабного исследования, проведенного в 20 ОИТ (Глумчер Ф.С. и соавт., 2016), среди патогенов группы ESCAPE преобладали Pseudomonas aeruginosa (20,20%) и Staphylococcus aureus MRSA (17,73%). Из патогенов ESCAPE большинство (32,38%) случаев менингоэнцефалита были вызваны Staphylococcus aureus MRSA и 27% – Enterobacter spp., а в 32,58% случаев пневмоний определялась Pseudomonas aeruginosa, Acinetobacter baumannii (15,25%) и Enterobacter spp. (14,31%).
Среди возбудителей нозокомиального перитонита преобладали Enterococcus faecium (24,61%), а также Pseudomonas aeruginosa (17,45%), Enterobacter spp. (17,23%) и Esсherichia coli (17,45%). Среди возбудителей нозокомиальных инфекций мочевыводящих путей чаще всего определялись Esсherichia coli (26,27%), Enterococcus faecium (22,30%) и Klebsiella pneumoniae (19,21%).
Приняв во внимание все эти данные, значение адекватной и своевременной АБТ для пациентов трудно переоценить. В свое время A. Kumar и соавт. (2006) показали, что каждый час задержки АБТ у пациентов с септическим шоком приводит к росту летальности на 7,6%.
При своевременном старте АБТ в течение 30 мин выживает 80% пациентов, в то время как при ее задержке на 6 ч – менее 40%.
Тем не менее, учитывая неблагополучную ситуацию с ростом АБР, стратегическим вопросом рационального использования АБП является ограничение использования АБ в парадигме баланса между их применением, сохранением эффективности и профилактикой развития устойчивости возбудителей к тому или иному АБП:
Сегодня к выбору стартовой АБТ в ОИТ существует ряд требований. АБ должен назначаться:
- в соответствии с чувствительностью к нему возбудителя инфекции;
- в такой разовой и суточной дозе и таким путем введения, которые обеспечат терапевтическую концентрацию в очаге воспаления;
- в такой разовой и суточной дозе и таким путем введения, которые исключат или максимально ограничат развитие побочных эффектов.
Кроме того, в клинической практике часто возникает необходимость применения комбинированной АБТ. Поэтому следует привести критерии ее использования:
- комбинированная АБТ не может применяться рутинно при лечении большинства инфекций, в том числе при бактериемии;
- для большинства инфекций, связанных с сепсисом и септическим шоком, адекватной является длительность АБТ 7-10 дней;
- более длительные курсы АБТ показаны пациентам с замедленным клиническим ответом, очагами хронических инфекций, MRSA-бактериемией, некоторыми грибковыми и вирусными инфекциями, иммунодефицитом (в том числе нейтропенией).
Следует отметить, что при выборе стартового АБП необходимо тщательно собрать анамнез, обратив особое внимание на госпитализацию и наличие АБТ в течение предшествующих 3 мес (лечение цефалоспоринами II и III поколений, фторхинолонами).
Какой же препарат выбрать для стартовой АБТ? В этом смысле представляют интерес результаты сравнительных исследований фармацевтической и микробиологической эквивалентности брендовых и генерических АБП, осуществленных P.A. Lambert и соавт. (2008) и R. Jones (2008). Учеными было установлено, что многие генерики не соответствуют стандартам Фармакопеи ЕС в отношении стерильности и примесей, обладают достоверно меньшей антимикробной активностью (диапазон активности составляет 5-35% по сравнению с брендом), а в среднем у 16% генериков было выявлено недостаточное дозирование до 2,6 г/сут.
Рекомендованные схемы выбора АБП для лечения грампозитивных нозокомиальных инфекций включают: гликопептиды (ванкомицин, тейкопланин), оксазолидиноны (линезолид), глицилциклины (тайгециклин), даптомицин, цефалоспорины V поколения.
Что касается выбора АБП для лечения грамнегативных нозокомиальных инфекций, то в качестве монотерапии применяют защищенные цефалоспорины (цефоперазон/сульбактам) и пенициллины (пиперациллин/тазобактам). В случае необходимости применения комбинированной АБТ рекомендованы цефалоспорины III-IV поколений с аминогликозидами (тобрамицин) или колистин, а также фторхинолоны II-IV поколений.
Кроме того, в ОИТ необходимо проводить своевременный и постоянный контроль очага инфекции. Этот контроль включает максимально быструю идентификацию (или исключение) фокуса инфекции у пациентов с сепсисом и осуществление соответствующего медицинского вмешательства. Также у таких пациентов рекомендовано быстрое удаление устройств для внутрисосудистого доступа (они могут стать источником сепсиса или септического шока) после того, как будет установлен другой сосудистый доступ.
С учетом всего вышесказанного мероприятия по регулированию и оптимизации применения АБ в Украине зависят от совместных усилий всех специалистов, вовлеченных в лечебный процесс.
По завершении доклада Сергей Александрович ответил на вопросы присутствующих.
? Какой из карбапенемов предпочтительнее для лечения тяжелых нозокомиальных инфекций, вызванных полирезистентными штаммами микроорганизмов?
– Высокая частота развития полирезистентности возбудителей нозокомиальных инфекций к АБ означает, что лечение этих инфекций в большинстве случаев возможно только препаратами резерва, в частности карбапенемами.
Меропенем, по сравнению с имипенемом, более эффективен для лечения инфекций, вызванных грамотрицательными микроорганизмами, однако в случае инфекций, вызванных грамположительной флорой, его действие не столь выражено. Дорипенем обладает сопоставимым терапевтическим действием в отношении грамположительных и грамотрицательных возбудителей инфекций, а также более стабилен в растворах при температуре 37 °C. Эти свойства дорипенема позволяют применять его в схемах с непрерывными инфузиями, длительно поддерживая необходимую концентрацию в плазме крови.
? Каковы перспективы преодоления проблемы АБР в Украине?
– Инициативы ВОЗ по сдерживанию роста АБР во всех странах мира являются важными и для Украины. Однако в нашей стране проблема усугубляется тем, что она все еще недостаточно изучена и данные об уровне АБР в Украине отсутствуют. На основании рекомендаций ВОЗ был разработан Национальный план действий по борьбе с устойчивостью к противомикробным препаратам.
Стратегической целью является укрепление инфекционного контроля и мониторинга АБР в лечебных учреждениях. Эффективной мерой по снижению АБР является также временный отказ от применения некоторых АБ для лечения нозокомиальных инфекций. Немаловажным направлением является реформирование агропромышленной отрасли, где АБ сегодня используются нерационально.
? Какие дополнительные меры необходимы для предотвращения и замедления селекции резистентности микроорганизмов в ОИТ?
– Принципы инфекционного контроля в ОИТ включают целый ряд мер, призванных, наряду с рациональным использованием АБП, предотвратить перекрестное инфицирование пациентов. Это:
- изоляция пациентов с инфекционными осложнениями, вызванными поли- и панрезистентными штаммами микроорганизмов;
- прерывание механизма передачи инфекции;
- назначение АБТ только при наличии инфекционного осложнения (а не в случае колонизации или контаминации);
- использование принципа деэскалационной АБТ;
- проведение эмпирической АБТ на основе локальных микробиологических данных лечебного учреждения;
- применение адекватной антибиотикопрофилактики хирургических инфекций (от разовой дозы до приема в течение 1, а в некоторых случаях – до 3 сут).
 Проблеме АБР в парадигме угрозы национальной безопасности, возможностей и путей решения посвятил свое выступление ректор ФГБОУ ВО «Смоленский государственный медицинский университет», доктор медицинских наук, профессор Роман Сергеевич Козлов (РФ).
Проблеме АБР в парадигме угрозы национальной безопасности, возможностей и путей решения посвятил свое выступление ректор ФГБОУ ВО «Смоленский государственный медицинский университет», доктор медицинских наук, профессор Роман Сергеевич Козлов (РФ).
– АБР является общей и актуальной для любой страны мира проблемой и вопросом повышенного внимания врачей всех специальностей. Мы, например, занимаемся исследованиями и мониторингом АБР с 1993 года.
На базе нашего медицинского университета были созданы Научно-исследовательский институт антимикробной химиотерапии и Межрегиональная ассоциация по клинической микробиологии и антимикробной химиотерапии.
Кроме того, был создан Федеральный научно-методический центр по мониторингу резистентности к антимикробным препаратам, который стал 4-м в Европе (после Великобритании, Голландии и Швеции) центром сотрудничества с ВОЗ по сдерживанию темпов роста АБР.
С момента практически случайного открытия пенициллина Флеммингом буквально каждые несколько лет появлялись новые классы АБП. Так, 40-е годы прошлого столетия стали эрой β-лактамов и цефалоспоринов; следующее десятилетие ознаменовалось появлением тетрациклинов и аминогликозидов (1950 г.), макролидов (1952 г.), гликопептидов (1958 г.).
В 1962 г. были созданы новые молекулы АБП – хинолоны и стрептограмины, а в 1968-м появился триметоприм. Такие успехи и достижения позволили многим экспертам утверждать, что в ближайшее время проблема инфекционных заболеваний в мире будет окончательно решена.
Однако данное утверждение было стратегической ошибкой, так как совершенно не учитывало адаптационных свойств микроорганизмов, которые последовательно эволюционировали от монорезистентности к поли- и панрезистентности. При этом в 70-80-е гг. прошлого столетия появлялись новые АБ, новые их классы не создавались.
Одной из причин было то, что фармацевтическим компаниям стало невыгодно создавать и производить новые классы АБП вследствие возросших издержек на их разработку, регистрацию, исследования, производство, а также большого отрезка времени (более 20 лет), требовавшегося для возврата инвестиций.
 Например, новые классы АБП, появившиеся на фармацевтическом рынке в начале 2000-х годов (оксазолидиноны, липопептиды, кетолиды), были созданы в 80-е годы ХХ ст. (Wenzel R.P., 2004). Какова же ситуация относительно АБП на сегодняшний день?
Например, новые классы АБП, появившиеся на фармацевтическом рынке в начале 2000-х годов (оксазолидиноны, липопептиды, кетолиды), были созданы в 80-е годы ХХ ст. (Wenzel R.P., 2004). Какова же ситуация относительно АБП на сегодняшний день?
С одной стороны, в наших странах зарегистрировано более 200 наименований АБП. Из них ≥20 классов – антибактериальные, ≥8 – противогрибковые, 8 классов – противовирусные и 12 классов – антипротозойные. И все же, несмотря на это, клиницистам в их практике не хватает новых эффективных АБП, прежде всего – для работы в стационарах.
С другой стороны, назрела необходимость использовать новые подходы в АБТ, с тем чтобы сохранить эффективность существующих классов АБП на фоне увеличившейся продолжительности жизни наших пациентов, улучшения качества лечения и повышения выживаемости при тяжелых инфекционных заболеваниях.
Однако на протяжении последних 20 лет самой большой проблемой оказался недостаток знаний по АБ и АБР всеми участниками лечебного процесса (медработники, фармацевты, пациенты). И хотя ситуация меняется, но не так быстро и кардинально, как хотелось бы. В 2015 г. на Всемирной ассамблее ВОЗ был представлен Глобальный план преодоления АБР, предлагающий программу мероприятий, направленных на замедление появления новых штаммов и распространения уже существующих.
Этот документ стал стимулом для разработки и принятия национальных программ по преодолению проблемы АБР в странах Европы. В 2017 г. в РФ была принята стратегия предупреждения и распространения АБР на период до 2030 года. Она определяет задачи по сдерживанию биологической угрозы, связанной с распространением АБР, а также государственную политику профилактики и ограничения распространения устойчивости к АБП. В рамках стратегии, в частности, планируется ужесточить контроль над рецептурным отпуском АБ.
Как известно, в наших странах абсолютное большинство фармацевтов и провизоров практикуют безрецептурный отпуск АБ. При этом необходимо напомнить, что назначение АБП в целом является прерогативой лечащего врача. Однако наши пациенты по-прежнему предпочитают самостоятельно лечиться с помощью АБП в тех случаях, когда эти препараты не показаны. Так, по нашим данным, структура вариантов самолечения острых респираторных инфекций в 2016 г. выглядела следующим образом: 53,2% больных не использовали АБП, 36,9% – использовали сочетание АБП и не-АБП, 9,9% – лечились с помощью АБП.
При этом используя АБ, которые отпускают без рецепта, из домашних аптечек, оставшиеся от предыдущего лечения, в том числе (что является наибольшей проблемой) препараты с истекшим сроком годности. Поэтому важно не только ужесточить контроль над рецептурным отпуском АБ в аптеках, оптимизировать назначения врачей, но и повысить уровень осведомленности пациентов с применением всех имеющихся на сегодня информационных ресурсов.
Еще одной серьезной проблемой остается недостаточность эпидемиологических данных о тех или иных инфекциях, в то время как мы наблюдаем эволюцию и разнообразие патогенов. Так, в 40-60-е годы прошлого столетия преобладали пиогенные стрептококки, затем, вплоть до 60-70-х годов, в стационарах приоритетными возбудителями нозокомиальных инфекций были золотистые стафилококки, а с 80-х годов стали доминировать грамнегативные возбудители.
В результате такой эволюции патогенов с 2009 г. так называемая проблемная шестерка состоит из таких представителей микромира: Enterococcus faecium, Staphylococcus aureus MRSA, Klebsiella pneumoniae, Acinetobacter baumannii, Pseudomonas aeruginosa, Enterobacter spp., входящих в представленный ВОЗ список критических патогенов (Boucher H.W. et al., 2009).
Изменение доли бактериальных возбудителей нозокомиальных инфекций и отсутствие адекватной регистрации этой патологии в стационарах не позволяют надлежащим образом реагировать на распространение АБР. Например, в РФ зафиксирован отчетливый рост резистентности Enterobacter spp.; динамика устойчивости нозокомиальных изолятов Klebsiella pneumoniae к карбапенемам за период 2002-2016 гг. показала рост АБР с 9 до 23%; Acinetobacter baumannii прочно занял второе место по частоте развития нозокомиальных инфекций в стационарах, практически наряду с Pseudomonas aeruginosa, роль которой в последнее десятилетие, наоборот, стала снижаться. Такая картина в целом совпадает с ситуацией в стационарах наших западноевропейских соседей, равно как и возросшая частота выделения БЛРС-продуцирующих патогенов при внебольничных инфекциях мочевых путей (ИМП).
Актуальной проблемой также остается своевременная современная микробиологическая диагностика. Сегодня недостаточно только идентифицировать того или иного возбудителя и определить его чувствительность и устойчивость к различным АБП. Необходимо выявить молекулярный механизм устойчивости патогенов, так как без этого невозможно рациональное и эффективное использование АБ. Например, проблема резистентности к карбапенемам в настоящее время преодолима, однако для ее решения необходимо точно идентифицировать механизм устойчивости патогенов.
Современный принцип идентификации бактерий проводят с использованием технологии MALDI-ToF MS. С ее помощью идентифицируют микроорганизмы по масс-спектру их уникальных рибосомальных белков, своеобразных «отпечатков пальцев» бактерий. Этапы процесса идентификации выглядят следующим образом: проведение первичного посева с выделением изолированных колоний микроорганизмов; быстрая экстракция микробных белков в кислой среде; молекулярная идентификация возбудителя при помощи MALDI масс-спектра + компьютерной базы данных, которая содержит более 2800 видов бактерий и грибов, что позволяет определить тот или иной патоген и механизм его резистентности всего за 5-15 минут.
Необходимо упомянуть еще об одном крайне серьезном аспекте – использовании АБП в ветеринарии. Например, по данным M. Melon, в 2001 г. структура использования АБ в США выглядела следующим образом: с профилактической целью у животных применялись 11,2 млн кг АБ и с терапевтической целью – дополнительно еще 900 тыс кг, в то время как у людей – только 1,3 млн кг.
При этом такое масштабное использование АБ в животноводстве не решает проблему контаминации патогенами продуктов животного происхождения, поскольку:
- 20% мяса, продаваемого в торговых сетях, оказалось контаминировано сальмонеллами;
- заболеваемость сальмонеллезом в США составляет 1,4 млн случаев в год;
- количество летальных исходов – 600 случаев в год.
Чрезмерное использование АБП в ветеринарии приводит к тому, что полирезистентность приобретают те микроорганизмы, которым она практически не свойственна (например, сальмонелла).
Что касается ситуации с АБП в целом, то сегодня во всем мире отмечается дефицит инновационных препаратов. Выход на рынок новых АБ ежегодно снижается, а их созданием занимаются единичные крупные фармкомпании. Также не вызывает сомнение, что особое внимание необходимо уделять качеству инновационных препаратов.
Так, исследования оригинальных и генерических препаратов, проведенные N.A. Lehr и соавт. (2002) и А.А. Никулиным и соавт. (2010), выявили ряд особенностей, существенно влияющих на эффективность и безопасность:
- наличие нерастворимых частиц, выявленное у внутривенных форм генериков, ведет к нарушению микроциркуляции в ишемизированных тканях;
- в клинической практике (при сепсисе, шоке, массивных хирургических вмешательствах) наличие в препарате нерастворимых частиц в растворе для внутривенного введения может неблагоприятно сказаться на эффективности терапии и повысить риск неблагоприятного исхода.
При этом в современной медицине генерики необходимы, так как они сохраняют бюджет системы здравоохранения и снижают экономические издержки, однако в этой группе должны быть представлены исключительно препараты с доказанной эквивалентностью.
В целом следует отметить, что эффективные АБ предоставляют огромные возможности в современной медицине, так как без них, например, невозможно проводить операции на сердце, выхаживать недоношенных новорожденных и лечить онкологических больных. Однако при сохранении темпов роста АБР к 2050 году в мировой экономике прогнозируются потери до 7% ВВП (210 трлн долларов США).
Резюмируя вышеизложенное, можно сделать вывод, что рациональный и адекватный подход к проблеме АБР в любой стране предполагает:
- наличие национальной политики применения АБП, базирующейся на региональных и локальных особенностях резистентности патогенов;
- осуществление инфекционного контроля в лечебных учреждениях;
- обучение и информирование специалистов и населения о рациональном применении АБП;
- ограничение бесконтрольного применения АБП;
- стимулирование государственно-частного партнерства в области разработки и производства инновационных препаратов.
В конце доклада профессор Козлов также ответил на некоторые вопросы аудитории.
? Какие классы АБП сегодня предпочтительнее для лечения инфекций, вызванных полирезистентными патогенами?
– Важнейшим классом для лечения инфекций, вызванных в том числе (как это ни парадоксально) и CRE-микроорганизмами, остаются карбапенемы. При этом меропенем определен в регистрационном удостоверении в качестве одного из двух препаратов, используемых для длительных инфузий. В случае идентификации CRE-патогенов используются комбинации карбапенемов с другими АБП (колистин, тайгециклин, фосфомицин).
? Существуют ли другие подходы к созданию и применению инновационных препаратов для воздействия на мультирезистентные патогены?
– Действительно, в некотором смысле возможности АБ упростили решение ряда проблем. Но всегда ли такой легкий путь – наиболее правильный? Например, применить АБ при бактериальной диарее легче, чем обеспечить повсеместный доступ к чистой воде, вакцинации, профилактике инфекций. Однако такая ситуация ведет к неграмотному применению АБП в мире и, соответственно, к росту АБР. Другие подходы к созданию инновационных препаратов предполагают изменение мышления на всех уровнях (локальном, региональном и далее по восходящей).
Примерами такого мышления сегодня могут служить: государственно-частное партнерство в совместных исследованиях; нетрадиционные способы воздействия на патогены с использованием фагов, фаголизинов, индукции антивирулентности, иммуномодуляции макроорганизма; создание вакцин и моноклональных антител для лечения и профилактики инфекций.
Выступления спикеров, имеющих большой авторитет в научном мире, очередной раз подтвердили серьезность угрозы АБР для здоровья мировой популяции, продовольственной безопасности и развития, а также необходимость изменения подходов к назначению и рациональному использованию антибиотиков во всем мире. На локальном уровне данная ситуация требует постоянных и совместных усилий всех участников лечебного процесса, на региональном – тесного сотрудничества национальной системы здравоохранения, правительства, фармацевтических компаний и международных организаций.
ЗИВОКС (лінезолід), розчин для інфузій, по 2 мг в 1 мл розчину, по 300 мл в системі для внутрішньовенного введення, по 1 системі в упаковці з ламінованої фольги; таблетки, вкриті плівковою оболонкою, по 600 мг, по 10 таблеток у блістері, по 1 блістеру в картонній коробці. Коротка інструкція для медичного застосування препарату
Показання до застосування: Лікування інфекцій, спричинених чутливими штамами анаеробних або аеробних грампозитивних мікроорганізмів, включаючи інфекції, що супроводжуються бактеріємією, такі як: нозокоміальна пневмонія; негоспітальна пневмонія; ускладнені інфекції шкіри та її структур, зокрема інфекції на тлі діабетичної стопи без супутнього остеомієліту, спричинені Staphylococcus aureus (метицилін-чутливими та метицилін-резистентними ізолятами), Streptococcus pyogenes або Streptococcus agalactiae; неускладнені інфекції шкіри та її структур, спричинені Staphylococcus aureus (тільки метицилін-чутливими ізолятами) або Streptococcus pyogenes; інфекції, спричинені ентерококами, включаючи резистентні до ванкоміцину штами Enterococcus faecium та faecalis. Якщо збудники інфекції включають грамнегативні мікроорганізми, клінічно показане призначення комбінованої терапії.
Спосіб застосування та дози. Зивокс дорослим та дітям від 12 років призначають по 600 мг кожні 12 годин внутрішньовенно або перорально, при неускладнених інфекціях шкіри та її структур – дорослі: 400 мг перорально кожні 12 годин, діти віком від 12 років: 600 мг перорально кожні 12 годин. Тривалість внутрішньовенної інфузії 30-120 хвилин.
Максимальна доза для дорослих і дітей не має перевищувати 600 мг 2 рази на добу. Дітям внутрішньовенно застосовують з перших днів життя.
Таблетки застосовують дітям старше 12 років. Дозування дітям вказані в інструкції до застосування. У разі переводу пацієнта з парентеральної форми на пероральну підбір дози не потрібен, оскільки біодоступність лінезоліду при прийомі внутрішньо становить майже 100%. Детальніше див. повну інстр.
Протипоказання. Гіперчутливість до лінезоліду або будь-якого іншого компоненту препарату, а також до інших компонентів препарату. Зивокс не слід застосовувати пацієнтам, які приймають будь-які медичні препарати, що пригнічують моноаміноксидазу А та В (наприклад, фенелзин, ізокарбоксазид, селегілін, моклобемід), або протягом двох тижнів після прийому таких препаратів.
За винятком випадків, коли є можливість ретельного спостереження та моніторингу артеріального тиску, Зивокс не слід призначати пацієнтам з такими супутніми клінічними станами або супутнім прийомом нижчезазначених препаратів: неконтрольована артеріальна гіпертензія, феохромоцитома, карциноїд, тиреотоксикоз, біполярна депресія, шизоафективний розлад, гострі епізоди запаморочення; інгібітори зворотного захоплення серотоніну, трициклічні антидепресанти, агоністи 5-НТ1 рецепторів серотоніну (триптани), прямі та непрямі симпатоміметики (включаючи адренергічні бронходилататори, псевдоефедрин, фенілпропаноламін), вазопресори (епінефрин, норепінефрин), допамінергічні сполуки (допамін, добутамін), петидин або буспірон.
Побічна дія. Найчастіше повідомлялося про головний біль, діарею, нудоту та кандидоз. Часто спостерігали: кандидоз або грибкові інфекції, головний біль, перверсії смаку, діарею, нудоту, блювання, аномальні функціональні печінкові проби, збільшення рівнів аланінамінотрансферази, аспартатамінотрансферази або лужної фосфатази, підвищення азоту сечовини крові, зміни в біохімічному, клінічному аналізі крові. Детальніше див. повну інстр.
Особливості застосування. Повідомлялося про виникнення оборотної мієлосупресії, вираженість якої може бути залежною від дози препарату та тривалості лікування. Про випадки псевдомембранозного коліту повідомлялося при застосуванні майже всіх антибактеріальних препаратів, включаючи лінезолід; ступінь його тяжкості може варіювати від незначного до такого, що становить загрозу для життя. При застосуванні лінезоліду повідомляли про розвиток лактоацидозу.
Пацієнти, в яких під час застосування лінезоліду виникають симптоми та прояви метаболічного ацидозу, включаючи рецидивуючу нудоту або блювання, біль у животі, низький рівень бікарбонатів або гіпервентиляцію, мають негайно звернутися за медичною допомогою. Повідомлялося про розвиток периферичної нейропатії, а також нейропатії зорового нерва, яка іноді прогресувала до втрати зору в пацієнтів, які отримували лікування препаратом Зивокс.
Повідомлялося про випадки судом у пацієнтів, які отримували терапію препаратом Зивокс. Застосування антибіотиків іноді може призводити до надмірного росту нечутливих організмів. У разі виникнення суперінфекцій під час лікування слід вживати відповідних заходів. В період вагітності Зивокс треба призначати лише коли очікувана перевага від лікування для матері вища за потенційний ризик для плода. Слід припинити годування груддю протягом лікування препаратом. Детальніше див. повну інструкцію з медичного застосування.
Взаємодія з іншими лікарськими засобами: Зивокс - розчин, сумісний з: 5% розчином декстрози, 0,9% розчином хлориду натрію, розчином Рінгер-лактату для ін’екцій. Лінезолід є неселективним інгібітором моноамінооксидази зворотної дії. Тому застосування лінезоліду не рекомендоване, якщо неможливо проводити пильне спостереження та моніторинг стану пацієнта. У здорових добровольців із нормальним артеріальним тиском лінезолід посилює підйом артеріального тиску, спричинений псевдоефедрином та фенілпропаноламіду гідрохлоридом. Детальніше див. повну інструкцію з медичного застосування.
Фармакологічні властивості. Зивокс ‒ це антибактеріальний препарат.
Умови відпуску. За рецептом.
Перед використанням препарату необхідно ознайомитися з інструкцією для медичного застосування та проконсультуватись із лікарем.
Інформація для лікарів і фармацевтів. Призначено для розповсюдження на семінарах, симпозіумах, конференціях з медичної тематики.
Реєстраційні посвідчення № UA/1969/01/01 від 31.10.2014 р., зі змінами від 22.12.2016 р., та UA/1969/02/01 від 19.06.2014 р., зі змінами від 17.02.2016 р.
За додатковою інформацією звертайтесь до Представництва «Пфайзер Експорт Бі. Ві.» в Україні: 03038, м. Київ, вул. М. Амосова, 12. Бізнес-центр «Горизонт парк»,
тел.: (044) 391-60-50.
ТИГАЦИЛ (тайгециклін) по 50 мг у скляних флаконах, по 10 флаконів у картонній коробці.
Показання до застосування. Ускладнені інфекції шкіри та м’яких тканин, за винятком інфікованої діабетичної стопи; ускладнені інтраабдомінальні інфекції. Тигацил слід застосовувати тільки у випадках, коли інші антибіотики не прийнятні до застосування.
Спосіб застосування та дози. Тривалість лікування слід обирати залежно від тяжкості захворювання, локалізації інфекції та клінічної відповіді пацієнта. Початкова рекомендована доза для дорослих становить 100 мг, надалі слід застосовувати по 50 мг кожні 12 годин впродовж 5-14 днів.
Тайгециклін слід застосовувати для лікування дітей віком від 8 років тільки після консультації з лікарем, який має достатній досвід лікування інфекцій. Діти віком від 8 до 12 років: 1,2 мг/кг тайгецикліну кожні 12 годин внутрішньовенно, максимальна доза – 50 мг кожні 12 годин протягом 5-14 днів. Підлітки віком від 12 до 18 років: 50 мг кожні 12 годин протягом 5-14 днів.
Тайгециклін застосовують лише шляхом внутрішньовенної інфузії тривалістю від 30 до 60 хвилин. Дітям бажано вводити тайгециклін у вигляді внутрішньовенної інфузії тривалістю понад 60 хвилин. Приготовлений розчин потрібно використати негайно.
Протипоказання. Гіперчутливість до діючої речовини чи до будь-якої з допоміжних речовин, вказаних у розділі «Склад». Пацієнти з гіперчутливістю до антибіотиків тетрациклінового ряду можуть мати гіперчутливість до тайгецикліну.
Побічні реакції. Найчастішими побічними реакціями були нудота (21%) та блювання (13%), сепсис/септичний шок, пневмонія, абсцес, інфекції, подовження активованого часткового тромбопластинового часу, подовження протромбінового часу, гіпоглікемія, гіпопротеїнемія, запаморочення, флебіт, діарея, біль у черевній порожнині, диспепсія, анорексія, підвищення рівня аспартатамінотрансферази (АсАТ) в сироватці крові, підвищення рівня аланінамінотрансферази (АлАТ) у сироватці крові, гіпербілірубінемія, свербіж, висипання, погіршення загоєння, реакції в місці ін’єкції, головний біль, підвищення рівня амілази в сироватці крові, підвищення рівня азоту сечовини в крові.
Особливості застосування. Пацієнтам із порушенням функції нирок та пацієнтам, які знаходяться на гемодіалізі, пацієнтам літнього віку, пацієнтам із легким чи помірним ураженням печінки корекція дози не потрібна. Перед початком та під час застосування тайгецикліну необхідно регулярно проводити функціональні печінкові проби, перевіряти параметри коагуляції, показники крові, рівні амілази та ліпази.
Безпеку та ефективність застосування препарату Тигацил дітям віком до 8 років не було встановлено. Тайгециклін не слід застосовувати вагітним, окрім клінічних випадків, коли жінка потребує застосування тайгецикліну. Необхідно прийняти рішення припинити годування груддю або припинити/перервати терапію тайгецикліном з огляду на користь грудного вигодовування для дитини та користь терапії для жінки. При застосуванні тайгецикліну може виникнути запаморочення, що може впливати на здатність керувати автотранспортом та іншими механізмами.
Взаємодія з іншими лікарськими засобами та інші види взаємодій. При одночасному застосуванні тайгецикліну з антикоагулянтами треба ретельно контролювати результати досліджень коагуляції. Варфарин не впливав на фармакокінетичний профіль тайгецикліну.
Тайгециклін іn vitro не проявляє властивостей конкурентного інгібітору або інгібітору необоротної дії щодо ензимів CYP450. При одночасному застосуванні тайгецикліну з дигоксином потреби в коригуванні дози немає. При дослідженнях in vitro між тайгецикліном та антибіотиками інших класів, які часто застосовують у терапії, антагонізму виявлено не було. Супутнє застосування антибіотиків із пероральними протизаплідними засобами може знизити ефективність останніх.
Згідно з результатами дослідження in vitro тайгециклін є субстратом Р-глікопротеїну. Комбіноване застосування з інгібіторами Р-глікопротеїну (наприклад, кетоконазолом або циклоспорином) або індукторами Р-глікопротеїну (наприклад, рифампіцином) може вплинути на фармакокінетику тайгецикліну.
Не можна вводити одночасно з тайгецикліном через один і той самий Y-подібний катетер: амфотерицин В, ліпідний комплекс амфотерицину В, діазепам, езомепразол, омепразол та розчини для внутрішньовенного введення, які можуть призвести до збільшення значення рН понад 7. Не слід змішувати з іншими лікарськими засобами, для яких не була доведена сумісність із тайгецикліном.
Фармакологічні властивості. Тайгециклін – антибіотик гліцилциклінового ряду, інгібує трансляцію білка у бактеріях шляхом приєднання до рибосомної субодиниці 30S та шляхом блокування входу молекул аміно-ацил-тРНК в сайт А рибосоми. Загалом вважається, що тайгецикліну притаманна бактеріостатична дія.
Категорія відпуску. За рецептом.
Перед використанням препарату потрібно ознайомитися з повною інструкцією для застосування.
Інформація для лікарів та фармацевтів. Призначено для розповсюдження на семінарах, конференціях, симпозіумах з медичної тематики.
Реєстраційне посвідчення МОЗ України № UA/12347/01/01 від 04.07.2017 р., наказ МОЗ України № 760 від 04.07.2017 р.
За додатковою інформацією звертайтесь у:
Представництво «Пфайзер Експорт Бі. Ві.» в Україні:
03038, м. Київ, вул. М. Амосова, 12. Тел. (044) 391-60-50.
Напечатано при поддержке Представительства «Пфайзер Экспорт Би.Ви.» в Украине.
PP-MRR-UKR-0011
Подготовила Наталия Позднякова
Тематичний номер «Хірургія, Ортопедія, Травматологія, Інтенсивна терапія» № 3 (33), вересень 2018 р.