3 грудня, 2018
Гепатопротектори: вплив на мітохондріальний оксидативний стрес
 У структурі причин фіброзу печінки останнім часом істотно збільшилась частка неалкогольного стеатогепатиту (НАСГ), зумовленого неалкогольною жировою хворобою печінки (НАЖХП) [24, 31]. Встановлено, що НАЖХП зустрічається у 80% пацієнтів з ожирінням (ІМТ >30 кг/м2) [15], проте НАЖХП та НАСГ можуть спостерігатись і у пацієнтів із надлишковою масою тіла (ІМТ >25 кг/м2) [17]. НАСГ – одна з найбільш важливих проблем охорони здоров’я у світі у зв’язку з тим, що захворювання може спричинити цироз та гепатокарциному [24].
У структурі причин фіброзу печінки останнім часом істотно збільшилась частка неалкогольного стеатогепатиту (НАСГ), зумовленого неалкогольною жировою хворобою печінки (НАЖХП) [24, 31]. Встановлено, що НАЖХП зустрічається у 80% пацієнтів з ожирінням (ІМТ >30 кг/м2) [15], проте НАЖХП та НАСГ можуть спостерігатись і у пацієнтів із надлишковою масою тіла (ІМТ >25 кг/м2) [17]. НАСГ – одна з найбільш важливих проблем охорони здоров’я у світі у зв’язку з тим, що захворювання може спричинити цироз та гепатокарциному [24].
До основних причин фіброзу печінки також належать: генетичні, аутоімунні та метаболічні порушення, хронічні вірусні інфекції, холестаз, зміни складу або концентрації жовчних кислот, венозна обструкція, паразитарні інфекції, медикаментозно-індукований гепатит (найчастіше розвивається внаслідок прийому антибіотиків, цитостатиків, протигрибкових, гормональних, нестероїдних протизапальних препаратів тощо).
У гепатоцитах в ендоплазматичному ретикулумі (ЕПР) відбувається синтез багатьох протеїнів сироватки крові. Їх продукцію забезпечує комплекс локальних та системних регуляторних механізмів [26]. В ЕПР відбуваються також процеси укладання та дозрівання трансмембранних, секреторних і ЕПР-залежних білків. Поліпептидні ланцюги, які синтезовані на поверхні рибосом, прилеглих до гранулярності ЕПР, входять у його порожнини. В ЕПР лінійні послідовності амінокислот набувають тривимірної структури, після цього функціонально зрілі протеїни переміщуються у цитозоль [5].
Патологічні фактори (зокрема, хронічна вірусна інфекція) спричиняють порушення цього процесу. Внаслідок цього у порожнині ЕПР накопичуються розгорнуті або неправильно згорнуті білки [23, 35], що становить загрозу для клітини та індукує стрес ЕПР (рис.).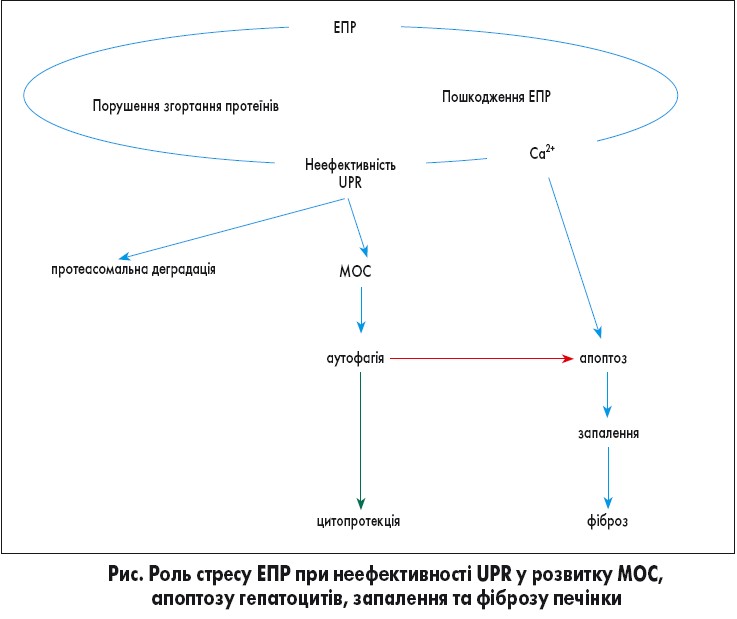
При цьому активується комплекс високоспецифічних внутрішньоклітинних сигнальних шляхів (UPR – unfolded protein response). Сигнали про наявність незгорнутих або неправильно згорнутих протеїнів у порожнині ЕПР через UPR надходять до цитоплазми та ядра [21, 29]. Як наслідок, уповільнюється трансляція та деградація неправильно згорнутих білків, експресуються молекулярні шаперони ЕПР (спеціальні білки, у тому числі білки теплового шоку, які допомагають їх згортанню), а також розширюється просвіт ЕПР, що зменшує навантаження білками та створює умови для їх кращої деградації. Так, білки теплового шоку зв’язуються з розгорнутим білком і утримують його від занадто швидкого згортання, яке, найімовірніше, виявиться неправильним. Якщо ж після декількох спроб білок все одно згортається неправильно, то білок теплового шоку направляє його у цитозоль, де він знищується шляхом протеасомної деградації [28]. Таким чином клітина очищується від пошкоджених протеїнів.
Одним із найдавніших механізмів захисту клітин, у тому числі від вірусної інфекції, є аутофагія. Виділяють два її типи: мікро- і макроаутофагію. Перший тип забезпечує направлення окремих білкових молекул у лізосому для їх знищення. Це аутофагія, опосередкована шаперонами, запускається за активної участі білка теплового шоку Hsc70, який направляє білок, який необхідно знищити, до поверхні лізосоми [25]. Другий тип аутофагії пов’язаний з утворенням мембранної структури (аутофагосоми) навколо тієї частини клітини, яка підлягає знищенню, при цьому разом із частиною цитоплазми захоплюються віруси [25].
Якщо аутофагія неефективна, активується апоптоз. Доведено, що накопичення жовчних кислот індукує стрес ЕПР, що призводить до пошкодження та загибелі гепатоцитів [16].
Встановлено, що стрес ЕПР та запуск UPR відіграють важливу роль при вірусних інфекціях (вірусних гепатитах В і С та ін.), оскільки в інфікованих вірусом клітинах продукується велика кількість вірусних білків [19, 22, 34, 35], зокрема поверхневого антигена гепатиту В [26]. Цитозольний незрілий структурний протеїн Core191 вірусу гепатиту С також індукує стрес ЕПР і UPR у гепатоцитах [33].
Високоінтенсивний стрес ЕПР та активація UPR призводять до мітохондріального окисного стресу (МОС), який можна розглядати як складову стресу ЕПР.
Накопичено багато даних, які підтверджують взаємозв’язок МОС, продукції цитокінів і фіброгенезу при хронічних дифузних запальних захворюваннях печінки [7].
Cтрес ЕПР та аутофагія направлені на виживання клітини в токсичних умовах [30]. Тривала активація UPR внаслідок МОС через неспроможність шляхом аутофагії ліквідувати велику кількість пошкоджених мітохондрій призводить до ініціації апоптозу і програмованої загибелі клітин. Отже, саме із МОС пов’язана цитодеструктивна дія вірусної інфекції.
Окрім цього, апоптоз запускається також через надмірний вихід у цитоплазму іонів кальцію. Ca2+ сигналізація, у свою чергу, пов’язана зі збудженням мембранних структур, що підвищує чутливість клітин до розпізнавання геномів вірусних частинок, які надійшли у клітину [18]. Так, доведено, що у клітинах, інфікованих вірусом гепатиту С, первинне пошкодження відбувається на мембранах ЕПР, асоційованих із мітохондріями, що спричиняє вивільнення Ca2+ з ЕПР та надходження в мітохондрію. Як наслідок, виникає дисфункція мітохондрій, що призводить до утворення активних форм кисню (МОС) та азоту, зниження окисного фосфорилювання та підвищення анаеробного гліколізу та ліпогенезу [32].
Стрес ЕПР та апоптоз гепатоцитів стимулюють імунні клітини та зірчасті клітини печінки (основна ланка розвитку фіброзу печінки), внаслідок чого продукуються інфламасоми та прозапальні цитокіни (інтерлейкіни ІЛ‑1β та ІЛ‑18), що призводить до прогресування фіброзу печінки через формування та накопичення сполучної тканини, порушення архітектоніки і тканинного ремоделювання [20, 27, 31]. Посилюють ці процеси порушення метаболізму глюкози та жирів. Портальні фібробласти при холестатичному ураженні печінки активуються у портальні міофібробласти, які експресують альфа-гладеньком’язовий актин (α-SMA) і продукують фіброгенний екстрацелюлярний матриксний колаген 1 типу і фібронектин, які відіграють важливу роль при портальному фіброзі [16].
Згідно із сучасними уявленнями важливим напрямом профілактики та корекції фіброзу печінки є вплив на стрес ЕПР та МОС. У цій оглядовій статті розглянемо можливості застосування з метою гепатопротекції препарату Антраль® (діюча речовина – синтезована в Україні координаційна сполука алюмінію з N-(2,3-диметилфеніл)-антраніловою кислотою). Препарат чинить протизапальну, знеболювальну, цитопротекторну [3], антиоксидантну та імуностимулювальну дію [11, 14].
Координаційні (комплексні) сполуки утворюються в результаті приєднання нейтральних молекул (лігандів) до певного центрального іона або атома (комплексоутворювача). Разом вони утворюють внутрішню сферу (комплекс); зовнішню координаційну сферу формують молекули або іони, які оточують комплекс. Координаційні сполуки широко поширені у живій (хлорофіл – це комплексна сполука магнію з порфіринами, гемоглобін містить комплекс заліза (II) з порфіриновими циклами) та неживій природі (мінерали переважно є координаційними сполуками металів); у медицині та фармації (інсулін – комплекс цинку, вітамін B12 – кобальту) тощо.
Комплексоутворення є важливим напрямом синтезу нових лікарських засобів та зумовлює їх фармакотерапевтичні переваги, зокрема, високу безпеку завдяки низькій токсичності [3].
Важливо враховувати, що роль металу у комплексі є високоспецифічною: його заміна призводить до значної або повної втрати активності комплексу.
Гепатопротекторна активність препарату Антраль® зумовлена вираженими антиоксидантними та мембраностабілізуючими властивостями, а також пов’язана з його імуностимулювальною та протизапальною дією. Антраль® знижує синтез простагландинів та інших медіаторів запалення, має антиексудативний, антиальтеративний та аналгезуючий ефекти [4]. Препарат індукує продукцію ендогенного інтерферону та фагоцитарну активність нейтрофілів і макрофагів, знижує рівень циркулюючих імунних комплексів, у тому числі найбільш токсичної середньомолекулярної фракції, нормалізує співвідношення хелперів/супресорів.
Антиоксидантні властивості препарату зумовлені наявністю оксиметильної групи у N-положенні бензольного кільця [1], його вплив на МОС асоційований із підвищенням активності антиоксидантних ферментів та інгібуванням ліпопероксидації.
Проведено велику кількість клінічних досліджень із вивчення гепатопротекторних властивостей препарату Антраль®, зокрема, з метою оцінки його ефективності у пацієнтів із токсичними та вірусними ураженнями печінки. Так, при гепатитах та НАЖХП препарат чинить цитопротекторну, мембраностабілізувальну та репаративну дію [2, 9], при цьому у хворих збільшується рівень глікогену в печінці, підвищується синтез білка та фосфоліпідів.
Включення препарату Антраль® у схему лікування хронічних гепатитів токсичного генезу забезпечує зменшення суб’єктивних та об’єктивних проявів захворювання: зникають біль і тяжкість у правому підребер’ї, нудота, гіркий присмак у роті, загальна слабість; зменшуються розміри печінки, вона стає більш м’якою та еластичною; помітно зменшуються жовтяниця і прояви астеновегетативного синдрому; швидше нормалізується рівень амінотрансфераз (АЛТ і АСТ), показник тимолової проби, підвищується рівень альбумінів і білковий коефіцієнт [12].
Ефективність препарату встановлена і при алкогольному гепатиті [8]. При його застосуванні у таких пацієнтів спостерігалося покращення самопочуття, швидша ліквідація жовтяниці та синдрому ендогенного токсикозу, зникнення больових відчуттів при пальпації печінки, зменшення розмірів печінки та селезінки. У 84% хворих досягнуто нормалізації білкового коефіцієнта, рівня білірубіну, АЛТ, АСТ, лужної фосфатази (ЛФ), γ-глютамілтранспептидази (ГГТ) [8], тоді як у групі порівняння, яка отримувала інші гепатопротектори, – лише у 33%. У результаті застосування препарату Антраль® у пацієнтів встановлено: ліквідацію Т-лімфопенії, підвищення кількості Т-хелперів, зменшення рівня циркулюючих імунних комплексів, посилення фагоцитарної активності нейтрофілів і макрофагів [8, 13], підвищення рівня аденозинтрифосфату (АТФ) у плазмі крові та еритроцитах, зростання енергетичного заряду клітин, зниження початково підвищеного рівня пірувату і лактату у крові та покращення мікрогемодинаміки [8, 10, 13].
При тривалому застосуванні Антраль® не чинить імунотоксичного, алергенного, кумулятивного, тератогенного, ульцерогенного та місцевоподразнювального ефектів [6], тому вважається досить безпечним препаратом.
Таким чином, сучасні гепатопротектори мають насамперед забезпечувати захист від МОС у гепатоцитах при НАЖХП, хронічних вірусних гепатитах В і С, холестазі тощо.
Результати експериментальних та клінічних досліджень (швидка ліквідація суб’єктивних, об’єктивних та лабораторних проявів запалення, покращення енергопродукції та зменшення рівня лактату у крові) дають підстави стверджувати, що у результаті застосування препарату Антраль® зменшується МОС та відновлюється мітохондріальне окисне фосфорилювання, що запобігає апоптозу гепатоцитів, запаленню та фіброзу печінки.
Література
1. Анохіна Г.А., Романенко М.С., Герасименко О.М., Копиловська Т.О. Патогенетичне обґрунтування застосування Антралю в лікуванні пацієнтів із хронічними захворюваннями підшлункової залози // Здоров’я України. – 2016. – № 3. – С. 54.
2. Бабак О.Я., Фадеенко Г.Д., Колесникова Е.В. Oпыт применения препарата Aнтраль в составе комплексной терапии неалкогольной жировой болезни печени // Здоров’я України. – 2010.
3. Григор’єва Г.С., Киричок Л.М., Конахович Н.Ф. та ін. Комплексоутворення як спосіб підвищення нешкідливості сполук мікроелементів // Современные проблемы токсикологии. – 1998. – № 1. – С. 21-23.
4. Дроговоз С.М., Щекина Е.Г., Ушакова А. Современные подходы к терапии заболеваний гепатобилиарной системы // Провізор. – 2008.
5. Зверев Я.Ф., Брюханов В.М. Стресс эндоплазматического ретикулума глазами нефролога (сообщение). // Нефрология. – 2012. – Т. 16. – № 3 (Вып. 1). – С. 54-71.
6. Мохорт М.А., Серединська Н.М., Киричок Л.М. Модифікація молекули n-(2,3-диметилфеніл)-антранілової кислоти – шлях до створення високоефективних лікарських засобів різних фармакотерапевтичних груп (огляд літератури та власних досліджень) // Журнал НАМН України. – 2012. – № 18(2). – С. 152-160.
7. Осьодло Г.В., Федорова О.О. Комбінований захист печінки – основа сучасної гепатопротекції // Рациональная фармакотерапия. – 2016. – № 39(2). – С. 45-52.
8. Скалыга И.М., Фролов В.М. Патология печени сочетанного вирусного и алкогольного генеза. – Харьков; Луганск: Изд-во ЛГМУ, 1994.
9. Урбанович А.М. Неалкогольный стеатогепатит у пациентов с СД 2 типа: возможность коррекции метаболических нарушений // Здоров’я України. – 2009.
10. Фролов А.Ф., Гайдаш И.С., Фролов В.М., Лоскутова И.В. Вирусные гепатиты А и Е у детей (эпидемиология, патогенез, клиника, лечение). – Киев-Луганск: Изд-во ЛГМУ, 1996.
11. Фролов В.М., Григорьева А.С. Антраль – эффективный препарат для лечения заболевания печени // Український медичний часопис. – 2003. – № 2(34). – С. 65-68.
12. Фролов В.М., Григор’єва Г.С., Лоскутова I.В. Досвід і перспективи застосування нового препарату Антраль у клінічній практиці // Фармакологічний вісник. – 2000. – № 2. – С. 2-5.
13. Фролов В.М., Романюк Б.П., Петруня А.М. Токсические и медикаментозные поражения печени и их лечение. – Луганск: Изд-во ЛГМУ, 1994.
14. Фролов А.Ф., Фролов В.М., Терешин В.А. Сравнительная оценка эффективности антраля и амизона у больных вирусным гепатитом // Украинский химиотерапевтический журнал. – 2001. – № 3. – С. 44-50.
15. Akhtar S. Liver, biliary tract and pancreas. Solved Question Papers of Pathology and Genetics for BSc Nursing. New Delhi, 2012.
16. Borkham-Kamphorst E., Steffen B.T., van de Leur E. et al. Portal myofibroblasts are sensitive to CCN-mediated endoplasmicreticulum stress-related apoptosis with potential to attenuate biliary fibrogenesis. Cell Signal, 2018.
17. Chow W.C., Tai E.S., Lian S.C. et al. Significant non-alcoholic fatty liver disease is found in non-diabetic, pre-obese Chinese in Singapore. Singapore Med J, 2007; 48(8): 752-757.
18. Hare D.N., Collins S.E., Mukherjee S. et al. Membrane Perturbation-Associated Ca2+ Signaling and Incoming Genome Sensing Are Required for the Host Response to Low-Level Enveloped Virus Particle Entry. J Virol, 2015; 90(6): 3018-3027.
19. He C., Qiu Y., Han P. et al. ER stress regulating protein phosphatase 2A-B56, targeted by hepatitis B virus X protein, induces cell cycle arrest and apoptosis of hepatocytes. Cell Death Dis, 2018; 9(7): 762.
20. He Q., Fu Y., Ding X. et al. High-mobility group box 1 induces endoplasmic reticulum stressand activates hepatic stellate cells. Lab Invest, 2018.
21. Hotamisligil G.S. Endoplasmic Reticulum Stress and the Inflammatory Basis of Metabolic Disease. Cell, 2010; 140 (6): 900-917.
22. Gu L.L., Shen Z.L., Li Y.L. et al. Oxymatrine Causes Hepatotoxicity by Promoting the Phosphorylation of JNK and Induction of Endoplasmic Reticulum Stress Mediated by ROS in LO2 Cells. Mol Cells, 2018; 41(5): 401-412.
23. Jheng J.R., Ho J.Y., Horng J.T. ER stress, autophagy, and RNA viruses. Frontiers in Microbiology, 2014. – Vol. 5. – 1-13.
24. Kanda T., Matsuoka S., Yamazaki M. et al. Apoptosis and non-alcoholic fatty liver diseases. World J Gastroenterol, 2018; 24(25): 2661-2672.
25. Kudchodkar S.B., Levine B. Viruses and autophagy. Rev Med Virol, 2009; 19(6): 359-378.
26. Kuscuoglu D., Janciauskiene S., Hamesch K. et al. Liver – master and servant of serum proteome. J Hepatol, 2018; 69(2): 512-524.
27. Luangmonkong T., Suriguga S., Mutsaers H. et al. Targeting Oxidative Stress for the Treatment of Liver Fibrosis. Rev Physiol Biochem Pharmacol, 2018.
28. Ruggiano A., Foresti O., Carvalho P. ER-associated degradation: Protein quality control and beyond. J. Cell Biol, 2014. – Vol. 204(6). – 869-879.
29. Rutkowski D.T., Hegde R.S. Regulation of basal cellular physiology by the homeostatic unfolded protein response. The Journal of Cell Biology, 2010; 189 (5): 783-794.
30. Sano R., Hou Ying-Chen Claire, Hedvat M. et al. Endoplasmic reticulum protein BI‑1 regulates Ca2+-mediated bioenergetics to promote autophagy. Genes & development, 2012; 26:1041-1054.
31. Schuster S., Cabrera D., Arrese M., Feldstein A.E. Triggering and resolution of inflammation in NASH. Nat Rev Gastroenterol Hepatol, 2018; 15(6): 349-364.
32. Scrima R., Piccoli C., Moradpour D., Capitanio N. Targeting Endoplasmic Reticulum and/or Mitochondrial Ca2+Fluxes as Therapeutic Strategy for HCV Infection. Front Chem, 2018; 6: 73.
33. Takahashi S., Sato N., Kikuchi J. et al. Immature Core protein of hepatitis C virus induces an unfolded protein response through inhibition of ERAD-L in a yeast model system. Genes Cells, 2017; 22(2): 160-173.
34. Wang D., Hou C., Cao Y. et al. BP1 activation enhances MANF expression via binding to endoplasmic reticulum stress response elements within MANF promoter region in hepatitis B. Int J Biochem Cell Biol, 2018; 99: 140-146.
35. Zhang L., Wang A. Virus-induced ER stress and the unfolded protein response. Front Plant Sci, 2012; 3: 293.
Тематичний номер «Гастроентерологія. Гепатологія. Колопроктологія» № 3 (49), жовтень 2018 р.


