10 грудня, 2018
Рекомбинантный человеческий тромбопоэтин повышает эффективность применения комбинации циклофосфамида в средних дозах и гранулоцитарного колониестимулирующего фактора с целью мобилизации стволовых клеток периферической крови у пациентов с множественной миеломой
Когортное исследование
Множественная миелома (MM) – распространенная онкогематологическая патология, рутинным методом лечения которой является аутологическая трансплантация кроветворных стволовых клеток (АТКСК). Применение в клинической практике инновационных лекарственных средств, включая бортезомиб и леналидомид, значимо повысило общую выживаемость пациентов с ММ [1], вследствие чего лечение ММ фактически вступило в «эру новых лекарств». Однако и на данном этапе АТКСК остается важным компонентом общей стратегии комплексного лечения ММ. В этом контексте представляет интерес проведение дополнительных клинических исследований, которые позволили бы четко ответить на вопросы о том, каким образом лучше всего осуществлять начальную индукционную химиотерапию, а также подготовку к АТКСК и поддерживающую терапию после нее [2, 3].
Одним из ключевых предварительных условий выполнения АТКСК является мобилизация и забор достаточного количества аутологических кроветворных стволовых клеток периферической крови (СКПК). Химиотерапия циклофосфамидом в комбинации с гранулоцитарным колониестимулирующим фактором (Г-КСФ) представляет собой наиболее часто используемую стратегию мобилизации стволовых клеток периферической крови у пациентов с ММ. Однако у некоторых пациентов, получавших этот режим, сообщалось о субоптимальном ответе на его применение [4]. Потенциальной способностью к дальнейшему улучшению результатов мобилизации СКПК обладают новые препараты (в частности, плериксафор), их назначение в комбинации с циклофосфамидом и Г-КСФ положительно сказывается на результатах забора клеток и чистоте полученных образцов [5, 6]. Однако даже в тех странах, в которых доступны эти инновационные лекарственные средства, высокая стоимость существенно ограничивает их широкое применение. Чтобы определить наиболее эффективную стратегию мобилизации и забора аутологических стволовых клеток периферической крови, мы назначали 142 пациентам с ММ комбинацию циклофосфамида в средних дозах и Г-КСФ с дополнительным введением рекомбинантного человеческого тромбопоэтина либо без такового.
Методы
Пациенты
С января 2010 г. по июнь 2015 г. на базе нашего госпиталя в исследование было включено 142 пациента с ММ, которым назначались циклофосфамид в средней дозе в комбинации с Г-КСФ (с введением рекомбинантного человеческого тромбопоэтина или без него) с целью мобилизации и забора аутологических СКПК. Все включенные в исследование пациенты соответствовали диагностическим критериям, установленным Международной рабочей группой по изучению множественной миеломы (IMWG) [7]. Для определения стадии ММ у этих пациентов использовали критерии Дьюри – Салмона (DS) и критерии Международной системы стадирования (ISS) [8]. Из 142 участников исследования 81 пациент был мужского пола, а 61 – женского; медиана возраста составила 51 год (диапазон 29-68 лет). Семьдесят два пациента получали циклофосфамид и Г-КСФ наряду с рекомбинантным человеческим тромбопоэтином (группа тромбопоэтина – ТПО), а 70 – циклофосфамид и Г-КСФ без рекомбинантного человеческого тромбопоэтина (группа не-TПO). Двум пациентам в группе не-TПO в последующем назначили рекомбинантный человеческий тромбопоэтин с целью вторичной мобилизации; при этом для забора большего количества CD34+ клеток некоторым больным было проведено 2 последовательные повторные мобилизации (вторая мобилизация именовалась вторичной). Все пациенты предоставили информированное согласие на участие в данном исследовании. Протоколы мобилизации и забора СКПК были одобрены локальным этическим комитетом пекинского госпиталя Чаоян.
Стратегии мобилизации
С целью мобилизации СКПК у пациентов с ММ использовали циклофосфамид в комбинации с Г-КСФ (с введением рекомбинантного человеческого тромбопоэтина либо без него). С целью химиотерапии циклофосфамид в дозе 2,5 г/м2 площади поверхности тела вводили в течение 2 дней. Кроме того, пациентам назначали Г-КСФ в дозе 10 мг/кг массы тела в сутки, когда после химиотерапии количество лейкоцитов снижалось <1×109/л; при этом данный препарат никогда не применяли позднее чем через 6 дней после химиотерапии.
Г-КСФ вводили подкожно 1 раз в сутки до завершения забора СКПК. Пациентам, которые получали рекомбинантный человеческий тромбопоэтин, этот препарат вводили подкожно 1 раз в сутки в дозе 15 000 ЕД через 6 дней после химиотерапии и до завершения забора стволовых клеток.
Забор стволовых клеток периферической крови
После применения режима мобилизации, когда количество лейкоцитов быстро восстанавливалось до >4×109/л, а количество CD34+ – до ≥20 клеток/мл, всем пациентам выполняли катетеризацию бедренной вены и осуществляли забор стволовых клеток с использованием системы COM.TEC (Fresenius Kabi AG, Германия). Мононуклеарные клетки периферической крови выделяли с помощью программы изолирования лимфоцитов. Во взятых образцах мононуклеарных клеток периферической крови рутинно исчисляли количество CD34+ клеток. Общая цель забора заключалась в получении CD34+ в количестве ≥5×106 клеток/кг. Забор стволовых клеток периферической крови осуществляли на протяжении 1-3 последовательных дней. Результат забора СКПК расценивался как успешный, если количество CD34+ составляло ≥5×106 и ≥2×106 клеток/кг соответственно. Получение CD34+ в количестве <2×106 клеток/кг рассматривалось как неудачный результат (неэффективность) забора стволовых клеток периферической крови.
Статистический анализ
Для выполнения статистического анализа использовали программное обеспечение IBM SPSS Statistics (версия 20.0, IBM Corp, Армонк, Нью-Йорк). P <0,05 свидетельствовало о статистически значимом различии между теми или иными критериями.
Результаты
Исходные характеристики пациентов
Исходные характеристики пациентов включали возраст, пол, тип ММ, стадию заболевания по Дьюри – Салмону и согласно ISS, лечение до мобилизации и статус заболевания на момент мобилизации (табл. 1).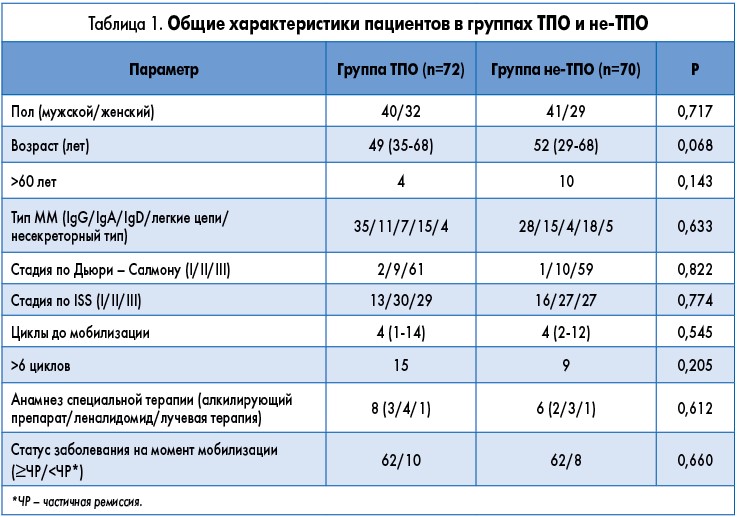
Пациенты в группах TПO и не-TПO имели аналогичные исходные характеристики. Общие характеристики 2 пациентов в группе не-ТПО, которые получали рекомбинантный человеческий тромбопоэтинсодержащий режим при вторичной мобилизации, были следующими:
- пациент 1 (мужчина, возраст 32 года, тип IgGk, стадия IIIA и стадия I по ISS), получил 4 цикла химиотерапии с использованием режима TAD (талидомид, эпирубицин и дексаметазон) до мобилизации и перед ее проведением вступил в фазу ЧР;
- пациент 2 (женщина, возраст 58 лет, стадия заболевания IIIA и тип III по ISS) получил 4 цикла химиотерапии с использованием режима PTD (бортезомиб, талидомид и дексаметазон) перед проведением мобилизации и вступил в фазу стойкой ЧР.
Результаты мобилизации и забора СКПК в группах TПO и не-TПO
Неудачный результат забора СКПК был констатирован у 17 пациентов в группе не-ТПО, из них 13 больным вторичная мобилизация не проводилась. В дальнейшем в группе не-ТПО в целом 18 пациентам была проведена вторичная мобилизация, 16 мобилизаций представляли собой процедуры спасения. Из 16 пациентов успешный забор клеток был осуществлен у 12, включая 2 больных, у которых результат процедуры был признан превосходным (2/12). Однако у 4 оставшихся пациентов попытка забора СКПК по-прежнему не увенчалась успехом (4/16).
У 6 пациентов в группе TПO забор СКПК оказался неудачным, у 5 из них вторичную мобилизацию не проводили. В дальнейшем в группе ТПО в целом у 5 пациентов была проведена вторичная мобилизация СКПК, у 4 из них мобилизация представляла собой процедуру спасения. Из этих 4 процедур мобилизации успешный результат забора СКПК был достигнут у 3 пациентов, в том числе у 1 пациента он был охарактеризован как превосходный. Однако у 1 пациента из 5 вновь была констатирована неэффективность забора СКПК.
Количество полученных при заборе CD34+, а также частота достижения успешного и превосходного результата забора клеток у пациентов из групп ТПО и не-ТПО представлены в таблице 2.
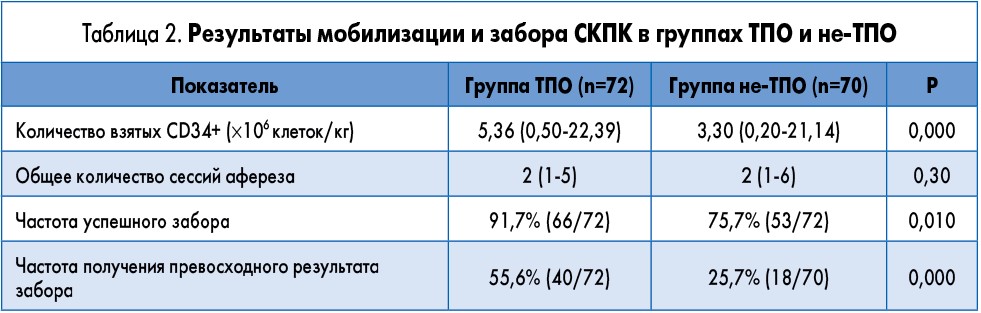 При сравнении с группой не-ТПО отношение шансов достижения успешного и превосходного результата забора СКПК в группе ТПО составило 3,528 (95% доверительный интервал 1,300-9,576) и 3,611 (95% доверительный интервал 1,776-7,341) соответственно.
При сравнении с группой не-ТПО отношение шансов достижения успешного и превосходного результата забора СКПК в группе ТПО составило 3,528 (95% доверительный интервал 1,300-9,576) и 3,611 (95% доверительный интервал 1,776-7,341) соответственно.
Данные по АТКСК в группах ТПО и не-ТПО
Из 142 включенных в исследование пациентов АТКСК была проведена у 119 больных. Режим кондиционирования, применявшийся у пациентов перед трансплантацией СКПК, заключался в назначении мелфалана (200 мг/м2, за 2 дня перед АТКСК). Некоторые пациенты также получали бортезомиб (1,3 мг/м2, за 6 и 2 дня до АТКСК и через 1 и 4 дня после АТКСК). Медиана количества CD34+ у 119 пациентов составила 2,27×106 клеток/кг (диапазон 0,25-10,85×106 клеток/кг). У всех перенесших АТКСК пациентов приживление гранулоцитов и тромбоцитов было выявлено через 11 (диапазон 9-19 дней) и 12 дней (диапазон 9-37 дней) после трансплантации соответственно. У 3 пациентов имела место задержка приживления тромбоцитов (>21 дня). Ни у одного пациента не было зафиксировано смертельного исхода, связанного с трансплантацией СКПК (табл. 3).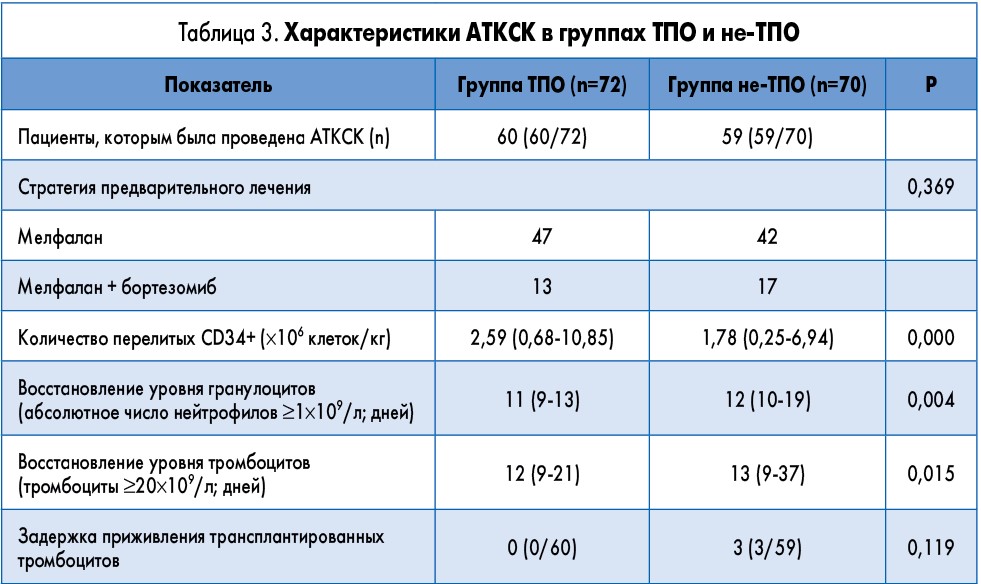
! Среди пациентов, которым была выполнена аутологическая трансплантация кроветворных стволовых клеток, медиана количества перелитых CD34+ была достоверно выше у больных из группы тромбопоэтина, чем у пациентов из группы без тромбопоэтина.
Обсуждение
Мобилизация и забор достаточного количества CD34+ является предварительным условием проведения АТКСК. Многие исследователи считают, что безопасное пороговое значение для инфузии CD34+ с целью проведения АТКСК составляет ≥2×106 клеток/кг [9]. Согласно данным недавних исследований, увеличение количества трансплантированных CD34+ может не только сократить время приживления гранулоцитов и тромбоцитов после АТКСК, но и также стимулировать улучшение результатов долгосрочного приживления тромбоцитов и помочь повысить общую выживаемость пациентов [10, 11]. Согласно рекомендациям Американского общества переливания крови и трансплантации костного мозга, при заборе аутологических СКПК целевое количество CD34+ должно составлять ≥5×106 клеток/кг [12]. Более того, поскольку у пациентов с ММ имеется высокая вероятность необходимости проведения повторной АТКСК, IMWG рекомендует, что при заборе аутологических СКПК у таких пациентов целевое количество CD34+ должно составлять 8-10×106 клеток/кг [13].
В свете этих данных и рекомендаций в нашем исследовании с целью оценки результатов забора аутологических СКПК у пациентов с ММ были использованы критерии Итальянской группы по трансплантации костного мозга (GITMO) [14] и критерии клиники Мейо [15]. Получение ≥2×106 CD34+ клеток/кг рассматривалось нами как успешный результат забора СКПК, а ≥5×106 CD34+ клеток/кг – как превосходный; получение <2×106 CD34+ клеток/кг расценивалось как неудачный забор. Предыдущие исследования показывают, что неудачный результат забора СКПК может иметь место примерно у 25% пациентов, которые в остальном пригодны для проведения АТКСК [4]. Данные, ранее собранные в нашем центре, также свидетельствуют о том, что у пациентов с ММ, которым назначали комбинированную химиотерапию и Г-КСФ с целью мобилизации СКПК, частота достижения успешного результата и получения оптимального количества клеток составляла 74,5 и 27,5% соответственно [16]. Эти данные указывают на то, что сегодня необходимо искать новые стратегии для улучшения результатов мобилизации CD34+.
Ранее полученные нами результаты с использованием относительно небольшой выборки пациентов продемонстрировали, что введение циклофосфамида в дозе ≥4,0 г/м2 не улучшало результаты забора CD34+ [16]. Напротив, эта химиотерапевтическая стратегия может повышать риск развития инфекции после химиотерапии, при которой, возможно, потребуется гемотрансфузия [17]. В свете полученных нами предыдущих результатов и данных, о которых сообщают другие исследователи [16-18], в качестве химиотерапевтического режима в настоящем исследовании нами была избрана стратегия назначения циклофосфамида, подразумевающая введение общей дозы 2,5 г/м2 в течение 2 суток.
В дальнейшем комбинация Г-КСФ с другими препаратами цитокинов продемонстрировала способность улучшать результат забора CD34+ [4]. Однако в нашем предыдущем исследовании мы получили далекие от идеала результаты при сравнении применения Г-КСФ в комбинации с гранулоцитарно-макрофагальным колониестимулирующим фактором или интерлейкином‑11 в качестве режима мобилизации СКПК [16]. При этом ТПО улучшал пролиферацию стволовых клеток/клеток-предшественников in vitro, а также поддерживал и даже повышал активность кроветворных стволовых клеток у мышей [19]. Исследования у приматов показали, что мобилизация СКПК с использованием Г-КСФ в комбинации с пегилированным фактором роста и развития мегакариоцитов увеличивает количество CD34+ в периферической крови. Это свидетельствует о том, что комбинированные режимы с включением агонистов рецепторов ТПО могут улучшать результаты мобилизации и забора СКПК [4]. Кроме того, результаты исследований с участием пациенток с раком грудной железы или другими солидными опухолями также показали, что применение комбинации химиотерапии, Г-КСФ и рекомбинантного человеческого тромбопоэтина обеспечивало получение большего количества СКПК [20-22]. На основании этого именно комбинация циклофосфамида, Г-КСФ и рекомбинантного человеческого тромбопоэтина была выбрана в качестве химиотерапевтического режима для использования с целью мобилизации СКПК в настоящем исследовании.
Предыдущие исследования продемонстрировали, что на результат забора СКПК влияют несколько факторов, в том числе – возраст, количество циклов химиотерапии до забора клеток и анамнез лечения (в особенности химиотерапия алкилирующими средствами и лучевая терапия). В нашем исследовании эти факторы были аналогичны в группах ТПО и не-ТПО и следовательно результаты мобилизации и забора клеток в этих 2 группах предсказуемо оказались сопоставимыми.
! Частота достижения успешного и превосходного результата забора стволовых клеток периферической крови в группе тромбопоэтина соответственно составила 91,7 и 55,6%, она была достоверно выше наблюдаемой в группе без тромбопоэтина (табл. 2).
Отношение шансов достижения как успешного, так и превосходного результата забора в группе ТПО при сравнении с группой не-ТПО составило >3. В целом эти результаты показывают, что использование ТПО наряду с циклофосфамидом и мобилизацией Г-КСФ может обеспечивать получение большего количества стволовых клеток.
Частота успешного результата забора СКПК в группе ТПО в данном исследовании была аналогичной таковой в клинике Мейо (86%), однако частота достижения превосходного результата в данном исследовании была ниже (55,6 в сравнении с 70%) [15]. Причины такого различия могли включать следующие факторы. В исследовании клиники Мейо число пациентов, которым была проведена вторичная мобилизация, составляло 15,7% (157/997). Из них у 63,7% была выполнена вторичная мобилизация ввиду субоптимального, а не неудачного результата первоначальной мобилизации (количество CD34+ ≥2×106 клеток/кг, но <5×106 клеток/кг). Более того, количество циклов химиотерапии у этих пациентов после первой ЧР и в течение 4 месяцев после индукционной терапии было относительно меньшим. Напротив, большинству пациентов в данном исследовании проводилась вторичная мобилизация, и это было обусловлено именно неудачей забора, а не субоптимальным забором клеток после первоначальной мобилизации. Кроме того, относительно значительная часть пациентов (20,8%, 15/72) получила более 6 циклов химиотерапии перед мобилизацией в нашем исследовании, а больше половины (6/10) больных отказались от проведения вторичной мобилизации. Оба этих фактора сказались на частоте достижения общего успеха и превосходного результата.
! Наши данные показали, что после аутологической трансплантации кроветворных стволовых клеток приживление гранулоцитов и тромбоцитов в группе тромбопоэтина было более быстрым, чем в группе без тромбопоэтина.
В группе ТПО не было выявлено какой-либо задержки приживления трансплантированных тромбоцитов, в то время как она была констатирована у 3 пациентов в группе не-ТПО. Однако различие в задержке приживления СКПК между 2 группами не было статистически значимым (P=0,119; табл. 3). Это могло быть ассоциировано с тем фактом, что у пациентов, которые получали циклофосфамид в комбинации с Г-КСФ и рекомбинантным человеческим тромбопоэтином с целью мобилизации, мог быть осуществлен забор большего количества аутологических СКПК. Таким образом, в последующем при АТКСК можно было осуществить инфузию достаточного количества CD34+. Поэтому приживление трансплантированных гранулоцитов и тромбоцитов происходило быстрее [10, 11]. Доза CD34+, инфузионно введенных пациентам в группе не-ТПО с замедленным приживлением трансплантированных клеток, составляла 0,25-0,64×106 клеток/кг. Эта относительно меньшая доза также могла способствовать задержке приживления трансплантата [10, 11]. Минимальное количество CD34+, инфузионно введенных пациентам в группе ТПО, составило 0,68×106 клеток/кг. Можно предположить, что относительно более высокая доза перелитых CD34+ могла предотвращать задержку приживления тромбоцитов у этих пациентов.
Эти результаты свидетельствуют, что у пациентов с ММ, которые считаются пригодными для проведения АТКСК или потенциально нуждающимися в ней, целевое количество CD34+ в собранных образцах СКПК для достижения успешного результата должно быть больше (идеальное количество – 8-10×106, а минимальное количество ≥5×106 клеток/кг). У тех пациентов, у которых был достигнут успешный результат забора клеток после первоначальной мобилизации, но при этом не было получено целевое количество клеток, следует рассмотреть возможность вторичной мобилизации и забора стволовых клеток периферической крови.
Таким образом, полученные нами результаты показывают, что циклофосфамид в комбинации с гранулоцитарным колониестимулирующим фактором и рекомбинантным человеческим тромбопоэтином является эффективной стратегией мобилизации стволовых клеток периферической крови.
В настоящее время в Украине зарегистрирован уникальный препарат на основе рекомбинантного человеческого тромбопоэтина – Эмаплаг. Как известно, тромбопоэтин представляет собой гликопротеин, который стимулирует пролиферацию и дифференциацию мегакариоцитов, способствует образованию, высвобождению и восстановлению уровня тромбоцитов, а также восстановлению общего содержания лейкоцитов. Сегодня Эмаплаг весьма успешно применяется для лечения тромбоцитопении, возникающей в результате проведения химиотерапии, у пациентов с солидными опухолями. Безусловно, результаты проведенного G. Wang и соавт. исследования открывают новые перспективы применения рекомбинантного человеческого тромбопоэтина в комплексной терапии онкологических заболеваний, в том числе – онкогематологической патологии. Они подтверждают, что включение рекомбинантного человеческого тромбопоэтина в схемы мобилизации позволяет получить большее количество стволовых клеток периферической крови, а значит – повысить вероятность успешного результата аутологической трансплантации кроветворных стволовых клеток.
Статья печатается в сокращении.
Список литературы находится в редакции.
Wang et al. Recombinant human thrombopoietin improves the efficacy of intermediate-dose cyclophosphamide plus granulocyte colony-stimulating factor in mobilizing peripheral blood stem cells in patients with multiple myeloma. A cohort study. Medicine. 2017; 96: 50.
Перевела с англ. Елена Терещенко
Более детальная информация о применении рекомбинантного человеческого тромбопоэтина на сайте Emaplug.com.ua.
Тематичний номер «Онкологія. Гематологія. Хіміотерапія» № 4 (55), жовтень 2018 р



