18 грудня, 2018
Неспецифічний аортоартеріїт (хвороба Такаясу) та серцево-судинна система
Неспецифічний аортоартеріїт (НАА), або хвороба Такаясу, згідно з Міжнародною номенклатурою васкулітів (International Chapel Hill Consensus Conference Nomenclature of Vasculitides, 2012), – рідкісна форма системного васкуліту (СВ), що вражає судини великого діаметру [65].
НАА пов’язаний зі значною захворюваністю та смертністю серед молодих пацієнтів [76, 115, 136]. Ураження артерій серця, нирок, центральної нервової системи є причиною тяжкої захворюваності та смертності при НАА [71, 88], що підтверджують дані досліджень, за якими ураження серця є основною причиною захворюваності та смертності при НАА [32, 112]. Захворюваність пацієнтів із НАА асоційована з ішемією та артеріальною гіпертензією (АГ) і включає застійну серцеву недостатність (СН), транзиторну ішемічну атаку (ТІА), інсульт, порушення зору [122]. Розрив аневризми аорти, застійна СН унаслідок аортальної недостатності та АГ – дві основні причини смерті пацієнтів із НАА [88, 148]. Н. Wang і співавт. розглядають наявність тяжких функціональних порушень та ураження серця при НАА як предикторів смерті чи великих подій у майбутньому [151]. Оскільки серцево-судинні захворювання залишаються однією з основних причин смерті та захворюваності, рання діагностика НАА, його активності є необхідними для раннього виявлення ураження серцево-судинної системи при НАА [80].
У випадках ревматологічного захворювання з початковими симптомами, які пов’язані з ураженням серця, лікар загальної практики може бути першим фахівцем, який бачить пацієнта; тому знання симптомів СВ має важливе значення для їх ранньої діагностики [96]. Незначна поширеність, гетерогенність і неспецифічність початкових симптомів часто призводить до затримки встановлення діагнозу НАА та лікування. Окрім того, деякою мірою існує недостатня обізнаність про НАА per se. Важливо, щоб лікарі первинної медичної допомоги, ревматологи, кардіологи, нефрологи та серцево-судинні хірурги були більш обізнані щодо цього захворювання [94].
Саме з такою метою підготовлено цей огляд літератури, адже рання діагностика та своєчасне призначення лікування сприятимуть поліпшенню прогнозу у хворих на НАА.
Визначення
НАА – артеріїт, часто гранулематозний, який переважно вражає аорту та/або її основні гілки. Зазвичай розвивається у віці до 50 років, що є основною відмінністю від гігантоклітинного артеріїту (ГКА), який розвивається після 50 років [65].
НАА – панартеріїт із запальним потовщенням стінок із поступовим прогресуванням до фіброзної облітераційної стадії, що призводить до розвитку стенозів, оклюзій та аневризм артерій із розвитком ішемії відповідних органів і систем і пов’язаний зі значною захворюваністю та смертністю серед молодих пацієнтів [76, 115, 136]. У результаті оклюзії чи стенозу артерій у пацієнтів виявляють відсутність пульсу, тому НАА ще має назву «хвороба відсутності пульсу» або «оклюзивна тромбоартеріопатія», синдром Марторелла, синдром дуги аорти. НАА відомий також як артеріїт Такаясу, або хвороба Такаясу [50, 72, 111, 116].
Історія
У 1761 році італійський патологоанатом Giovanni Battista Morgagni описав у 41-річної жінки відсутність пульсу на променевій артерії та дані аутопсії цієї хворої [79]. Перший опис НАА зробив 1830 року японський терапевт Rokushu Yamamoto, який спостерігав у 45-річного чоловіка персистуючу лихоманку з розвитком у подальшому відсутності пульсу на правій верхній кінцівці й ослаблення його на лівій верхній кінцівці та відсутністю пульсу на сонних артеріях, розвитком задишки та раптовою смертю на 11-му році захворювання [104]. У 1856 році W.S. Savory [129] і A. Kussmaul у 1872 році [77] детально описали ураження аорти та її гілок невідомої етіології. У 1905 році японський офтальмолог Mikito Takayasu доповів про спостереження змін артерій сітківки ока у 21-річної жінки зі скаргами на зниження гостроти зору зі специфічним кільцеподібним артеріовенозним анастомозом навколо диска зорового нерва, а опублікував ці дані у 1908 році [142]. Під час обговорення доповіді M. Takayasu K. Onishi та T. Kagoshima представили свої спостереження у двох пацієнтів із подібними проявами на очному дні та відсутністю пульсу на променевих артеріях [109]. У 1951 році K. Shimizu та K. Sano опублікували підсумки клінічних проявів НАА під назвою «Хвороба відсутності пульсу» (pulseless disease) [125].
Епідеміологія
НАА належить до рідкісних захворювань. Його діагностують серед населення всіх країн світу, однак найбільш поширена хвороба Такаясу в Японії, Південно-Східній Азії, Індії, Китаї, в країнах Латинської Америки, Центральній та Південній Америці [29, 66]. Захворюваність на НАА становить 2,6 випадку на 1 млн населення в Сполучених Штатах і 1,26 на 1 млн населення в Північній Європі на рік, тоді як у Японії, за даними аутопсій, діагностують 1 випадок НАА на кожні 3000 аутопсій [89, 149].
НАА розвивається у молодих жінок частіше, ніж у чоловіків [72, 132, 137, 138]. Так, хворобу Такаясу діагностують у жінок у 8-10 разів частіше, ніж у чоловіків [76, 89, 122, 136]. Проте співвідношення захворюваності між жінками та чоловіками відрізняється в різних країнах: у Японії воно становить 9:1 [78], у Мексиці – 6,9:1, в Ізраїлі – 1,2:1 відповідно [18]. Як було зазначено вище, НАА частіше виникає в осіб, молодших 40 років [94]. За даними ретроспективного багатоцентрового дослідження за участю 318 пацієнтів з НАА, середній вік діагностики НАА становив 36 років (25-47), з яких жінок було 86,8% [31], що підтверджують результати роботи, за якими понад 90% пацієнтів захворіли на НАА у віці до 40 років [76]. Однак, за даними іншого дослідження, середній вік пацієнтів становив 25 років [137], і лише 15% пацієнтів були у віці до 15 років [148]. Ці епідеміологічні особливості є наріжним каменем у проведенні диференційної діагностики з ГКА [76]. Хоча НАА розвивається переважно у молодих осіб у другій чи третій декаді життя, але не є рідкістю у дітей і людей після 40 років [60]. Слід зауважити, що наймолодшому пацієнту, в якого діагностували НАА, було 6 міс [122].
Етіологія та патогенез
Етіологія НАА невідома [89, 111, 122], але інфекційні агенти, генетичні чинники та чинники зовнішнього середовища відіграють важливу роль у розвитку цього захворювання [10, 104, 146], зокрема мікобактерії туберкульозу та віруси [61, 100]. Генетичну схильність до НАА підтверджує часта асоціація захворювання з HLA-B*52, HLA-DRB*1301, HLA-B/MICA, HLA-DQB1/HLADRB1, HLA-DRB1*1502 та ін. [124, 126]. Географічна відмінність поширеності НАА (захворювання частіше зустрічається у населення країн Азії), географічні особливості локалізації ураження аорти та більша захворюваність жінок також вказують на те, що важливу роль у розвитку НАА відіграють етнічні та генетичні чинники [71, 107]. До того ж описані сімейні випадки захворювання, що може свідчити про генетичні причини хвороби Такаясу [75]. Окрім того, не з’ясована роль ендокринних чинників у розвитку НАА (враховуючи, що частіше на НАА хворіють жінки) [89].
Зрозумілою є дія аутоімунних механізмів у патогенезі НАА [10, 102]. Їхня роль у розвитку цього захворювання також підтверджена даними щодо асоціації НАА з хворобою Крона, виразковим колітом, саркоїдозом, тиреоїдитом Хашимото, ревматоїдним артритом, анкілозивним спондилітом, системним червоним вовчаком, поліміозитом і системною склеродермією [26, 71, 73], виявленням антитіл до ендотеліальних клітин, антикардіоліпінових та антиаортальних аутоантитіл у пацієнтів з НАА [9, 102]. Окрім того, ефективність глюкокортикоїдів (ГК) і цитостатиків підтверджує роль аутоімунних механізмів у розвитку НАА [88, 112].
Цитокіни (такі як фактор некрозу пухлини-α (ФНО-α), інтерлейкін‑6 (ІЛ‑6), інтерферон-γ, лімфокіни, хемокіни й інші білки (включно з перфоринами та матриксними металопротеїназами) беруть участь у індукції та посиленні запальної реакції та пошкодженні тканин [10, 145]. Це призводить до запалення, некрозу, неоваскуляризації, міграції гладеньком’язових клітин, проліферації інтими та формування гігантських багатоядерних клітин [9]. Потенційна роль ФНО-α в патогенезі НАА (гранулематозне запалення є характерною рисою НАА, і ФНО-α відіграє важливу роль у формуванні гранульоми) підтверджується ефективністю анти-ФНО-α терапії в пацієнтів із рефрактерним НАА [59]. Результати дослідження показали підвищення рівня сироваткового ІЛ‑6, ІЛ‑8, ІЛ‑18 [4], ФНО-α [114, 145] у хворих на НАА.
Патоморфологія
На ранній стадії захворювання відзначають гранулематозний артеріїт [116] із переважною локалізацією запалення у внутрішній частині середньої оболонки, адвентиції та у ділянці vasa vasorum [146]. Мононуклеарні клітини ініціюють і сприяють поширенню ураження судин. Цей процес починається з міграції лейкоцитів до адвентиції судин через vasa vasorum (діє як портал входу), через який відбувається клітинна інфільтрація. Наступна продукція хемокінів і цитокінів впливає як на інтенсивність відповіді, так і на типи клітин, що рекрутуються в середню оболонку та інтиму (наприклад, макрофаги, активовані дендритні клітини, натуральні клітини-кілери (NK-клітини), γδ Т-лімфоцити, B-лімфоцити, макрофаги та гігантські багатоядерні клітини) [10, 66, 89]. Імунна відповідь призводить до запалення, міграції гладеньком’язових клітин, некрозу, формування гігантських багатоядерних клітин, вираженої проліферації міофібробластів в інтимі, відкладення мукополісахаридів, що зумовлює гіперплазію (потовщення) інтими, а згодом і фіброзу та фіброзу середньої оболонки й адвентиції (пізня стадія) [10, 66, 111, 146]. Далі прогресує зменшення просвіту артерій із розвитком стенозу або оклюзії артерій, які найчастіше зазнають уражень при НАА [89, 111, 146]. Іноді спостерігаються їх тромбози [111, 149]. У результаті деструкції еластичних волокон і гладеньком’язових клітин відбувається дилатація судин або формування аневризми [89, 146]. У хронічній фазі запалення спостерігають неоднорідний запальний інфільтрат, що містить мононуклеарні клітини, з розвитком фіброзу та неоваскуляризації, тоді як у фазі ремісії виявляють лише фіброз у всіх шарах стінки судин [146].
Отже, внаслідок гранулематозного артеріїту розвиваються стенотичні чи оклюзійні ураження, котрі призводять до ішемії органів та/або дилатації й формування аневризми [29, 89, 116, 146] та тромбозу [146, 149]. Причому для цього захворювання притаманне сегментарне ураження судин [146].
Хоча найчастіше патерн захворювання змінюється географічно [94], стеноз артерій відзначають у понад 90% пацієнтів, тоді як дилатація або аневризми – приблизно в 17-25% випадків [71, 88, 89, 100, 112, 148]. Гирло аорти є найпоширенішим місцем розвитку аневризм, що може призвести до аортальної недостатності [88]. Аневризми (сакулярні або фузиформні) зазвичай співіснують зі стенотичними ураженнями. Дисекції артерій є надзвичайно рідкісними та локалізуються зазвичай у черевному відділі аорти [146].
Хоча будь-яка артерія еластичного або м’язового типу може бути залучена в патологічний процес, основні гілки аорти уражаються у всіх пацієнтів із НАА. Найбільш поширеним місцем стенозу є підключичні, брахіоцефальні, безіменні артерії, загальні сонні та хребцеві артерії [89, 111, 123], але також можуть уражатися легеневі, коронарні [29], ниркові артерії, особливо у хворих із країн Азії, що пояснює підвищений рівень захворюваності на АГ у цьому регіоні [123], та ін. При НАА частіше ураження виявляють у гирлі артерій [146] та їх проксимальних відділах [89]. Слід зауважити, що частіше розвивається стеноз черевного, ніж грудного відділу аорти. Ураження черевного відділу аорти та її гілок можуть викликати ішемію вісцеральних органів, АГ або переміжну кульгавість [89].
Є декілька класифікацій анатомічних типів НАА. Згідно з класифікацією групи Numano (1996) НАА поділяють на шість типів (рис. 1): тип I – дуга аорти та її гілки; тип IIа – висхідна аорта, дуга аорти та її гілки; тип IIb – висхідна аорта, дуга аорти та її гілки та низхідна грудна аорта; тип III – грудна низхідна та черевний відділ аорти і/або ниркoві артерії; тип IV – черевний відділ аорти і/або ниркoві артерії; тип V – поєднання типів IIb і IV. Ураження коронарних артерій (КА) позначається як С (+), а легеневих артерій – Р (+) [58].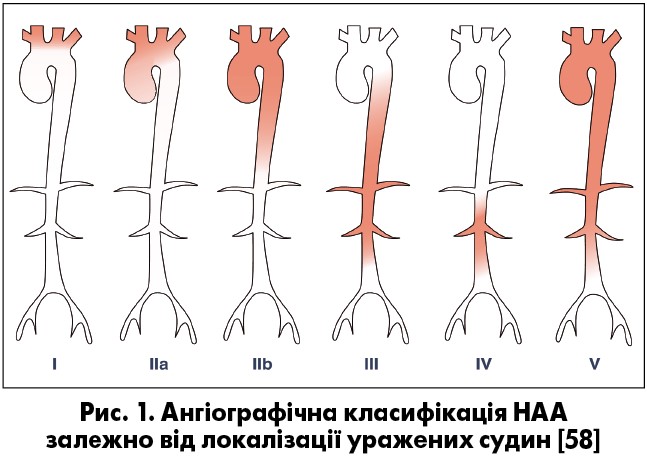
Ці типи ураження судин спостерігаються у всіх регіонах, хоча відзначають географічні особливості їх ураження при НАА. Так, у Японії частіше спостерігається більш високий рівень ураження дуги аорти (reverse coarctation), а в Південно-Східній Азії, Індії та Африці частіше спостерігають «синдром середньої частини аорти» (middle aortic syndrome), ураження грудного та черевного відділів аорти та ниркових артерій, у Північній Америці – гілок дуги аорти та черевного відділу аорти [61, 134, 146]. V анатомічний тип, як відомо, асоційований із АГ, серцево-судинною захворюваністю та пізньою смертністю хворих на НАА [136], який, за даними дослідження, найчастіше виявляли у Кореї (у 54,5% випадків) [80] та часто виявляють у Японії, Китаї, Північній Америці та Мексиці [58, 71, 137].
Клінічна картина
Клінічні прояви НАА залежать від басейну артерій, що уражуються [50], розвитку ішемії органів [72], наявності колатералей [89, 122] та стадії захворювання [16, 112]. Розрізняють три стадії НАА. Перша стадія – це рання системна стадія, в якій можуть відзначати конституціональні симптоми (наприклад, втома, нездужання, запаморочення, лихоманка). Ця стадія є стадією преваскуліту (prevasculitic stage). Друга стадія – стадія васкуліту, коли відзначають стенози, аневризми та каротидинію. Симптоми, що характеризують цю стадію, включають втому, лихоманку, нездужання, артралгії, задишку, серцебиття, головний біль, висипку, кровохаркання. Симптоми судинної недостатності включають оніміння рук, переміжну кульгавість, розмитість зору, диплопію, амавроз фугакс, інсульт, ТІА. Третя стадія – це стадія фіброзу, яку деякі автори характеризують як латентне «перегорання» патологічного процесу («burnt out» phase) [72]. Слід зауважити, що на пізніх стадіях НАА спостерігають симптоми, які пов’язані з локалізацією та поширеністю стенозу/оклюзії, тромбозу артерій великого діаметру з розвитком ішемії або з ознаками з боку уражених органів [29, 52, 89]. Характерні клінічні ознаки НАА наведені у таблиці 1 [66]. Крім того, деякі пацієнти можуть мати безсимптомний перебіг НАА – лише під час огляду в них спостерігають відсутність пульсу або різний артеріальний тиск (АТ) на кінцівках [89].
Симптоми, що пов’язані з ішемією, представлені в таблиці 2 і включають: ішемічний інсульт, ТІА, порушення зору (наприклад, розмитість зображень, диплопія, амавроз), каротидинію, біль у животі, переміжну кульгавість (вираженість симптомів залежить від розвитку колатералей) [122, 123].
Типовими для НАА є ураження центральної нервової системи (ТІА, інсульт, головний біль, цереброваскулярна недостатність (запаморочення, пресинкопе, синкопе) внаслідок ураження сонних і хребцевих артерій [153] та офтальмологічні розлади, такі як нечіткість зору, диплопія, скотоми, амавроз фугакс, ретинопатія Такаясу [88, 89].
 Залучення в патологічний процес артерій черевної порожнини, за даними ангіографії, зустрічається у 18-66% пацієнтів [71, 88]. Проте ознаки ішемії не характерні (чи розвиваються рідко) внаслідок розвитку колатерального кровотоку. Пацієнтам із наявністю мезентеріальної ішемії (розвитком черевної жаби або інфаркту вісцеральних органів) показана реваскуляризація [89].
Залучення в патологічний процес артерій черевної порожнини, за даними ангіографії, зустрічається у 18-66% пацієнтів [71, 88]. Проте ознаки ішемії не характерні (чи розвиваються рідко) внаслідок розвитку колатерального кровотоку. Пацієнтам із наявністю мезентеріальної ішемії (розвитком черевної жаби або інфаркту вісцеральних органів) показана реваскуляризація [89].
НАА може ускладнюватися небезпечним для життя ураженням легеневих артерій і розвитком легеневої гіпертензії [144]. Слід зауважити, що ураження легеневої артерії – особливість, притаманна тільки НАА та не зустрічається при інших формах аортитів [100]. Оклюзія, стеноз і постстенотична дилатація виявляються більш ніж у 55% пацієнтів із НАА при застосуванні методів дослідження з візуалізацією [92], але більшість з них безсимптомні [89]. Клінічні симптоми, такі як кровохаркання, задишка, кашель або біль у грудній клітці, зустрічаються приблизно у 25% пацієнтів із НАА. Частота розвитку легеневої АГ становить 12-15% [16, 80]. Є повідомлення про рідкісні випадки ураження легень із розвитком інтерстиційного пневмоніту, плеврального випоту, масивного кровохаркання та тромбозу легеневих артерій [89, 92].
Ураження нирок спостерігають у вигляді стенозу ниркових артерій (у 25-89% пацієнтів із НАА), який є найбільш частою причиною АГ [88, 89, 138], а також ураження клубочкового апарату – мезангіо-проліферативний гломерулонефрит, IgA-нефропатія, хвороба мінімальних змін, фібрилярний і мембранозно-проліферативний гломерулонефрити та ін. [83].
Ураження шкіри спостерігається у 28% пацієнтів із НАА. Частими проявами є вузлувата еритема, гангренозна піодермія [122].
Майже у половини пацієнтів із НАА діагностують ураження серця [16, 71, 95] як наслідок ураження судин і/або його первинного ураження [80]. Слід зауважити, що в патологічний процес при НАА потенційно може бути залучена будь-яка структура серця [16, 71, 95]. Важливо наголосити, що у пацієнтів із НАА ураження серцево-судинної системи чи розвиток СН є значущими предикторами смертності [32, 136]. Залучення серця у патологічний процес є однією з основних причин захворюваності та смертності при НАА і може проявлятися патологією клапанів серця (типово – аортальна недостатність), АГ, перикардитом, міокардитом, порушенням ритму серця, ДКМП, коронаритом із розвитком ішемії міокарда (стенокардія та ІМ), СН, раптовою смертю [73, 89, 95, 96, 99, 122, 143, 157].
За результатами спостереження B.P. Mwipatayi і співавт., ураження серця констатували у 45% пацієнтів, АГ (унаслідок стенозу ниркових артерій і коарктації аорти) – у 77%, СН – 33%, ІХС – у 5% (з них у 10 пацієнтів спостерігали типову стенокардію, у 4 – ІМ) [100]. Згідно з даними іншого дослідження за участю 204 пацієнтів із НАА, АГ спостерігали у 69,1% хворих, застійну СН – у 13,2%, атипову коарктацію – у 17,7%, ТІА – у 7,4%, інсульт – у 12,7% [80]. Серед пацієнтів з АГ (69,1%) у 48,9% виявили ураження ниркових артерій, у 23,4% – атипову коарктацію аорти, які корелювали з АГ (р<0,0001 і р=0,0001 відповідно) [80].
Аневризма аорти. Формування аневризми та її ускладнення, такі як аортальна недостатність, СН і розрив аневризми, можуть бути фатальними [26]. Аневризми, як правило, виявляють у пацієнтів із тривалим захворюванням. Більшість пацієнтів з аневризмою аорти мають сприятливий прогноз, однак у деяких пацієнтів розмір аневризми може швидко збільшуватися з розвитком тромбозу або розриву. Розрив аневризми аорти є рідкісним ускладненням НАА [26], що може бути пов’язане з потовщенням стінки артерій унаслідок вираженого фіброзу середньої оболонки й адвентиції [26]. Е. Sueyoshi і співавт. повідомили про формування 17 аневризм аорти у 14 з 31 пацієнта з НАА. Три аневризми швидко збільшувалися у розмірах з наступним розривом (дві з них розташовані в грудному відділі аорти, одна – в черевному відділі аорти) [139]. Описаний випадок формування фузиформної аневризми правої КА (з наявністю тромбу) й аневризми черевного відділу аорти з розривом останньої та летальним кінцем 38-річної пацієнтки з НАА (яка ще страждала на саркоїдоз та тиреоїдит Хашимото). Окрім того, в літературі є повідомлення про формування аневризми аорти (висхідна частина аорти, дуга аорти, низхідна частина грудного та черевного відділів аорти) та її швидкого збільшення у низхідній частині грудного відділу аорти на 79% за 1 міс (з 5,6 до 10 см) [119].
Аортальна недостатність. При НАА у 7-55% випадків спостерігають розвиток аортальної недостатності залежно від методу діагностики [16, 32, 71, 80, 88, 95, 107, 136]. Це ускладнення розвивається внаслідок розширення висхідної частини аорти та формування її аневризми, в результаті чого відбувається дилатація аортального кільця, а також сепарація та потовщення стулок клапана в результаті аортиту [71, 88, 89, 95]. За результатами дослідження, недостатність аортального клапана може призводити до розвитку застійної СН, порушення ритму серця, які є основними причинами смерті пацієнтів із НАА в Японії [103]. Проте пацієнти з НАА в інших азіатських країнах, таких як Китай, Таїланд та Індія, мають високу частоту цереброваскулярних подій унаслідок реноваскулярної АГ, яка є основною причиною смерті [104].
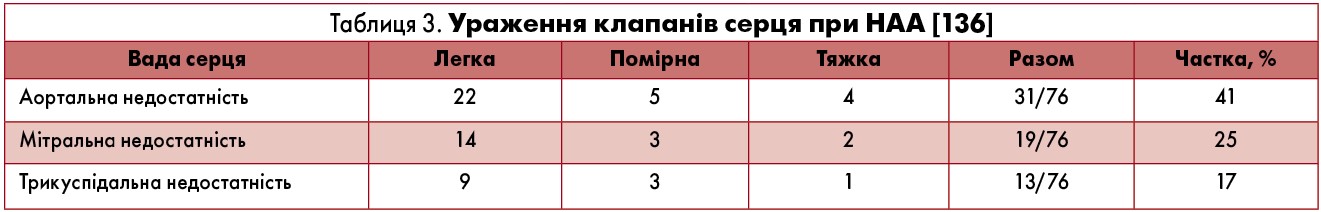 За даними дослідження, у 41% пацієнтів із НАА діагностували аортальну недостатність, з яких у 94% випадків були жінки. Слід зауважити, що 75% пацієнтів із аортальною недостатністю страждали на АГ. Мітральна недостатність виявлена у 25% пацієнтів, 95% з яких – жінки; трискупідальна недостатність – у 17% хворих, серед них 85% – жінки (табл. 3) [136].
За даними дослідження, у 41% пацієнтів із НАА діагностували аортальну недостатність, з яких у 94% випадків були жінки. Слід зауважити, що 75% пацієнтів із аортальною недостатністю страждали на АГ. Мітральна недостатність виявлена у 25% пацієнтів, 95% з яких – жінки; трискупідальна недостатність – у 17% хворих, серед них 85% – жінки (табл. 3) [136].
Клінічна картина аортальної недостатності різна: від безсимптомної до гемодинамічно значущої регургітації з розвитком швидко прогресійної застійної СН [71, 95] чи ішемії міокарда внаслідок недостатнього надходження крові в КА [89], яка потребує хірургічного втручання. За даними дослідження, вираженість регургітації зменшується при оптимальному контролі запалення імуносупресивною терапією [82].
АГ є основною причиною захворюваності, пов’язаної з НАА, і розвивається приблизно у 33-90% пацієнтів [16, 89, 132, 136, 149]. Невиявлена або недостатньо контрольована АГ може призвести до значної захворюваності та смертності [92]. Є деякі географічні відмінності поширеності АГ. Так, її розвиток відзначають щонайменше в 40% пацієнтів у США та Європі [88, 148], у 80% випадків – у Індії, Японії, Мексиці та Кореї [88].
Патогенез АГ при НАА є складним, багатофакторним і не повністю з’ясованим. АГ при НАА розвивається внаслідок звуження грудної аорти (атипова коарктація), стенозу однієї або обох ниркових артерій (ішемія нирок) чи супраренального відділу черевного відділу аорти, порушення функції барорецепторів аорти та ішемії головного мозку [48, 52, 57, 104, 106]. Зменшення еластичності стінок аорти й артерій, що спостерігається при НАА, також може сприяти підвищенню АТ [71, 95, 101]. Слід зауважити, що АГ при НАА переважно реноваскулярного походження [52]. Так, стеноз ниркових артерій виявляють у 25-89% пацієнтів, який є найбільш частою причиною АГ [16, 52, 88, 89, 136], що підтверджують дані дослідження, за якими у 50% пацієнтів із НАА виявлена АГ, у 89% з яких діагностовано ураження ниркових артерій [136].
За даними дослідження M.E. Soto і співавт., 74% пацієнтів із НАА страждали на АГ, 38% з яких були у віці 19-28 років. Найчастіше причиною АГ був стеноз ниркових артерій – у 75% пацієнтів, двосторонній – у 67% хворих, правої ниркової артерії – у 28% пацієнтів і лівої – у 5% хворих, рідше – стеноз низхідної грудної аорти [136], як це повідомлялося в літературі [104].
Одна з проблем спостереження за цими пацієнтами пов’язана з відсутністю даних, чи точно периферичний АТ відображає аортальний тиск, адже більш ніж у 90% пацієнтів виявляють стенотичні ураження артерій, найчастішою їх локалізацією є підключичні та брахіоцефальні артерії, тому АТ на одній чи двох руках може не відображати аортальний тиск. Підвищений аортальний тиск підвищує ризик ускладнень [140, 149].
Атеросклероз. При захворюваннях, які асоційовані з хронічним запаленням, спостерігають ранній розвиток атеросклерозу [93, 147]. Так, описаний прискорений розвиток атеросклерозу при системному червоному вовчаку та ревматоїдному артриті [39, 120]. Окрім того, є дані досліджень, які за допомогою методів візуалізації, зокрема ультразвукового дослідження, виявили ранній розвиток атеросклерозу поряд із характерними змінами артеріальної стінки у пацієнтів із НАА [81]. При НАА описаний атеросклероз і виявлені атеросклеротичні ураження КА, а також інших судин у вигляді атеросклеротичних бляшок, кальцифікації аорти [132]. Ці дані підтверджують результати аутопсій, за якими у молодих пацієнтів спостерігали атеросклеротичні зміни артерій [104].
У пацієнтів із НАА порівняно зі здоровими особами виявляють потовщення комплексу інтима-медіа сонних артерій [131] і збільшення артеріальної жорсткості [101], які є сурогатними маркерами атеросклерозу [43], зокрема і КА [101]. Слід зауважити, що збільшення товщини комплексу інтима-медіа сонних артерій спостерігають навіть у пацієнтів із ангіографічно нормальними сонними артеріями при активному захворюванні. Окрім цього, стенотичні та розширені ділянки великих і середніх артерій при НАА стають місцями надзвичайно високої турбулентності кровотоку та, відповідно, судинного стресу, являють собою осередки для атеросклеротичного ураження артерій [131].
Коронарит є не частим проявом НАА. При НАА відзначають відносно низьку частоту ураження КА, таких як стеноз, обструкцію, аневризми КА та коронарний синдром обкрадування (coronary steal syndrome), але ішемія міокарда може бути фатальною, тому хірургічне лікування рекомендоване пацієнтам зі стенозом устя КА [45]. Ураження КА, за даними досліджень, виявляли у 5-30% пацієнтів із НАА [26, 45, 88, 104, 118, 141], однак, за результатами іншого дослідження, ураження КА виявляли у 44,4% пацієнтів (за даними комп’ютерної томографії-ангіографії – КТ-ангіографії) [137]. Частота ІХС при НАА відносно низька [132], але пов’язана з тяжкими ускладненнями, що загрожують життю [7, 110].
Розрізняють три різні морфологічні типи ураження КА: тип 1 (стеноз або оклюзія устя та проксимальних сегментів КА, найбільш частий), тип 2 (дифузний або фокальний коронарит) і тип 3 (формування аневризм КА – найбільш рідкісний) [110, 129]. Як було сказано вище, ураження КА проявляється у вигляді стенозу, оклюзії, аневризми та синдрому коронарного обкрадання. Ураження КА частіше відзначають у ділянці устя чи проксимальних відділах [88, 104, 129, 132], що підтверджують дані дослідження, згідно з якими 87,5% гемодинамічно значущих стенозів виявлені в устях КА [45]. Рідше зустрічаються дифузне або фокальне звуження дистальних відділів КА, аневризми та міжкоронарні фістули або фістули між коронарними та бронхіальними артеріями [5, 45]. Запалення судин зазвичай призводить до стенозу, але може призвести до формування аневризми КА [45, 141], яке є дуже рідкісним і в літературі є повідомлення лише про окремі випадки. Так, H. Suzuki і співавт. описали гігантську аневризму лівої КА у 71-річної жінки з НАА, яка померла від тяжкої аортальної недостатності та прогресійної недостатності лівого шлуночка (ЛШ). Розміри аневризми – 5×6×5 см, а при аутопсії виявлена ще одна сакулярна аневризма розміром 2 см у проксимальній частині правої КА [141]. У літературі є повідомлення про формування гігантської аневризми правої КА (6 см) та лівої КА (2,2 см) у 44-річної пацієнтки з НАА [68]. M. Endo і співавт. [45] описали ектазії та аневризми КА у 4 пацієнтів із найбільшим діаметром у 25 мм. Аневризми КА є небезпечними для життя ускладненнями НАА, оскільки призводять до стазу крові, тромбозу, можуть збільшуватися або розриватися, що здатне спричиняти ІМ, тампонаду серця та раптову смерть [141].
Необхідно зауважити, що за винятком рідкісних випадків (наприклад, патерн «нитка з перлин» – картина артеріальних стенозів і дилатації), ангіографічні дані не дозволяють розрізнити запальний і незапальний характер уражень КА. Діагноз коронариту часто вимагає високої клінічної настороженості та інтеграції різних даних (наприклад, екстракардіальні прояви, рівень запальних маркерів, ознаки ураження судин за даними методів дослідження з візуалізацією) [95].
При НАА описані стабільна [32, 88, 91, 136] та нестабільна стенокардії [19], гострий коронарний синдром/ІМ [64, 88, 131, 135, 158] і раптова смерть унаслідок ураження КА [150]. У літературі є повідомлення про випадки ІМ, що ускладнився кардіогенним шоком [64], повною АВ-блокадою [159].
Стенокардія при НАА зустрічається у 5-16% пацієнтів із НАА [32, 88, 91]. За даними дослідження 18 пацієнтів з наявністю стенокардії (типової чи атипової) та задишки, яким проводили КТ-ангіографію, у 38,9% пацієнтів із НАА спостерігали типову стенокардію, у 33,3% – атипову стенокардію, ще у 27,8% – задишку [136]. Слід зауважити, що ішемію міокарда виявлено у 25,9% пацієнтів із НАА при проведенні магнітно-резонансної томографії (МРТ) з пізнім підсиленням гадолінієм, а типовий для ІМ патерн – у 22,2% пацієнтів. Необхідно наголосити, що не виявлено асоціації патології міокарда при НАА та серцево-судинними чинниками ризику атеросклерозу [30].
ІМ рідко зустрічається у молодих осіб, але НАА є однією з основних причин його розвитку в молодих жінок [64]. Слід зазначити, що причинами ІМ у пацієнтів до 45 років є: атеросклероз КА, неатеросклеротичне ураження артерій, гіперкоагуляція (антифосфоліпідний синдром, мутація V фактора Лейдена та ін.) та використання речовин (наприклад, вживання кокаїну) [44]. Тому у разі розвитку типового болю в грудній клітці з ознаками гострого коронарного синдрому в жінок молодого віку необхідно мати на увазі і СВ, зокрема НАА, як одну із причин розвитку ІМ [64, 159]. При НАА ІМ зустрічається у 7-20% пацієнтів [88, 132, 136]. У літературі про випадки ІМ при НАА описані обструктивні, аневризматичні або змішані ураження КА [110]. У випадку, про який ідеться в роботі А. Saxena і співавт., за допомогою коронарографії (КГ) не виявлено стенозу чи оклюзії КА. Автори припустили, що причиною ІМ у цієї пацієнтки можуть бути коронароспазм, транзиторний тромбоз чи залучення у запальний процес мікроциркуляторного русла міокарда [129].
Є повідомлення про ізольований коронарит із розвитком ІМ у 23-річної жінки та швидкого формування двох аневризм проксимального та середнього відділів передньої міжшлуночкової артерії (упродовж 2 тиж). Цей випадок становить особливий інтерес, оскільки виявлено ізольоване ураження КА. Автори дійшли висновку, що в пацієнтки, можливо, атиповий перебіг НАА. Підвищення рівня маркерів запалення, характерна еволюція ангіографічних змін, а також відповідь на ГК та циклофосфамід надали авторам суттєві докази того, що коронарит є причиною ІМ у цієї пацієнтки. Адже відомо, що ураження аорти та її гілок може розвинутися навіть за 5-20 років після ранньої «преваскулітної» стадії захворювання [7]. Описаний випадок вираженого стенозу стовбура лівої КА та правої КА у 48-річного чоловіка, який був направлений кардіологом на аорто-коронарне шунтування з недіагностованим НАА [122]. Необхідно зауважити, що, за даними дослідження, у 33% пацієнтів із ІМ проведена коронарна реваскуляризація [136].
Міокардит рідко спостерігають при НАА [89]. Розвиток міокардиту слід підозрювати за наявності у пацієнта із НАА болю в грудній клітці або СН за відсутності ураження перикарда, КА або клапанів. При дослідженні крові можуть спостерігатися підвищений рівень маркерів пошкодження міокарда, за даними ехокардіографії (ЕхоКГ) часто виявляють гіпокінез ЛШ та дилатацію камер серця [52, 95]. До 50% пацієнтів із НАА мають такий ступінь запалення міокарда, який часто субклінічний [95].
Описаний випадок розвитку міокардиту в 15-річного хлопця. За даними ендоміокардіальної біопсії виявлена інфільтрація міокарда CD16+ лімфоцитами, Т-лімфоцитами та некроз кардіоміоцитів. Традиційна терапія СН була недостатньо ефективною. Однак лікування ГК у поєднанні з традиційною терапією СН привело до покращення систолічної функції міокарда та його морфології. Розвиток міокардиту спричинений активованими Т-клітинами та деякими молекулами, що пов’язані з цими клітинами, включаючи перфорини, людський лейкоцитарний антиген (HLA) класів I і II, а також молекулами міжклітинної адгезії 1 типу (ICAM‑1). Ці дані дослідження можуть свідчити про те, що аутоімунні цитотоксичні механізми, подібні до тих, що відзначають у артеріальній стінці, можуть також спричиняти ураження міокарда в пацієнтів із НАА [143], що підтверджує ефективність ГК і циклофосфаміду [6]. Їх застосування сприяло покращенню функції та структури серця [6] у поєднанні з традиційною терапією СН [143]. Необхідно зауважити, що наявність антигена HLA Bw52 асоційовано з дисфункцією ЛШ при НАА [143].
X. An і співавт. опублікували дані про розвиток гострої СН унаслідок міокардиту, тромбозу шлуночків та емболії правої легеневої артерії [6]. У пацієнтки за результатами ЕхоКГ виявлені дилатація камер серця, дифузний гіпокінез обох шлуночків, тромб у ЛШ, невелика кількість перикардіального випоту, помірна легенева гіпертензія, фракція викиду (ФВ) ЛШ дорівнювала 28%, а згодом знизилася до 12%. За рік до появи цих симптомів пацієнтка відзначала переміжну кульгавість, субфебрильну температуру, висипку на нижніх кінцівках. Окрім цього, при обстеженні спостерігали асиметрію пульсу на променевих артеріях та АТ на верхніх кінцівках, відсутність пульсу на артеріях стоп, 3/6 систолічний шум на трикуспідальному клапані. Рівень натрійуретичного пептиду В-типу (BNP) дорівнював 2009 нг/л (референтні значення <300 нг/л). За даними ультразвукового дослідження судин виявлені множинні стенози артерій і потовщення стінки стегнових артерій. За даними КТ-ангіографії виявлено емболію правої легеневої артерії. Таким чином, у пацієнтки наявні 4 критерії НАА (вік <40 років, симптоми ішемії нижніх кінцівок, ослаблення пульсу, різний АТ на верхніх кінцівках і стеноз артерій за даними ультразвукового дослідження). Окрім того, у пацієнтки виявлений туберкульоз легень. Після призначення нітрогліцерину, фуросеміду, гепарину (з наступним призначенням варфарину), β-блокаторів, метилпреднізолону, циклофосфаміду та туберкулостатичної терапії відзначали підвищення ФВ ЛШ до 41%. За 2 міс потому під час ЕхоКГ та КТ-ангіографії судин легень тромби не виявлені [6].
ДКМП спостерігають у 4,0-8,3% пацієнтів із НАА [52, 134]. Описаний випадок у 14-річної дівчинки з Південної Кореї, госпіталізованої в зв’язку з розвитком задишки. Пацієнтка 5 років тому лікувалася з приводу виразкового коліту. За даними лабораторного дослідження рівень С-реактивного білка (СРБ) становив 6,29 мг/дл, а швидкість зсідання еритроцитів (ШЗЕ) – 120 мм/год. За допомогою ЕхоКГ виявлено дилатацію ЛШ із великим пристінковим тромбом і розширення висхідної аорти. Тривимірна комп’ютерна томографія (КТ) показала розширення та нерівномірність (звивистість) висхідної та низхідної аорти з множинними стенозами її гілок, зокрема 50% стеноз проксимальних відділів правої ниркової артерії та оклюзію лівої ниркової артерії. За даними КГ стеноз КА не виявлений. Після встановлення діагнозу НАА в поєднанні з виразковим колітом призначено преднізолон, гідрохлоротіазид, спіронолактон, еналаприл та еноксапарин, а згодом – варфарин. Після 6 тиж лікування спостерігали незначне покращення функції ЛШ і відсутність тромбу в ЛШ [73].
Описаний випадок госпіталізації 21-річного чоловіка для оцінки відсутності пульсу на обох верхніх кінцівках. За 5 днів до того був проведений тромболізис стрептокіназою в зв’язку з розвитком ІМ нижньої стінки ЛШ. За даними ЕхоКГ було виявлено дилатацію лівого передсердя, ЛШ, помірну мітральну регургітацію, ФВ ЛШ дорівнювала 30%. За допомогою мультидетекторної КТ виявлена оклюзія брахіоцефальної та лівої підключичної артерії, виражений двосторонній стеноз ниркових артерій та аневризматичне розширення низхідної аорти. Ці зміни були підтверджені за допомогою інвазивної аортографії. За даними КГ виявлена оклюзія проксимальних відділів правої КА з колатеральним кровотоком із передньої міжшлуночкової артерії та огинаючої артерії. Пацієнту встановлений діагноз ДКМП та ІМ, що асоційовані з НАА [42].
M. Stojanovic і співавт. описали випадок затримки встановлення діагнозу НАА у 26-річної жінки, яку госпіталізували зі скаргами на нездужання, задишку, біль у грудній клітці, субфебрильну температуру, нічну пітливість, втрату маси тіла на 10 кг. Симптоми прогресували упродовж 2 років. При об’єктивному обстеженні виявлений пансистолічний шум у прекардіальній ділянці, шум над загальними сонними артеріями, ослаблення пульсу на лівій променевій артерії. При лабораторному дослідженні: підвищення ШЗЕ (105 мм/год) і СРБ, підвищення γ-глобулінової фракції білків та імуноглобуліну G. За даними трансторакальної ЕхоКГ виявлені зміни, характерні для ДКМП: дилатація ЛШ зі зниженням систолічної функції (ФВ ЛШ дорівнювала 30%), а також відзначали помірну аортальну недостатність, дилатацію висхідної аорти та потовщення стінки аорти. Доплерівське ультразвукове дослідження сонних артерій виявило виражені стенози біфуркації загальних сонних артерій, потовщення стінки підключичних артерій зі значним зменшенням кровотоку в лівій підключичній артерії. За допомогою КТ-ангіографії діагностували декілька стенозів і дилатацію дуги аорти, висхідної та низхідної аорти. У пацієнтки наявні 5 із 6 критеріїв НАА Американського коледжу ревматології [8], тому було розпочато імуносупресивне лікування преднізолоном, за декілька тижнів – азатіоприном, а також призначено симптоматичне лікування СН зі значним покращенням систолічної функції ЛШ (ФВ ЛШ становила 50%) [138].
Необхідно зауважити, що при НАА може розвинутися вторинна кардіоміопатія внаслідок тривалої АГ, патології клапанного апарату та ІХС [136].
Перикардит рідко зустрічається при НАА [89] і спостерігається приблизно у 8% пацієнтів із НАА [88], іноді як початковий прояв захворювання [49]. У даному випадку діагностований ексудативний перикардит із проведенням перикардіоцентезу [49].
СН спостерігається у 7-25% пацієнтів із НАА і виникає внаслідок неконтрольованої АГ, аортальної недостатності, ІХС, міокардиту, ДКМП, порушення ритму серця, ураження легеневих артерій із розвитком легеневої гіпертензії [6, 88, 90, 95, 108, 136]. Однак, за даними ретроспективної оцінки 272 пацієнтів із НАА [100], СН спостерігали у 33% з них, вона була причиною смерті у 46% всіх летальних випадків [100], а за даними обсерваційних досліджень виявлено відносно значну поширеність дисфункції ЛШ у пацієнтів із НАА, що дорівнювала 15-50% випадків [80, 108]. За даними дослідження, у пацієнтів із НАА та СН за результатами ЕхоКГ ФВ ЛШ дорівнювала 34,75±6,58%, а у пацієнтів без СН – 59,85±7,59% (р=0,00001) [136]. Основною причиною розвитку СН був ІМ. 50% пацієнтів із СН померли за час спостереження (1974-2003 роки) [136].
Описаний випадок розвитку СН у 15-річної дівчини, у якої за даними ЕхоКГ виявлена дилатація ЛШ, а ФВ дорівнювала 15%. Результати МРТ показали дифузний інтерстиціальний фіброз. Пацієнтці встановлено діагноз НАА після дообстеження за даними позитронно-емісійної томографії (ПЕТ), МРТ-ангіографії, МРТ, КГ (змін КА не виявлено), на основі дилатації правої підключичної артерії та звуження просвіту черевного відділу аорти. Після призначення преднізолону, стандартної терапії СН і статинів (виявлена сімейна гіперхолестеринемія на основі генетичного аналізу) стан пацієнтки покращився, за 12 міс потому ФВ ЛШ дорівнювала 45% [108].
Описаний випадок НАА у 27-річної жінки, у якої в якості початкових симптомів були прояви СН NYHA ІІІ (класифікація Нью-Йоркської асоціації кардіологів). При обстеженні пацієнтки виявлені ознаки СН, різний пульс на променевих артеріях, з різницею систолічного АТ на верхніх кінцівках більш ніж на 10 мм рт. ст., шум над сонними артеріями. Результати 2D-ЕхоКГ показали виражений дифузний гіпокінез, ФВ ЛШ 15-20%, дилатація правого передсердя та шлуночка, нижньої порожнистої вени, тяжка легенева гіпертензія (систолічний тиск у легеневій артерії – 90 мм рт. ст.), недостатність трикуспідального клапана. За даними аортографії – дифузне потовщення та стеноз лівої загальної сонної артерії та підключичної артерії, дифузне потовщення інтими та медії низхідної аорти з помірним звуженням її просвіту, виражене фокальне звуження низхідної аорти (70%) із дифузним потовщенням інтими та медії (рис. 2). Встановлений діагноз НАА на підставі критеріїв Американського коледжу ревматології (1990) [8]: вік менше 40 років, ослаблення пульсу на лівій променевій артерії, різниця систолічного АТ понад 10 мм рт. ст. на верхній кінцівках, шум над сонними артеріями, зміни на аортографії. Причинами розвитку симптомів СН були ДКМП і тяжка легенева гіпертензія [72].
M.A. Khan і співавт. доповіли про випадок НАА та туберкульозу в 9-річної дівчинки, у якої розвинулася гостра СН за 1 міс після початку протитуберкульозної терапії, що була призначена в зв’язку з туберкульозним лімфаденітом. За даними ЕхоКГ виявлена дилатація лівого передсердя та ЛШ зі зменшенням ФВ ЛШ до 35%. За допомогою КТ виявлений виражений дискретний стеноз грудного відділу аорти зі зменшенням просвіту до 3 мм. Проведено лікування метилпреднізолоном упродовж 4 тиж, однак симптоми СН і стеноз аорти не зменшилися. За даними аортографії – виражений стеноз аорти. Пацієнтці проведена імплантація стента, градієнт тиску після чого знизився з 95 до 13 мм рт. ст. За 50 днів після імплантації стента в аорту ФВ ЛШ повернулася до норми, а за даними рентгенограми органів грудної клітки виявлено нормалізацію розмірів серця [157].
Описаний випадок НАА у 8-річної японської дівчини, у якої початкові прояви захворювання були у вигляді гострої СН та дихального дистресу. АТ на правій руці дорівнював 128/64 мм рт. ст., а на лівій – 94/56 мм рт. ст. на в/в інфузії допаміну та добутаміну. Дані лабораторних досліджень: СРБ – 0,64 мг/дл, D-димер – 4,8 мкг/мл, BNP – 3190 пг/мл. За даними трансторакальної ЕхоКГ – гіпертрофія ЛШ, ФВ ЛШ дорівнювала 24% [99].
НАА асоційований із підвищеним ризиком внутрішньосудинного та внутрішньосерцевого тромбозу [73]. Так, за даними досліджень виявлений тромбоз шлуночків і легеневої артерії у пацієнтів із НАА [6, 73, 97]. Запалення стінки судин [2, 6, 73], прискорений розвиток атеросклерозу та зміна ламінарного кровотоку в результаті зміни анатомії судинної стінки – все це може сприяти виникненню артеріального тромбозу й ішемії органів при НАА [2]. При запаленні посилюються прокоагулянтні чинники та пригнічуються антикоагулянтні та фібринолітична активність, що може приводити до тромбоутворення [2]. Так, у пацієнтів із НАА були підвищеними рівні 4 фактора тромбоцитів, β-тромбоглобуліну, комплексу тромбін-антитромбін ІІІ, фібринопептиду А, D-димеру [2], рівня селектину Р тромбоцитів [70], тромбоксану В2 плазми [105], що може призводити до гіперкоагуляції та тромбозу уражених судин із розвитком стенозу/оклюзії артерій та ішемії органів [2]. Окрім того, хронічне запалення може бути причиною пошкодження ендотелію, що призводить до втрати фізіологічних антикоагулянтних, антиагрегантних і вазодилататорних властивостей ендотелію та до тромбозу [2].
У літературі є повідомлення про раптову смерть у пацієнтів із НАА. У 15-річної дівчини за рік після встановлення діагнозу НАА (V типу, Р+), яка була госпіталізована для оцінки помірної дисфункції ЛШ, за 5 міс розвинулися неконтрольована реноваскулярна АГ, симптоми СН, погіршилася систолічна функція ЛШ, виявлені тромби у ЛШ. Виконано стентування лівої ниркової артерії, проводилася комбінована антигіпертензивна терапія. Проте прогресування захворювання відбувалося швидко, незважаючи на терапію ГК і метотрексатом [97].
Також було встановлено, що пацієнти з НАА мають вищу поширеність метаболічного синдрому та пов’язані з ним такі стани/захворювання, котрі включають дисліпідемію, цукровий діабет, гіперінсулінемію порівняно з групою контролю здорових осіб [37].
Список літератури знаходиться в редакції.
Тематичний номер «Кардіологія, Ревматологія, Кардіохірургія» № 4 (59) вересень-жовтень 2018 р.



