18 грудня, 2018
Вибір нестероїдних протизапальних препаратів у пацієнтів ревматологічного профілю
За матеріалами IV Науково-практичної конференції «Міждисциплінарні проблеми в ревматології» (16 травня, м. Київ)
 Ревматологічні захворювання, зокрема остеоартрит (ОА), чинять надзвичайно великий негативний вплив на різні аспекти життя, що значною мірою пов’язаний із больовим синдромом (J. Groppel et al., 2015). Недаремно в сучасних рекомендаціях щодо ведення пацієнтів з ОА особливо наголошують саме на больовому синдромі та його усуненні як основного чинника погіршення якості життя (О. Bruyere et al., 2014). При цьому невід’ємним компонентом лікування є нестероїдні протизапальні препарати (НПЗП).
Ревматологічні захворювання, зокрема остеоартрит (ОА), чинять надзвичайно великий негативний вплив на різні аспекти життя, що значною мірою пов’язаний із больовим синдромом (J. Groppel et al., 2015). Недаремно в сучасних рекомендаціях щодо ведення пацієнтів з ОА особливо наголошують саме на больовому синдромі та його усуненні як основного чинника погіршення якості життя (О. Bruyere et al., 2014). При цьому невід’ємним компонентом лікування є нестероїдні протизапальні препарати (НПЗП).
Вибору НПЗП у пацієнтів ревматологічного профілю на прикладі клінічних випадків присвятила доповідь керівник центру ревматології Клінічної лікарні «Феофанія» Державного управління справами (м. Київ), доктор медичних наук, професор Ірина Юріївна Головач.
Лектор зазначила, що вибір тактики лікування пацієнтів з ОА залежить від того, якого саме пацієнта ми лікуємо: чи то є особа похилого віку з ОА колінних суглобів ІІ-ІІІ стадії з коморбідним ураженням шлунка та серця; чи молодший пацієнт без коморбідності з посттравматичним ОА 0-І стадії; або ми маємо іншу ситуацію. З огляду на локалізацію ОА та його стадію, вік пацієнта й наявність супутньої патології можна сформувати понад 100 клінічних комбінацій, що потребують персоніфікованого підходу щодо вибору, зокрема, НПЗП.
Сьогодні тривають дискусії стосовно різних підходів у лікуванні ОА, зокрема щодо ролі симптом-модифікувальних препаратів сповільненої дії чи топічних лікарських засобів. Проте, коли йдеться про лікування больового синдрому та вплив НПЗП на біль, розходжень у думках немає: препарати цієї групи (як неселективні, так і селективні) рекомендовані для ОА будь-якої локалізації (табл. 1).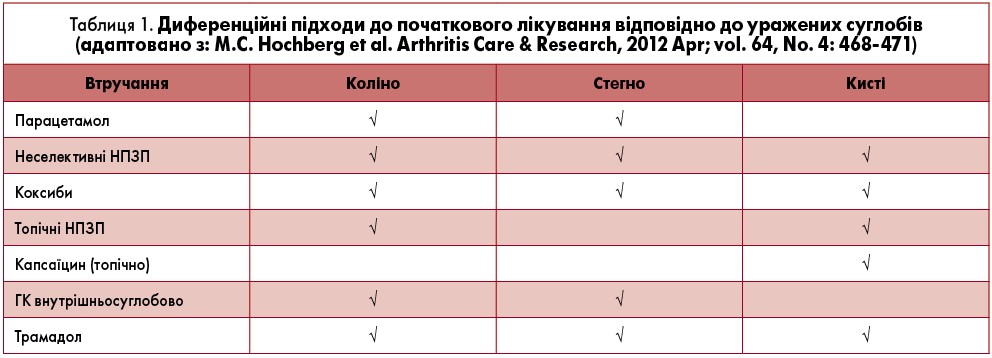
Згідно з рекомендаціями Комісії Європейського товариства з вивчення клінічних і економічних аспектів остеопорозу й ОА (ESCEO) 2014 року та оновленими рекомендаціями ESCEO 2016 року, переривчастий або навіть постійний прийом НПЗП є обов’язковим компонентом комплексної терапії ОА (О. Bruyere et al., 2014; О. Bruyere et al., 2016).
НПЗП активно впливають на патогенетичні механізми ОА та метаболізм суглобового хряща, а їхній знеболювальний ефект при ОА є більш виразним, аніж у парацетамолу, та порівнянним із деякими опіоїдами.
На сьогодні ОА розглядають як гетерогенне захворювання з частою коморбідністю, котра разом з індивідуальними чинниками ризику створює фенотип, притаманний певному пацієнту (S. Bierma-Zeinstra et al., 2011). У зв’язку з цим вибір конкретного лікарського засобу для тривалої терапії має ґрунтуватися не тільки на даних щодо ефективності, а й на оцінці профілю безпеки, враховуючи ризик гастроінтестинальних і кардіоваскулярних ускладнень, а також імовірний вплив НПЗП на метаболізм суглобового хряща при тривалому застосуванні.
Слід зауважити, що пацієнтів без чинників ризику в реальній клінічній практиці майже не існує. Поширеними чинниками, що підвищують ризик шлунково-кишкових ускладнень терапії НПЗП, є вік, куріння, чоловіча стать, зловживання алкоголем. Хворі віком від 60 років автоматично потрапляють до групи помірного ризику: багато хто з них приймають високі дози НПЗП, ацетилсаліцилову кислоту (АСК), глюкокортикоїди (ГК), антикоагулянти, мають виразкову хворобу в анамнезі. Натомість наявність в анамнезі виразкової хвороби в поєднанні з двома та більше додатковими чинниками ризику автоматично зараховує пацієнта до групи високого ризику розвитку гастроінтестинальних ускладнень (F.L. Lanza et al., 2009).
Додатковим незалежним чинником ризику НПЗП-гастропатій є наявність інфекції Helicobacter pylori. Відповідно до розділу Маастрихтського консенсусу V, присвяченого НПЗП-гастропатіям, пацієнтам з історією пептичної виразки чи кровотечі з верхніх відділів шлунково-кишкового тракту (ШКТ), котрі тривало отримують НПЗП-терапію, має бути призначено інгібітори протонної помпи (ІПП), проведено тест на хелікобактерну інфекцію та за необхідності ініційовано антихелікобактерну терапію (P. Malfertheiner et al., 2017).
Під час доповіді було акцентовано на існуванні зв’язку між хронічним больовим синдромом і кардіоваскулярними подіями. Хронічний больовий синдром реалізує свої негативні ефекти через активацію симпатоадреналової системи, цитокінову агресію, активацію тромбоцитів, підвищення коагуляції. Також певну роль відіграють зменшення функціональної активності пацієнтів, підвищена потреба в знеболювальних препаратах, депресія – всі ці чинники призводять до прогресування та загострення серцево-судинної патології. Лектор зазначила, що серцево-судинні ускладнення (інфаркт міокарда – ІМ, інсульт, інші тромботичні події) на тлі прийому НПЗП розвиваються навіть частіше, ніж ускладнення з боку ШКТ. Інша річ, що серцево-судинні ускладнення виникають пізніше. Натомість небажані реакції з боку ШКТ виникають набагато швидше й можуть спостерігатися навіть за 1-2 дні після прийому НПЗП.
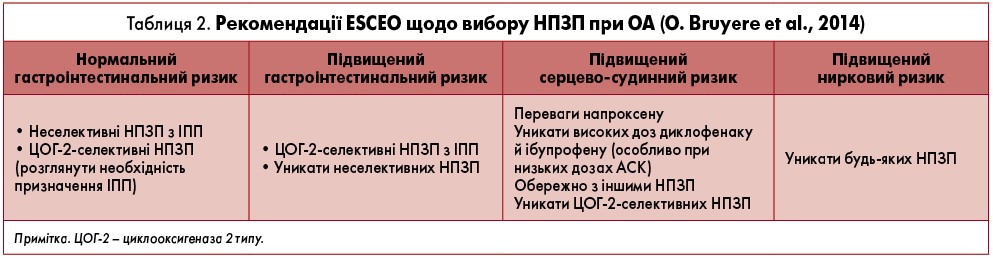
Загалом, відповідно до рекомендацій ESCEO, обираючи той чи інший НПЗП, необхідно враховувати будь-які ризики (гастроінтестинальний, серцево-судинний, нирковий) (О. Bruyere et al., 2014; О. Bruyere et al., 2016) (табл. 2).
Клінічні випадки, котрі навела професор І.Ю. Головач, продемонстрували, як цю рекомендацію можна застосовувати в реальній практиці.
Клінічний випадок
Пацієнтка В., 65 років, пенсіонерка.
Скарги на болі в колінних суглобах упродовж останніх 5 років, посилення болю та набряк суглобів останні 2 роки.
Застосовувала народні методи лікування (розтирання, компреси), керуючись телерекламою та порадами сусідів, неодноразове введення кортикостероїду внутрішньом’язово з позитивним клінічним ефектом, але з підвищенням артеріального тиску (АТ) після введення, через що використання препарату було припинено. Після безконтрольного прийому НПЗП (іноді різних груп і форм) почав турбувати біль у шлунку, через що їх прийом також було припинено.
Анамнез: артеріальна гіпертензія (АГ) (приймає периндоприл + індапамід), гіперхолестеринемія (без корекції), ожиріння (вага – 88 кг, зріст – 163 см, індекс маси тіла (ІМТ) – 33,5 кг/м2), ерозивний гастрит, асоційований із Helicobacter pylori (за даними езофагогастродуоденоскопії), ОА.
Оцінка суглобового синдрому: помірно виражений больовий синдром із помірними функціональними обмеженнями (візуально-аналогова шкала (ВАШ) у спокої – 4 бали, після навантаження – 6 балів; альгофункціональний індекс Лекена – 6,5 бала; індекс WOMAC: шкала болю – 220, шкала скутості – 75, шкала функціонального індексу – 612).
За даними лабораторних досліджень, ревматоїдний фактор – негативний. Загальний аналіз крові – в нормі, привертають увагу підвищені рівні холестерину та тригліцеридів.
Обрана лікувальна тактика: проведено ерадикацію хелікобактерної інфекції, призначено антигіпертензивну терапію з ретельним контролем АТ і частоти серцевих скорочень (ЧСС), статинотерапію (розувастатин 20 мг увечері), рекомендовано корекцію харчування та фізичні методи реабілітації для зниження маси тіла.
Зважаючи на наявність АГ і виразкового анамнезу (ерозії та інфікування Helicobacter рylori), з-поміж НПЗП пацієнтці рекомендований прийом амтолметин гуацилу 600 мг зранку, а також симптом-модифікувальний препарат сповільненої дії (глюкозамін сульфат 1500 мг/добу зранку впродовж тривалого періоду).
Амтолметин гуацил (Найзилат) було обрано завдяки його виразному знеболювальному, протизапальному та жарознижувальному ефектам і протективному гастроентерологічному впливу. Препарат амтолметин гуацил є першим у світі неселективним НПЗП із доведеними гастропротекторними властивостями.
Амтолметин гуацил є похідним толметину, який за хімічною структурою є похідним фенілоцтової кислоти. Він має здатність стимулювати периферичні рецептори капсаїцину, що забезпечує місцеву знеболювальну дію та призводить до стимуляції вивільнення пептиду, який кодується геном кальцитоніну, зумовлюючи підвищення синтезу оксиду азоту в слизовій оболонці ШКТ. Амтолметин гуацил стимулює вивільнення бікарбонату, котрий є основою лужного буфера шлункового соку, та пригнічує перекисне окислення ліпідів, що також призводить до зниження секреції соляної кислоти та прискорення репаративних процесів у слизовій оболонці шлунка.
За даними метааналізу, ризик розвитку ускладнень з боку ШКТ, зокрема у вигляді перфорацій і кровотеч, був найнижчим саме в амтолметин гуацилу серед усіх включених в аналіз НПЗП. Ризик розвитку ускладнень від прийому цього препарату становить 0,2-0,3, зокрема серйозних шлунково-кишкових ускладнень – 0,3 (R. Marcolongo et al., 1999). При цьому його призначають натще: на відміну від інших НПЗП амтолметин гуацил рекомендують застосовувати зранку до прийому їжі.
Водночас препарат має прийнятний профіль кардіоваскулярної безпеки. Дослідження ефективності та кардіоваскулярної безпеки використання амтолметин гуацилу в пацієнтів із хронічним болем у нижній частині спини та контрольованою АГ (КОРОНА) продемонструвало, що кардіоваскулярні події (ІМ, інфаркт мозку, раптова серцева смерть, розвиток/прогресування серцевої недостатності) у хворих з анкілозуючим спондилітом, що приймали Найзилат, не були зафіксовані протягом дослідження (І.З. Гайдукова та співавт., 2016).
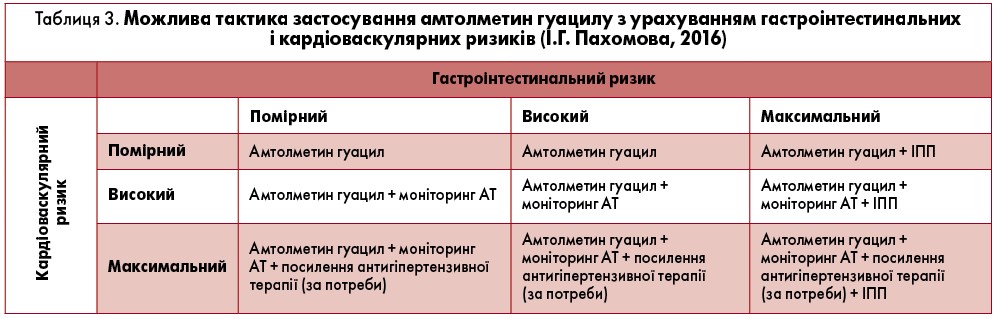
На сьогодні запропоновано можливу тактику застосування амтолметин гуацилу з урахуванням гастроінтестинальних і кардіоваскулярних ризиків (табл. 3).
Клінічний випадок
Пацієнт М., 58 років, працює.
Скарги на біль у колінних суглобах протягом останніх 10 років після активних занять спортом (катання на лижах), із численними мікротравмами. Больовий синдром наростав поступово, з періодичними загостреннями, через що пацієнт був вимушений припинити спортивну активність. Безсистемно приймав НПЗП, часто застосовував поєднання двох препаратів, періодично використовував хондропротектори (головним чином, у вигляді біодомішок). Часто виникали реактивні синовіти (до 5-6 епізодів на рік), під час епізодів яких зловживав внутрішньосуглобовим уведенням ГК (>6 уведень на рік).
Анамнез: виразка шлунка на тлі нераціонального прийому НПЗП 5 років тому, постійний диспепсичний синдром від застосування різних НПЗП, АГ і гіперхолестеринемія (без належної корекції).
Оцінка суглобового синдрому: помірно виражений больовий синдром із тенденцією до підвищення інтенсивності після навантаження з помірними функціональними обмеженнями (ВАШ у спокої – 4 бали, після навантаження – 7 балів; альгофункціональний індекс Лекена – 7,8 бала; індекс WOMAC: шкала болю – 320, шкала скутості – 68, шкала функціонального індексу – 656).
За даними лабораторних досліджень, ревматоїдний фактор – негативний. Наявний синдром гіперхолестеринемії, ознаки активного запального синдрому.
Інструментальні обстеження виявили рівень АТ – 160/90 мм рт. ст., ЧСС – 67 уд/хв, еритематозну гастропатію, поодинокі дрібні ерозії в пілоричному відділі шлунка. Тест на Helicobacter pylori – негативний.
Обрана лікувальна тактика: фізичні вправи для колінних суглобів під наглядом лікаря-реабілітолога, антигіпертензивна терапія (інгібітор ангіотензинперетворювального ферменту (ІАПФ) із сечогінним препаратом), розувастатин 20 мг увечері.
Призначено симптом-модифікувальний препарат сповільненої дії (глюкозаміну сульфат у дозі 1500 мг/добу зранку впродовж тривалого періоду).
Через підвищені кардіоваскулярний і гастроінтестинальний ризики призначено амтолметин гуацил у дозі 600 мг 2 р/добу сумісно з ІПП (із можливою їх відміною за 3-4 тиж).
Варто зазначити, що амтолметин гуацил є препаратом вибору в пацієнтів із виразковим анамнезом. Експериментальні дослідження продемонстрували в лабораторних тварин загоєння виразок і відсутність їх прогресування після індукції індометацином із подальшим застосуванням амтолметин гуацилу (E. Tubaro et al., 2000). Також у клінічних дослідженнях було встановлено, що частота рецидивів пептичних виразок у групі амтолметин гуацилу є в 3 рази нижчою, ніж у групі диклофенаку (G. Bianchi-Porro et al., 1999).
Клінічний випадок
Пацієнтка Т., 77 років, продавець.
Скарги на біль і скутість суглобів кистей, плечових і променево-зап’ясткових суглобів, у ділянці шиї, а також набряк п’ястково-фалангових суглобів кистей і колінних суглобів протягом останніх 3 років. Ранкова скутість триває до обіду та потребує прийому НПЗП.
Самостійно приймала парацетамол, комбіновані хондропротектори циклами (1-2 міс), періодично лікувалася фізіотерапевтичними методами. Лікування давало лише тимчасове полегшення: біль, скутість, функціональні обмеження прогресували, з’явилася деформація суглобів кистей, що свідчить про типову картину ревматоїдного артриту.
Анамнез і супутні захворювання: ішемічна хвороба серця – ІХС (торік перенесла гострий ІМ, встановлення стента з лікарським покриттям), перебувала на двокомпонентній антиагрегантній терапії (АСК, клопідогрель), також приймала бісопролол, статини. Пацієнтка курить (10 цигарок на добу впродовж останніх 20 років), має АГ (приймає еналаприл + гіпотіазид), менопаузу (8 років) і незначно підвищений ІМТ – 25,4 кг/м2.
Об’єктивні та лабораторні дослідження виявили підвищення рівня С-реактивного білка (18 мг/л) і швидкості осідання еритроцитів (26 мм/год). Виявлено набряк п’ястково-фалангових суглобів кистей, правого колінного суглоба, анкілоз лівого променево-зап’ясткового суглоба.
Клінічний статус: ревматоїдний артрит в активній фазі, коморбідність щодо серцево-судинної патології – ІХС, АГ і серцева недостатність. Пацієнтка належить до групи високого кардіоваскулярного й гастроінтестинального ризику: велика довжина стента зумовлює збільшення ризику ішемічних ускладнень, а постійний прийом ГК і НПЗП + жіноча стать – ризику кровотеч.
Обрана лікувальна тактика: метотрексат у стартовій дозі 7,5 мг/тиж і амтолметин гуацил сумісно з ІПП, антигіпертензивна терапія (ІАПФ, сечогінний препарат, бісопролол 5 мг/добу), подвійна антитромбоцитарна терапія, розувастатин 20 мг увечері.
У цьому випадку амтолметин гуацил також було обрано невипадково серед НПЗП. Слід зазначити, що деякі НПЗП при одночасному прийомі пригнічують антиагрегантний ефект АСК. Насамперед ідеться про ібупрофен (особливо у високих дозах). Своєю чергою, доведено, що амтолметин гуацил має антитромбоцитарну активність, яка перевершує таку АСК; він не пригнічує ефекти АСК і може бути рекомендований при запальних станах із ризиком тромбоемболічних ускладнень (E. Tubaro, L. Belogi, C.M. Mezzadri, 2001).
Професор І.Ю. Головач наголосила на таких перевагах застосування амтолметин гуацилу:
- доведений гастропротективний ефект завдяки особливостям будови молекули й індукції продукції оксиду азоту (G. Goruzzi et al., 2002);
- гастропротективні властивості щодо зміненої слизової оболонки шлунка, якщо передував прийом гастротоксичних НПЗП (E. Tubaro et al., 1995);
- антитромбоцитарна активність, яка перевершує таку АСК (E. Tubaro, L. Belogi, C.M. Mezzadri, 2001).
Якщо взяти до уваги все вищесказане, можна «намалювати» портрет пацієнта, котрому може бути призначено амтолметин гуацил:
- хронічний больовий синдром на тлі ревматологічних захворювань, які потребують тривалого прийому НПЗП;
- високий ризик ерозивно-виразкових ускладнень ШКТ: пацієнти літнього віку, чоловіки;
- виразковий анамнез та анамнез виразкових ускладнень;
- диспепсія й ерозивні зміни слизової оболонки, що виникли на тлі попереднього прийому НПЗП;
- помірний кардіоваскулярний ризик, АГ.
Отже, наведені клінічні випадки демонструють, що навіть поєднання множинних чинників ризику в пацієнта з ОА та побоювання лікаря щодо можливих серцево-судинних або шлунково-кишкових ускладнень не є причинами для відмови від призначення НПЗП. По-перше, ми завжди маємо можливість вплинути на деякі чинники ризику; по-друге, маємо НПЗП – амтолметин гуацил (Найзилат), який не тільки не збільшує серцево-судинний або гастроінтестинальний ризик, а й має протективні ефекти.
Підготувала Олександра Демецька
Тематичний номер «Кардіологія, Ревматологія, Кардіохірургія» № 4 (59) вересень-жовтень 2018 р.