28 січня, 2019
Биохимические аспекты новых лекарственных препаратов от ожирения
Ожирение – это хроническое, рецидивирующее, многофакторное нейроповеденческое заболевание, при котором увеличение жира в организме способствует дисфункции жировой ткани и ее биомеханическому воздействию на окружающие ткани с развитием метаболических и психосоциальных последствий для здоровья [1].
Всемирная организация здравоохранения признала ожирение как новую неинфекционную эпидемию XX и XXI столетий. [2]. Ожирение является глобальной проблемой общественного здравоохранения. Сейчас на Земле проживает 1,5 млрд человек с избыточным весом и 500 млн – с ожирением (из них 200 млн мужчин и 300 млн женщин) [3]. Распространенность данного заболевания за последние несколько лет в мире повысилась с 4,8 до 9,8% у мужчин и с 7,9 до 13,8% у женщин. От ожирения страдает каждый десятый ребенок, около 30% населения в экономически развитых странах имеет массу тела, которая превышает норму. Из-за указанной патологии продолжительность жизни уменьшается в среднем от 3 до 5 лет. С каждым годом число людей с ожирением прогрессирует и каждые 10 лет увеличивается на 10%. В июне 2013 г. АМА (American Medical Association) официально признала ожирение болезнью [4].
Основные причины этого заболевания: генетическая предрасположенность (генетические синдромы Прадера-Вилли, Барде-Бидля, Кохена, Альстрема, Фрелиха), неврологические (черепно-мозговая травма, опухоль головного мозга), эндокринная патология, факторы окружающей среды, отсутствие физической активности, сидячий образ жизни, стресс, депрессия, неправильное питание, влияние некоторых лекарственных препаратов, аденовирусная инфекция, курение, алкоголь. Считается, что модель формирования и сохранения ожирения следует рассматривать как аналогичную таким хроническим заболеваниям, как алкоголизм или наркомания.
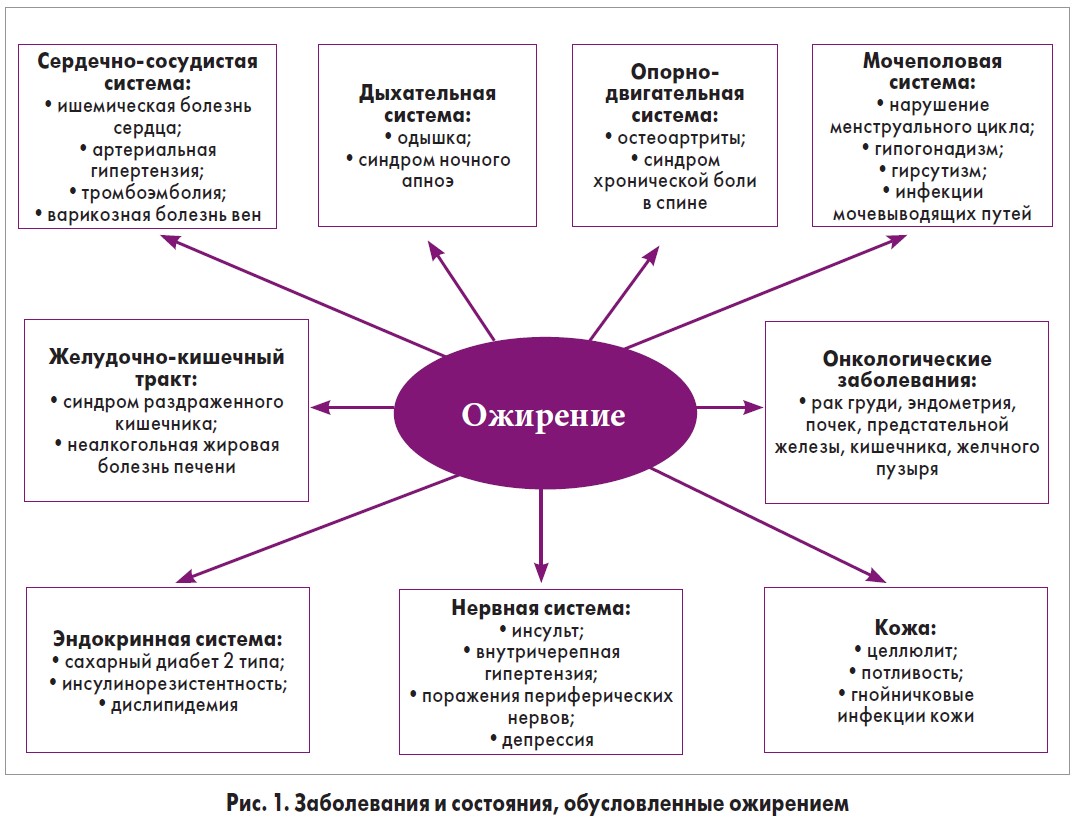
Ожирение является не только косметической проблемой. При данном заболевании повышается риск развития различных патологических состояний (рис. 1) [5].
Индекс массы тела как метод оценки ожирения
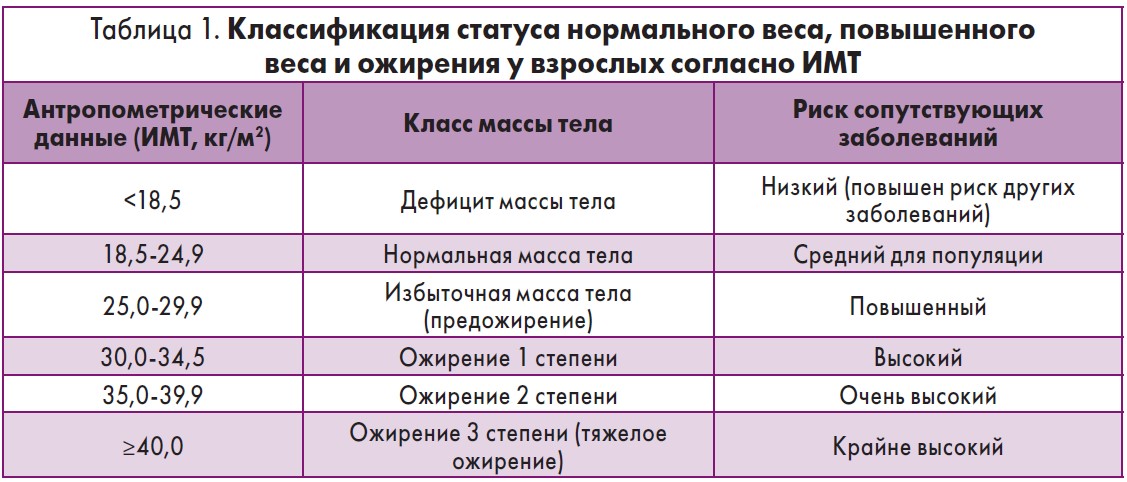
Определить ожирение используя только массу тела человека невозможно, поскольку низкорослые люди имеют меньший вес, чем высокие. Поэтому для стандартизации был выбран параметр индекс массы тела (ИМТ), или индекс Кетле. ИМТ – это простой и надежный скрининговый критерий оценки нормальной, избыточной массы тела и ожирения. Идеальное значение ИМТ составляет 18,5-24,9 кг/м2. Показатель ИМТ, равный 25 кг/м2, является пограничным значением для излишнего веса у взрослого человека, а 30 кг/м2 – пограничным значением для ожирения.
Классификация массы тела с использованием ИМТ представлена в таблице 1.
Из недостатков метода определения ИМТ следует отметить, что он не является надежной оценкой наличия жировой ткани и может как переоценивать, так и недооценивать ее содержание. У некоторых лиц ИМТ плохо коррелирует с метаболическими заболеваниями и патологиями, связанными с ожирением. Данный метод не способен дифференцировать жир от мышечной массы, не учитывает этнические и расовые особенности.
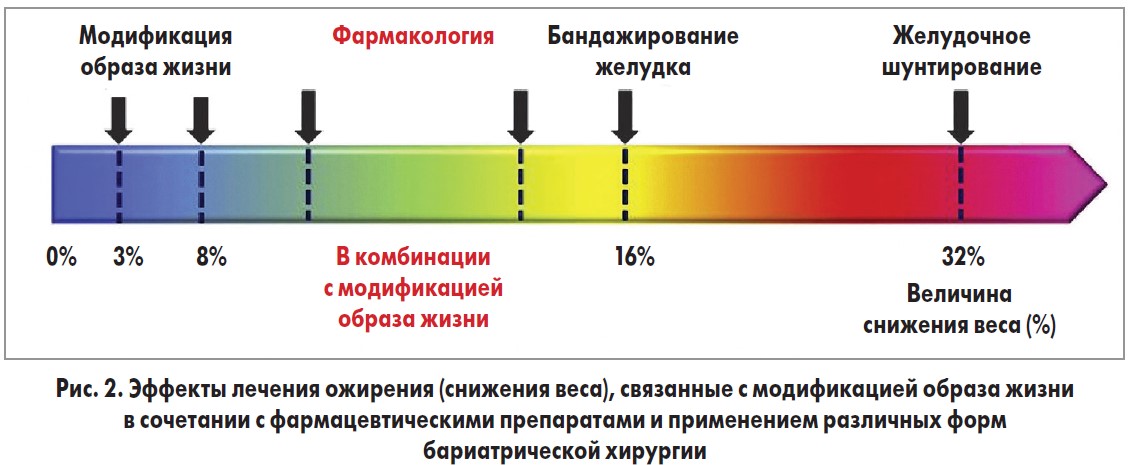
В современной клинической практике используются такие методы лечения ожирения: психо-, дието-, фармако-, физиотерапия, лечебная физкультура, хирургическое лечение. Так, при модификации образа жизни (диета + физические упражнения) вес снижается на 3-10%, при сочетании модификации образа жизни с фармакологическими лекарственными препаратами – на 5-12%, в случае хирургического лечения – на 15-30% (рис. 2) [6].
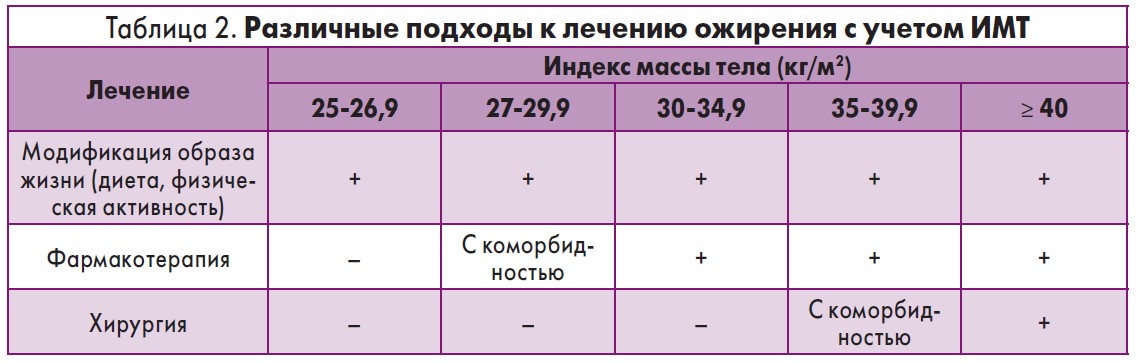
При разных ИМТ используются различные подходы к лечению ожирения (табл. 2) [7].
Эпидемиологические данные свидетельствуют о том, что ожирение и избыточный вес являются факторами, связанными с повышенным риском смерти. Даже умеренное снижение массы тела (от 5 до 10%) приводит к уменьшению связанных с ожирением метаболических и сердечно-сосудистых факторов риска. Фармакотерапия может быть рассмотрена для пациентов с избыточным весом и ожирением, которые не добились успеха после многочисленных попыток похудеть с применением диеты и физических упражнений и которым нельзя рекомендовать изменение образа жизни из-за тяжелых хронических заболеваний.
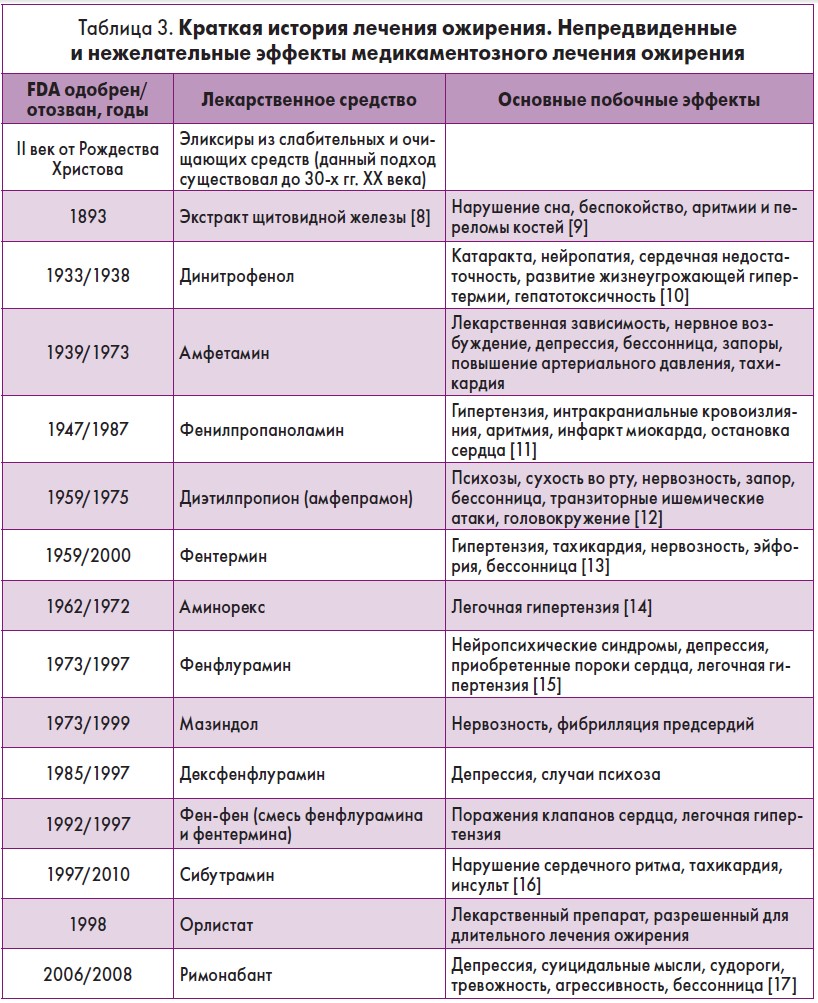
Историю фармакотерапии ожирения можно назвать «историей изъятия из обращения» (табл. 3).
 Лекарственным препаратом, который одобрен для лечения ожирения и применяется в клинической практике, является орлистат, который был разработан в Швейцарии. Орлистат зарегистрирован и используется более чем в 140 странах мира: с 1998 г. >38 млн пациентов с ожирением прошли курс терапии данным средством. Препарат имеет доказанную в масштабных международных клинических исследованиях эффективность, хорошо переносится.
Лекарственным препаратом, который одобрен для лечения ожирения и применяется в клинической практике, является орлистат, который был разработан в Швейцарии. Орлистат зарегистрирован и используется более чем в 140 странах мира: с 1998 г. >38 млн пациентов с ожирением прошли курс терапии данным средством. Препарат имеет доказанную в масштабных международных клинических исследованиях эффективность, хорошо переносится.
Механизм действия орлистата (Xenical)
Орлистат – это синтетическое производное липстатина, продукта жизнедеятельности плесневого гриба Streptomyces toxytricini, который ингибирует желудочную и панкреатическую липазы. Желудочно-кишечные липазы – ключевые ферменты, участвующие в гидролизе триглицеридов пищи, высвобождении жирных кислот и моноглицеридов, которые затем всасываются через слизистую оболочку кишечника. Благодаря структурному сходству с триглицеридами орлистат взаимодействует с активным участком фермента, ковалентно связываясь с его сериновым остатком. Связывание имеет обратимый характер, но в физиологических условиях подавляющий эффект препарата в ходе пассажа через желудочно-кишечный тракт остается неизменным. Вследствие этого около трети триглицеридов пищи не переваривается и не всасывается, что позволяет создать дополнительный дефицит калорий по сравнению с применением только диеты. При этом орлистат не влияет на обмен углеводов, белков и фосфолипидов. Таким образом, указанное средство обладает местным механизмом действия, которое ограничено желудочно-кишечным трактом.
До недавнего времени орлистат был единственным препаратом для похудения, однако за последние 6 лет Управление по контролю качества продуктов питания и лекарственных средств (FDA, США) утвердило 4 новых препарата для лечения ожирения: Qsymia, Belviq (2012), Сontrave и Saxenda (2014).
Общим в показаниях к применению данных средств при лечении ожирения у взрослых является ИМТ:
- ≥30 кг/м2 (для пациентов без сопутствующих заболеваний);
- не меньше 27 кг/м2 (для пациентов, имеющих хотя бы одно сопутствующее заболевание, например артериальную гипертензию, сахарный диабет 2 типа, дислипидемию).
Qsymia® (фентермин/топирамат)
Лекарственный препарат Qsymia® (комбинация фентермина и топирамата) – разработка фармацевтической компании Vivus Inc. (США), одобрен FDA 17 июля 2012 г. [18].
Фентермин является аналогом амфетамина и применялся в США с 1959 г. в качестве супрессанта аппетита (краткосрочный курс ≤12 нед), однако препарат был изъят из-за побочных эффектов в 2000 г. Топирамат был утвержден в 1996 г. как лекарственное средство для лечения судорог (до 400 мг/день) и профилактики мигрени (до 100 мг/день). Разработанная новая комбинация фентермин/топирамат способствует уменьшению массы тела и улучшению течения сопутствующих заболеваний, связанных с избыточным весом. Низкая доза фентермина легко абсорбируется и немедленно высвобождается (пик концентрации – через 6 ч, время полувыведения – 20 ч), чтобы обеспечить эффект в начале дня, тогда как высвобождение топирамата оказывает влияние в более поздний период времени (пик концентрации – через 10 ч, время полувыведения – 65 ч). Лекарственное средство Qsymia® имеет 4 разнодозовые комбинации, состоящие из фентермина/топирамата в соотношении 3,75 мг/23 мг, 7,5 мг/46 мг, 11,25 мг/69 мг и 15 мг/92 мг [19, 20].
Механизм действия Qsymia®
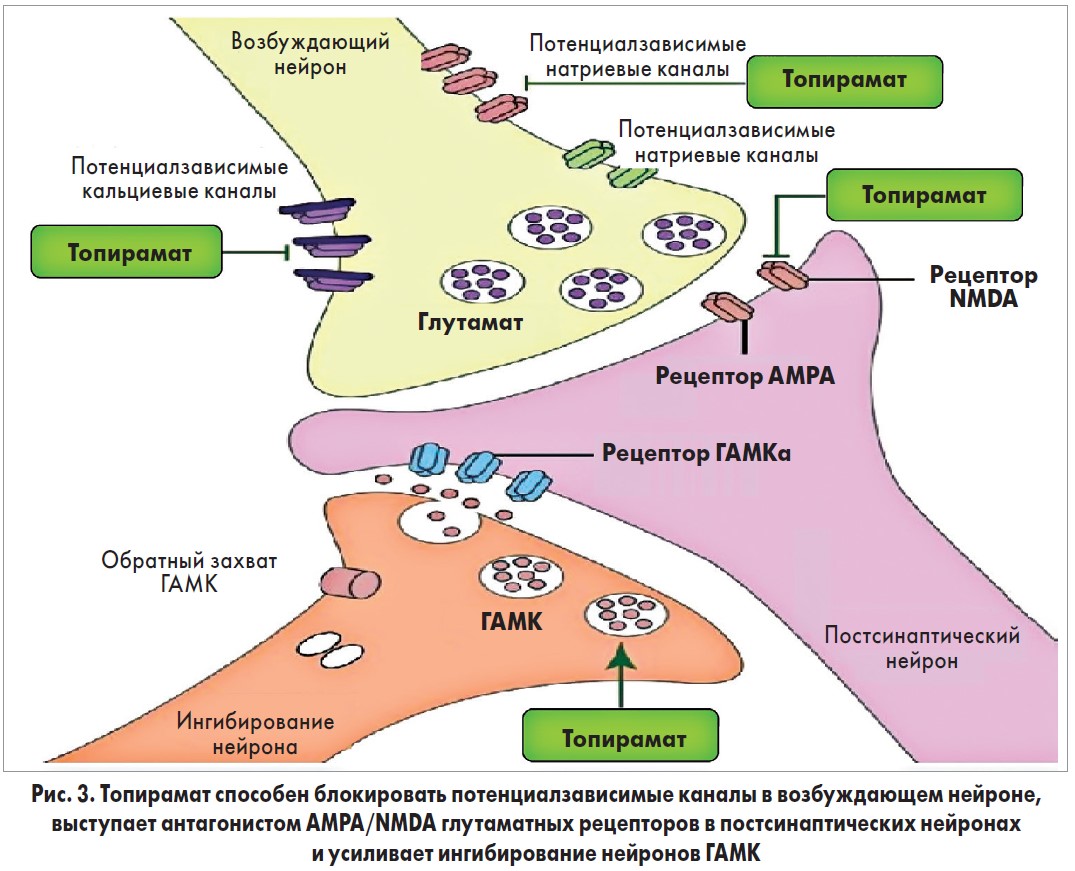 Фентермин (α, α-диметилфениламин-HCl) является центральным симпатомиметиком, который приводит к увеличению норэпинефрина (НЭ) в центральной нервной системе (ЦНС), высвобождая НЭ из нейронов гипоталамуса, что снижает аппетит и потребление пищи. Что касается топирамата (2,3:4,5-ди-О-изопропилиден-β-D-фруктопиранозы сульфамат), то его механизм влияния, связанный с потерей веса, не совсем понятен. Исследования на животных показывают, что топирамат является антагонистом действия глутамата на рецепторы α-амино‑3-гидрокси‑5-метил‑4-изоксазолпропионовой кислоты (AMPA) / каинатные рецепторы и приводит к увеличению рецепторопосредованной γ-аминомасляной кислоты (ГАМК) (рис. 3) [21, 22]. Топирамат также ингибирует потенциалзависимые натриевые и кальциевые каналы, изоферменты карбоксиангидразы II и IV. Он может снизить потребление пищи через воздействие на карбоангидразу путем изменения вкуса или при действии на передачу ГАМК, поскольку активация рецептора ГАМК и взаимодействие между ГАМК и лептином оказывают влияние на аппетит и метаболизм веществ [23].
Фентермин (α, α-диметилфениламин-HCl) является центральным симпатомиметиком, который приводит к увеличению норэпинефрина (НЭ) в центральной нервной системе (ЦНС), высвобождая НЭ из нейронов гипоталамуса, что снижает аппетит и потребление пищи. Что касается топирамата (2,3:4,5-ди-О-изопропилиден-β-D-фруктопиранозы сульфамат), то его механизм влияния, связанный с потерей веса, не совсем понятен. Исследования на животных показывают, что топирамат является антагонистом действия глутамата на рецепторы α-амино‑3-гидрокси‑5-метил‑4-изоксазолпропионовой кислоты (AMPA) / каинатные рецепторы и приводит к увеличению рецепторопосредованной γ-аминомасляной кислоты (ГАМК) (рис. 3) [21, 22]. Топирамат также ингибирует потенциалзависимые натриевые и кальциевые каналы, изоферменты карбоксиангидразы II и IV. Он может снизить потребление пищи через воздействие на карбоангидразу путем изменения вкуса или при действии на передачу ГАМК, поскольку активация рецептора ГАМК и взаимодействие между ГАМК и лептином оказывают влияние на аппетит и метаболизм веществ [23].
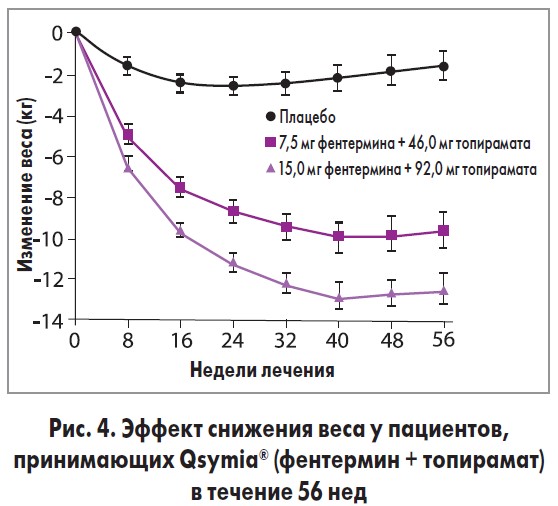 В одно из международных клинических исследований фазы III [24], которое длилось 56 нед, были включены пациенты с избыточным весом и ожирением в возрасте 18-70 лет с ИМТ 27-45 кг/м2 и двумя или более сопутствующими заболеваниями (гипертония, дислипидемия, диабет, абдоминальное ожирение). Участники были разделены на следующие группы: плацебо, 1-я группа (1 р/день перорально 7,5 мг фентермина + 46,0 мг топирамата), 2-я группа (1 р/день перорально 15,0 мг фентермина + 92,0 мг топирамата). Результаты исследований представлены на рисунке 4.
В одно из международных клинических исследований фазы III [24], которое длилось 56 нед, были включены пациенты с избыточным весом и ожирением в возрасте 18-70 лет с ИМТ 27-45 кг/м2 и двумя или более сопутствующими заболеваниями (гипертония, дислипидемия, диабет, абдоминальное ожирение). Участники были разделены на следующие группы: плацебо, 1-я группа (1 р/день перорально 7,5 мг фентермина + 46,0 мг топирамата), 2-я группа (1 р/день перорально 15,0 мг фентермина + 92,0 мг топирамата). Результаты исследований представлены на рисунке 4.
Побочные эффекты Qsymia®: бессонница, сухость во рту, головокружение, запор, парестезия.
Belviq® (Lorcaserin)
Лекарственный препарат Belviq® (Lorcaserin hydrochloride) разработан биофармацевтической компанией Arena Pharmaceuticals, Inc. (США) для лечения ожирения; был утвержден FDA 27 июня 2012 г. Однако Arena Pharmaceuticals, Inc. в январе 2017 года объявила о том, что продает Belviq® компании Eisai Co., Ltd. (Япония).
Лоркасерин представляет собой агонист серотонина (5-гидрокситриптамина, 5-НТ) с химической формулой (R)-8-хлор‑1-метил‑2,3,4,5-тетрагидро‑1Н‑3-бензазепина гидрохлорида полугидрат. Гидрохлорид лоркасерина предназначен для перорального применения. Стандартная дозировка препарата составляет 10 мг, которые вводятся 2 р/сут. Если масса тела пациента на протяжении первых 12 нед терапии лоркасерином гидрохлоридом уменьшилась менее чем на 5%, то его использование прекращается ввиду слабой результативности.
Механизм действия Belviq®
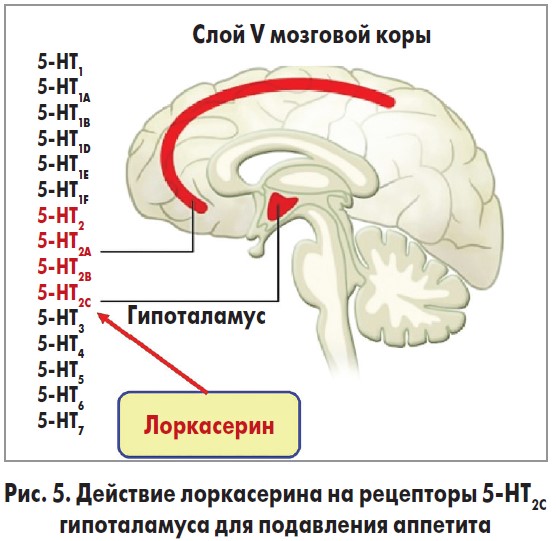 Лоркасерина гидрохлорид влияет на рецепторы 5-НТ2С в ЦНС, в частности в гипоталамусе, чтобы уменьшить аппетит. Препарат стимулирует рецепторы 5-НТ2С в проопиомеланокортиновых нейронах и дугообразном ядре. Это обусловливает высвобождение альфа-меланокортинстимулирующего гормона (α-MSH), который действует на рецепторы меланокортина 4 в паравентрикулярных ядрах и приводит к подавлению аппетита [26, 27]. Существует 14 подтипов 5-НТ-рецепторов, каждый из которых имеет различную активность. 5-НТ2С тесно связан с рецепторами 5-HT2A и 5-HT2B (рис. 5) [28]. Сродство лоркасерина гидрохлорида к рецептору 5-НТ2С примерно в 15 раз больше его сродства к 5-НТ2А и в 100 раз больше – к 5-НТ2В [29]. Аффинность связывания зависит от дозы препарата. При максимальной дозировке (20 мг/сут) связывание становится менее селективным для 5-НТ2С, то есть больше препарата связывается с другими серотониновыми рецепторами, такими, например, как 5-HT2A [30].
Лоркасерина гидрохлорид влияет на рецепторы 5-НТ2С в ЦНС, в частности в гипоталамусе, чтобы уменьшить аппетит. Препарат стимулирует рецепторы 5-НТ2С в проопиомеланокортиновых нейронах и дугообразном ядре. Это обусловливает высвобождение альфа-меланокортинстимулирующего гормона (α-MSH), который действует на рецепторы меланокортина 4 в паравентрикулярных ядрах и приводит к подавлению аппетита [26, 27]. Существует 14 подтипов 5-НТ-рецепторов, каждый из которых имеет различную активность. 5-НТ2С тесно связан с рецепторами 5-HT2A и 5-HT2B (рис. 5) [28]. Сродство лоркасерина гидрохлорида к рецептору 5-НТ2С примерно в 15 раз больше его сродства к 5-НТ2А и в 100 раз больше – к 5-НТ2В [29]. Аффинность связывания зависит от дозы препарата. При максимальной дозировке (20 мг/сут) связывание становится менее селективным для 5-НТ2С, то есть больше препарата связывается с другими серотониновыми рецепторами, такими, например, как 5-HT2A [30].
Побочные эффекты Belviq®: тревожные или депрессивные состояния, нарушение зрения, суставные и мышечные боли, ознобы, утомляемость, нарушение сознания, боли в области малого таза, затруднения дыхания.
Contrave® (Naltrexon/Bupropion)
Препарат Contrave® (Naltrexon/Bupropion), утвержденный FDA в сентябре 2014 года, является разработкой биофармацевтической компании Orexigen Therapeutics, Inc. (США) и компании Takeda Pharmaceuticals America. Он представляет собой комбинацию опиоидного антагониста налтрексона с химической формулой (5α)-17-(циклопропилметил)- -4,5-эпокси‑3,14-дигидроксиморфинан‑6-он и аминокетонового антидепрессанта бупропиона с химической формулой (±)-2-(трет-Бутиламин)-1-(3-хлорфенил) пропан‑1-он.
Налтрексон – антагонист опиоидных рецепторов, который был синтезирован в 1965 г., а затем одобрен FDA в качестве монотерапии при лечении опиоидной зависимости (1984). Бупропион – ингибитор обратного захвата дофамина и НЭ, который использовался в основном при терапии депрессии и в качестве вспомогательного средства для прекращения курения.
Каждая таблетка содержит 8 мг налтрексона и 90 мг бупропиона. Дозировка заключается в титровании препарата в течение 4 нед.
Механизм действия Contrave®
Точный нейрохимический механизм влияния комбинации налтрексона/бупропиона, которая приводит к потере веса, полностью не установлен [31]. Однако данные доклинических исследований показали, что указанное соединение работает синергически [32, 33]. Проопиомеланокортин (РОМС), находящийся в дугообразном ядре гипоталамуса, продуцирует эндогенные опиоиды, такие как α-MSH и β-эндорфин [34, 35]. α-MSH активирует рецепторы меланокортина 4, что приводит к снижению потребления пищи, увеличению расхода энергии и потере веса [36, 37]. β-эндорфин снижает клеточную активность РОМС при связывании с μ-опиоидным рецептором (MOP-R) [38]. Бупропион способствует образованию клеточного РОМС и высвобождению β-эндорфина [39]. Налтрексон, опиоидный антагонист, блокирует MOP-R и нарушает β-эндорфиновое ингибирование обратной связи клетками РОМС (рис. 6). Комбинация налтрексон/бупропион усиливает сигнальный эффект РОМС значительно больше, чем при использовании их в отдельности. Доклинические исследования, проведенные на мышах, подверженных голоданию, показали, что прямое введение налтрексона и бупропиона в вентральную область мезолимбического тракта способствует уменьшению потребления пищи. Это выражалось сильнее при использовании комбинации препаратов. Предполагается, что налтрексон и бупропион имеют независимые, но синергичные механизмы действия [40].
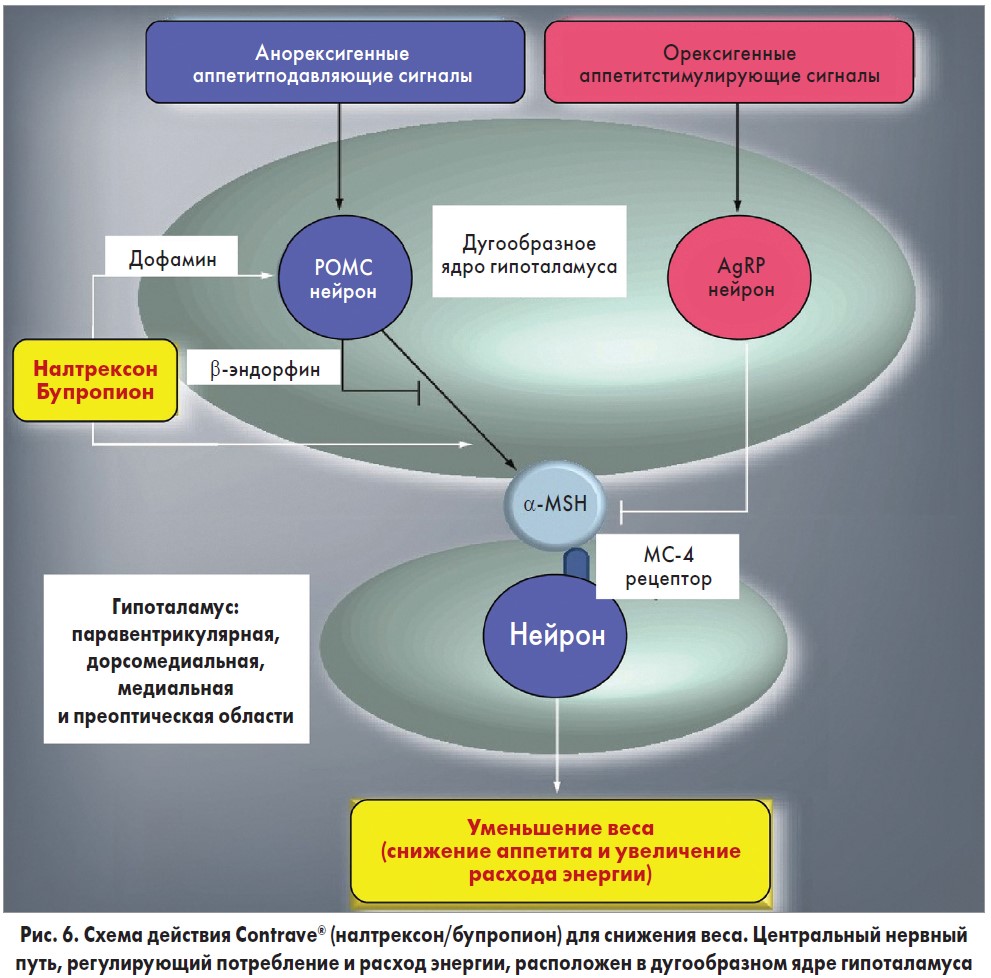
Побочные эффекты Contrave®: тошнота, запор, диарея, головная боль.
Saxenda® (лираглутид)
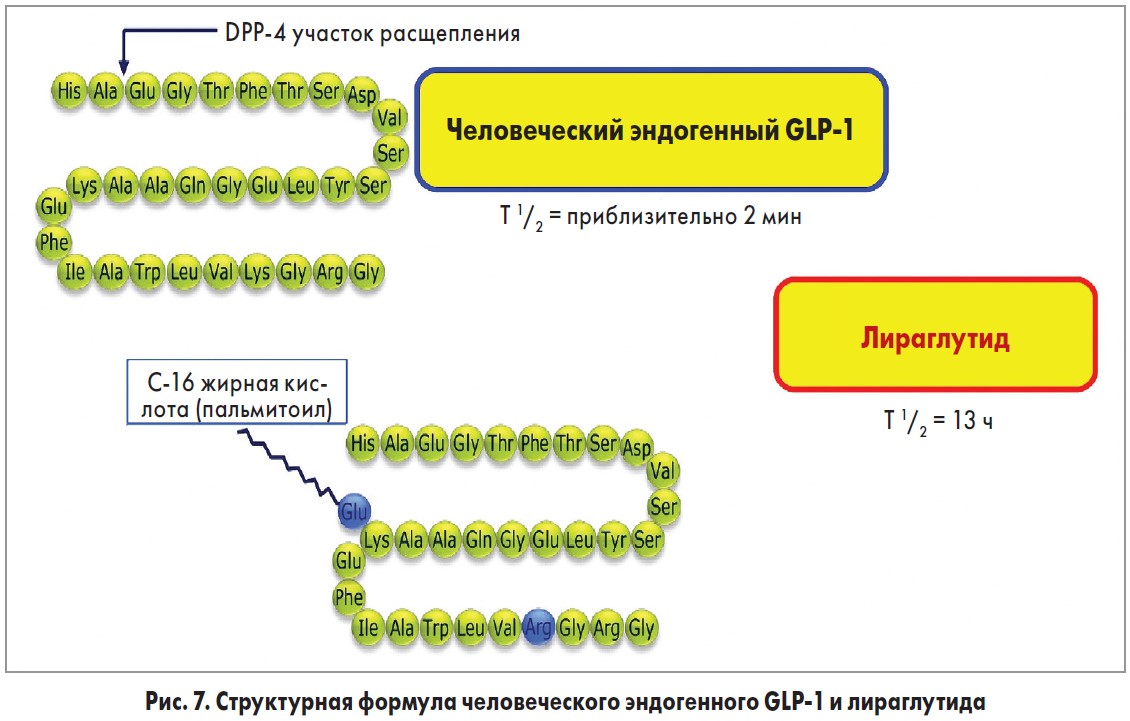
Saxenda® (лираглутид) разработан компанией Novo Nordisk (Дания) и утвержден FDA 23 декабря 2014 года. Лекарственное средство содержит лираглутид, аналог человеческого глюкагоноподобного пептида‑1 (GLP‑1), и действует как агонист рецептора GLP‑1. Способ получения заключается во внедрении рекомбинантной ДНК в штамм дрожжей Saccharomyces cerevisiae. Гомологичность составляет 97% с природным человеческим GLP‑1. Отличие лираглутида от нативного GLP‑1 состоит в замене аминокислоты лизина на аргинин в положении 34 и присоединении C‑16 жирной кислоты (пальмитиновой) с «прокладкой» в виде глутаминовой кислоты на оставшемся остатке лизина в положении 26 пептидного предшественника (рис. 7). Связываясь с рецепторами GLP‑1, лираглутид стимулирует секрецию инсулина, подавляет выработку глюкагона, тормозит моторику желудка и стимулирует центр насыщения гипоталамуса.
Препарат Saxenda® представляет собой шприц-ручку с регулируемой концентрацией лираглутида от 0,6 до 3,0 мг для подкожных инъекций. Предварительно заполненная ручка содержит 3 мл раствора, эквивалентного 18 мг лираглутида. Терапевтическая доза для лечения ожирения составляет 3,0 мг/день. Увеличивать ее рекомендуется постепенно (стартовая – 0,6 мг/сут, еженедельно на 0,6 мг). Лечение Saxenda® следует прекратить через 12 нед при дозе 3,0 мг/день, если пациент не уменьшил свой вес по крайней мере на 5% от первоначального.
Клинические испытания Saxenda® показали, что прием препарата в дозе 3 мг/сут способствует снижению веса на 5% у 50% пациентов и на 10% – у 22% больных.
Механизм действия Saxenda®
 GLP‑1 образуется в результате синтеза препроглюкагона и последующего его расщепления на биологически активные формы – GLP‑1 (1-36), который составляет приблизительно 80% циркулирующего GLP‑1, и GLP‑1 (1-37) [41, 42]. Эндогенный GLP‑1 секретируется из эндокринных L-клеток слизистой оболочки кишечника в ответ на присутствие питательных веществ в просвете кишечника и действует через связанный с G-белком мембранный рецептор (GLP‑1R). В циркуляторном русле период полураспада GLP‑1 составляет менее 2 мин из-за его быстрого расщепления ферментом дипептидилпептидазой-IV и нейтральными эндопептидазами [43, 44]. В отличие от человеческого GLP‑1, лираглутид устойчив к метаболической деградации под воздействием обеих пептидаз и имеет период полураспада в плазме 13 ч после подкожного введения.
GLP‑1 образуется в результате синтеза препроглюкагона и последующего его расщепления на биологически активные формы – GLP‑1 (1-36), который составляет приблизительно 80% циркулирующего GLP‑1, и GLP‑1 (1-37) [41, 42]. Эндогенный GLP‑1 секретируется из эндокринных L-клеток слизистой оболочки кишечника в ответ на присутствие питательных веществ в просвете кишечника и действует через связанный с G-белком мембранный рецептор (GLP‑1R). В циркуляторном русле период полураспада GLP‑1 составляет менее 2 мин из-за его быстрого расщепления ферментом дипептидилпептидазой-IV и нейтральными эндопептидазами [43, 44]. В отличие от человеческого GLP‑1, лираглутид устойчив к метаболической деградации под воздействием обеих пептидаз и имеет период полураспада в плазме 13 ч после подкожного введения.
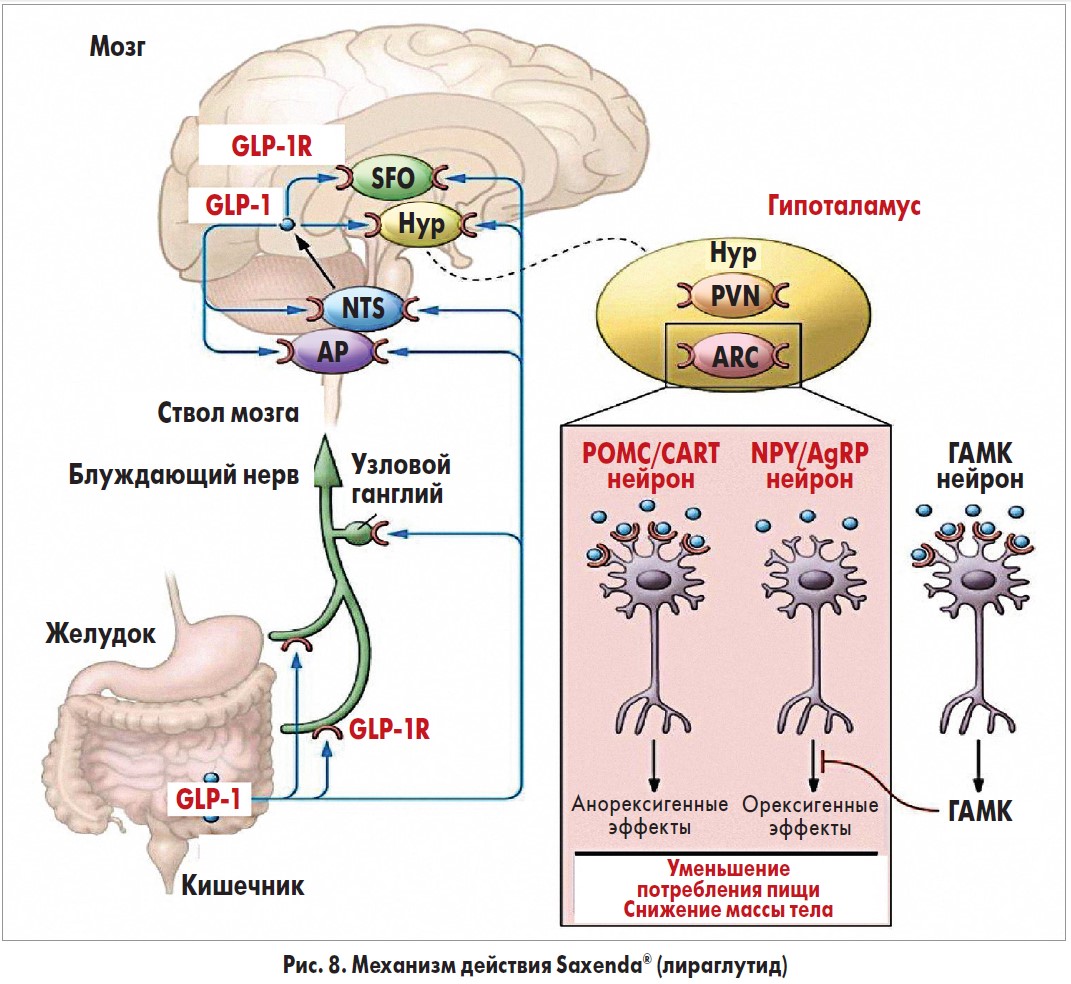
GLP‑1 классифицируется как инкретиновый гормон (INCRETIN – INestinal seCRETion of INsulin), поскольку он стимулирует снижение уровня глюкозы в крови за счет увеличения количества инсулина, выделяемого β-клетками поджелудочной железы. Механизм, посредством которого GLP‑1 регулирует аппетит, опосредуется как через периферическую нервную систему, так и через ЦНС. Важным эффектом GLP‑1 является замедление опорожнения желудка: таким образом усиливается чувство его наполнения и, следовательно, насыщения. В исследованиях на животных GLP‑1 напрямую стимулировал POMK/CART-нейроны и косвенно ингибировал экспрессию нейропептида Y и агути-подобного белка через ГАМК-зависимую сигнализацию (рис. 8). Эти данные могут свидетельствовать о том, что рецепторы GLP‑1 на POMK/CART-нейронах опосредуют снижение массы тела, индуцируемое лираглутидом. Несмотря на то что на животных моделях действие лираглутида изучено хорошо, в гипоталамусе человека вышеуказанные процессы продемонстрировать сложнее. Поэтому вопрос о том, как именно лираглутид модулирует нейрональную активность гипоталамуса, продолжает оставаться предметом научных исследований. Применение Saxenda® на базе активного ингредиента лираглутида помогает снизить вес благодаря уменьшению темпов всасывания пищи в желудке (подавление аппетита на 15-20%).
Побочные эффекты Saxenda®: тошнота, рвотные позывы, боли в эпигастрии, нарушение ритма дефекации, быстрая утомляемость.
Выводы
1. В настоящее время лекарственными средствами для лечения ожирения, одобренными FDA, являются: Xenical® (Roche Pharmaceuticals, Швейцария), Qsymia® (Vivus Inc., США), Belviq® (Eisai Co. Ltd., Япония), Contrave® (Takeda Pharmaceuticals America), Saxenda® (Novo Nordisk, Дания).
2. Согласно требованиям FDA, новые препараты должны способствовать уменьшению массы тела в среднем на 5%.
3. Медикаментозная терапия назначается в том случае, если в течение 6 мес на фоне коррекции веса с помощью диеты и физических нагрузок масса тела не снижается на 5-10%.
4. Хорошим целевым эффектом препаратов от ожирения считается уменьшение массы тела на 3-10% в течение 6 мес и последующее ее удержание на этом уровне.
5. Перед пациентом врачу-клиницисту необходимо ставить реалистичные цели:
- потеря веса до 10% от исходного;
- снижение массы тела на 3-5% от исходной при наличии у больного факторов риска (артериальная гипертензия, гиперлипидемия и гипергликемия).
Нереалистичные цели способствуют нарушению диеты, отказу от выполняемых рекомендаций, возвращению к привычному образу жизни и последующему увеличению веса.
Список литературы находится в редакции.