1 лютого, 2019
Використання інсуліну гларгін 300 ОД/мл та інсуліну деглюдек 100 ОД/мл у пацієнтів із цукровим діабетом 2 типу, які раніше не отримували інсулін: більше спільного, ніж відмінного
За результатами рандомізованого прямого порівняльного дослідження BRIGHT
Аналоги базального інсуліну тривалої дії мають значні переваги в застосуванні у хворих на цукровий діабет (ЦД), оскільки на відміну від інсуліну NPH (Neutral Protamine Hagedorn – нейтральный протамін Хагедорна, ізофан-інсулін НПХ) характеризуються більш тривалим ефектом, більш сприятливим фармакокінетичним профілем і забезпечують менші добові коливання рівня глікемії, зменшують ймовірність розвитку гіпоглікемій. Аналоги базальних інсулінів покращують результати лікування пацієнтів із ЦД 2 типу. Вони дають змогу легше досягати цільових показників глікемії, при цьому ймовірність її виникнення є мінімальною. Сьогодні аналоги базальних інсулінів все частіше використовуються не лише ендокринологами, а й лікарями загальної практики.
Пошук препаратів з оптимальними фармакокінетичними та фармакодинамічними характеристиками сприяв створенню другого покоління аналогів базального інсуліну тривалої дії, таких як інсулін деглюдек 100 ОД/мл (IDeg‑100) та інсулін гларгін 300 ОД/мл (Gla‑300), які забезпечують стабільність рівня глюкози крові протягом доби. У клінічних дослідженнях BEGIN та EDITION було показано, що IDeg‑100 та Gla‑300 знижують рівень глікованого гемоглобіну (HbA1с) так само, як і Gla‑100. При цьому використання цих препаратів у пацієнтів із ЦД 2 типу рідко викликало розвиток гіпоглікемії. До сьогодні прямі клінічні порівняння IDeg‑100 та Gla‑300 були відсутні.
У цьому огляді ми повідомляємо про результати першого прямого рандомізованого дослідження BRIGHT, метою якого було порівняння ефективності та безпеки Gla‑300 та IDeg‑100 саме в тих пацієнтів із ЦД 2 типу, в яких не було досягнуто адекватного контролю глікемії при використанні пероральних засобів або агоністів рецепторів глюкагоноподібного пептиду 1 (GLP‑1).
Дизайн та методи дослідження
Дослідження BRIGHT (reg. № NCT02738151, ClinicalTrials.gov) – це мультицентрове (у 158 містах 16 країн) відкрите рандомізоване активно контрольоване дослідження в паралельних групах хворих із неконтрольованим ЦД 2 типу (HbA1c ≥7,5% [≥58 ммоль/моль] та ≤10,5% [≤91 ммоль/моль] при скринінгу), які приймають пероральні цукрознижувальні засоби, у тому числі інгібітори натрій-глюкозного контранспортера 2 типу (SGLT2) або агоністи GLP‑1.
До критеріїв виключення були віднесені поточне чи попереднє використання інсуліну, нових цукрознижувальних засобів та/або препаратів для схуднення протягом останніх 3 міс перед скринінгом, індекс маси тіла <25 кг/м2 або >40 кг/м2, кінцева стадія ниркової недостатності, будь-які протипоказання до використання IDeg‑100 чи Gla‑300, гіперчутливість в анамнезі до активних компонентів чи допоміжних речовин IDeg‑100 чи Gla‑300.
Рандомізація та лікування
Учасників дослідження було рандомізовано на 2 групи, 1-ша отримувала Gla‑300, 2-га – IDeg‑100. Пацієнти були розподілені за рівнем HbA1c (<8% чи >8%), використанням препаратів сульфонілсечовини та глінідів (чи приймає пацієнт цей препарат) на момент скринінгу. Gla‑300 та IDeg‑100 застосовувалися пацієнтами самостійно шляхом підшкірних ін’єкцій 1 раз на добу в проміжку від 18:00 до 20:00. Початкова доза препарату призначалася згідно з інструкцією та становила 0,2 ОД/кг для Gla‑300 та 10 ОД для IDeg‑100, а в подальшому корегувалася до досягнення цільових значень глікемії згідно зі стандартним алгоритмом титрування дози. Дозу коригували принаймні щотижня, але не частіше ніж кожні 3 дні до досягнення цільового рівня глюкози плазми крові 80-100 мг/дл (за результатами самостійного вимірювання), уникаючи розвитку гіпоглікемії.
«Активний» період титрування дози становив 12 тиж, метою якого було досягнення цільового значення глюкози крові натще. Протягом ще 13-24 тиж дозволялося титрувати дозу за нагальної потреби. Корекція дози (-2,0, +2, +4 або +6 ОД) залежала від середнього рівня глюкози натще протягом трьох останніх вимірів. Основна терапія протягом дослідження змінювалася лише тоді, коли поставало питання щодо безпеки лікування або виникала необхідність зниження дози чи припинення лікування.
Кінцеві точки дослідження
Передусім оцінювалася зміна HbA1c з початку терапії до 24-го тиж лікування, далі: зміна рівня глюкози плазми натще та глюкози плазми натще, виміряної самостійно; показників 8-разового вимірювання глюкози вдома протягом періоду лікування; частка учасників дослідження, які досягли цільового значення HbA1c <7,0% (<53 ммоль/моль) до 24-го тиж; частка учасників, які досягли цільового значення HbA1c <7,0% (<53 ммоль/моль) до 24-го тиж без підтверджених гіпоглікемій (≤70 мг/дл та <54 мг/дл) протягом 24 тиж лікування.
Вивчення безпеки включало наявність і частоту розвитку гіпоглікемій протягом 24 тиж лікування, у тому числі під час активного періоду титрування дози (0-12 тиж) та під час підтримувального періоду (13-24 тиж). Документована симптоматична гіпоглікемія супроводжувалася характерними симптомами та підтвердженим низьким рівнем глюкози крові (≤70 мг/дл або <54 мг/дл). Тяжкою гіпоглікемія вважалася тоді, коли стан хворого потребував дій від іншої людини у вигляді допомоги у вживанні вуглеводів, застосуванні глюкагону чи проведенні реанімаційних заходів. Підтверджена гіпоглікемія включала задокументовані симптоматичні чи безсимптомні гіпоглікемії (≤70 мг/дл або <54 мг/дл) та тяжкі стани, якщо такі виникали. Гіпоглікемія, що виникала з 00:00 до 05:59, вважалася нічною. Також вивчали зміну ваги тіла та розвиток побічних реакцій.
Результати
Початкові характеристики
Пацієнтів (n=929) було рандомізовано на 2 групи: 1-ша (n=466) отримувала Gla‑300, 2-га (n=463) – IDeg‑100. Загалом 99,5% учасників дослідження отримали лікування частково, а 94,2% – завершили 24-тижневий курс терапії. На початку дослідження найчастішими гіпоглікемічними препаратами були метформін (91,5%) і похідні сульфонілсечовини (65,7%) (табл.).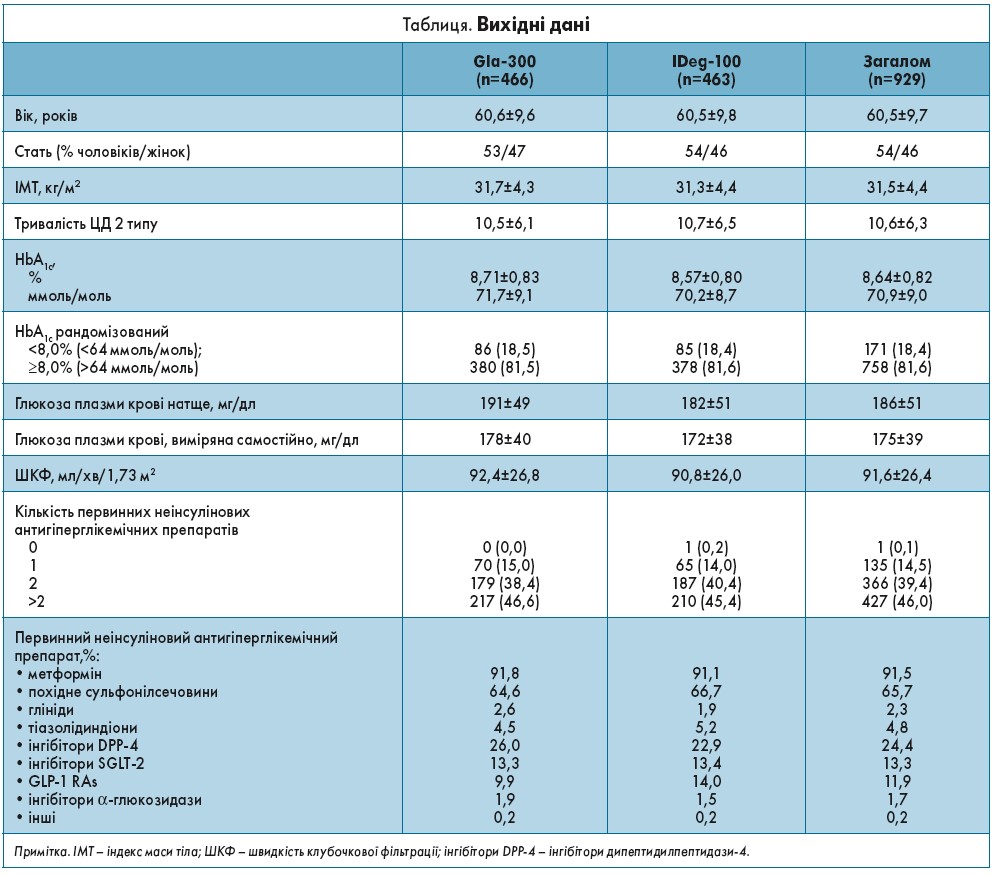
Глікемічний контроль
Середній HbA1c (± середнє відхилення, СВ) на початку дослідження становив у 1-й та 2-й групах 8,7±0,8% (72±9 ммоль/моль) та 8,6±0,8% (70±9 ммоль/моль) відповідно. До 24-го тиж цей показник знизився до 7,0±0,8% (53±9 ммоль/моль) та 7,0±0,8% (53±8 ммоль/моль) відповідно.
Кількість учасників дослідження, які досягли значення HbA1c <7,0% (<53 ммоль/моль) та HbA1c <7,0% (<53 ммоль/моль) без підтвердженої гіпоглікемії (глюкоза плазми ≤70 мг/дл або <54 мг/дл) у будь-який час дня (протягом 24 год) чи тижня, були схожі в обох групах.
Гіпоглікемія
Гіпоглікемія в будь-який час протягом доби
Випадок підтвердженої гіпоглікемії (≤70 мг/дл) в будь-який час протягом доби (за 24 год) за 24 тиж лікування спостерігався майже з однаковою частотою в обох групах (у 66,5 та 69% відповідно; відношення шансів (ВШ) 0,88; 95% ДІ 0,66-1,17). Також не було різниці в лікуванні випадків гіпоглікемії з рівнем глюкози <54 мг/дл. У хворих, які на момент скринінгу отримували похідні сульфонілсечовини чи глініди, була вищою ймовірність розвитку гіпоглікемії, ніж у пацієнтів, які не приймали ці препарати. Незважаючи на це, не було зафіксовано коливань лікувальних ефектів у хворих, які отримували похідні сульфонілсечовини та глініди, відносно частоти підтвердженої гіпоглікемії (≤70 мг/дл та <54 мг/дл). Кількість випадків підтвердженої гіпоглікемії (≤70 мг/дл) в будь-який час доби протягом 24 тиж лікування була зіставною в разі застосування Gla‑300 та IDeg‑100 та визначалася з частотою 9,3 та 10,8 випадки на пацієнто-рік відповідно (відношення ризиків (ВР) 0,86; 95% ДІ 0,71-1,04). Порівнювалася кількість підтверджених випадків гіпоглікемії (<54 мг/дл) при використанні Gla‑300 та IDeg‑100 (0,6 проти 0,9 випадки на пацієнто-рік; ВР 0,69 [95% ДI 0,45-1,08]). Згідно з отриманими результатами при використанні Gla‑300 гіпоглікемії виникали рідше.
Протягом перших 12 тиж лікування кількість підтверджених випадків гіпоглікемії в групі Gla‑300 була меншою, ніж у групі IDeg‑100. Протягом 13-24 тиж лікування частота гіпоглікемій була однакова в обох групах.
Задокументована симптоматична гіпоглікемія в будь-який час доби протягом перших 12 тиж лікування в групі Gla‑300 також визначалася рідше.
Нічна гіпоглікемія (з 00:00 до 05:59)
Частота випадків підтвердженої нічної гіпоглікемії протягом 24 тиж лікування була схожою в обох групах лікування (28,6% при використанні Gla‑300 та 28,8% – IDeg‑100; ВШ 0,99; 95% ДI 0,74-1,32). Гіпоглікемія з рівнем <54 мг/дл визначалася з однаковою частотою в обох групах. Частота випадків підтвердженої нічної гіпоглікемії (≤70 мг/дл) протягом 24 тиж лікування Gla‑300 та IDeg‑100 становила 1,8 та 2,3 випадки на пацієнто-рік відповідно (ВР 0,81; 95% ДI 0,58-1,12), тобто значуще не відрізнялася в обох групах.
Протягом перших 12 тиж частота підтвердженої нічної гіпоглікемії (≤70 мг/дл) була нижча на тлі використання Gla‑300, якщо порівняти з IDeg (1,4 та 2,2 випадки на пацієнто-рік відповідно; ВР 0,65 [95% ДI 0,43-0,98]). При цьому частота гіпоглікемій <54 мг/дл була однакова в обох групах. Для задокументованої нічної симптоматичної гіпоглікемії були отримані схожі результати.
Тяжка гіпоглікемія
Загалом протягом 24 тиж дослідження лише в одного учасника (жінка, 49 років, яка лікувалася метформіном) виникла тяжка гіпоглікемія. Цей випадок був зафіксований у групі Gla‑300 протягом 13-24 тижнів. Це було пов’язано з пропуском вечері та відсутністю корекції дози інсуліну після нетяжкої гіпоглікемії, яка виникла на 2 дні раніше.
Доза інсуліну
Середня добова доза інсуліну становила 16,9±4,4 одиниці (0,19±0,04 ОД/кг) у групі Gla‑300 та 10,2±1,9 одиниці (0,12±0,04 ОД/кг) у групі IDeg‑100. На 24-й тиж середня добова доза становила 50,5±25,6 одиниці (0,54±0,26 ОД/кг) у групі Gla‑300 та 39,2±23,3 одиниці (0,43±0,24 ОД/кг) у групі IDeg‑100. Середня доза зросла від початку до 24-го тиж дослідження на 33,6±24,4 одиниці (0,36±0,25 ОД/кг) та на 29,1±23,3 одиниці (0,31±0,24 ОД/кг) для Gla‑300 та IDeg‑100 відповідно.
Маса тіла
Середня вага тіла учасників зросла з початку дослідження (90,6±16,1 та 88,7±15,9 кг у групі Gla‑300 та групі IDeg‑100 відповідно) до 24-го тиж (92,5±16,6 та 91,4±16,7 кг), абсолютний приріст ваги становив 2,0±3,8 кг у групі Gla‑300 та 2,3±3,6 кг у групі IDeg‑100.
Побічні реакції
Загалом 202 (43,7%) пацієнти та 221 (47,8%) учасник у групах Gla‑300 та IDeg‑100 відповідно повідомили про розвиток побічних реакцій протягом 24 тиж досліджень. Про серйозні побічні реакції повідомили 21 (4,5%) хворий та 20 (4,3%) учасників відповідно. 4 (0,9%) пацієнти в групі Gla‑300 та 5 (1,1%) пацієнтів у групі IDeg‑100 повідомили про побічні дії, які призвели до припинення використання досліджуваних препаратів. Один смертельний випадок було зареєстровано в групі Gla‑300, він був пов’язаний з аденокарциномою товстого кишечника. Місцеві побічні реакції на ін’єкцію виникли в 1,7% (n=8) та 1,3% (n=6) пацієнтів у групах Gla‑300 та IDeg‑100 відповідно.
Висновки
Сьогодні в основі прямого порівняння Gla‑300 та IDeg‑100 знаходяться результати досліджень фармакодинаміки та фармакокінетики зазначених препаратів у випадку ЦД 1 типу та отриманих у ході непрямих метааналізів. BRIGHT – це перше пряме порівняльне дослідження клінічної ефективності й безпеки двох аналогів базального інсуліну тривалої дії другого покоління у хворих на ЦД 2 типу. У дослідженій популяції, в якій пацієнти раніше не отримували інсулінотерапію та мали неконтрольований тривалий перебіг ЦД 2 типу, а також приймали декілька пероральних гіпоглікемічних засобів, з або без GLP‑1, використання Gla‑300 було подібним до такого IDeg‑100 щодо зниження вихідного HbA1c з 8,6 до 7,0% за 24 тижні. Більше того, майже однакова кількість учасників в обох групах досягла цільового значення HbA1c без розвитку підтвердженої гіпоглікемії. Остання розвивалася рідко, хоча дещо частіше, ніж у дослідженні EDITION (де, на відміну від BRIGHT, прийом похідних сульфонілсечовини та глінідів на період експерименту припинявся). Найбільш значущим фактом є те, що за 24 тиж виник лише один випадок тяжкої гіпоглікемії, що підтверджує безпеку обох базальних інсулінів тривалої дії, використання яких може забезпечити досягнення цільового рівня глікемії за умови правильного призначення й титрування препаратів.
На кінець дослідження значення глюкози плазми крові натще було майже однаковим в обох групах. Глюкоза плазми крові натще, виміряна самостійно, на початку дослідження була вищою в групі Gla‑300, але знизилася майже до такого ж рівня, що й у групі IDeg‑100, при цьому в кінці дослідження не було різниці між пацієнтами обох груп.
Причини незначної невідповідності між значеннями глюкози плазми крові натще та глюкози плазми крові натще, отриманими при самостійному вимірі, залишаються нез’ясованими, але вони можуть бути відображенням різниці в заборі крові (час, відношення до їжі) для цих двох досліджень. Крім цього, результати рівня глюкози плазми крові натще, отримані при самостійному вимірюванні пацієнтами, можуть мати більше клінічне значення, оскільки на їх основі проводиться титрування дози інсуліну. Проте ці дані узгоджуються з результатами метааналізу (який порівнював програми досліджень EDITION та BEGIN), згідно з якими виникала невідповідність між зміною рівня глюкози плазми натще (FPG, plasma fasting glucose) та глюкози плазми натще при самостійному вимірі (SMPG, Self-measured plasma glucose) при використанні Gla‑300 та IDeg‑100 відносно Gla‑100.
Варто зауважити, що добова варіабельність глікемії (оцінена на основі 8-разового самостійного виміру глюкози плазми крові) в дослідженні BRIGHT була зіставною в групах Gla‑300 та IDeg‑100 на початку дослідження та на момент 24-го тиж, що продемонструвало відсутність різниці при використанні цих препаратів. Зміна варіабельності глікемії з початку дослідження до 24-го тиж була мінімальною, що вказує на плавне зниження рівня глікемії при використанні обох базальних інсулінів тривалої дії в пацієнтів із ЦД 2 типу. Необхідне подальше вивчення змін варіабельності глікемії при використанні Gla‑300 та IDeg‑100 у хворих на ЦД 2 типу в клінічній практиці.
Випадки гіпоглікемії виникали з однаковою частотою в досліджуваних групах протягом 24 тиж лікування. Проте підтверджена гіпоглікемія (≤70 та <54 мг/дл) рідше виявлялася в групі Gla‑300, ніж у групі IDeg‑100 протягом початкового періоду титрування дози (0-12 тиж), незважаючи на те що цей період також був часом найбільшого збільшення дози інсуліну та більшого зниження глюкози плазми крові. Протягом 13-24 тиж на тлі незначних змін дози інсуліну підтверджена гіпоглікемія спостерігалася з однаковою частотою в обох групах. Те, що гіпоглікемія в групі Gla‑300 виникала рідше, ніж у групі IDeg‑100, під час інтенсивнішого титрування дози інсуліну, може сприяти впевненості пацієнта в тому, що правильний вибір дози та її корекція значуще зменшують ризик розвитку гіпоглікемії. Необхідні подальші дослідження для оцінки ризику розвитку гіпоглікемій на тлі використання Gla‑300 та IDeg‑100 у хворих із тривалим перебігом ЦД 2 типу, аби побачити, чи відповідатимуть отримані дані результатам цього дослідження.
Менша кількість певних видів гіпоглікемій у групі Gla‑300 проти групи IDeg‑100 може бути відображенням фармакокінетичних і фармакодинамічних відмінностей зазначених препаратів. Незважаючи на обмежену кількість доступних досліджень, вивчення фармакокінетичних і фармакодинамічних особливостей IDeg‑100 вказує на більше зниження рівня глюкози між 8-ю та 12-ю годинами з моменту застосування, ніж при використанні Gla‑300. Призначення цього препарату ввечері може пояснити принаймні дещо частіший розвиток нічної гіпоглікемії на тлі його застосування, ніж при використанні IDeg, що спостерігалося в цьому дослідженні. Проте існує необхідність детальнішого вивчення фармакокінетики та фармакодинаміки Gla‑300 та IDeg‑100 у хворих на ЦД 2 типу.
Середня початкова доза Gla‑300 була вища на 0,07 ОД/кг, ніж доза IDeg‑100, що відповідало інструкції (0,2 ОД/кг для Gla‑300 та 10 ОД для IDeg‑100), та залишалася вищою протягом дослідження. До 24-го тиж доза Gla‑300 була на 0,11 ОД/кг вища, ніж при використанні IDeg‑100. Ця різниця була очікуваною, позаяк схожі результати були отримані при порівнянні IDeg‑100 та Gla‑100 в дослідженні BEGIN та Gla‑300 і Gla‑100 в дослідженні EDITION. Різниця в дозуванні виникала не через менший потенціал Gla‑300 (інсулін Gla‑300 має такий самий потенціал, як і інсулін короткої дії чи Gla‑100 після внутрішньовенного застосування), а через особливості способу введення. Підшкірне введення потребує більшої дози Gla‑300 для компенсації його меншої біодоступності. Таке пояснення опосередковано пояснює те, що використання дещо більших доз Gla‑300 в дослідженні BRIGHT не збільшило частоту виникнення гіпоглікемій та не позначилося на вазі тіла.
Перевагами зазначеного дослідження є те, що воно є прямим рандомізованим, а в ході його проведення була можливість оцінити значення HbA1c на початку та в кінці. Роботу було проведено ефективно, із систематично правильним титруванням дози інсуліну, а більшість пацієнтів (які на початку мали схожі характеристики) закінчили дослідження. Недоліком можна вважати відкритий дизайн, але цього неможливо було уникнути, оскільки використовувалися ручки аналогів базальних інсулінів, які є специфічними для кожного препарату. Крім того, дослідження тривало лише 24 тиж, а результати подальшого спостереження є не менш важливими.
Це пряме порівняльне дослідження Gla‑300 та IDeg‑100 у хворих на ЦД 2 типу, які раніше не отримували інсулін, показало, що використання обох аналогів базального інсуліну тривалої дії другого покоління було асоційовано зі схожим зниженням HbA1c, покращенням глікемічного профілю та глюкози плазми крові натще, визначеної самостійно. Глікемічний контроль було досягнуто поряд із низькою частотою гіпоглікемій в обох групах. Однак використання Gla‑300 було пов’язано з нижчою частотою виникнення підтвердженої гіпоглікемії в будь-який час доби, ніж використання IDeg‑100 протягом 0-12 тиж, коли відбувалося основне титрування дози інсуліну та виникало найбільш значуще зниження рівня глюкози плазми крові. Gla‑300 асоціювався з нижчою частотою підтвердженої нічної гіпоглікемії під час початкового періоду титрування.
У цілому профіль безпеки Gla‑300 та IDeg‑100 був схожий, оба інсуліни добре переносилися. Це перше дослідження, в якому порівнювався ризик розвитку гіпоглікемії на тлі використання Gla‑300 та IDeg‑100. Треба зазначити, що, оскільки був лише один випадок тяжкої гіпоглікемії, зниження ризику її розвитку не має бути фактором, що впливав би на вибір одного з цих базальних інсулінів тривалої дії в пацієнтів із ЦД 2 типу, які раніше не отримували інсулін. Крім того, між цими аналогами базальних інсулінів другого покоління більше спільного, ніж відмінного. Тому вибір одного з цих препаратів має ґрунтуватися не стільки на оцінці клінічних факторів, скільки на доступності препарату та його вартості.
J. Rosenstock, A. Cheng, R. Ritzel, Z. Bosnyak et al. More Similarities Than Differences Testing Insulin Glargine 300 Units/mL Versus Insulin Degludec 100 Units/mL in Insulin-Naive Type 2 Diabetes: The Randomized Head-to-Head BRIGHT Trial // Diabetes Care 2018;41:2147-2154.
Скорочений переклад з англ. Валерія Палько
Тематичний номер «Діабетологія, Тиреоїдологія, Метаболічні розлади» № 3 (43) жовтень 2018 р.


