2 квітня, 2019
Урогенитальные инфекции: междисциплинарный подход
Под таким названием 2-3 ноября в Киеве состоялся научный симпозиум с международным участием, организованный ГУ «Институт урологии НАМН Украины» и общественной организацией «Всеукраинская ассоциация врачей» под эгидой Министерства здравоохранения и Национальной академии медицинских наук Украины. Участники форума обсудили актуальные темы современной урологии – антибиотикотерапия в условиях возрастающей бактериальной резистентности, альтернативные подходы к лечению и профилактике инфекций мочевыводящих путей (ИМП), урогенитальные инфекции у женщин.

В приветственном слове к участникам симпозиума глава оргкомитета заведующий кафедрой урологии НМУ им. А.А. Богомольца, заведующий отделом воспалительных заболеваний ГУ «Институт урологии НАМН Украины» (г. Киев) доктор медицинских наук, профессор С.П. Пасечников акцентировал внимание на широком представительстве форума. Он отметил, что проблема ИМП является весьма актуальной и хорошо знакомой темой, которая требует междисциплинарного обсуждения с врачами-терапевтами, семейными врачами, акушерами-гинекологами, врачами функциональной и лабораторной диагностики и некоторыми другими специалистами. Именно поэтому организаторами был выбран междисциплинарный формат обсуждения важнейших практических тем.
Актуальность проблемы обусловлена широкой распространенностью ИМП во всем мире. Кроме того, расширение знаний о микробиоме человека сформировало новые вопросы: нужно ли избавляться от бактерий при отсутствии клинических проявлений заболевания; является ли бактериурия признаком патологии; насколько необходимо профилактическое применение антибиотиков при подготовке к хирургическим вмешательствам; какие специалисты должны лечить урогенитальные инфекции; существуют ли альтернативные антибиотикам методы борьбы с инфекционным процессом.
С.П. Пасечников отметил, что нынешний симпозиум призван дать ответы клиницистам на многие из этих вопросов.
 Доклад руководителя клиники урологии, детской урологии и андрологии Гисенского университета им. Юстуса Либиха (Германия) профессора Флориана M.E. Вагенленера (Florian М.Е. Wagenlehner) «Смена парадигм ведения пациентов с острым циститом» представил доктор медицины Жахонгир Ф. Алиджанов.
Доклад руководителя клиники урологии, детской урологии и андрологии Гисенского университета им. Юстуса Либиха (Германия) профессора Флориана M.E. Вагенленера (Florian М.Е. Wagenlehner) «Смена парадигм ведения пациентов с острым циститом» представил доктор медицины Жахонгир Ф. Алиджанов.
В соответствии с определением Европейской ассоциации урологов (EAU), неосложненный цистит рассматривается как острое, спорадическое или рецидивирующее воспаление мочевого пузыря, которое наблюдается у женщин без структурных и функциональных нарушений мочевого тракта, болезней почек и сопутствующих заболеваний, способных привести к более тяжелому исходу. Клинический диагноз неосложненного цистита может быть установлен с высокой вероятностью на основании наличия ирритативных симптомов мочеиспускания (дизурия, частые позывы и ургентность) при отсутствии отделяемого из влагалища или раздражения. Докладчик подробно изложил принцип оценки степени выраженности симптомов острого неосложненного цистита на основании анкеты Acute Cystitis Symptom Score (ACSS).
В последние годы была изменена парадигма стерильности мочи, в связи с чем пересмотрены рекомендации EAU относительно лечения бессимптомной бактериурии. В настоящее время признано, что при обнаружении бессимптомной бактериурии назначение терапии требуется только определенным категориям пациентов: больным при подготовке к урологическим вмешательствам, лицам с неконтролируемым сахарным диабетом и беременным.
С глобальной проблемой роста бактериальной резистентности связано изменение взглядов экспертов на целесообразность лечения неосложненных ИМП, в частности цистита. Докладчик привел результаты исследований, свидетельствующие об эпидемиологических последствиях применения антибиотиков. Использование антибактериальных препаратов приводит к значительному повышению резистентности большинства уропатогенов. В настоящее время считается нецелесообразным применение цефалоспоринов и фторхинолонов в терапии цистита. Они показаны в случаях, когда возбудитель чувствителен только к этим препаратам. Наименее выражены последствия применения так называемых старых антибиотиков – фосфомицина, нитрофурантоина, пивмециллинама. На сегодняшний день лучшим выбором при лечении острого цистита признано назначение фосфомицина в дозе 3 г однократно.
Согласно руководству EAU по ведению пациентов с ИМП, женщинам с острым неосложненным циститом рекомендованы в качестве препаратов первой линии нитрофурантоин 100 мг 2 раза в сутки в течение 5 дней, или фосфомицин 3 г однократно, или пивмециллинам 400 мг 2 раза в сутки в течение 5 дней. Альтернативные схемы лечения могут включать в себя триметоприм-сульфаметоксазол (при уровне резистентности Escherichia coli <20%) 160/800 мг 2 раза в сутки в течение 3 дней, или фторхинолоны, или β-лактамные антибиотики. При этом эксперты EAU отмечают, что к фторхинолонам в некоторых регионах наблюдается высокая устойчивость микроорганизмов, а эффективность β-лактамов ниже, чем других препаратов, что требует пристального наблюдения за состоянием больных. В случаях наличия у пациентки гипертермии, боли в боку, симптомов интоксикации и прочих следует рассмотреть альтернативный диагноз (пиелонефрит или осложненная ИМП) и назначить соответствующее лечение.
Учитывая проблемы, возникающие при применении антибиотиков, некоторыми исследователями начато изучение эффективности противовоспалительных препаратов в купировании симптомов острого неосложненного цистита. В докладе представлены результаты исследований (Gágyor I. et al., 2015; Bleidorn J. et al., 2016), в которых сравнивали эффективность ибупрофена (400 мг 3 раза в сутки) и фосфомицина (3 г однократно).
Многими специалистами в качестве альтернативного варианта лечения неосложненных ИМП рассматривается фитотерапия. В исследовании (Stange R. et al., 2017), организованном с целью сравнения эффективности комбинированного лекарственного средства растительного происхождения (трава настурции – Tropaeoli majoris и корень хрена обыкновенного – Armoraciae rusticanae) и антибиотика ко-тримоксазола при остром неосложненном цистите, была продемонстрирована сопоставимая эффективность исследуемых препаратов.
В течение многих лет в качестве эффективного средства при лечении неосложненного цистита зарекомендовал себя фитониринговый препарат Канефрон® Н (компания «Бионорика СЕ», Германия). Этот препарат содержит траву золототысячника, корень любистка и листья розмарина в равных пропорциях. Его действующее вещество представляет собой специальный экстракт BNO 1040, стандартизированный по содержанию ключевых биологически активных веществ входящих в его состав лекарственных растений.
Преимущества Канефрона Н по сравнению с антибиотиками доказаны в ряде исследований. Так, в эксперименте A. Gessner (2016) с использованием мышиных моделей продемонстрировано, что в отличие от фосфомицина и нитрофурантоина Канефрон® Н не влияет на состав кишечной микрофлоры даже при десятикратном превышении дозы.
Противовоспалительный эффект Канефрона Н обусловлен свойством экстракта BNO 2103 в зависимости от концентрации ингибировать синтез простагландина E2, а также выделение макрофагами провоспалительных цитокинов – интерлейкинов ИЛ‑1β и ИЛ‑6. Кроме того, это соединение блокирует неспецифическую активацию комплемента и липоксигеназы с последующим угнетением синтеза лейкотриенов. В эксперименте in vivo было показано, что экстракт BNO 2103 способствует существенному снижению чувствительности к боли вследствие циклофосфамид-индуцированного цистита даже в самой низкой тестируемой дозе. Также доказано (Бреннельс и соавт., 2012) наличие спазмолитического действия препарата Канефрон® Н на сократимость изолированного мочевого пузыря. На сегодняшний день в исследованиях in vitro и in vivo доказан антиадгезивный эффект Канефрона Н. Так, снижение адгезии E. coli к клеткам мочевого пузыря на 61% под воздействием этого препарата было продемонстрировано в исследовании
in vitro (Кюнсте и соавт., 2013).
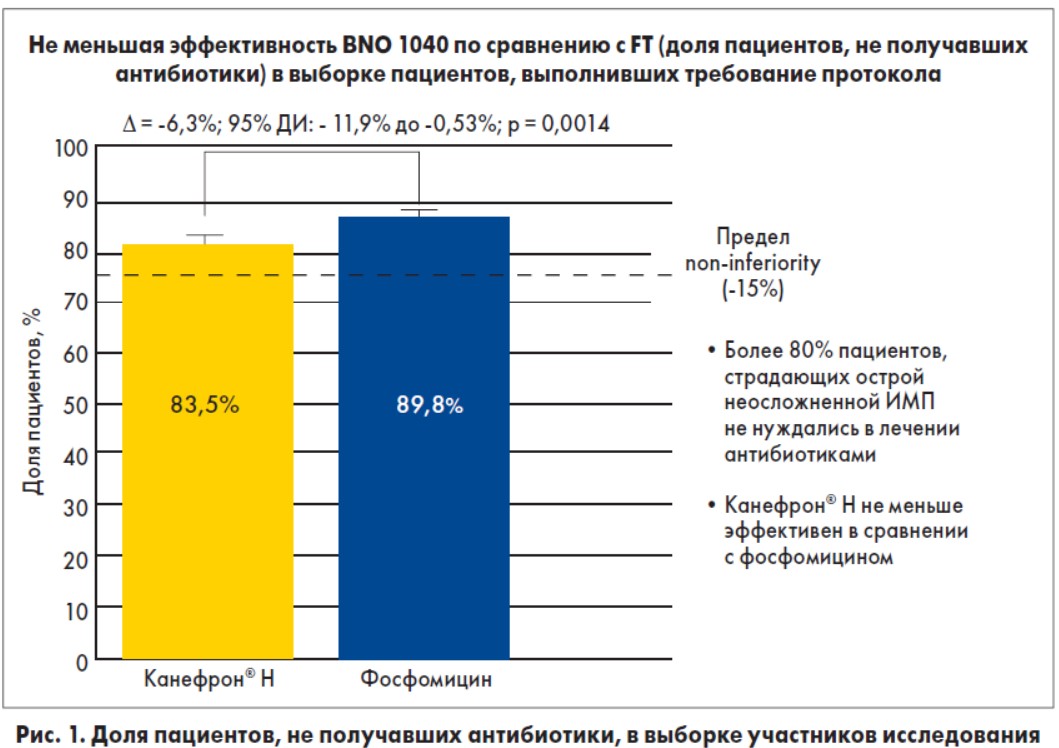
Далее в докладе были представлены результаты рандомизированного контролируемого двойного слепого мультицентрового международного исследования Can UTI‑7, в котором сравнивали эффективность применения Канефрона Н и фосфомицина трометамола у пациенток с острой неосложненной ИМП (рис. 1). В исследование вошли женщины (n=659) в возрасте 18-70 лет с типичными симптомами впервые диагностированного острого цистита и суммой >6 баллов оценки трех основных симптомов ИМП (дизурия, поллакиурия, ургентные позывы к мочеиспусканию). В соответствии с дизайном исследования пациентки группы Канефрона Н (n=325) получали в течение 7 дней данный препарат и одну дозу плацебо фосфомицина; участницы группы фосфомицина (n=334) принимали антибиотик (3 г) однократно и плацебо, имитирующее Канефрон® Н, на протяжении 7 дней. С целью определения наличия рецидива контрольное обследование проводили через 30 дней после даты последнего приема препаратов (38-й день). В качестве первичной конечной точки определяли долю пациентов, дополнительно получавших антибиотики для лечения острых неосложненных ИМП на протяжении исследования (1-38-й дни). Вторичные конечные точки включали оценку согласно анкете ACSS на 4-й, 8-й и 38-й день; наличие бактериурии и лейкоцитурии, подтвержденных бактериальным посевом мочи при каждом визите.
Согласно полученным результатам, 83,5% пациентов в группе Канефрона Н и 89,8% – в группе фосфомицина трометамола не получали дополнительной антибиотикотерапии. Таким образом, при лечении острого неосложненного цистита Канефрон® Н был не менее эффективным, чем антибиотик, с 6,3% пределом не меньшей эффективности (non-inferiority) при возможных 15%. Результаты опроса по шкале ACSS показали тенденцию к снижению тяжести симптомов цистита, а также повышение качества жизни на фоне терапии Канефроном Н. Эти результаты были сопоставимы с аналогичными показателями у пациентов, лечившихся фосфомицином. Снижение среднего балла выраженности симптомов инфекции на 4-й день было несколько выше в группе фосфомицина, но сопоставимым в конце лечения и на протяжении дальнейшего наблюдения. Частота побочных эффектов была сопоставимой в обеих группах: 15,1% при приеме Канефрона Н и 12,9% – при приеме фосфомицина трометамола. Нежелательные явления главным образом были обусловлены нарушениями со стороны желудочно-кишечного тракта (диарея, тошнота, боль в животе). При этом отмечено, что гастроинтестинальные расстройства реже наблюдались в группе Канефрона Н (4%) по сравнению с антибиотиком (6,6%). Исследователи пришли к выводу, что Канефрон® Н является эффективной альтернативой антибиотикам в лечении острого неосложненного цистита (уровень доказательности 1b). Его применение может способствовать значительному уменьшению использования антибиотиков в амбулаторных условиях.
Подводя итог вышеизложенному, Ж.Ф. Алиджанов подчеркнул, что антибактериальная терапия остается рекомендуемой опцией лечения ИМП, однако следует взвешенно подходить к выбору препарата при неосложненном течении заболевания. Таким образом, фитотерапия является эффективным альтернативным вариантом лечения, способствующим предупреждению роста антибиотикорезистентности.
 Ректор государственного учреждения образования «Белорусская медицинская академия последипломного образования» (г. Минск), доктор медицинских наук, профессор Д.М. Ниткин в своем выступлении подробно остановился на теме уросепсиса.
Ректор государственного учреждения образования «Белорусская медицинская академия последипломного образования» (г. Минск), доктор медицинских наук, профессор Д.М. Ниткин в своем выступлении подробно остановился на теме уросепсиса.
Согласно определению EAU, уросепсис – это угрожающая жизни полиорганная недостаточность, вызванная неуправляемым ответом хозяина на инфекцию, исходящую из мочевого тракта и/или мужских половых органов.
Факторы риска развития уросепсиса:
- неадекватное ведение больных пиелонефритом, острым простатитом, эпидидимитом и пр.;
- нерациональная антибиотикотерапия;
- нарушение уродинамики (мочекаменная болезнь, аномалии развития мочевыводящих путей);
- эндоскопические манипуляции;
- инфекции, обусловленные формированием биопленок («биофильм-инфекция», госпитальная инфекция);
- иммунодефицитные состояния;
- химиотерапия;
- прием кортикостероидов;
- состояние после трансплантации органов;
- сопутствующие заболевания (сахарный диабет);
- пожилой возраст.
Следует учитывать, что пациент может перейти из относительно безопасного состояния (например, бактериурии) к тяжелому сепсису в сравнительно короткие сроки при наличии у него отягчающих факторов.
В последние годы экспертами внесены существенные изменения в классификацию септического процесса. Ранее сепсис определялся как состояние, характеризующееся синдромом системного воспалительного ответа при наличии инфекционного процесса в организме. В современную классификацию сепсиса не включен синдром системного воспалительного ответа.
В соответствии с современными взглядами сепсис определяется следующим образом:
- сепсис – угрожающая жизни органная дисфункция, вызванная дисрегуляторным ответом организма на инфекцию;
- органную дисфункцию следует рассматривать как остро возникшее вследствие инфекции изменение общего количества баллов на ≥2 пункта по шкале Sepsis-related Organ Failure Assessment (SOFA);
- пациентов с инфекцией, которые имеют высокий риск смерти или длительного пребывания в отделении интенсивной терапии, можно идентифицировать с помощью индекса quick SOFA (qSOFA). Он учитывает изменение сознания, систолическое артериальное давление (АД) ≤100 мм рт. ст. или частоту дыхания ≥22 вдоха/мин.
Септический шок следует рассматривать как разновидность сепсиса, при котором наблюдаемые циркуляторные, клеточные/метаболические изменения достаточно выражены для существенного повышения риска смерти. Наличие септического шока у пациента можно констатировать, если он соответствует клиническим критериям сепсиса при условии персистирующей артериальной гипотензии, требующей применения вазопрессоров для поддержания среднего АД ≥65 мм рт. ст., в сочетании с уровнем лактата >2 ммоль/л (18 мг/дл) при отсутствии гиповолемии.
Докладчик подчеркнул, что основным методом диагностики уросепсиса является клинический. К дополнительным методам относятся клинико-лабораторные, микробиологический (исследование крови, мочи, отделяемого дренажей, биопсийного материала), визуализационные для поиска очага инфекции (УЗИ, компьютерная томография), определение маркеров воспаления и органной дисфункции (цитокины, С-реактивный белок, лактат, среднесрочный проадреномедуллин, прокальцитонин).
Лечение уросепсиса рекомендовано начинать в первые 6 часов и включать эмпирическую антибактериальную терапию, специфическое урологическое лечение и интенсивную поддерживающую терапию.
В соответствии с рекомендациями EAU (2018), для эмпирической антибактериальной терапии следует использовать антибиотики широкого спектра с чувствительностью к большинству вероятных уропатогенов (с учетом данных локального микробиологического мониторинга) в максимальных терапевтических дозах. В качестве стартовой эмпирической терапии обычно назначают цефалоспорины 3-4-го поколения, аминогликозиды, фторхинолоны, пиперациллин/ингибитор β-лактамаз, карбапенемы.
Кроме антибактериальной терапии в комплекс лечения уросепсиса входят иммунотерапия; антиферментные препараты; антигипоксические препараты; профилактика тромбозов; профилактика стрессовых язв; седация; экстракорпоральные методы детоксикации; искусственная вентиляция легких; раннее начало энтерального питания (<48 ч).
В заключение доклада Д.М. Ниткин акцентировал внимание на мерах по профилактике уросепсиса, к числу которых относятся:
- изоляция пациентов с полирезистентными штаммами инфекции;
- рациональный выбор антибиотика для профилактики и лечения ИМП с целью предотвращения роста антибиотикорезистентности; назначение альтернативных (в том числе растительных) препаратов при доброкачественном течении заболевания;
- уменьшение продолжительности пребывания пациента в стационаре (особенно перед операцией);
- раннее удаление катетеров и дренажей;
- применение закрытых дренажных систем;
- использование минимально инвазивных методов устранения обструкции;
- соблюдение принципов асептики.
 Весьма обширный и содержательный доклад «Инфекции мочевых путей у беременных» представил руководитель отделения внутренней патологии беременных ГУ «Институт педиатрии, акушерства и гинекологии им. Е.М. Лукьяновой НАМН Украины» (г. Киев), член-корреспондент НАМН Украины, доктор медицинских наук, профессор В.И. Медведь.
Весьма обширный и содержательный доклад «Инфекции мочевых путей у беременных» представил руководитель отделения внутренней патологии беременных ГУ «Институт педиатрии, акушерства и гинекологии им. Е.М. Лукьяновой НАМН Украины» (г. Киев), член-корреспондент НАМН Украины, доктор медицинских наук, профессор В.И. Медведь.
Он отметил, что современная концепция лечения ИМП подразумевает их деление на неосложненные и осложненные. Неосложненная ИМП – это заболевание, возникающее у молодой женщины без предсуществующей урологической патологии.
Факторы, осложняющие ИМП:
- анатомические нарушения мочевых путей: врожденные аномалии развития и/или расположения; поликистоз почек, стриктуры мочеточников, уретры; мочекаменная болезнь;
- функциональные нарушения мочевой системы: гиперактивный мочевой пузырь, пузырно-мочеточниковый рефлюкс, мочеточниково-лоханочный рефлюкс;
- тяжелые сопутствующие заболевания: сахарный диабет, сердечная недостаточность, почечная недостаточность, СПИД, нейтропения различного генеза.
В результате длительных дискуссий специалистов беременность признана фактором, осложняющим течение ИМП, несмотря на то что она является абсолютно физиологическим состоянием женщины.
Доказано, что частота острых манифестных ИМП, в частности пиелонефрита, зависит от выявления и лечения у беременных бессимптомной бактериурии. По данным эпидемиологических исследований, среди беременных распространенность бессимптомной бактериурии составляет около 8%, острой инфекции нижних мочевых путей – 1-4%, верхних – 1-2,5%. В случае активного лечения у менее чем 5% таких женщин клинически развивается ИМП, при отсутствии лечения – у 15-57%.
В руководстве EAU (2018) были обновлены отдельные главы, в частности раздел, касающийся проблемы наиболее эффективного лечения взрослых с бессимптомной бактериурией. В обновленном гайдлайне подчеркнуто, что терапия не назначается:
- небеременным женщинам, не имеющим факторов риска (уровень доказательности – 2a; степень рекомендаций – A);
- пациентам с хорошо контролируемым сахарным диабетом (1b; А);
- женщинам в постменопаузе (1a; А);
- пожилым пациентам, проживающим в домах престарелых (1a; А);
- пациентам с дисфункциональными и/или реконструированными нижними отделами мочевыводящих путей (2b; В);
- при катетер-ассоциированных ИМП (4; С);
- пациентам с почечными трансплантатами (1b; А);
- пациентам до операций артропластики (1b; А);
- при рецидивирующих ИМП (1b; А).
Скрининг и лечение бессимптомной бактериурии целесообразны перед проведением инвазивных урологических процедур и у беременных женщин.
Как правило, у беременных бессимптомная бактериурия существует до наступления беременности, чем обусловлена необходимость проведения скрининга в І триместре. Кроме того, в редакции руководства EAU 2014 года отмечено, что соответствующий критериям ВОЗ результат бактериологического исследования (105 КОЕ/мл) должен быть получен дважды при бескатетерном заборе мочи, но достаточно однократного посева при заборе мочи катетером. В нашей стране, согласно приказу МЗ Украины от 15.07.2011 № 417 «Об организации амбулаторной акушерско-гинекологической помощи в Украине», скрининг на бактериурию является обязательным в I триместре, и таковая подлежит лечению даже при однократном выявлении обсеменения.
Рекомендации EAU разработаны на основе результатов значительного количества рандомизированных клинических исследований, посвященных проблеме целесообразности лечения бессимптомной бактериурии у пациенток во время беременности. Авторы одиннадцати (n=2002) из них сообщили, что антибиотикотерапия способствовала значительному уменьшению количества рецидивов ИМП по сравнению с плацебо или отсутствием лечения. В шести испытаниях (n=716) было обнаружено, что антибиотикотерапия более эффективна в купировании бактериурии по сравнению с плацебо. Целью нескольких исследований была оценка влияния проводимого лечения на перинатальные исходы. Согласно результатам восьми исследований (n=1689), лечение антибиотиками ассоциировалось с более низкой частотой рождения детей с меньшей массой тела по сравнению с плацебо или отсутствием лечения. В четырех рандомизированных клинических испытаниях (n=854) определен более низкий риск преждевременных родов на фоне антибиотикотерапии по сравнению с плацебо или отсутствием лечения.
С учетом этих результатов эксперты EAU пришли к выводу: учитывая благоприятное воздействие антибиотиков на материнскую и плодовую среду, беременные должны пройти скрининг и курс лечения по поводу бессимптомной бактериурии. В то же время они подчеркивают, что большинство доступных исследований имеют низкое методологическое качество и относятся к 60-80 годам прошлого века. С тех пор радикально изменились протоколы диагностики и лечения, а также доступность медицинских услуг. Поэтому качество имеющихся доказательств для этой рекомендации невелико. В новых исследованиях более высокого методологического уровня благоприятные эффекты лечения антибиотиками не столь очевидны. Ввиду этого рекомендуется ориентироваться на национальные рекомендации по лечению бессимптомной бактериурии у беременных.
С целью сравнения эффективности различных схем антибактериальной терапии у беременных с бессимптомной бактериурией проведено 16 рандомизированных испытаний. На основании их результатов сделаны следующие выводы:
- однократная доза связана с гораздо более низкой частотой побочных эффектов, но со значительно более высокой частотой маленького веса новорожденного;
- поэтому для лечения бессимптомной бактериурии во время беременности следует применять стандартный краткосрочный курс лечения;
- необходимо подчеркнуть, что общее качество научных данных, подтверждающих эту рекомендацию, невелико.
Таким образом, всем беременным с бессимптомной бактериурией рекомендуется антибактериальная терапия в течение 7 дней с целью предупреждения персистирующей бактериурии, преждевременных родов и рождения детей с низкой массой тела.
Согласно руководству EAU, для диагностической оценки неосложненного цистита, в том числе у беременных, желательно бактериологическое исследование мочи. Использование тест-полосок (стиков) рассматривается как разумная альтернатива посеву мочи.
Культуральное исследование мочи рекомендуют в следующих ситуациях:
- при подозрении на острый пиелонефрит;
- при наличии симптомов, которые не устраняются или повторяются в течение 2-4 нед после завершения лечения;
- женщинам с атипичными симптомами;
- беременным;
- мужчинам с подозрением на ИМП.
Количество колоний уропатогенов, равное 103 КОЕ/мл, является микробиологическим диагностическим критерием у лиц с симптомами неосложненного цистита.
При развитии острого пиелонефрита в моче определяются пиурия (≥1×104/мл нецентрифугированной мочи) и бактериурия (≥104 КОЕ/мл). Для диагностики возможных осложнений пиелонефрита у беременных должны применяться преимущественно УЗИ или магнитно-резонансная томография, чтобы избежать радиационного риска для плода, возникающего при использовании других методов (компьютерная томография, экскреторная урография или сканирование с димеркаптоянтарной кислотой).
Обязательному лечению у беременных подлежат симптомные ИМП, в частности цистит. Для этого могут быть рекомендованы короткие курсы антимикробной терапии. Препаратами выбора являются пенициллины, цефалоспорины, фосфомицин, нитрофурантоин (при отсутствии дефицита глюкозо‑6-фосфатдегидрогеназы и не в конце беременности), триметоприм (не в І триместре) и сульфонамиды (не в последнем триместре).
Профилактика рецидивирующей ИМП состоит в посткоитальном применении антибактериальных средств женщинами с анамнезом частых ИМП до наступления беременности. Во время гестации с этой целью рекомендованы два препарата: цефалексин 125 или 250 мг либо цефаклор 250 мг один раз в сутки.
В соответствии с результатами Глобального исследования относительно распространенности инфекций, связанных с предоставлением медицинской помощи в урологии (2003-2015), с участием в общей сложности 21 230 пациентов из 56 стран, резистентность бактерий к антибиотикам составляет 10-40%. Чтобы не усугублять данную проблему, исследователи повсеместно заняты поиском эффективных вариантов лечения, альтернативных антибиотикам. В связи с этим на конгрессе EAU (2017) было уделено внимание обсуждению нескольких вариантов профилактических мер.
Так, для иммунопрофилактики у пациенток с ИМП может быть рекомендован лиофилизированный лизат бактерий E. coli ОМ‑89 (Uro-Vахоm). Как было показано в нескольких рандомизированных исследованиях, этот препарат более эффективен, чем плацебо, и имеет хороший профиль безопасности. Важно то, что препарат исследован у беременных. При этом доказана его безопасность, и он разрешен к применению в акушерской практике.
В отношении профилактики пробиотиками (Lactobacillus spp.) не получено убедительных данных о пользе этих препаратов для профилактики ИМП. Однако различия в эффективности между имеющимися лекарственными средствами свидетельствуют о необходимости дальнейших исследований.
До 2013 года в рекомендации EAU в качестве профилактического средства ИМП у беременных были включены продукты из клюквы. В небольшом числе исследований показано, что клюква полезна для снижения частоты рецидивов ИМП у женщин. Тем не менее, согласно результатам метаанализа, включающего 24 исследования (n=4473), продукты из клюквы существенно не снижают частоту развития манифестной ИМП у лиц с бессимптомной бактериурией. Соответственно с 2014 года в руководстве EAU по ИМП отмечено, что из-за противоречивых результатов исследований рекомендации относительно ежедневного употребления клюквенных продуктов не могут быть сделаны.
В настоящее время в качестве нового превентивного средства рассматривается применение D-маннозы. В рандомизированном плацебо-контролируемом исследовании было показано, что суточная доза 2 г D-маннозы значительно превосходит плацебо и настолько же эффективна, как нитрофурантоин 50 мг в профилактике рецидивирующей ИМП. Однако эксперты EAU отметили, что этот результат является показательным, но недостаточным для рекомендации. Поэтому в настоящее время D-маннозу следует использовать только в контексте клинических исследований.
Было подчеркнуто, что на сегодняшний день в профилактике ИМП эффективен препарат Канефрон® Н, оказывающий на мочевыделительную систему комплексное воздействие: спазмолитическое, диуретическое, противовоспалительное, антибактериальное. Кроме того, препарат улучшает почечную гемодинамику (расширяет артериолы клубочков) и одновременно может уменьшать протеинурию. Основным преимуществом Канефрона Н в акушерской практике является абсолютная безопасность для плода и отсутствие побочных эффектов.
 Следует отметить, что в соответствии со статьей 16а Директивы 2001/83/ЕС Европейского парламента и Совета Евросоюза от 06.11.2001 «О своде законов Сообщества в отношении лекарственных средств для человека» показание «беременность» не может быть внесено в инструкцию по применению ни одного препарата, не изученного в рандомизированных плацебо-контролируемых исследованиях у беременных (и детей). Однако, учитывая большую доказательную базу и длительный опыт применения, в феврале 2017 года в Германии, а с января 2018 года в Украине, было сделано исключение для Канефрона Н: данный препарат при необходимости может применяться во время беременности.
Следует отметить, что в соответствии со статьей 16а Директивы 2001/83/ЕС Европейского парламента и Совета Евросоюза от 06.11.2001 «О своде законов Сообщества в отношении лекарственных средств для человека» показание «беременность» не может быть внесено в инструкцию по применению ни одного препарата, не изученного в рандомизированных плацебо-контролируемых исследованиях у беременных (и детей). Однако, учитывая большую доказательную базу и длительный опыт применения, в феврале 2017 года в Германии, а с января 2018 года в Украине, было сделано исключение для Канефрона Н: данный препарат при необходимости может применяться во время беременности.
На основании результатов систематического обзора 17 клинических исследований с участием 2142 беременных был сделан вывод об эффективности и безопасности Канефрона Н при лечении ИМП, в том числе при длительном применении (до 28 недель).
Заканчивая выступление, В.И. Медведь подчеркнул, что проблема ИМП у беременных является чрезвычайно актуальной и остается предметом пристального внимания клиницистов. По мнению большинства экспертов, потенциальный риск этого патологического состояния в отношении перинатальных исходов обусловливает необходимость его своевременной диагностики и целесообразность антимикробной терапии.
Подготовила Виктория Недвиженко
Тематичний номер «Урологія. Нефрологія. Андрологія» №3 (14), листопад-грудень 2018 р.