2 квітня, 2019
Визначення, патогенез та ведення диспепсії: що нового?
 Диспепсія – загальний термін, яким традиційно позначають симптоми, що, ймовірно, походять із верхніх відділів травного тракту. Ці симптоми є відносно неспецифічними, тож не дивно, що вони можуть бути пов’язані з безліччю патологічних станів. У цьому полягає перший виклик для лікаря: з-поміж хворих із симптомами функціонального походження виявити пацієнтів із потенційно небезпечними для життя хворобами, як-от рак шлунка. Другим, не менш серйозним викликом є власне визначення і ведення функціональної диспепсії (ФД); цьому питанню присвячено представлений огляд.
Диспепсія – загальний термін, яким традиційно позначають симптоми, що, ймовірно, походять із верхніх відділів травного тракту. Ці симптоми є відносно неспецифічними, тож не дивно, що вони можуть бути пов’язані з безліччю патологічних станів. У цьому полягає перший виклик для лікаря: з-поміж хворих із симптомами функціонального походження виявити пацієнтів із потенційно небезпечними для життя хворобами, як-от рак шлунка. Другим, не менш серйозним викликом є власне визначення і ведення функціональної диспепсії (ФД); цьому питанню присвячено представлений огляд.
Визначення
На відміну від Римських критеріїв для синдрому подразненого кишечнику (СПК), які майже не змінювалися протягом понад 30 років, критерії ФД зазнавали дуже значних змін.
Римські критерії ІІІ відрізняються від попередніх версій двома ключовими моментами. По-перше, замість поділу диспепсії на рефлюксоподібну, виразкоподібну, дискінетичну і неспецифічну ФД класифікували на два окремі синдроми – постпрандіальний дистрес-синдром (ПДС), що характеризується пов’язаними з прийомом їжі відчуттям переповнення і раннім насиченням, і синдром епігастрального болю (СЕБ), за якого симптоми з’являються між прийомами їжі. По-друге, з діагнозу ФД були виключені пацієнти з вираженою печією або такі, хто задовольняє критеріям СПК. Попри ці зміни, Римські критерії ІІІ діагностують ФД із чутливістю і специфічністю лише 60,7 та 68,7% відповідно, що не надто відрізняється від попередньої редакції документа.
Римські критерії IV, опубліковані у 2016 р., характеризуються значно ширшим підходом до визначення і потенційної патофізіології функціональних гастроінтестинальних розладів, визнаючи потенційну роль таких феноменів, як низькорівневе запалення, зміни кишкової мікробіоти та порушення роботи вісі «головний мозок – травний тракт». Крім того, ФД тепер вважається не окремим захворюванням, а радше спектром, що має багато спільного з гастроезофагеальною рефлюксною хворобою (ГЕРБ) та СПК. Синдром функціональної нудоти та блювання був виділений в окремий розлад. Поділ ФД на ПДС та СЕБ зберігся, хоча дещо змінилося визначення ПДС. Тепер, крім відчуття переповнення та раннього насичення, воно також включає біль і відчуття печіння в епігастрії, пов’язані з прийомом їжі. Отже, пацієнтів слід класифікувати не на підставі наявних симптомів як таких, а передусім залежно від зв’язку між погіршенням симптомів та прийомом їжі.
Інші зміни, уведені Римськими критеріями IV, полягали в намаганні точніше визначити мінімальні пороги для частоти і тяжкості симптомів диспепсії. Симптоми мають бути достатньо тяжкими, щоб турбувати пацієнта (відволікати від звичайної діяльності), і з’являтися частіше, ніж у загальній популяції (принаймні 3 дні на тиждень для ПДС і 1 день на тиждень для СЕБ). Лише час покаже, чи допоможуть ці нові критерії більш точно діагностувати ФД.
Епідеміологія
Поширеність ФД варіює від 10 до 30% у різних дослідженнях і в середньому становить 21%. ФД частіше зустрічається в жінок, курців, Helicobacter pylori-позитивних осіб та людей, які приймають нестероїдні протизапальні препарати. Крім того, поширеність ФД є нижчою при використанні Римських критеріїв III (7,6%), ніж у разі застосування Римських критеріїв IV (29%).
Диспепсія є глобальною проблемою, проте її розповсюдженість суттєво різниться залежно від географічного регіону. Загалом захворюваність на ФД є вищою в західних популяціях порівняно зі східними. Виразко- та рефлюксоподібні симптоми частіше зустрічаються на Заході, а диспепсія за типом порушення моторики – на Сході. У західних популяціях ФД асоціюється з нижчим соціально-економічним класом, а в східних – навпаки. Ці відмінності можуть бути зумовлені численними факторами, зокрема дієтою, особливостями способу життя, розповсюдженістю Нр-інфекції та ін.
Патофізіологія
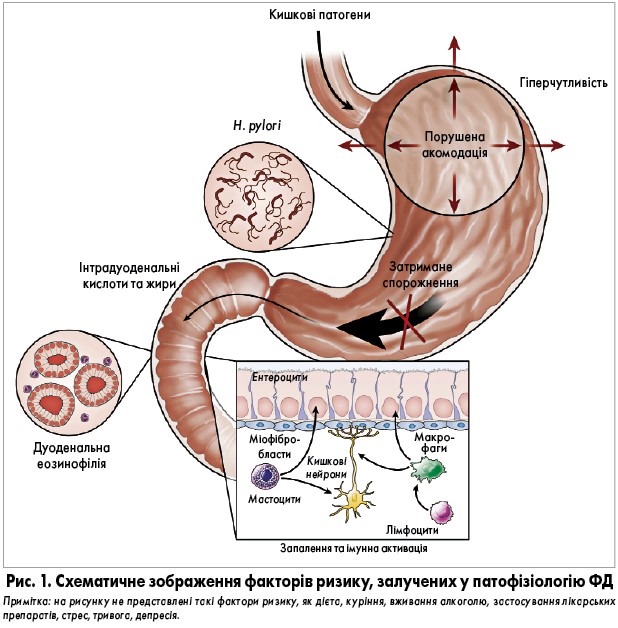
ФД, хоча й не зменшує тривалість життя, суттєво знижує його якість. Поза сумнівом, ФД має складу природу, тож різноманітні симптоми, асоційовані з цим захворюванням, можуть виникати або погіршуватися внаслідок різних патофізіологічних механізмів (рис. 1). Протягом багатьох десятиліть вважалося, що головним джерелом симптомів ФД є шлунок; у дослідженнях останніх років були отримані свідчення, що симптоми також можуть виникати через порушення функції дванадцятипалої кишки (ДПК) та інших органів.
Сповільнене спорожнення шлунка
Традиційно сповільнене спорожнення шлунка (ССШ) розглядали як один із провідних механізмів патофізіології ФД. За даними різних досліджень, розповсюдженість ССШ серед пацієнтів із ФД становить від 20 до 50%. Загалом спорожнення шлунка від твердої їжі в цій когорті подовжується в 1,5 раза порівняно з контролем. З клінічного погляду важливо розрізняти ПДС як підтип ФД і так званий ідіопатичний гастропарез, які мають спільні симптоми. Крім того, взаємозв’язок між ССШ і більшістю інших симптомів ФД залишається не до кінця вивченим, оскільки ті самі симптоми можуть спостерігатись і в пацієнтів з нормальним спорожненням шлунка. Імовірно, єдиним винятком є відчуття переповнення після їди, яке стабільно асоціюється із ССШ.
Порушення акомодації шлунка
Акомодація шлунка опосередковується ваговагальним рефлексом, що запускається прийомом їжі та генерується шляхом активації NO-ергічними нервами, які розслаблюють дно і верхню частину тіла шлунка. В акомодації також бере участь антрофундальний рефлекс – розслаблення дна шлунка у відповідь на розтягнення антруму. У дослідженні Tack і співавт. (1998) порушена акомодація реєструвалась у 40% пацієнтів з ФД, причому достовірним її предиктором було раннє насичення (спостерігалося в 90% пацієнтів).
Золотим стандартом дослідження акомодації є баростат-тест, який передбачає розташування поліетиленового балона в дні шлунка під флюорографічним контролем. Хоча цей тест має відмінну відтворюваність, у рутинній клінічній практиці він не використовується, оскільки має інвазивну природу і змінює нормальну фізіологію шлунка. Більш простою та фізіологічною альтернативною є тест із навантаженням водою, коли пацієнт п’є воду до появи відчуття заповненого шлунка, а об’єм випитої води слугує сурогатним маркером акомодації. Під час цього тесту пацієнти з ФД випивають значно менше води і повідомляють про більш тяжкі симптоми. Такий же тест із вживанням нутрієнтів замість води надає аналогічні результати стосовно вжитого об’єму та симптомів ФД; це є свідченням того, що калорійність не визначає максимально переносимий об’єм. Утім, результати навантажувальних проб і дослідження з баростатом не завжди корелюють одне з одним.
Ще один неінвазивний метод оцінки акомодації – ультрасонографія, додатковою перевагою якої є можливість одночасно вивчити інші параметри шлункової моторики, як-от спорожнення. Зрештою, акомодацію шлунка також можна оцінювати за допомогою комп’ютерної або магнітно-резонансної томографії, проте зі зрозумілих причин ці методи в клінічній практиці майже не використовуються.
Гіперчутливість шлунка
Дослідження з використанням баростату засвідчили, що пацієнти з ФД мають знижені пороги до першого відчуття, дискомфорту та болю під час розтягнення проксимального відділу шлунка. Загалом гіперчутливість присутня в 34% пацієнтів з ФД і поєднується з постпрандіальним болем в епігастрії, відрижкою та зниженням маси тіла. Гіперчутливість у постпрандіальному періоді є особливо характерною для ФД. Взаємозв’язок між гіперчутливістю шлунка та симптомами ФД, імовірно, пояснюється надмірною активацією мультимодальних аферентних шляхів.
Гіперчутливість ДПК до кислоти та ліпідів
Можливість залучення ДПК до патогенезу ФД уперше було встановлено в дослідженні, у якому в 59% пацієнтів з ФД розвивалася нудота протягом короткочасного періоду перфузії ДПК кислотою; у здорових добровольців той же стимул не зумовлював жодних симптомів (Schwartz et al., 2001). Як було продемонстровано в подальших дослідженнях, пацієнти з ФД мають порушену моторну відповідь ДПК на кислотне середовище, що призводить до зниженого кліренсу екзогенної кислоти з цибулини ДПК. Це пояснює підвищену розповсюдженість спонтанної експозиції ДПК до кислоти в денний час і після їди в пацієнтів з тяжкими симптомами ФД. З більш низьким рівнем рН у ДПК корелює нездатність доїсти порцію їжі.
Симптоми диспепсії часто виникають після вживання жирної їжі. На відміну від здорових осіб у пацієнтів з ФД інтрадуоденальна інфузія ліпідів підвищує чутливість шлунка до розтягнення і спричиняє відчуття переповнення, дискомфорт і нудоту. Ця відповідь, імовірно, опосередковується холецистокініном (ХЦК), оскільки призначення антагоніста рецепторів ХЦК дезлоксиглумібу запобігає симптомам диспепсії, індукованим ліпідами або розтягненням.
Післяінфекційна ФД
Як і СПК, ФД може розвиватися de novo після кишкової інфекції. Наприклад, у дослідженні Tack і співавт. (2002) 17% пацієнтів з ФД вважали, що безпосередньою причиною їхніх симптомів є кишкова інфекція. У цих хворих частіше зустрічалися раннє насичення, нудота та зниження маси тіла, пов’язані з порушеною акомодацією внаслідок дисфункції шлункових NO-ергічних нейронів. У проспективному дослідженні харчова інфекція, зумовлена кишковою сальмонелою, підвищувала імовірність розвитку ФД у понад 5 разів протягом року, при цьому предикторами розвитку ФД були біль у животі та блювання в гострому періоді токсикоінфекції. Інфекція Giardia lamblia також може провокувати вісцеральну гіперчутливість і затримувати спорожнення шлунка.
Запалення та імунна активація
Порівняно із загальною популяцією пацієнтів з ФД у хворих на післяінфекційну ФД (ПІ-ФД) частіше виявляються фокальні агрегати Т-лімфоцитів, зокрема CD8+ клітин (цитотоксичних Т-лімфоцитів), у ДПК, що асоціюється із ССШ. Крім того, в пацієнтів з ПІ-ФД відзначають знижену кількість CD4+ клітин (Т-хелперів, моноцитів і дендритних клітин) на 1 крипту та підвищену кількість макрофагів, що оточують крипти. Також у цих хворих частіше виявляють гістологічні ознаки дуоденіту, з яким корелює такий симптом, як відчуття печіння в епігастрії.
Запалення не обмежується лише ПІ-ФД. Так, у пацієнтів з ФД загалом спостерігається підвищення експресії гістаміну, серотоніну й триптази в слизовій оболонці шлунка, системна імунна активація з підвищенням рівня моноцитів, фактора некрозу пухлини, інтерлейкінів 1β і 10, а також кишково-специфічних Т-лімфоцитів у периферичній крові. Кожен із цих факторів корелює з різними симптомами ФД.
Еозинофілія ДПК
У дослідженні за участю 51 пацієнта з ФД і 48 здорових добровольців підвищена кількість еозинофілів у цибулині ДПК асоціювалася зі збільшенням імовірності ФД у 11,7 раза (Talley et al., 2007). Варто зазначити, що еозинофілія шлунка в цих пацієнтів не спостерігалася, а дуоденальна еозинофілія після поправки на вік, стать і статус інфекції Hp корелювала з раннім насиченням. В інших дослідженнях дуоденальна еозинофілія асоціювалася з ПІ-ФД, інфільтрацією ДПК мастоцитами, алергією та ФД за типом ПДС.
Інфекція H. pylori
Тривалий час вважалося, що хелікобактерний гастрит може зумовлювати диспепсію внаслідок порушення секреції кислоти, моторики та передачі нейроендокринних сигналів. В експериментальних дослідженнях Hp-інфекція асоціювалася з експресією глюкагоноподібного пептиду-1 і прискореним гастроінтестинальним транзитом. Натомість у пацієнтів з ФД наявність Hp, схоже, не змінює швидкість спорожнення шлунка. Нр-інфекція також не впливає на акомодацію шлунка, проте може спричиняти вісцеральну, зокрема шлункову, гіперчутливість, найімовірніше, внаслідок запалення.
Психосоціальні фактори
ФД тісно пов’язана з різноманітними психічними і психологічними порушеннями, зокрема з депресією та тривогою, які не лише беруть участь у патогенезі симптомів у деяких пацієнтів з ФД, а й стимулюють цих хворих звертатися по медичну допомогу. Роль емоцій, відповіді на стрес, психологічних процесів і психіатричних коморбідних станів при ФД пояснюється існуванням вісі «травний тракт – головний мозок», яка вивчається за допомогою функціональних візуалізаційних досліджень. Цікаво, що ступінь соматизації в пацієнтів з ФД є таким самим, як і у хворих з органічною диспепсією.
Ведення ФД
Ведення ФД починається з пояснень. Необхідно запевнити пацієнта в тому, що його захворювання не є смертельним, однак при цьому не слід применшувати серйозність його скарг, більше уваги варто приділити розумінню справжньої природи симптомів і їх впливу на повсякденне життя.
Дієта
З функціональною диспепсією асоціюються вісцеральне ожиріння, вживання консервів, алкоголю, а також дієта, багата на жири та сіль. Через спільну симптоматику СПК і ФД у розвитку симптомів останньої можуть брати участь поліоли, дисахариди та моносахариди, що ферментуються. Також є дослідження, що пов’язують диспепсичні симптоми з уживанням газованих напоїв і гострих спецій.
Антидепресанти
Висока розповсюдженість коморбідного психологічного дистресу серед пацієнтів з ФД стала підставою для дослідження антидепресантів при цьому розладі. Проте докази терапевтичної користі антидепресантів у разі ФД є неоднозначними. Метааналіз показав, що в пацієнтів із ФД селективні інгібітори зворотного захоплення серотоніну неефективні, натомість трициклінічні антидепресанти й антипсихотики можуть полегшувати симптоми, особливо за наявності супутніх розладів настрою. В одному дослідженні пацієнти з виразкоподібним болем в епігастрії та нормальним спорожненням шлунка краще відповідали на амітриптилін (Talley et al., 2015), в іншому випробуванні нортриптилін не полегшував симптомів у пацієнтів з ідіопатичним гастропарезом (Parkman et al., 2013).
Ерадикація H. pylori
У низці досліджень ерадикація Hp мала наслідком слабке (10%), але клінічно значиме полегшення симптомів ФД. Метааналіз показав, що полегшення симптомів через 3 міс є предиктором ремісії через 1 рік. На ерадикаційну терапію краще відповідають чоловіки та пацієнти з підвищеним індексом маси тіла, натомість послідовна терапія не має переваг над стандартною потрійною терапією щодо симптомів (як і щодо частоти ерадикації). Доцільність додавання препаратів вісмуту до стандартної потрійної терапії при ФД не доведена. Якщо порівнювати стратегію test-and-treat та емпіричну терапію інгібіторами протонної помпи, остання має фармакоекономічні переваги в популяціях з низькою розповсюдженістю Нр (<10-20%).
Прокінетики
Широко застосовуваний прокінетик метоклопрамід не має надійних доказів ефективності при ФД. Метааналіз досліджень селективного антагоніста серотонінових рецепторів 5-НТ4 мосаприду також не продемонстрував жодної користі цього препарату. У порівняльному дослідженні домперидону та цинітаприду (агоніст 5-НТ4 та антагоніст дофамінових рецепторів D2) частота полегшення симптомів становила 81,8 та 85,5% відповідно, при цьому цинітаприд ефективніше зменшував тяжкість відчуття переповнення після їди, раннього насичення та здуття.
Іптоприд – новий прокінетик, який інгібує ацетилхолінестеразу і є антагоністом D2-рецепторів. У метааналізі, що охопив 2620 пацієнтів, ітоприд полегшував симптоми диспепсії. Проте більш глибоке вивчення окремих досліджень показало, що перевага ітоприду спостерігається головним чином у пацієнтів з вираженою печією.
У японському дослідженні за участю пацієнтів з ФД за типом ПДС акотіамід (антагоніст мускаринових рецепторів й інгібітор ацетилхолінестерази) частіше зменшував 3 постпрандіальні симптоми (дистрес, здуття на раннє насичення) порівняно з плацебо (15,3 vs 9,0%). Наразі тривають дослідження цього препарату в Європі та США для вивчення його ефективності в інших етнічних популяціях.
Покращення акомодації шлунка
Антидепресант буспірон, який є частковим агоністом серотонінових рецепторів 5-НТ1А, може полегшувати розслаблення дна і тіла шлунка, в такий спосіб зменшуючи тяжкість відчуття переповнення після їди, раннього насичення і здуття верхньої частини живота без суттєвих побічних реакцій.
Інші методи
У короткочасних (10 тиж) і довготривалих (6 міс) дослідженнях психотерапія підвищувала ефективність стандартного консервативного лікування ФД. Крім того, психодинамічна терапія може покращувати відповідь симптомів на ерадикацію Нр. Хоча ці методи є перспективними, доцільність їх застосування в аспекті співвідношення «вартість/ефективність» не оцінювалася. Доказова база акупунктури, гомеопатичних засобів, фітотерапії й інших подібних методів не є достатньо переконливою.
У невеликому дослідженні із застосуванням позитронно-емісійної томографії в пацієнтів з ФД було встановлено підвищену експресію канабіноїдних рецепторів 1 типу в регіонах головного мозку, залучених у вісцеральну ноцицепцію і гомеостатичну регуляцію прийому їжі. Отже, ці рецептори можна розглядати як нову терапевтичну мішень при ФД.
Диспепсія: клінічний алгоритм
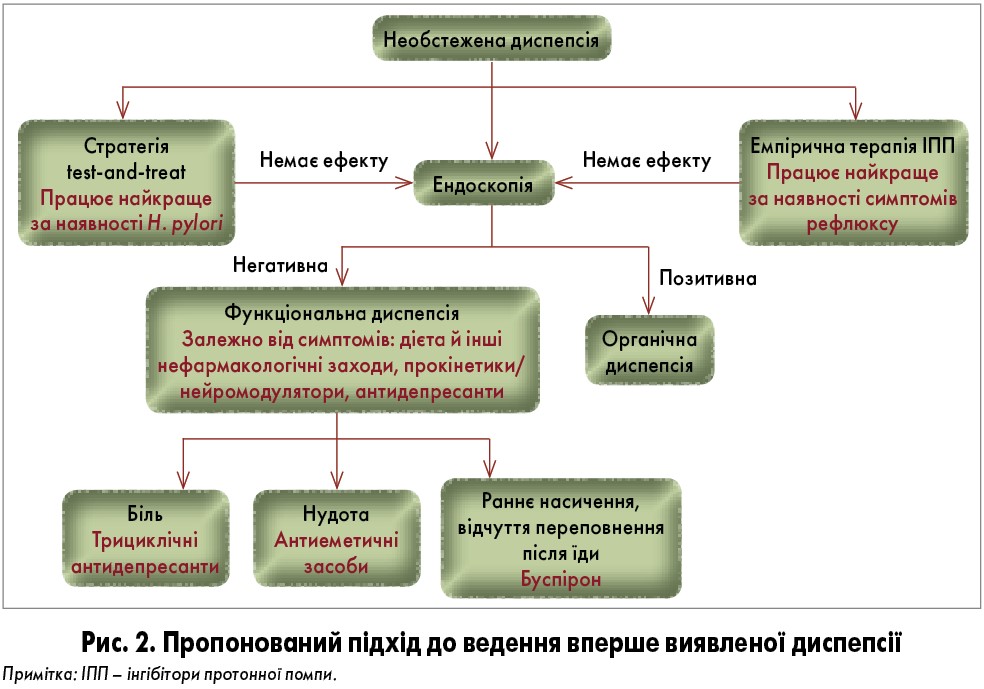
На рисунку 2 зображений спрощений алгоритм ведення пацієнта з уперше діагностованими симптомами диспепсії.
Першочерговим завданням є ідентифікація так званих червоних прапорців; їх наявність у певному контексті (вік, етнічна приналежність, захворювання в анамнезі тощо) може свідчити про необхідність невідкладного пошуку органічної хвороби, який зазвичай розпочинають з ендоскопії. За відсутності червоних прапорців, а також у популяції чи в пацієнта з високою імовірністю Hp-інфекції фармакоекономічно вигідним підходом є стратегія test-and-treat. За низької імовірності Нр-інфекції та за наявності виражених симптомів рефлюксу доцільне емпіричне призначення інгібітора протонної помпи. У разі відсутності ефекту можна провести ендоскопію, хоча надто сподіватися на її інформативність не варто. Вичерпавши ці методи, часто доводиться призначати препарати «поза показаннями» – прокінетики короткими курсами, трициклічні антидепресанти або буспірон залежно від провідного симптому. Отже, в багатьох випадках доводиться спочатку призначати інгібітори протонної помпи, а потім – прокінетики. Тому, на наш погляд, коли в пацієнтів із симптомами диспепсії застосовується стратегія емпіричної терапії, доцільно відразу призначати дозофіксовану комбінацію інгібітора протонної помпи та прокінетика, краще пролонгованого вивільнення, наприклад препарат Омез ДСР (омепразол 20 мг у кишковорозчинних пелетах + домперидон 30 мг з поступовим вивільненням протягом доби). Оскільки Омез ДСР приймається 1 раз на добу, це значно покращує прихильність до терапії в зазначеного контингенту хворих, що, своєю чергою, підвищує ефективність емпіричного лікування та має перевагу перед роздільним застосуванням інгібітора протонної помпи та прокінетика. Також слід приділити увагу коморбідним психопатологічним станам і симптомам, спільним для інших функціональних гастроінтестинальних захворювань, зокрема СПК та закрепу; лікування останнього може значно полегшити симптоми з боку верхніх відділів травного тракту. У резистентних випадках і за наявності тяжких симптомів можна розглянути доцільність психотерапії.
Список літератури знаходиться в редакції.
Медична газета «Здоров’я України 21 сторіччя» № 5 (450), березень 2019 р.