19 квітня, 2019
Патогенез і сучасні принципи лікування діабетичної ретинопатії
Діабетична ретинопатія (ДР) – часте мікросудинне ускладнення цукрового діабету (ЦД), що є основною причиною втрати зору в осіб працездатного віку.
Розрізняють дві стадії ДР: непроліферативну (ранню) та проліферативну (пізню). Перша характеризується підвищеною проникністю й оклюзією капілярів; під час огляду очного дна виявляють мікроаневризми, крововиливи та тверді ексудати. Характерною особливістю проліферативної ДР (ПДР) є неоваскуляризація, що клінічно проявляється порушеннями зору, оскільки нові аномальні судини зумовлюють вітреальні крововиливи чи тракційне відшарування сітківки.
Найчастішою причиною втрати зору при ЦД є макулярний набряк (МН), що може відбуватися на будь-якій стадії ДР і спричиняти спотворення візуальних образів і зниження гостроти зору (ГЗ). Він характеризується набуханням або потовщенням макули внаслідок під- і внутрішньоретинального накопичення рідини через пошкодження гематоретинального бар’єра – ГРБ (Romero-Aroca P. et al., 2016).
Сучасні методи лікування ДР включають лазерну фотокоагуляцію (ЛФ) та хірургічні втручання на скловидному тілі, що забезпечують стабілізацію ГЗ. Для покращення ГЗ на різних стадіях ДР застосовують інтравітреальне введення препаратів, які пригнічують судинні ендотеліальні фактори росту (СЕФР). Проте після 2 років терапії анти-СЕФР покращення ГЗ було досягнуто лише у 29% пацієнтів із МН (Gonzalez V. et al., 2016). Це можна пояснити існуванням інших патогенетичних механізмів ДР.
Сучасні уявлення про патогенез ДР
Гіперглікемія та мікроваскулопатія сітківки
Важливу роль у патогенезі мікросудинних ушкоджень сітківки відіграє гіперглікемія. Її вплив реалізується через декілька метаболічних шляхів (поліоловий, гексозаміновий, протеїнкіназний) або кінцеві продукти глікування (Brownlee M., 2005).
Найбільш ранніми реакціями судин сітківки на гіперглікемію є дилатація та зміни кровотоку, що вважаються проявами ауторегуляції для покращення метаболізму сітківки (Bek T., 2017). Гіперглікемія спричиняє апоптоз перицитів, які забезпечують структурну цілісність стінок капілярів (Naruse K. et al., 2000; Romeo G. et al., 2002). Як наслідок, виникає локальне витягування стінок капілярів із формуванням мікроаневризм (Ejaz S. et al., 2008). Паралельно відбувається апоптоз клітин ендотелію, потовщення базальних мембран і пошкодження ГРБ (Beltram E., Porta M., 2013). Усі вказані процеси зумовлюють оклюзію капілярів та ішемію сітківки (Huang H. et al., 2015).
В умовах гіперглікемії підвищується рівень фосфоліпази А2, що також стимулює СЕФР і посилює проникність капілярів унаслідок фосфорилювання білків щільного з’єднання, зокрема оклюдину (Lupo G. et al., 2013). Посилену експресію СЕФР у сітківці та скловидному тілі виявлено як у тваринних моделях діабету, так і в пацієнтів із ПДР і МН (Li J. et al., 2010; Aiello L. et al., 1994; Adamis A. et al., 1994).
У регуляції проникності судин задіяні й інші ангіогенні фактори, зокрема ангіопоетини (Анг‑1, Анг‑2), які взаємодіють з ендотеліальним рецептором тирозинкінази Tie2 (Patel J. et al., 2005; Rangasamy S. et al., 2011). Ці ангіогенні фактори можуть бути новими терапевтичними цілями при ДР.
Запалення
Встановлено, що при ДР спостерігається хронічне запалення низького ступеня (Miyamoto K. et al., 1999; Yuuki T. et al., 2001). На ранніх стадіях ДР ключову роль відіграє лейкостаз, зокрема оклюзія капілярів сітківки моноцитами та гранулоцитами, що корелює з пошкодженням ендотелію та ГРБ (Schroder S. et al., 1991). Ці процеси реалізуються через шлях Fas (CD95) / Fas-ліганд (Joussen A. et al., 2003). Лейкостазу сприяє адгезія лейкоцитів до ендотелію, опосередкована молекулами адгезії. Посилену адгезію лейкоцитів та експресію лейкоцитарних β2-інтегринів CD11a, CD11b і CD18 виявлено як в експериментальних моделях, так і у хворих на ЦД (Barouch F. et al., 2000; Chibber R. et al., 2000). Підвищується також кількість молекул адгезії, зокрема молекул міжклітинної адгезії‑1 (ICAM‑1), молекул адгезії судинних клітин (VCAM‑1) і селектинів (E‑селектин), а їх концентрація в плазмі крові корелює з тяжкістю ДР (Limb G. et al., 1999; Kasza M. et al., 2017). Пригнічення CD18 або ICAM‑1 за допомогою анти-CD18 F(ab9)2 фрагментів або антитіл істотно знижує лейкостаз у сітківці й ураження судин (Joussen A. et al., 2004).
У патогенезі ДР задіяні також хемокіни: моноцитарний хемотаксичний білок‑1 (МХБ‑1), запальні білки макрофагів‑1α та β, що притягують і активують лейкоцити (Suzuki Y. et al., 2011). Дефіцит МХБ‑1 зменшує витік із судин сітківки (Rangasamy S. et al., 2014). У хворих на ЦД істотно підвищені рівні таких прозапальних цитокінів, як фактор некрозу пухлини-α (ФНП‑α), інтерлейкіни (ІЛ) 1, 6, 8, причому рівень їх експресії корелює з тяжкістю ДР (Koleva-Georgieva D. et al., 2011; Boss et al., 2017).
Важливу роль у патогенезі ДР відіграє також дисфункція гліальних клітин – астроцитів, клітин Мюллера та мікроглії, котрі підтримують структуру та гомеостаз сітківки. При гіперглікемії мікроглія активується, що посилює секрецію ФНП‑α, ІЛ‑6, МХБ‑1 та СЕФР; далі активуються клітини Мюллера й астроцити, що стимулює утворення прозапальних цитокінів (Sorrentino F. et al., 2016; Abcouwer S., 2017).
Нейродегенерація сітківки
Це один із ранніх механізмів ДР, зумовлений апоптозом нейронів сітківки внаслідок стимуляції проапоптичних молекул, зокрема розщепленої каспази‑3, Bax і Fas (Podesta F. et al., 2000; Kowluru R., Koppolu P., 2002). Причиною дегенерації сітківки на субклітинному рівні є дисфункція мітохондрій з експресією таких проапоптичних білків, як цитохром С та проапоптичний фактор (Abu-El-Asrar A. et al., 2004). У дослідженнях in vitro високий уміст глюкози спричиняє фрагментацію мітохондрій та апоптоз (Tien T. et al., 2017).
Ще одним механізмом дегенерації сітківки при ЦД є окисний стрес. У тваринних моделях ЦД продемонстровано значне підвищення утворення часточок реактивного кисню, тоді як пригнічення цього процесу запобігало порушенням зору та зменшувало апоптоз нейронів сітківки, індукований каспазою‑3 (Sasaki M. et al., 2010).
Нейродегенерація є незалежним патофізіологічним механізмом ДР, оскільки втрата клітин гангліїв і зменшення товщини сітківки спостерігаються до виникнення мікросудинних змін, навіть таких ранніх, як мікроаневризми (Van Dijk H. et al., 2009; Sohn E. et al., 2016).
Сучасна терапія ДР
Антиангіогенна терапія
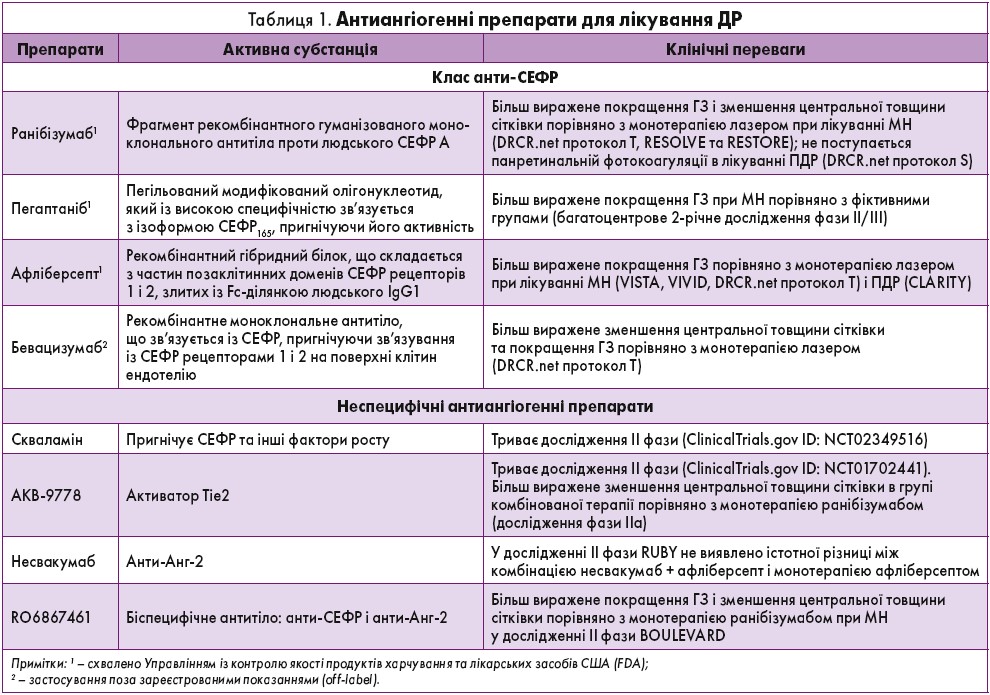
Включає насамперед препарати класу анти-СЕФР: ранібізумаб, пегаптаніб, афліберсепт і бевацизумаб, які вводяться інтравітреально (табл. 1). Можливими проявами їхньої побічної дії є підвищення внутрішньоочного тиску (ВОТ), запалення, кон’юнктивальні та вітреальні крововиливи (Wells J. et al., 2015).
Найбільш вивченим є ранібізумаб, який краще коригує зір у пацієнтів із МН, аніж монотерапія лазером (Massin P. et al., 2010; Mitchell P. et al., 2011). У цієї категорії пацієнтів аналогічні переваги доведено й для афліберсепту в дослідженнях VISTA та VIVID (Heier J. et al., 2016). Як свідчать результати досліджень DRCR.net протокол S та CLARITY анти-СЕФР ефективні в лікуванні ПДР (Gross J. et al., 2015; Sivaprasad S. et al., 2017). За даними дослідження DRCR.net протокол T, афліберсепт ефективніше покращує ГЗ у пацієнтів із середньотяжкими й тяжкими порушеннями, ніж ранібізумаб і бевацизумаб (Wells J. et al., 2015). У зв’язку з коротким періодом півжиття анти-СЕФР слід уводити 1-2 рази на місяць. З іншого боку, це підвищує ризик ендофтальміту: в дослідженні DRCR.net протокол I, яке тривало 5 років, зареєстровано три випадки цього ускладнення на 3973 ін’єкції – 0,08% (Elman M. et al., 2010).
Антиангіогенні препарати інших класів. Вивчається ефективність скваламіну, що пригнічує не тільки СЕФР, а й інші ангіогенні фактори (PDGF, bFGF), у пацієнтів із МН (Wroblewski J., Hu A., 2016).
Розроблено також препарати, котрі впливають на передачу сигналів у шляху Анг – Tie2. Наприклад, AKB‑9778 блокує негативний регулятор Tie2 – судинну ендотеліальну білкову тирозинфосфатазу; в результаті активується Tie2 і зменшується проникність судин. Триває дослідження, що вивчає ефективність AKB‑9778 у лікуванні МН (Campochiaro P. et al., 2016).
Інгібітор Анг‑2 несвакумаб зменшує проникність судин завдяки активації Tie2 і нині проходить II фазу клінічних випробувань з афліберсептом у пацієнтів із МН (дослідження RUBY). У дослідженні BOULEVARD вивчають дію біспецифічного антитіла RO6867461, що чинить вплив як на СЕФР, так і на Анг‑2 у пацієнтів із МН. Обидва препарати не продемонстрували клінічно значущих побічних ефектів.
Протизапальна терапія
Інтравітреальні кортикостероїди набувають дедалі більшої ваги в лікуванні МН, особливо в разі рефрактерності до анти-СЕФР, коли задіяні різні цитокіни, такі як ФНП‑α, хемокіни та фосфорильовані білки щільного з’єднання (Lattanzio R. et al., 2017). Наразі випробувані ін’єкції тріамцинолону ацетоніду, імплантати дексаметазону та флуоцинолону ацетоніду (табл. 2). Можливими побічними ефектами при інтравітреальному використанні кортикостероїдів є вітреальні кровотечі, підвищення ВОТ, глаукома, катаракта.
У дослідженні DRCR.net протокол I інтравітреальне введення тріамцинолону істотно зменшувало центральну товщину сітківки й ефективно покращувало ГЗ у пацієнтів із МН упродовж 24 тиж. Пізніше ефективність терапії знижувалася та підвищувався ризик несприятливих побічних ефектів: за 2 роки спостереження підвищення ВОТ виявлено в 50% пацієнтів, 59% учасників прооперовані з приводу катаракти. Проте в осіб із псевдофакією ефективність тріамцинолону прирівнювалася до такої ранібізумабу (Elman M. et al., 2010).
Інтравітреальний імплантат дексаметазону – це біодеградувальна система доставки, яка вивільняє препарат у склоподібне тіло протягом 6 міс, що забезпечує тривалу експозицію, значно зменшує необхідність повторних ін’єкцій та підвищує прихильність до лікування. За 3 роки спостереження в дослідженні імплантату дексаметазону (0,7 і 0,35 мг) у пацієнтів із МН у середньому було необхідно 4 ін’єкції. При цьому значно покращувалася ГЗ і зменшувалася центральна товщина сітківки порівняно з контрольною групою. Разом із тим у понад 60% пацієнтів виникла катаракта (Boyer D. et al., 2014). У дослідженні тривалістю 18 міс імплантат дексаметозону 0,7 мг значно покращував ГЗ і зменшував центральну товщину сітківки в пацієнтів із рефрактерним МН (Pacella F. et al., 2016). Зрідка при використанні такого виду трансплантатів можлива дислокація передньої камери, але при цьому можна провести репозицію імплантату шляхом уведення збалансованого сольового розчину (Pacella F. et al., 2016).
Проводилися клінічні випробування двох імплантатів флуоцинолону ацетоніду. У пацієнтів із персистуючим або повторним МН використовували препарат Ретісерт 0,59 мг, схвалений для лікування хронічного неінфекційного заднього увеїту. Встановлено більш виражене покращення ГЗ, аніж при стандартній терапії. Проте відзначалася висока частота побічних ефектів: підвищення ВОТ у 61,4% пацієнтів, виникнення катаракти – в 91% (Pearson P. et al., 2011). У зв’язку з цим випробувано інший імплантат – Ілувеїн у двох моделях, які вивільняли флуоцинолону ацетонід у дозах 0,23 та 0,45 мкг/добу. Через 2 роки обидві моделі суттєво підвищували ГЗ у пацієнтів із персистуючим МН, що потребувало однієї ін’єкції. ВОТ значно менше підвищувався при використанні дози 0,23 мкг/добу (Campochiaro P. et al., 2011).
Отже, інтравітреальні кортикостероїди є ефективними в лікуванні МН, а застосування імплантатів із тривалим вивільненням істотно зменшує кількість внутрішньоочних ін’єкцій, що підвищує комплаєнс і знижує вартість. Однак, зважаючи на високу частоту побічних ефектів, кортикостероїди зазвичай розглядають як варіант терапії другої лінії в разі неефективності інших лікувальних процедур. При ПДР ефективність кортикостероїдів не доведена, тому препарати класу анти-СЕФР залишаються терапією першої лінії.
Негормональна протизапальна терапія. Одним із найважливіших прозапальних цитокінів, які присутні в склоподібному тілі пацієнтів із ДР, є ІЛ‑6, тому його досліджували як перспективну мішень протизапальної терапії. Розроблено антитіла проти ІЛ‑6 (EBI‑031) та його рецептора (тоцилізумаб), ефективність і безпека яких наразі вивчаються в клінічних випробуваннях у пацієнтів із МН. Клінічне тестування в дослідженнях фази IIb проходить також люмінат (ALG‑1001), який блокує кілька рецепторів молекули адгезії інтегрину.
Лазерна фотокоагуляція
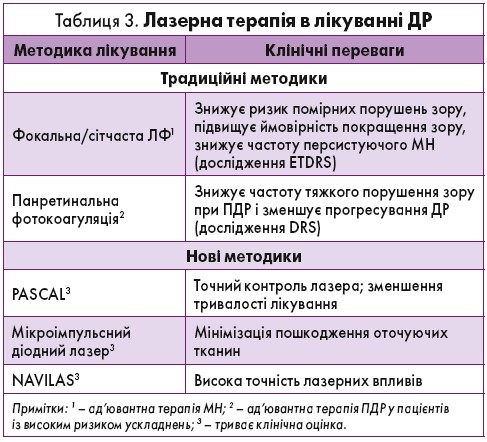 Традиційні методики ЛФ. До появи анти-СЕФР золотим стандартом лікування МН і ПДР була ЛФ (табл. 3). У дослідженні ETDRS, яке тривало 3 роки, показано, що фокальна/сітчаста ЛФ ефективно зменшує МН і знижує ризик помірної втрати зору на 50% (Early Treatment Diabetes Retinopathy Study Group, 1987).
Традиційні методики ЛФ. До появи анти-СЕФР золотим стандартом лікування МН і ПДР була ЛФ (табл. 3). У дослідженні ETDRS, яке тривало 3 роки, показано, що фокальна/сітчаста ЛФ ефективно зменшує МН і знижує ризик помірної втрати зору на 50% (Early Treatment Diabetes Retinopathy Study Group, 1987).
Панретинальна фотокоагуляція (ПРФ) також використовується для лікування ПДР і значно зменшує ймовірність тяжкого зниження ГЗ, особливо в осіб із високим ризиком вітреальних кровотеч (Diabetic Retinopathy Study Research Group, 1978). Точні механізми, за допомогою яких ЛФ сприяє регресії неоваскуляризації та зменшує МН, залишаються нез’ясованими. Ймовірно, ЛФ стимулює пігментний епітелій сітківки, викликає оклюзію мікроаневризм, знижує кровотік у сітківці, що зменшує її товщину та покращує оксигенацію (Arnarsson A., Stefansson E., 2000; Ogata N. et al., 2001). Однак ЛФ є деструктивною методикою, що може спричинити пошкодження клітин сітківки, а отже, й побічні ефекти: порушення полів зору (центральні – при фокальній ЛФ, периферичні – при ПРФ), погіршення нічного бачення та ГЗ (Fong D. et al., 2007). Хоча на сьогодні пріоритетною є терапія анти-СЕФР, ЛФ відіграє важливу роль як ад’ювантна чи рятівна. Зокрема, супутнє застосування фокальної ЛФ істотно зменшує потребу в ін’єкціях анти-СЕФР порівняно з монотерапією анти-СЕФР у пацієнтів із МН (Distefano L. et al., 2017).
Нові методики ЛФ розробляють для зменшення кількості побічних ефектів. Зокрема, впроваджено напівавтоматичний метод для лікування МН і ПДР – патерн-сканувальний лазер (PASCAL). Точніший контроль лазера істотно зменшує час лікування та ймовірність ушкодження сітківки (Blumenkranz M. et al., 2006). Для зниження ризику мікроопіків та мінімізації пошкодження навколишніх тканин застосовують такі мікроімпульсні методи, як підпороговий мікроімпульсний діодний лазер (Vujosevic S. et al., 2013). Нещодавно була використана навігаційна лазерна система NAVILAS, що істотно підвищує точність лазерного впливу й покращує терапевтичний ефект (Neubauer A. et al., 2013).
Інші методи лікування
Пептид, спрямований на кардіоліпін (MTP‑131). Кардіоліпін – це фосфоліпід внутрішньої мембрани мітохондрій, що сприяє апоптозу нейронів сітківки (Paradies G. et al., 2009). Спрямований на нього селективний пептид MTP‑131 здатний послаблювати окисний стрес мітохондрій і продемонстрував захисний вплив на функцію зору в тварин з індукованим ЦД (Alam N. et al., 2015). Триває клінічне дослідження SPIOC‑101, в якому оцінюють ефект місцевого розчину MTP‑131 (Ocuvia™) у пацієнтів із МН.
Альфа-ліпоєва кислота – це мітохондрій-специфічний антиоксидант, що використовують як нейропротектор при хворобі Альцгеймера. В експерименті на тваринах препарат ефективно запобігав втраті гангліозних клітин і сприяв збереженню товщини внутрішнього й зовнішнього шарів сітківки при стрептозотоцин-індукованому діабеті (Kan E. et al., 2017). Показано, що добавки з α-ліпоєвою кислотою покращують ГЗ у пацієнтів із ЦД обох типів (Gebka A. et al., 2014).
Лютеїн належить до каротиноїдів, накопичується в сітківці та має потужні антиоксидантні, протизапальні й нейропротекторні властивості. Препарат продемонстрував позитивні ефекти в різних моделях захворювань сітківки, ефективно запобігаючи діабетичним змінам (Muriach M. et al., 2006; Li S. et al., 2009, 2012). Харчові добавки з лютеїном покращують функцію зору в пацієнтів із непроліферативною ДР (Moschos M. et al., 2017).
ARA290 – це невеликий пептид еритропоетину. Крім стимуляції еритропоезу, еритропоетин має нейропротекторні властивості, що продемонстровано в багатьох тваринних моделях нейродегенерації. У щурів із діабетом ARA290 ефективно запобігав дегенерації нейроглії та судин, які є важливими ланками патогенезу ДР (McVicar C. et al., 2011). Наразі ефективність ARA290 у лікуванні МН вивчається в дослідженні II фази.
Дарапладиб. У пошкодженні ГРБ при ДР вагому роль відіграє ліпопротеїн-асоційована фосфоліпаза А2 (Lp-PLA2). Пригнічення цього ферменту в щурів із ЦД значно зменшувало пошкодження (Canning P. et al., 2016). Специфічний інгібітор Lp-PLA2 дарапладиб продемонстрував значне покращення ГЗ і зменшення МН за 3 міс застосування в дослідженні фази IIa (Staurenghi G. et al., 2015).
Отже, ДР – це мікросудинне ускладнення, незалежними чинниками виникнення якого є запалення та нейродегенерація сітківки. Цілями сучасної терапії є молекули, задіяні в цих ланках патогенезу. За останнє десятиріччя інтравітреальні препарати анти-СЕФР визнані терапією першої лінії в лікуванні МН і ПДР. Однак їх застосування в клінічній практиці обмежується потребою частого введення, низькою прихильністю пацієнтів до лікування та високою вартістю. ЛФ і надалі відіграє важливу роль у лікуванні ДР як ад’ювантна терапія. Інтравітреальні кортикостероїди продемонстрували клінічні переваги в лікуванні рефрактерного МН або за відсутності ефекту від анти-СЕФР. При тяжких порушеннях сучасні терапевтичні засоби не дають змоги досягти ГЗ, необхідної для читання чи керування транспортними засобами. Для покращення якості життя таких пацієнтів слід застосовувати комбіновану терапію. Необхідні подальші дослідження для вивчення патогенезу ДР, розроблення нових препаратів і впровадження їх у клінічну практику.
Підготувала Ольга Королюк
Медична газета «Здоров’я України 21 сторіччя» № 6 (451), березень 2019 р