14 травня, 2019
Подагра: погляд на відому хворобу крізь призму останніх відкриттів та сучасних рекомендацій
 Подагра розпізнавалася в історії Homo sapiens із незапам’ятних часів. Перші повідомлення про це захворювання з’явилися в наукових джерелах із початку історії медичного письма, також воно згадувалося у біографіях багатьох відомих людей. Дана патологія зображалася як доля хворих, які жили у достатку, і як виклик майстерності лікарів того часу. Сьогодні ми є свідками значного прогресу в менеджменті пацієнтів із подагрою. Завдяки суттєвим досягненням у молекулярній біології, діагностичних методиках та фармакотерапії, вдалося отримати глибше розуміння хвороби і, відтак, удосконалити діагностику й лікування.
Подагра розпізнавалася в історії Homo sapiens із незапам’ятних часів. Перші повідомлення про це захворювання з’явилися в наукових джерелах із початку історії медичного письма, також воно згадувалося у біографіях багатьох відомих людей. Дана патологія зображалася як доля хворих, які жили у достатку, і як виклик майстерності лікарів того часу. Сьогодні ми є свідками значного прогресу в менеджменті пацієнтів із подагрою. Завдяки суттєвим досягненням у молекулярній біології, діагностичних методиках та фармакотерапії, вдалося отримати глибше розуміння хвороби і, відтак, удосконалити діагностику й лікування.
Подагра – це системне захворювання, яке є результатом відкладення кристалів моноурату натрію (КМУН) у тканинах осіб із гіперурикемією з наступним розвитком запалення в місці депозитів кристалів. Підвищення рівня сечової кислоти (СК) у сироватці крові за межі певного порогу є беззаперечною умовою для утворення депо кристалів. Незважаючи на те що гіперурикемія є основним патогенетичним дефектом подагри, у багатьох людей із цим симптомом не розвиваються напади подагричного артриту або навіть не утворюються депозити КМУН. Лише у 20‑25% осіб із рівнем СК, вищим за 540 мкмоль/л (9 мг/дл), розвивається подагра. Відповідно, вважається, що інші фактори, такі як генетична схильність, впливають на виникнення захворювання [1].
Рання клінічна презентація подагри – це гостре запалення суглоба(-ів), яке швидко зменшується на тлі прийому нестероїдних протизапальних препаратів (НПЗП) або колхіцину. Подагра здебільшого діагностується шляхом ідентифікації патогномонічних КМУН при аспірації суглобової рідини чи у тканинах тофусів. КМУН можуть бути депоновані у всіх тканинах, але переважно це відбувається навколо суглобів, що веде до утворення тофусів – патогномонічного симптому хронічної подагри. Камені у нирках та тофуси – це пізні вияви хвороби.
Зниження рівня СК шляхом модифікації харчування та використання препаратів із цією метою є головними засадами в лікуванні подагри. Вірна стратегія терапії сприяє розчиненню кристалів СК, перешкоджає процесу їх депонування та наступним запальним атакам [2].
Поширеність подагри становить 1‑4% населення [1], зростаючи до 10% у чоловіків і 6% у жінок, старших за 80 років. Щорічна частота виявлення захворювання становить 2,68 на 1 тис. осіб [3]. Дана патологія зустрічається в чоловіків у 2‑6 разів частіше, ніж у жінок. У світі захворюваність на подагру поступово збільшується через погані дієтичні звички, такі як вживання фаст-фуду, газованих напоїв, продуктів, що містять фруктозу, відсутність регулярного і достатнього фізичного навантаження, підвищену частоту ожиріння і метаболічного синдрому [3].
Патогенез гіперурикемії
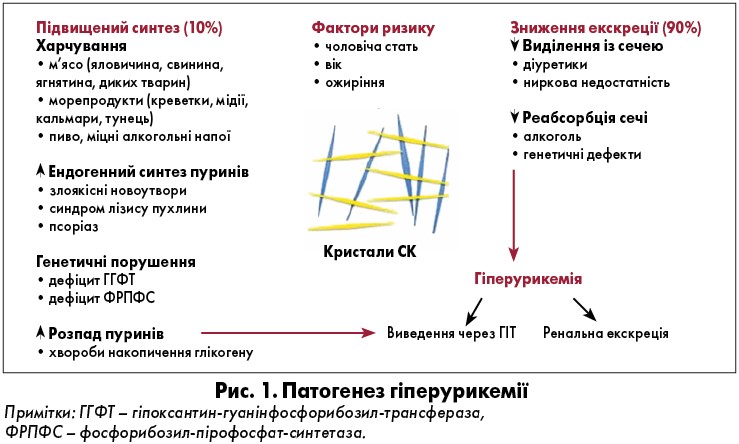
СК являє собою слабку кислоту з рН 5,8; урати, своєю чергою, є іонізованою формою СК. Відкладання кристалів у тканинах починає відбуватися, коли рівень СК у сироватці крові зростає вище межового рівня 404 мкмоль/л (6,8 мг/дл) [1]. Деякі фактори можуть впливати на розчинність СК у суглобах: рН синовіальної рідини, концентрація води, електролітів та інших синовіальних компонентів, таких як протеоглікани і колаген. Рівень СК визначається рівновагою між її ендогенною продукцією за рахунок клітинного обороту або вживанням пуринів та виділення нирками і гастроінтестинальним трактом (ГІТ). Встановлено, що збільшення продукції СК зумовлює лише 10% випадків подагри, а решта 90% викликана зниженою нирковою екскрецією [4].
Фактори, що впливають на рівні СК, включають, насамперед, вік і стать. У дітей рівень СК низький, а після досягнення пубертатного періоду концентрація починає зростати. У чоловіків показники СК вищі, ніж у жінок, проте у період постменопаузи вони сягають рівнів у чоловіків того ж віку. Рідко це спостерігається у дітей і молодих людей із деякими рідкісними вродженими аномаліями пуринового обміну. Такі ферментативні дефекти призводять до підвищення рівня СК із послідовної продукції кристалів у нирках і суглобах (рис. 1) [5].
Причини збільшення продукції СК
Генетичні порушення
Дефіцит ферментів, що беруть участь у метаболізмі пуринів, спостерігається при врождених генетично зумовлених аномаліях. Наприклад, синдром Леша – Ніхана є вродженим дефіцитом ферменту гіпоксантин-гуанінфосфорибозилтрансферази (ГГФТ), що залучений до метаболізму СК. Це генетичний Х-пов’язаний рецесивний розлад різного ступеня тяжкості за типом мутації. Клінічна картина даного захворювання включає неврологічні відхилення (дистонія, хорея), когнітивну дисфункцію, компульсивний розлад поведінки, суглобовий синдром (подагричний артрит) і сечокам’яну хворобу. За відсутності лікування відбуваються раннє утворення тофусів, руйнування суглобів з інвалідизацією та розвиток ниркової недостатності [6].
Іншою ферментативною аномалією, що викликає подагру в молодих людей, є підвищена активність фосфорибозил-пірофосфат-синтетази (ФРПФС) – X-пов’язаний домінантний спадковий розлад. Синдром має дві клінічні форми: тяжку ранню форму в дітей і легку пізню у дорослих. Клінічна картина включає неврологічні відхилення: сенсоневральну втрату слуху, гіпотонію та атаксію у тяжкій формі. Підвищений рівень СК проявляється сечокам’яною хворобою та артритом. Ці ферментативні порушення становлять менш ніж 10% випадків підвищення продукції уратів, утім їх також необхідно враховувати у разі виникнення подагричного артриту та сечокам’яної хвороби у молодих людей (до 30 років) без ожиріння [7].
Ендогенна гіперпродукція уратів
Підвищення ендогенного продукування СК відбувається внаслідок прискорення регенерації та метаболізму клітин, наприклад, при злоякісних новоутвореннях, гематологічних захворюваннях. Крім того, зростання концентрації пуринів може бути результатом хіміотерапії та пошкодження тканин. Збільшення маси тіла й ожиріння призводять до посиленої продукції СК, що зумовлює ризик гіперурикемії. Виявлено, що лептин знижує рівень уратів у сироватці крові, отже, втрата ваги і фізична активність вельми корисні для зменшення концентрації СК та ризику розвитку подагри [8].
Дієта
Споживання харчових продуктів тваринного походження і морепродуктів, багатих на пурини, особливо тих, що піддалися технологічній обробці, є ключовим елементом збільшення кількості попередників СК. Високий вміст пуринів у квасолі, сочевиці, грибах, горосі, бобових і молочних продуктах, однак вони не несуть жодного ризику щодо гіперурикемії, а отже, дозволені в дієті пацієнтів із подагрою. Крім того, продукти, багаті на вітамін С, молочні продукти з низьким вмістом жиру, певні рослинні олії (оливкова, соняшникова та соєва) сприяють зниженню ризику розвитку гіперурикемії та подагри [9]. Так, вітамін С підвищує ниркову активність, зокрема екскрецію СК, тому його можна використовувати як харчову добавку при лікуванні подагри [9].
Дослідження довели, що ймовірність виникнення подагри значною мірою пов’язана зі споживаною кількістю алкоголю. Крім того, ризик подагри та гіперурикемії залежить від типу напоїв [10]. Так, найвищий ризик встановлено для пива та міцного алкоголю, найнижчий – для сухих вин [10]. Власне, вживання сухих білих і червоних вин дозволене у дієті пацієнтів із подагрою.
Зниження екскреції СК
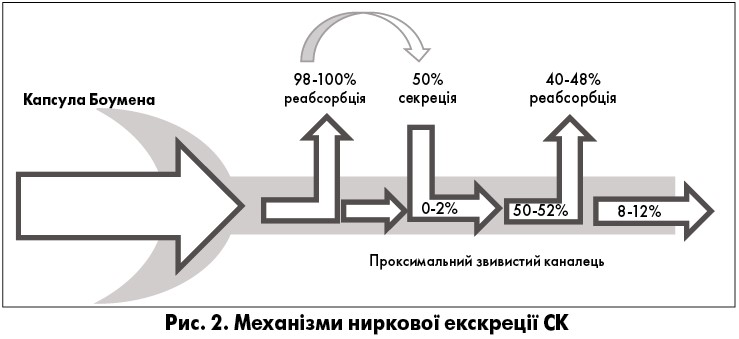
Дві третини екскреції уратів відбувається у нирках, а решта виводиться через шлунково-кишковий тракт (ШКТ). Зниження секреторної функції транспортера ABCG2 призводить до зменшення екскреції СК через ШКТ із підвищенням сироваткового рівня СК і посиленням ниркової екскреції [11].
Ниркова екскреція СК відбувається у чотири фази:
- перша – проходження СК через капсулу Боумена (клубочкова фільтрація);
- друга – наступна реабсорбція у проксимальних канальцях майже всіх уратів;
- третя – включає секрецію частини реабсорбованої СК у проксимальних канальцях;
- четверта – екскреція майже 10% відфільтрованих через капсулу Боумена уратів, решта абсорбується в організмі (рис. 2) [12].
Знижена ниркова екскреція уратів асоціюється з аутосомно-домінантними порушеннями. Уромодулін – це ген, який експресується у товстому висхідному сегменті петлі Генле і відповідає за регулювання водопроникності. Мутації гена уромодуліну зумовлюють зниження фракційної екскреції СК, що, своєю чергою, збільшує концентрацію СК у крові [13].
Кристали СК є погано розчинними субстанціями, тому для перетину ними клітинних мембран потрібні специфічні мембранні транспортери: URAT (переважно URAT1) й органічні аніонні транспортери (OAT1 та OAT3) [4]. URAT1 транспортує СК у реабсорбовану рідину через проксимальні трубочки за допомогою активного транспортного процесу [14]. Урикозуричні препарати, такі як пробенецид, бензбромарон і сульфінпіразон, знижують активність URAT1, а отже, і реабсорбцію СК у проксимальних канальцях. З іншого боку, такі препарати, як піразинамід, нікотинат і лактат збільшують реабсорбцію уратів, діючи на URAT1, переміщуючи СК із просвіту в тубулярні клітини, збільшуючи гломерулярну фільтрацію та канальцеву реабсорбцію СК, що запобігає її втраті у сечі та підвищує рівень СК у сироватці крові [14]. Речовини, що впливають на активність URAT1, можуть потенціювати або пригнічувати її відповідно до застосовуваної дози. Наприклад, низькі дози ацетилсаліцилової кислоти мають антиурикозуричний ефект, тоді як високі пригнічують URAT1, а отже, посилюють урикозуричну дію. Цей процес називається цис-інгібуванням URAT1 [15]. Саме тому низькі дози ацетилсаліцилової кислоти можуть зумовлювати гіперурикемію і провокувати гострі напади подагри.
Гени, відповідальні за регулювання екскреції СК
Ген SLC22A12 кодує транспортер URAT1, присутній на апікальної мембрані ниркових канальців [14]. SLC2A9 є ще одним геном, який бере участь у регуляції виведення СК – кодує транспортний білок у мембрані ниркових канальців [16]. Поліморфізм обох генів призводить до зниження екскреції СК і, відтак, до гіперурикемії. ABCG2 є генним транспортером для СК у проксимальних канальцях нирки, а також у ШКТ [4]. Гени SLC17A1, SLC17A3 теж є важливими детермінантами сироваткової концентрації СК, що діють як мембранні транспортери в кишечнику. Інші гени, які визначають рівень СК, включають SLC22A11, регуляторний білок глюкокінази (GCKR), Carmil (LRRC16A) і близький домен PDZ, що містить 1 (PDZK1) ген [16]. Зменшення/збільшення експресії цих генів суттєво моделює концентрацію СК у сироватці крові, ризик розвитку подагри та ступеня й швидкості ураження органів-мішеней – суглобів і нирок.
Патогенез гострого подагричного артриту
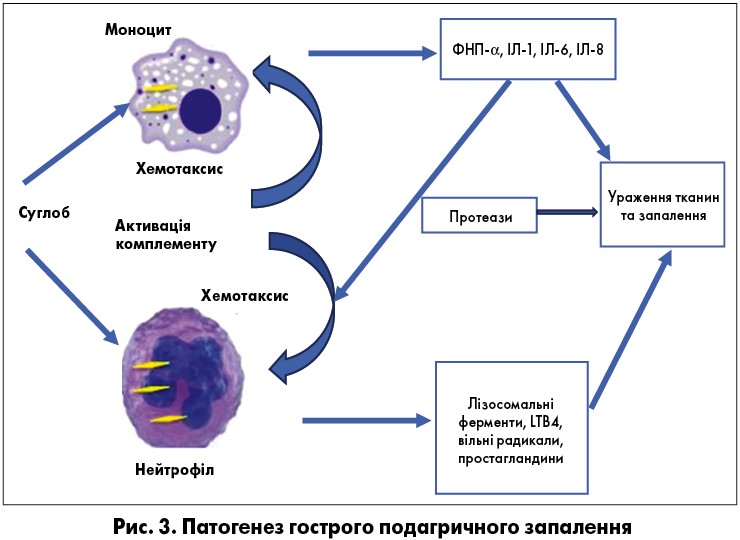
Депозиція кристалів СК у порожнині суглоба є основною причиною подагри. Ці кристали ініціюють запальний процес, поглинаючись синовіальними фагоцитами, що призводить до вивільнення лізосомальних ферментів і продукції запальних цитокінів та хемокінів. Крім того, кристали СК змінюють стабільність мембрани фагоцитарних клітин шляхом прямого утворення поперечних зв’язків із ліпідами мембран та глікопротеїнами. Це передбачає активацію G-білків, фосфоліпаз А2, С і D, тирозинкінази та інших кіназ, таких як мітоген-активовані (ERK1/ERK2, p38) і c-Jun N-кінцева [17]. Така взаємодія призводить до збільшення інтерлейкіну‑8 (IЛ‑8) у фагоцитах, зумовлюючи активацію нейтрофілів [17].
Патогенез подагричного артриту охоплює початкову активацію моноцитів і тучних клітин із наступним залученням нейтрофілів. До першого нападу подагри та у міжнападний період макрофаги поглинають кристали СК. Добре диференційовані макрофаги мають здатність утримувати ці кристали, не викликаючи запальної реакції. Водночас менш диференційовані моноцити продукують значну кількість фактора некрозу пухлин α (ФНП-α), IЛ‑1, IЛ‑6 та IЛ‑8 разом із ендотеліальною активацією після фагоцитозу уратних кристалів [18]. Слід зазначити, що тучні клітини є ключовими «гравцями» в індукції атаки подагричного артриту за рахунок продукції гістаміну та ІЛ‑1. Це зумовдює підвищення проникності судин і вазодилатацію [18].
Хемотаксичні фактори, що продукуються моноцитами і лаброцитами, викликають місцеву вазодилатацію та стимулюють нейтрофільний хемотаксис [19]. Крім того, активація ендотеліальних клітин додатково посилює запальну реакцію та локальну міграцію нейтрофілів. Вважається, що дія колхіцину після зупинки гострого нападу відбувається шляхом зміни афінності селектинів на ендотеліальних клітинах і нейтрофілах до медіаторів запалення, а також блокування нейтрофільної стимуляції, індукованої ендотеліальними клітинами [20]. У синовіальній оболонці наявна значна кількість хемотаксичних факторів, таких як лейкотрієни, фактор активації тромбоцитів та, переважно, IЛ‑8, відповідальних за активацію 90% нейтрофілів і запалення. Відповідно, націлювання на ІЛ‑8 може бути перспективним терапевтичним напрямком для припинення гострого нападу подагри [21].
Гострий напад подагри зазвичай самостійно регресує протягом декількох годин/днів від його початку. Це відбувається шляхом видалення і фагоцитозу кристалів СК макрофагами, супресією клітинної та хемокінової активації. Крім того, макрофаги очищають клітинні апоптотичні залишки, зупиняючи запальний каскад. Додатково, макрофаги секретують трансформуючий фактор росту β (ТФР-β), які елімінують IЛ‑1, що відіграє одну із ключових ролей у запальному процесі [22]. Інші механізми, які беруть участь у припиненні гострого нападу, включають протеоліз прозапальних цитокінів, зменшення експресії рецепторів ФНП-α та ІЛ на поверхні лейкоцитів. Вазодилатація та підвищена проникність судин також важливі для забезпечення екстравазації макрофагів у синовіальну рідину для очищення запальної зони (рис. 3) [22].
Патогенез хронічної подагри
Хронічний перебіг є особливістю подагри і наслідком персистуючого запалення, яке йде за рецидивними нападами гострого подагричного артриту. Хронічний подагричний артрит проявляється хронічним синовітом, кістковими ерозіями, пошкодженням хряща й утворенням тофусів. Наявність КМУН у синовіальній оболонці стимулює хондроцити до продукції запальних цитокінів, оксиду азоту та матриксних металопротеаз, що зумовлює пошкодження суглобового хряща [23, 24]. На рівні кістки IЛ‑1β та активація рецептора ядерного фактора κB (RANK) і RANK-ліганду (RANK-RANKL) є ключовими механізмами активації остеокластогенезу й утворення ерозій кісток [24]. Подагричні ерозії характеризуються наявністю нависаючих (ніби підритих) країв і звуженням суглобових щілин. Остеокласти вивільнюють численні прозапальні цитокіни, що також призводить до ерозій і руйнування кісток. У міжнападний період спостерігається стійке низькоінтенсивне запалення у тканинах суглобів. Ті ж самі цитокіни, що відповідають за гострі спалахи, можуть бути виявлені в менших концентраціях у період між атаками [25]. Ймовірне зменшення швидкості переходу інтермітуючої фази подагри у хронічну при тривалому застосуванні низьких доз протизапальних засобів, таких як колхіцин, і зниженні рівня СК до таргетного (<6 мг/дл) [24,25].
Нормальна екскреція СК становить 7‑10%, її зменшення призводить до підвищення рівня уратів у сироватці крові [26].
Цікаво, що сироваткові рівні СК знижуються під час гострого нападу подагри, що відображає процес депонування кристалів у тканинах суглобів. Таким чином, визначення концентрації СК у сироватці крові під час гострого нападу подагри може надати «хибно низькі» показники, відтак, відтермінувати встановлення діагнозу. Крім того, провокування гострого подагричного нападу є звичайним явищем після початку терапії алопуринолом або фебуксостатом без профілактичного застосування НПЗП або колхіцину, що пояснюється перерозподілом концентрацій СК. Також стани, які зумовлюють підвищену екскрецією СК, наприклад під час операції, можуть викликати гостру подагричну атаку. Відповідно, передбачається, що раптове зниження СК також спричиняє гострий подагричний артрит [27].
Хоча гіперурикемія є основною причиною подагри, сама СК є відомим антиоксидантом, що має захисну роль у судинному ендотелії. На сьогодні залишаються остаточно не з’ясованими наступні питання: чи корисна присутність СК? Яка концентрація СК важливіша – внутрішньо- чи позаклітинна? Наскільки низька концентрація СК є небезпечною для когнітивної функції [28]?
Вплив системних захворювань на СК
Подагра має високий індекс коморбідності та пов’язана із низкою супутніх станів, зокрема артеріальною гіпертензією, серцево-судинними захворюваннями, нирковою недостатністю, цукровим діабетом (ЦД), ожирінням і гіперліпідемією. Наявність цих патологічних станів і прийом препаратів, що використовуються у їхньому лікуванні, можуть сприяти розвитку подагри.
Подагра, як видається, частіше вражає суглоби з остеоартритом (ОА). Це спостереження показує, що пошкодження хряща в результаті ОА викликає утворення кристалів СК. Їх накопичення в суглобі є наслідком зниження васкуляризації та сприйнятливості синовіальної мембрани до проходження кристалів [29]. Артеріальна гіпертензія теж відома як фактор ризику розвитку гіперурикемії та подагри. Підвищення системного артеріального тиску призводить до зниження швидкості клубочкової фільтрації (ШКФ), зумовлюючи зменшення клубочкового кровотоку і виведення СК [30]. Гіперурикемія, своєю чергою, спричиняє підвищення артеріального тиску, а СК – розвиток гіпертонічної хвороби [31]. ЦД та інсулінорезистентність також є сприятливим фоном для гіперурикемії та подагри [32]. Порушення окисного фосфорилювання підвищує рівень аденозину, збільшує продукцію СК і знижує її ниркову екскрецію. Гіперурикемія асоціюється з метаболічним синдромом, інсулінорезистентністю, гіпертригліцеридемією та входить до розширеного переліку симптомів, що формують цей стан [33].
Клінічний діагноз
Асимптомна гіперурикемія
Перша клінічна стадія подагри – безсимптомна гіперурикемія. У пацієнтів відсутні клінічні симптоми або ознаки хвороби, і підвищений рівень СК (понад 420 мкмоль/л) виявляється випадково.
Гострий подагричний напад
Гострий подагричний напад зазвичай є моноартикулярним, сягаючи максимуму протягом кількох годин, із характерними ознаками запалення, серед яких типовий «червоно-синюшний» колір шкіри над запаленим суглобом, локальне підвищення температури, виразна болючість, набряк і втрата функції [23]. У великих суглобах – колінних і гомілковоступеневих, шкірні ознаки зустрічаються рідше, але набряк та біль можуть бути більш інтенсивними. Подагра має схильність до ураження суглобів нижніх кінцівок, таких як 1-й плеснефаланговий суглоб, який є «улюбленою» локалізацією для гострого нападу [23]. Інші суглоби, що також часто уражаються: тарзальні, метатарзальні, гомілковоступневі, колінні, зап’ясткові, п’ястково-фалангові, міжфалангові суглоби кистей. Зрідка можуть бути залучені крупні суглоби – кульшовий та плечовий, а також міжхребцеві. Типовим є ушкодження зв’язкового апарату склепіння ступні, бурсит ліктьового суглоба та ахілотендиніт [34]. Поліартикулярне ураження (залучення більш ніж трьох суглобів) під час гострого нападу завжди свідчить про його тяжкість, інтенсивне запалення, найчастіше зустрічається при тривалому анамнезі подагри або в жінок у постменопаузі [34].
Міжприступний період
Після купірування гострого нападу в пацієнтів наступає фаза ремісії – «світлий проміжок». Цей період характеризується відсутністю симптомів, але може бути раптово перерваний новими нападами, якщо не було проведене належне лікування гіперурикемії. З часом, за умов утримання гіперурикемії, напади стають частішими, тривалішими, інтенсивнішими та менш чутливими до дії протизапальних препаратів. За відсутності корекції гіперурикемії повторний напад розвивається впродовж року в 62% пацієнтів, двох років – у 78% [34].
Кожна наступна кристалічна атака перебігає важче, міжприступний період коротшає, залучаються нові суглобові групи, захворювання набуває періодичного поліартрикулярного мігруючого характеру [23].
Хронічна тофусна подагра
Тривала гіперурикемія може призвести до утворення депозитів уратів без симптомів, а іноді й пов’язаних із субклінічним запаленням. Далі розвиваються інтермітуючі епізоди гострого запалення, викликані відкладанням кристалів моноурату натрію у порожнині суглоба; з часом проміжки між цими атаками (спалахами запалення) зменшуються, артрит набуває хронічного перебігу, а запалення – персистуючого характеру. Наступний етап – структурне пошкодження суглобів унаслідок хронічного запального процесу та руйнування суглобових структур тофусами (депо моноурату натрію).
Тофуси утворюються за «природного» перебігу подагри та відсутності адекватної уратзнижувальної терапії (УЗТ) у середньому через 7‑10 років від дебюту захворювання. Частота виявлення сягає 34% і наростає паралельно тривалості хвороби, хоча зрідка вони можуть бути першим клінічним проявом подагри, передуючи типовим нападам артриту. Відкладання моноурату натрію у тканинах передбачає повільне епітаксіальне нарощення кристалів із формуванням кристалічних структур. Відкладання кристалів моноурату натрію найчастіше спостерігається у тканинах суглоба, навколосуглобових сумках, зв’язках, проте в літературі описані казуїстичні випадки відкладення уратних депозитів у стінці шлунка, тканинах нирки, міокарді та клапанах серця, а також хребті, що призводить до повної деструкції хребців і розвитку життєзагрозливої неврологічної симптоматики [35]. Гістологічно тофус є крейдоподібним (білого кольору в центральній його частині) вузлом, що складається із кристалів моноурату натрію, білків і мукополісахаридів; відкладання оточені гістіоцитами, лімфоцитарним валом і фібробластами. При обробці формаліном кристали моноурату натрію можуть розчинятися, що буває причиною відсутності у препараті кристалів при проведенні поляризаційної мікроскопії.
Рання поява тофусів спостерігається при деяких формах ювенільної подагри, на тлі прийому діуретиків, у жінок похилого віку, при мієлопроліферативних захворюваннях та деяких хворобах нирок [29].
Уратні депо зумовлюють постійне низькорівневе запалення у тканинах, підвищення запальних маркерів у синовіальній рідині, тканинах суглоба і крові, призводячи до ерозивно-деструктивного ураження суглобів і формування коморбідності. Недостатній контроль рівня СК у сироватці крові спричиняє запалення все нових і нових суглобів, що, як правило, поєднується з виникненням внутрішньошкірних і внутрішньокісткових тофусів, які можуть «розкриватися», формуючи характерні шкірні дефекти, які важко загоюються. Крім фізичного та естетичного дискомфорту, тофуси можуть викликати функціональні порушення, зниження якості життя хворих, їхньої працездатності, нерідко інвалідизацію.
Лабораторна діагностика
Діагностика подагри на основі наявності тільки гіперурикемії є поширеною помилкою серед лікарів різних спеціальностей. Гіперурикемія зазвичай перебігає безсимптомно і не потребує встановлення діагнозу подагри. Серед пацієнтів із рівнем СК 420‑479 мкмоль/л (7‑7,9 мг/дл) тільки у 0,09% щороку розвивається подагра, 480‑539 мкмоль/л (8‑8,9 мг/дл) – у 0,4%, вище 540 мкмоль/л (9 мг/дл) – у 0,5% [36]. Хоча гіперурикемія є характерною рисою подагри, слід зазначити, що під час подагричних атак ймовірне зниження СК до нормальних показників. Отже, хворобу може бути діагностовано навіть при нормальному сироватковому рівні СК за умов типового нападу і візуалізації кристалів СК у пунктаті із запаленого суглоба [37].
«Золотим» стандартом діагностики подагри є ідентифікація КМУН в аспіраті синовіальної рідини з використанням мікроскопії поляризованого світла і диференціації від інших кристалів, таких як кристали пірофосфату кальцію (КПФК). Зразки слід перевірити якомога швидше – краще протягом 6 год. При світловій мікроскопії кристали СК мають голкоподібну форму з різними розмірами. Їх можна легко відрізнити від КПФК (псевдоподагра), які зазвичай ромбоподібні. КМУН виявляються у синовіальній рідині на всіх стадіях захворювання [38].
Необхідно пам’ятати, що при типових проявах подагри – інтермітуючому запаленні 1-го плеснефалангового суглоба і гіперурикемії, клінічний діагноз потребує акуратності, оскільки не є певним без підтвердження наявності КМУН.
Наступний аналіз синовіальної рідини повинен включати підрахунок кількості лейкоцитів, розгляд біохімічних показників, бактеріальний посів із визначенням чутливості до антибіотиків. При гострому нападі подагри кількість лейкоцитів у синовіальній рідині може перевищувати 50 000 клітин/мл, біохімічний аналіз виявляє нормальний рівень глюкози на противагу септичному артриту, при якому бактерії споживають глюкозу, що призводить до її низької концентрації [39]. При атиповому перебігу подагри, наприклад, при множинному ураженні суглобів або атиповій локалізації, виявлення кристалів СК є необхідним для проведення диференційного діагнозу. Крім того, згідно з рекомендаціями Європейської протиревматичної ліги (EULAR), аналіз синовіальної рідини є обов’язковим і рекомендується для виключення інших причин, головним чином, септичного артриту [37].
Аналіз ступеня екскреції СК є корисним для оцінки етіології гіперурикемії у пацієнтів із подагрою. СК понад 800 мг/24 год свідчить, що, поряд зі збільшенням продукції, екскрецію СК не порушено. Ці пацієнти потребують лікарського засобу, який запобігає виробленню СК, наприклад інгібітора ксантиноксидази, а не урикозуричного агента. Крім того, таким хворим необхідно регулярно проводити оцінку функції нирок і ультрасонографічне дослідження [38] через високий ризик каменеутворення [39].
Рентгенологічна діагностика
Значення візуалізації при подагричному артриті не можна переоцінити. Це надзвичайно важливий метод дослідження для діагностики та клінічного спостереження, причому на сьогодні його потенціал зростає.
Рентгенографія
Рентгенографія (РГ) суглобів – це метод дослідження, який найбільш широко використовується у клінічній практиці, проте на ранніх стадіях подагри його значення мінімальне. Патогномонічні рентгенографічні зміни зазвичай з’являються за 10 років після першої подагричної атаки [41]. На ранніх стадіях подагри можна виявити асиметричні набряки м’яких тканин поблизу ушкоджених суглобів, але характерні ураження, такі як ерозії та тофуси, зазвичай не візуалізуються [41].
При хронічній тофусній подагрі головними рентгенологічними ознаками є:
- тофуси, артикулярні або періартикулярні щільні вузлики;
- відкладення КМУН у хрящовій тканині;
- звуження суглобових щілин [41];
- ерозії кісток із нависаючими краями – оскільки вони є результатом росту тофусів у кістковій тканині, зазвичай спостерігаються поблизу тофусів [42];
- проліферація кісткової тканини у вигляді нерівномірних спікул; періартикулярна остеопенія, як правило, відсутня [43];
- у тяжких випадках кальцифіковані КМУН можуть пенетрувати кістку (не слід плутати з кістковими інфарктами або енхондромами).
Рентгенографія має низьку чутливість (31%), проте її специфічність є високою (93%).
Досить добре відомий рентгенологічний феномен, типовий для пізньої подагри – симптом «пробійника». Вперше він описаний 1896 р. Huber як дефект субхондральної кістки діаметром 5 мм і більше, що розташовується в медіальній частині основи діафізу або голівці фаланги, частіше 1-го плеснефалангового суглоба. Обговорюючи симптом «пробійника», необхідно відзначити низку моментів, що вказують на значущість його виявлення. По-перше, патоморфологічним субстратом цього рентгенологічного феномена є внутрішньокістковий тофус (враження про кістозний утвір формується через те, що КМУН не затримують рентгенівських променів). Виявляючи «пробійник», стадію хвороби відразу ж визначають як хронічну тофусну. Загальноприйнято вважати тофуси будь-якої локалізації прямим показанням для початку противоподагричної терапії. Ґрунтуючись на власному досвіді та даних літератури можна зробити висновок, що симптом «пробійника» у хворих на первинну подагру є пізньою ознакою, що асоціюється із тривалим перебігом захворювання і хронічним артритом.
Ультразвукове дослідження
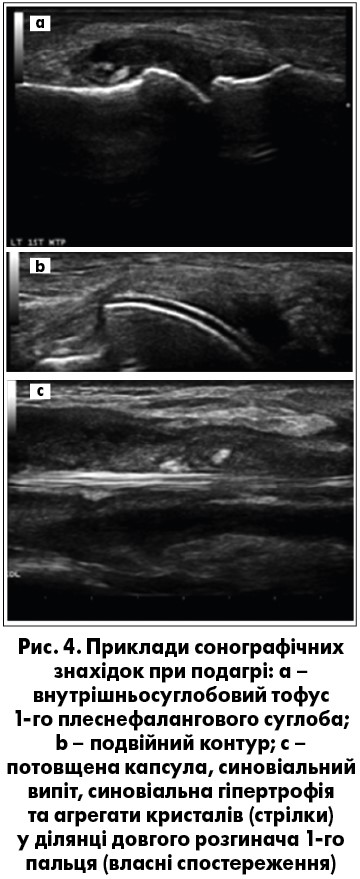 Останнім часом прогрес у технології ультразвукового дослідження (УЗД) заохочує його використання для діагностики багатьох захворювань з ураженням суглобів, зокрема подагри [44]. Основними показаннями до застосування УЗД при кристал-індукованому артриті є: виявлення випоту та синовіту суглобів, диференціація активного та неактивного синовітів, вивчення стану хряща, опис контурів кісток, а саме визначення наявності ерозій і остеофітів, оцінка стану сухожилків і кристалічного осаду, виконання процедур, керованих УЗД (діагностичні та/або терапевтичні), моніторинг еволюції захворювання, а також допомога у диференційній діагностиці з іншими артритами (рис. 4).
Останнім часом прогрес у технології ультразвукового дослідження (УЗД) заохочує його використання для діагностики багатьох захворювань з ураженням суглобів, зокрема подагри [44]. Основними показаннями до застосування УЗД при кристал-індукованому артриті є: виявлення випоту та синовіту суглобів, диференціація активного та неактивного синовітів, вивчення стану хряща, опис контурів кісток, а саме визначення наявності ерозій і остеофітів, оцінка стану сухожилків і кристалічного осаду, виконання процедур, керованих УЗД (діагностичні та/або терапевтичні), моніторинг еволюції захворювання, а також допомога у диференційній діагностиці з іншими артритами (рис. 4).
Подагрі властиві специфічні й неспецифічні УЗД-ознаки. До неспецифічних симптомів можна віднести наступні:
- Синовіальна рідина: зміна синовіальної рідини від абсолютно неехогенної до сукупності агрегатів змінної ехогенності. Агрегати мікрокристалів моноурату натрію можуть бути виявлені як гіперехогенні плями або ехопозитивні крапкові фокуси. Вони, як правило, знаходяться в підвішеному стані у суглобовому просторі, іноді даючи появу «снігової бурі» при пальпації суглоба під час дослідження [45].
- Синовіальна проліферація і гіперваскуляризація: доплерівський режим може диференціювати наявність чи відсутність активного запалення синовіальної тканини шляхом оцінки її васкуляризації. Це є вкрай важливим не тільки для діагностики, а також для моніторингу перебігу захворювання та відповіді на терапію [44].
- Ерозії кісток: визначаються при подагрі як інтра- та/або екстраартикулярна перерваність поверхні кістки у двох перпендикулярних площинах [46]. Частіше виявляються у пацієнтів із частими нападами подагри або у тих, хто має значну тривалість захворювання та тофуси [46]. УЗД втричі чутливіше, ніж рентгенографічне дослідження, у виявленні ерозій <2 мм [44].
- Симптом «подвійного контура», «уратна глазур», або «уратне обмерзання» (urate icing) над суглобовим хрящем є специфічним симптомом для подагри. Поява «подвійного контура» пов’язана зі здатністю КМУН депонуватися на поверхні хряща, що при УЗД виявляється як додаткова гіперехогенна світла лінія, яка йде паралельно лінії переходу субхондральної кістки у хрящ і відзначається незалежно від кута падіння ультразвукового променю [46]. Цей феномен можна виявити як при гострому запаленні, так і в пацієнтів зі стійкою безсимптомною гіперурикемією (доманіфестна стадія подагри) [44]. Повідомлялося також про помилкові позитивні результати – псевдопозитивний симптом «подвійного контура», який може виникати на поверхні хряща, повинен зникати після зміни кута прикладання датчика [47]. Цікаво, що симптом «подвійного контура» може зникнути при досягненні стійко низьких рівнів СК (нижчих за 360 мкмоль/л, або 6 мг/дл) протягом щонайменше 7 місяців [48].
- Депозити КМУН виявляють у вигляді тофусів чи агрегатів. Тофус – це обмежена, неоднорідна, гіперехогенна та/або гіпоехогенна агрегація, яка генерує акустичну тінь і може бути оточена анехогенним обідком. Агрегати являють собою гетерогенні гіперехогенні вогнища, які зберігають високий ступінь відбивної здатності навіть при меншому коефіцієнті підсилення або зміні кута інсонації. Тофуси також можуть виявлені на УЗД як «мокрий згусток цукру» (wet sugar clumps) овальної або ж неправильної форми [48]. Внутрішньосуглобові та внутрішньосумкові тофуси визначаються як гетерогенні гіперехогенні (відносно субдермального жиру) субстанції з погано визначеними краями з/без ділянок акустичного затінення у синовіальних кишенях чи суглобових сумках відповідно [50]. Доплерівське УЗД також може розрізняти активні/гарячі й неактивні/холодні тофуси залежно від доплерівського сигналу [44].
Комп’ютерна томографія
Комп’ютерна томографія (КТ) характеризується відмінною роздільною здатністю і високою контрастністю, а отже, є однією з найкращих методик для оцінки та характеристики кристалічних артропатій [41]. Проте КТ малоінформативна при гострому нападі подагри, оскільки не дозволяє візалізувати запалення, синовіт, тендиніт та остеїт; утім значення КТ важко переоцінити в діагностиці хронічної подагри. Цей метод здатний краще виявляти ерозії, ніж магнітно-резонансна томографія (МРТ) або РГ [51]. Ерозії описують як чітко визначені, літичні ураження кісток зі склеротичними нависаючими краями – симптом «пробійника» [52]. КТ порівняно з УЗД або МРТ здатна точніше диференціювати тофусні маси, оскільки середній показник за шкалою ослаблення рентгенівського випромінювання Хаунсфілда для депозитів КМУН досить стабільний та істотно відрізняється від такого для депозитів кристалів кальцію, причому незалежно від кальцифікації тофуса. Тофуси у м’яких тканинах – внутрішньосуглобові, а також внутрішньокісткові, з’являються у вигляді м’якотканинних мас з ослабленням сигналу, що полегшує їх розрізнення з іншими ураженнями м’яких тканин [52]. КТ корисна для відстеження динаміки хвороби та відповіді на терапію, але має недолік у вигляді радіаційного опромінення.
Двоенергетична комп’ютерна томографія
 Як і КТ, двоенергетична комп’ютерна томографія (ДЕКТ) може виявляти пошкодження, але не диференціює запалення. ДЕКТ перевершує всі інші доступні варіанти візуалізації у своїй здатності ідентифікувати уратні депозити (рис. 5) [53]. Висока роздільна здатність ДЕКТ робить цей швидкий, неінвазивний метод дослідження першорядним у візуалізації КМУН, змін м’яких тканин і ранніх ерозій. Це, зокрема, істотно допомагає в диференціальному діагнозі з пігментним вілонодулярним синовітом, псоріатичним, септичним, ревматоїдним, кристал-індукованими артритами, що можуть мати подібні клінічні ознаки з подагрою [54]. ДЕКТ високоточна у виявленні кристалів КМУН у суглобах, сухожиллях, зв’язках та м’яких тканинах і може бути використаний для виявлення субклінічної подагри з високою специфічністю [52]. Однак ДЕКТ не візуалізує відкладення кристалів на поверхні хряща – особливість, яку на УЗД можна виявити як синдром «подвійного контура» [55]. Незначна щільність тофусів внаслідок менших концентрацій кристалів, їх невеликі розміри (менш ніж 2 мм) зумовлюють помилково-негативні результати при ДЕКТ [55]. Крім того, описують багато помилково-позитивних результатів наявності тофусів навколо нігтьового ложа, у шкірі, ділянках металевих артефактів та у тяжких стадіях ОА [56]. ДЕКТ не є широко доступною, що обмежує її застосування для клінічних і дослідницьких цілей, витрати на випробування вищі, ніж КТ, а також цей метод пов’язаний із радіаційним опроміненням.
Як і КТ, двоенергетична комп’ютерна томографія (ДЕКТ) може виявляти пошкодження, але не диференціює запалення. ДЕКТ перевершує всі інші доступні варіанти візуалізації у своїй здатності ідентифікувати уратні депозити (рис. 5) [53]. Висока роздільна здатність ДЕКТ робить цей швидкий, неінвазивний метод дослідження першорядним у візуалізації КМУН, змін м’яких тканин і ранніх ерозій. Це, зокрема, істотно допомагає в диференціальному діагнозі з пігментним вілонодулярним синовітом, псоріатичним, септичним, ревматоїдним, кристал-індукованими артритами, що можуть мати подібні клінічні ознаки з подагрою [54]. ДЕКТ високоточна у виявленні кристалів КМУН у суглобах, сухожиллях, зв’язках та м’яких тканинах і може бути використаний для виявлення субклінічної подагри з високою специфічністю [52]. Однак ДЕКТ не візуалізує відкладення кристалів на поверхні хряща – особливість, яку на УЗД можна виявити як синдром «подвійного контура» [55]. Незначна щільність тофусів внаслідок менших концентрацій кристалів, їх невеликі розміри (менш ніж 2 мм) зумовлюють помилково-негативні результати при ДЕКТ [55]. Крім того, описують багато помилково-позитивних результатів наявності тофусів навколо нігтьового ложа, у шкірі, ділянках металевих артефактів та у тяжких стадіях ОА [56]. ДЕКТ не є широко доступною, що обмежує її застосування для клінічних і дослідницьких цілей, витрати на випробування вищі, ніж КТ, а також цей метод пов’язаний із радіаційним опроміненням.
Магнітно-резонансна томографія
На МРТ добре візуалізуються ознаки запалення, зміни синовіальної оболонки, наявність випоту, ерозії та набряк кісткового мозку (рис. 6). Описано користь МРТ під час диференціальної діагностики тофусу і новоутворення, інфекційних процесів, тунельних синдромів [57]. Крім того, цей метод може бути хорошим засобом контролю при проведенні УЗТ завдяки можливості оцінювати розміри і кількість тофусів у динаміці. Зображення тофусів варіабельне: сигнал від них може бути гомо- або гетерогенним, а інтенсивність – як низькою, так і високою, що залежить від ступеня гідратації та кальцифікації тофусу. У Т1-режимі тофуси характеризуються, як правило, гетерогенною низькою інтенсивністю сигналу. В Т2-режимі сигнал низької інтенсивності відзначається у разі наявності великої кількості кальцію, фібрину і кристалів, а гіперінтенсівний, навпаки, властивий для гідратованих тофусів [58].
МРТ є корисним методом для оцінки наявності подагри з нетиповою локалізацією: при ураженнях хребта [59], сакроіліальних зчленуваннях [60], синдромі зап’ястного каналу [61], параспінальному абсцесі [62] або внутрішньочеревних депозитах КМУН [63]. Діагноз подагри у цих клінічних випадках був виставлений за допомогою МРТ.
Позитронно-емісійна томографія
Повідомлення про випадки діагностування подагри за допомогою позитронно-емісійної томографії (ПЕТ/КТ) грунтуються на поглинанні суглобової та періартикулярної тканин ФДГ (18F-фтор‑2-дезокси-D-глюкози). Є дані про поглинання ФДГ м’якими тканинами, що допомагає ідентифікувати тофуси. Це може бути корисним, коли подагра локалізується в нетипових місцях при проведенні складного диференціального діагнозу [64].
Основні досягнення у візуалізації подагри відбувалися протягом останнього десятиріччя. Незважаючи на це, на даний час невідомо, які ще додаткові методи візуалізації можуть надати валідні й дійсні результати для діагностики подагри. Гіпотезується необхідність наступного розвитку УЗД і ДЕКТ для вдосконалення поточної генерації глобальних результатів, пов’язаних із діагностикою подагри.
Лікування
Подагра позиціонується як достатньо зрозуміле і добре контрольоване ревматичне захворювання. Зниження рівня урикемії дозволяє розчиняти/редукувати депозити патогенних кристалів і стишувати прояви хвороби. На сьогодні для уникнення помилкових терапевтичних стратегій створено низку рекомендацій [65‑67]. Найчастіше невдачі лікування зумовлені низькою прихильністю хворих до терапії [68], що підкреслює необхідність навчання пацієнта і лікаря.
Існують дослідження, які доводять, що нормалізація маси тіла (за допомогою дієти або хірургічним шляхом) ефективна для зниження рівня СК. Крім того, регулярна фізична активність може зменшити рівень смертності, пов’язаний із гіперурикемією. Доведено зв’язок між надлишковим споживанням м’яса й алкоголю та підвищенням ризику виникнення подагричної атаки, а також між вживанням молочних продуктів і зниженням рівня уратів (особливо кисломолочної продукції, низькокалорійних йогуртів) [69]. Проте дієта і модифікація способу життя не суттєво впливають на зниження рівня СК, їх слід розглядати здебільшого як заходи профілактики кардіоваскулярних ускладнень.
Із 2016 р. представлені оновлені рекомендації EULAR щодо терапії подагри [67]. Відповідно до цих рекомендацій, є два основних напрямки у лікуванні пацієнта з подагрою – купірування гострої подагричної атаки та корекція гіперурикемії.
Менеджмент загострень подагри
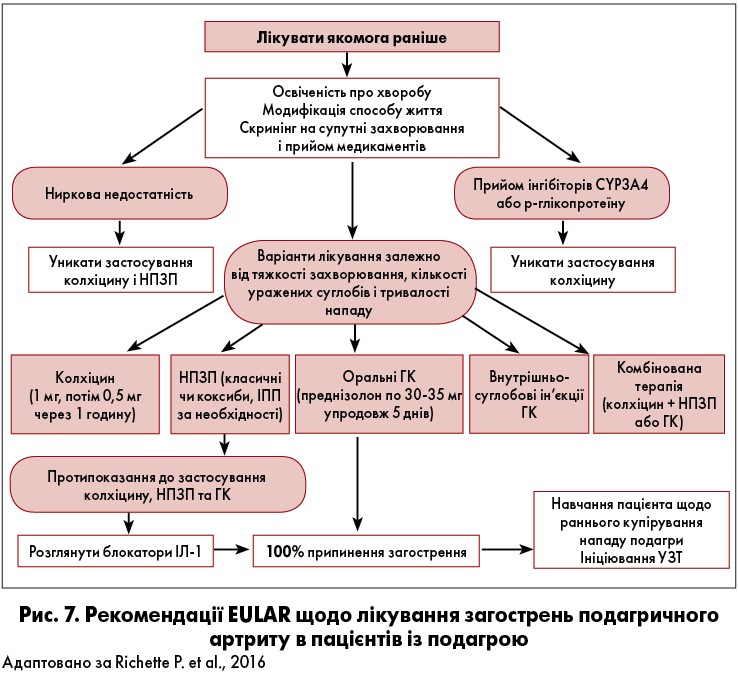
Препарати для усунення подагричної атаки включають колхіцин, НПЗП та глюкокортикоїди (ГК), які можна приймати сумісно у тяжких випадках. Ці медикаменти найбільш дієві при ранньому використанні (найдоцільніше у перші 24 год від початку нападу) (рис. 7). EULAR рекомендує навчати пацієнтів засадам надання собі першої медичної допомоги самостійно [67].
Колхіцин
При прийомі протягом 12 год після початку нападу 1,5 мг (1,0 мг, потім 0,5 мг/год та надалі по 0,5 мг тричі на день до зняття приступу) колхіцину виявилися настільки ж ефективними, як традиційні вищі дози [70]. У клінічній практиці цей препарат є набагато менш дієвим, якщо пацієнт починає його прийом пізніше ніж 12‑24 год після початку гострого подагричного артриту. EULAR та Американський коледж ревматології (ACR) обмежили застосування колхіцину хворим, у яких вже пройшло 12 і 24 год після початку нападу. Практикуючим лікарям слід пам’ятати, що колхіцин має вузьке вікно терапевтичної токсичності й може бути дуже токсичним при неправильному використанні. Гастроінтестинальна непереносимість (діарея, нудота або блювання) зустрічаються доволі часто. Подальша токсичність включає нейтропенію і мультиорганну недостатність, які можуть бути фатальними. Нещодавно максимальну добову дозу було зменшено до 2 мг (у розділених дозах). Ниркова недостатність знижує екскрецію колхіцину. Дози повинні бути обмежені 0,5‑0,6 мг/добу у пацієнтів із помірною нирковою недостатністю – ШКФ від 30 до 60 мл/хв і до 0,5‑0,6 мг кожні два або три дні в осіб зі ШКФ від 15 до 30 мл/хв [71]. Колхіцин протипоказаний у пацієнтів із V стадією хронічної хвороби нирок (ХХН): ШКФ <15 мл/хв або діаліз. Дози також повинні бути знижені у хворих на печінкову недостатність, оскільки препарат переважно виводиться через печінково-біліарну систему. Інгібітори цитохрому Р450 3А4 або глікопротеїну Р підвищують концентрацію у плазмі й токсичність колхіцину. Дози колхіцину слід зменшувати до 0,3 мг кожні три дні у разі призначення циклоспорину, кетоконазолу, кларитроміцину, ретронавіру і 1,2 мг кожні три дні при використанні дилтіазему або верапрамілу [72].
Токсичній вплив на м’язи, включаючи рабдоміоліз, зустрічається при одночасному застосуванні колхіцину та статинів, особливо у пацієнтів із нирковою недостатністю [73].
Колхіцин відноситься до «найстаріших» ліків, що використовуються в терапії подагри. Протизапальний ефект зумовлений дезінтеграцією мікротубул нейтрофілів і пригніченням їхньої міграції, підпорядкованої хемотаксису. Однак, незважаючи на видимість повної розшифровки протизапального механізму дії колхіцину, з’являється велика кількість доказів мультифасетного характеру його ефектів [76]. Колхіцин порушує розподіл молекул адгезії на поверхні нейтрофілів та ендотеліальних клітин, пригнічує взаємодії між лейкоцитами й ендотеліальними клітинами, втручаючись у процес трансміграції.
Більш того, біологічна дія колхіцину є дозозалежною. У мікромолярних концентраціях він пригнічує інфламасом-залежну активацію каспаз‑1NALP3, вивільнення ІЛ‑1β та експресію L-селектину на нейтрофілах. У наномолярних концентраціях колхіцин блокує вивільнення хемотаксичних факторів нейтрофільними лізосомами, адгезію нейтрофілів до ендотелію шляхом зменшення молекул адгезії на ендотеліальних клітинах, пригнічує виділення супероксидних аніонів нейтрофілами. У високій концентрації препарат впливає на експресію генів HUVEC (клітини ендотелію), які відіграють значну роль у запаленні й міграції нейтрофілів.
Нестероїдні протизапальні препарати
НПЗП, перш за все селективні ЦОГ‑2, використовуються у максимальній дозволеній дозі сумісно з інгібіторами протонної помпи (ІПП). Незважаючи на відсутність плацебо-контрольованих досліджень, їхня ефективність дуже висока. Раннє призначення дозволяє зменшити дози та тривалість використання НПЗП.
Глюкокортикоїди
Оральний преднізолон у добовій дозі 30‑35 мг/добу протягом 5‑7 днів продемонстрував значну ефективність у знятті гострого нападу подагри [74]. Він рекомендований ACR і EULAR як потенційна терапія першої лінії при лікуванні подагричних нападів [66, 67]. В останніх рекомендаціях ACR рекомендується більш висока доза ГК: 0,5 мг/кг маси тіла впродовж 5‑7 днів до зменшення проявів артриту з наступним поступовим зниженням дози до повної відміни. Незважаючи на відсутність рандомізованих клінічних випробувань, внутрішньосуглобові ін’єкції стероїдів дуже ефективні та рекомендовані як ACR, так і EULAR в управлінні моно- або поліартикулярними подагричними спалахами. Однак ГК можуть погіршити перебіг супутніх гіпертензії чи ЦД [75, 76] і зазвичай використовуються у пацієнтів із протипоказаннями або непереносимістю колхіцину (тобто хворим на ХХН).
Блокатори ІЛ‑1
Головним індуктором розвитку гострого запалення у хворих на подагру є стимуляція кристалами СК синтезу ІЛ‑1β, що опосередковується через систему Toll-подібних рецепторів, розташованих на поверхні моноцитів і мононуклеарних клітин синовіальної оболонки шляхом активації цитозольного білка NLRP3 (кріопірину). Своєю чергою, він активує каспазу‑1, під дією якої й утворюється активна форма ІЛ‑1β [76]. Крім того, саме гіперпродукція ІЛ‑1β у хворих на подагру може бути причиною розвитку в місцях відкладення КМУН хронічного запалення і деструктивних процесів. Застосування інгібіторів ІЛ‑1β при гострому нападі подагри є ефективнішим, ніж НПЗП і колхіцину, особливо у разі непереносимості останніх чи високого ризику ускладнень.
Серед блокаторів ІЛ‑1 для лікування гострого подагричного артриту представлені анакінра (антагоніст рецепторів IЛ‑1, що інгібує активність як IЛ‑1α, так і IЛ‑1β), канакінумаб (анти-IЛ‑1β моноклональне антитіло), кінерет (анти-IЛ-Ra), ринолацепт (анти-IЛ‑1 Trap).
Канакінумаб є високоспецифічним до IЛ‑1β, блокує рецептори до ІЛ‑1. Його призначають, якщо НПЗП або колхіцин протипоказані, а також при толерантності до них. Застосування канакінумабу може мати пріоритетне значення для хворих на подагру в разі наявності у них ниркової недостатності, враховуючи, що корегувати дозу препарату в пацієнтів із порушеннями функції нирок не потрібно. Також перспективним видається використання канакінумабу у хворих на подагру з ризиком розвитку кардіоваскулярних подій, які є основною причиною смерті. Результати досліджень свідчать, що анакінра ефективна при знятті гострих нападів подагри, тоді як ринолацепт приводить до зменшення виразності болю та запалення у хворих на хронічну подагру. Канакінумаб виявився ефективним як при гострому, так і при хронічному подагричному артриті, знижуючи ризик рецидиву в міжнападний період [77]. Канакінумаб застосовують у дозі >50 мг/добу протягом 16 тижнів для запобігання атакам подагричного артриту [67].
Лікування хронічної подагри і профілактика спалахів
На відміну від лікування гострої подагри, препарати для якої використовуються періодично, запобігання рецидиву подагри потребує довготривалого й скрупульозного застосування УЗТ [76]. УЗТ повинна розглядатися та обговорюватися з кожним хворим зі встановленим діагнозом подагри після перших проявів захворювання. УЗТ показана всім пацієнтам із рецидивними нападами артриту (два і більше на рік), тофусами, уратною артропатією та/або каменями в нирках та коморбідними станами. Починати УЗТ слід відразу ж після встановлення діагнозу, особливо у пацієнтів молодого віку (до 40 років), при дуже високому сироватковому рівні СК (>8,0 мг/дл, або 480 мкмоль/л) та/або за наявності супутніх захворювань (ниркова недостатність, артеріальна гіпертензія, ішемічна хвороба серця, серцева недостатність) [65‑67]. Пацієнти з подагрою повинні отримати повну інформацію та бути повністю залученими до процесу прийняття рішень, що стосуються проведення УЗТ.
Мішені терапії
Для розчинення/редукції КМУН рівень СК слід знизити до значень, нижчих за її рівень сатурації. Як ACR, так і EULAR вказують на цільові показники СК: нижчі за 360 мкмоль/л (6 мг/дл) для всіх пацієнтів, що страждають на подагру, і нижчі за 300 мкмоль/л (5 мг/дл) у хворих на тяжку подагру (поліартикулярне ураження та наявність тофусів), щоб забезпечити швидше розчинення кристалів. Рівень СК у крові необхідно регулярно перевіряти [65‑67]. Цей підхід нещодавно був оскаржений ACR, який рекомендував лікувати подагру для контролю симптомів, а не з метою отримання цільового рівня урикемії [78]. Проте численні клінічні та патофізіологічні дані свідчать про те, що досягнення урикемії нижче рівня насичення є найкращим і найнадійнішим способом боротьби з симптомами подагри у довгостроковій перспективі.
Освіта пацієнтів
Як наголошувалося вище, навчання пацієнтів є запорукою успіху управління подагрою, про що свідчить низка досліджень [79]. Лікар повинен надавати інформацію про патофізіологію хвороби, її зв’язок з урикемією, виліковний характер, урикемічні цілі, яких необхідно досягти, довічний характер УЗТ, раннє й швидке лікування раптових спалахів, механізми УЗТ-індукованих спалахів і способи їх запобігання. Навчання хворих потребує часу і часто має повторюватися, але це обов’язковий інструмент для досягнення успіху в довгостроковому менеджменті подагри.
Модифікація дієти та способу життя
Згідно з епідеміологічними дослідженнями щодо впливу способу життя на ризик розвитку подагри, EULAR та ACR рекомендують втрату ваги у пацієнтів з ожирінням; уникання вживання пива (зокрема безалкогольного), алкогольних і газованих солодких напоїв; обмеження м’яса та морепродуктів; підвищене споживання знежирених молочних продуктів разом; посилену фізичну активність [65‑67]. Проте дуже обмежена кількість доказів підтверджують ефективність цих змін. Малі та короткострокові контрольовані дослідження показали, що молочні продукти зменшують гіперурикемію, а втрата ваги, пов’язана з помірним обмеженням калорій/вуглеводів, а також збільшенням пропорційного споживання білка та ненасичених жирів, асоціювалася зі сприятливим впливом на рівень уратів і ліпопротеїдів [80, 81].
Однак модифікація дієти виявляється менш ефективною, ніж УЗТ для боротьби з гіперурикемією. Водночас поєднання обох аспектів є успішним у лікуванні хронічної подагри. Крім того, зміна способу життя, вправи і найважливіше – втрата ваги є важливими моментами для контролю метаболічного синдрому та серцево-судинних захворювань, асоційованих із подагрою [82]. Показано, що модифікація дієти, спрямована на корекцію гіпертензії або метаболічного синдрому, знижує концентрацію СК у крові [83]. Цільовий рівень СК є ключовим компонентом лікування подагри, який при правильному виконанні у довгостроковій перспективі сприяє зникненню ознак захворювання [84].
Припинення прийому гіперурикемічних препаратів
Слід намагатися відмінити ліки, що підвищують урикемію. Це переважно відбувається при прийомі антигіпертензивних препаратів. Тіазидні та петлеві діуретики збільшують урикемію в середньому на 0,65 і 0,96 мг/дл відповідно при лікуванні понад трьох місяців середньотерапевтичними дозами [85]. Бета-блокатори та інгібітори ангіотензинперетворювального ферменту (АПФ) також асоціююються з підвищеним ризиком виникнення подагри і збільшенням урикемії [84]. Блокатори кальцієвих каналів і лозартан, навпаки, знижують рівень СК; спіронолактон, який призначають при серцевій недостатності, не впливає на цей показник [86].
Уратзнижувальна терапія
Загальні принципи УЗТ
Ініціація УЗТ пов’язана з підвищеним ризиком загострення подагри через мобілізацію кристалів. Коли вони починають розчинятися, депозити стають більш крихкими, і кристали можуть дифундувати в суглобовий простір і викликати запалення. Це необхідно пояснити пацієнту. Ризик загострень повинен бути знижений шляхом прогресуючого титрування УЗТ і призначення низьких доз (0,5‑1 мг/добу) колхіцину або НПЗП як профілактику УЗТ-індукованих спалахів подагри у хворих без протипоказань до цих препаратів [85]. Профілактику зазвичай призначають протягом перших 6 місяців від початку УЗТ або довше при тофусній подагрі, при якій повне розчинення кристалічних відкладень займає більше часу. Цікаво, що довготривалий прийом низьких доз колхіцину має кардіопротективний ефект [76, 87]. Це є додатковою перевагою для пацієнтів із подагрою, що, як відомо, мають підвищений серцево-судинний ризик [86].
Рівень урикемії протягом життя повинен зберігатися нижче 360 мкмоль/л (6 мг/дл), щоб уникнути рецидиву депозиції кристалів і загострень. Концентрацію СК слід перевіряти кожні 6 місяців у довгостроковій перспективі, щоб заохочувати прихильність пацієнтів до УЗТ та уникати збільшення урикемії вище цільових рівнів внаслідок прийому нових ліків, дієтичних порушень або збільшення маси тіла. Недотримання довгострокової УЗТ є основною причиною невдач у курації осіб із подагрою. Цей недуг характеризується найгіршою прихильністю до лікування серед хронічних неінфекційних захворювань [88]. Ймовірно, це пов’язано з нерозумінням пацієнтами важливості запобігання спалахів хвороби, сприйняттям подагри як гострого захворювання, що потребує терапії тільки загострень. Тому освіта пацієнтів є ключовим фактором для підвищення успішності менеджменту подагри.
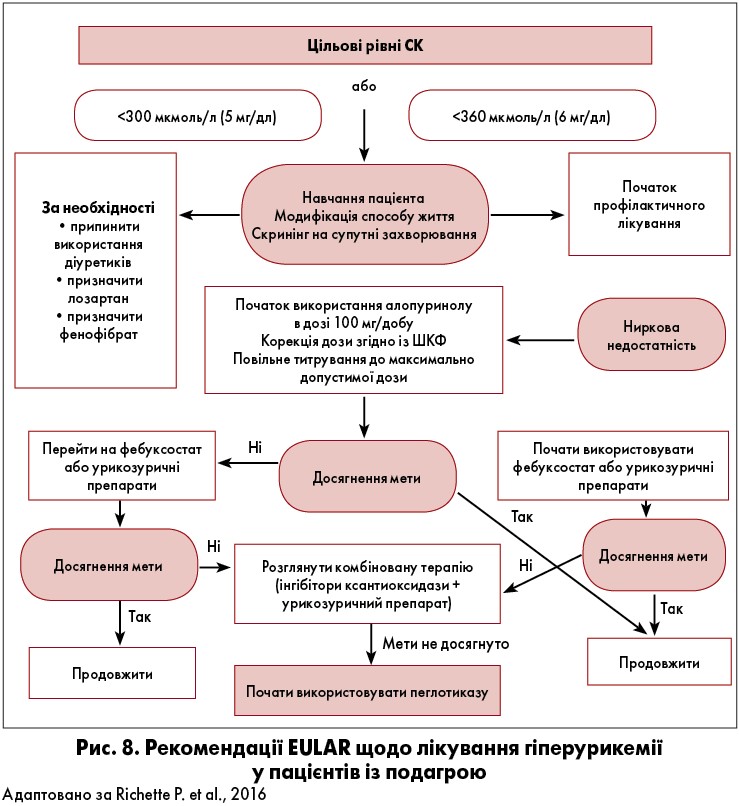
Рекомендації EULAR щодо лікування гіперурикемії у пацієнтів із подагрою схематично представлені на рисунку 8.
Алопуринол
Алопуринол є оральним інгібітором ксантиноксидази, який вперше був використаний у клінічній практиці в 60-х рр. минулого століття. Алопуринол є пурином, який швидко перетворюється на свій активний метаболіт оксипуринол ферментом ксантиноксидазою. Крім інгібування ксантиноксидази, оксипуринол пригнічує синтез пуринів через механізм, зумовлений ефектами ферментів ГГФТ і ФРПФС, та не спостерігається, коли концентрація цих ферментів недостатня [89]. Екскреція оксипуринолу відбувається, головним чином, через нирки і скорочується при нирковій недостатності. Поліморфізм ABCG2 гена впливає на зменшення транспорту алопуринолу, внаслідок чого досягається менше зниження рівня СК у процесі лікування [90]. Оскільки оксипуринол має тривалий період напіввиведення, алопуринол можна призначати один раз на день. Ефективність зниження концентрації уратів залежить від дози алопуринолу, його рекомендовано пацієнтам із нормальною нирковою функцією як першу лінію терапії, починаючи з низьких доз (100 мг/добу) і збільшувати за необхідності на 100 мг кожні 2‑4 тижні до отримання цільового сироваткового рівня СК. Якщо на початку застосування алопуринол при добовій дозі 300 мг у більш ніж 90‑95% хворих на подагру сприяв досягненню цільових показників СК, сьогодні лише меншість пацієнтів, які приймали 300 мг/добу алопуринолу, досягають таргетної урикемії (<6 мг/дл) [91]. Це можна пояснити збільшенням наявності у хворих ожиріння і вищим початковим рівнем СК у сироватці крові. Максимальна затверджена доза алопуринолу становить 800 або 900 мг/добу в пацієнтів із нормальною функцією нирок [92]. Алопуринол та інші інгібітори ксантиноксидази не можна призначати сумісно з азатіоприном і 6-меркаптопурином, оскільки ксантиноксидаза бере участь у метаболізмі цих препаратів.
Алопуринол зазвичай добре переноситься. Дискомфорт у животі, нудота і діарея, гепатотоксичність або негативний вплив на кістковий мозок, гострий інтерстиціальний нефрит є рідкісними ранніми побічними ефектами, які можуть бути частиною синдрому гіперчутливості до алопуринолу. Гінекомастія і периферична нейропатія спостерігалися дуже рідко під час тривалого лікування алопуринолом [89]. Пацієнтів слід попередити про побічні ефекти з боку шкіри, що можуть розвиватися протягом 2‑3 перших місяців лікування і потребують негайного припинення прийому алопуринолу. Це можуть бути доброякісні макулопапулярні висипання і небезпечні для життя тяжкі шкірні реакції, які нерідко мають форму гострої генералізованої екзантеми [93], токсичного епідермолізу / синдрому Стівенса – Джонсона. Фактори ризику шкірної токсичності включають початковий період використання алопуринолу (<3 місяці), жіночу стать, анамнез шкірної реакції на алопуринол, носійство HLA⁄B‑5801, високу початкову дозу і ниркову недостатність [94]. Відсутність титрування алопуринолу також асоціюється з тяжкою шкірною реакцією.
Обговорюється вплив функції нирок на дозу алопуринолу. ACR не слідує традиційним рекомендаціям щодо зниження максимальної дози алопуринолу відповідно до кліренсу креатиніну, але рекомендує збільшувати дозу до досягнення мети, без обмеження у хворих на ХХН [65, 66]. Причиною цього є те, що коригувати алопуринол за кліренсом креатиніну рідко дозволяє належний контроль урикемії в осіб із нирковою недостатністю [95]. EULAR рекомендує обмежувати дозу алопуринолу відповідно до кліренсу креатиніну та використовувати альтернативні препарати, якщо не вдається досягти цільових рівнів урикемії на монотерапії алопуринолом.
Фебуксостат
Фебуксостат – оральна форма УЗТ, непуриновий інгібітор ксантиноксидази, застосовується один раз на день, доступний у вигляді таблеток 80 і 120 мг. Доза 120 мг/добу – максимальна, схвалена у США і Європі відповідно. Фебуксостат 80 мг є потужнішим агентом УЗТ, аніж алопуринол 300 мг/добу [96, 97]. Через змішаний нирковий і печінковий метаболізм препарат можна призначати без зниження дози у пацієнтів із помірною нирковою і печінковою недостатністю. Нещодавні дослідження показали, що ефективність та безпека фебуксостату зберігаються у хворих, кліренс креатиніну в яких нижчий за 30 мл/хв [98]. Побічні ефекти включають рідкісні й ранні реакції гіперчутливості печінки або нирок, а також доброякісні висипання на шкірі, які мали місце у 5% пацієнтів під час третьої фази випробувань. Дуже рідко повідомлялося про серйозні шкірні реакції [99].
Фебуксостат, як і алопуринол, інгібує фермент ксантиноксидазу шляхом приєднання до молібден-птеринового центру, єдиного у всіх пуринів. Однак є ціла низка відмінностей цієї взаємодії. Так, алопуринол зв’язується тільки з редукованою формою ензиму, фебуксостат формує комплекс з обома формами ксантиноксидази – редукованою та оксидійованою. Переваги фебуксостату є унікальними у світлі того, що дві різні форми ферменту можуть обмінюватися іонами молібдену (механізм «пінг-понг») і, перетворюючись з однієї форми на іншу, «втікати» від дії алопуринолу. Фебуксостат практично повністю заповнює вузькі канали, що ведуть до молібденового центру, стійко пригнічуючи активність ферменту. Алопуринол є інгібітором механізму дії ензиму, тимчасово усуваючи його активність. Фебуксостат інгібує ксантиноксидазу шляхом утворення високоафінних міцних зв’язків із обома формами ензиму, алопуринол демонструє слабший зв’язок лише з однією формою ферменту. Інгібований алопуринолом фермент реактивується швидко (Т1/2=300 хв при 25 °C) під дією спонтанної реоксидації молібденового центру. Фебуксостат, навпаки, пригнічує ензим тривало через утворення вкрай стабільних зв’язків. Він практично не впливає на інші ферменти пуринового і піримідинового метаболізму, на відміну від алопуринолу, що дозволяє називати його селективним інгібітором ксантиноксидази [76].
ACR розглядає фебуксостат як першу лінію УЗТ [65,66], тоді як EULAR рекомендує цей препарат у пацієнтів із непереносимістю або рефрактерністю до алопуринолу. Титрування дози рекомендується для зменшення запальних спалахів, індукованих УЗТ, навіть якщо немає доказів того, що це покращує толерантність до фебуксостату [67].
Урикозуретики
Урикозуретики знижують рівень СК у крові за рахунок збільшення екскреції СК із сечею. Відтак при прийомі цих препаратів підвищується ризик розвитку уратних каменів. Коли урикемія знижується, урикозурія – також, і ризик каменеутворення зменшується. Урикозуретики не слід призначати як монотерапію пацієнтам з анамнезом сечокам’янної хвороби, прийом необхідно супроводжувати великою кількістю води; рН сечі варто тримати вище 6,0 для зниження концентрації СК та профілактики літіазу [100].
За винятком лезинураду, урикозуретики можна застосовувати самостійно; але наразі вони найчастіше використовуються у комбінації з інгібіторами ксантиноксидази, коли за допомогою урикозодепресантів не вдається досягти цільових показників урикемії. Пробенецид був першим і дуже популярним препаратом УЗТ. У міру доступності алопуринолу, пробенецид відійшов у тінь, його прийом потребує розділення доз, високого споживання рідини і контролю рН сечі. Сьогодні пробенецид залишається однією з терапевтичних можливостей у пацієнтів з непереносимістю або рефрактерністю до алопуринолу та фебуксостату [101]. Початкова доза препарату становить 250 мг двічі на добу із щотижневим підвищенням дози до 1 г два рази на день. Вищі дози мають токсичний вплив на центральну нервову систему.
Сульфінпіразон є менш поширеним урикозуретиком, його зазвичай призначають двічі на день у загальній добовій дозі 200‑400 мг. Побічні ефекти включають симптоми з боку шлунково-кишкового тракту, шкірні висипання, порушення агрегації тромбоцитів і рідко токсичний вплив на кістковий мозок. Бензбромарон є потужним урикозуричним препаратом, який застосовують у дозі 100‑200 мг/добу [85]. Після повідомлень про значну гепатотоксичність препарат заборонений в Європі, але використовується в Азії.
Лезинурад – новий селективний інгібітор URAT1, який нещодавно був схвалений у дозі 200 мг/добу в США та Європі як додаткова терапія до інгібіторів ксантиноксидази [102, 103]. Цей препарат має подвійний механізм дії – урикозуричний і урикоздепресивний. Препарат блокує URAT1-транспортер органічних аніонів, сприяючи виведенню СК з організму. При його прийомі спостерігається тимчасове підвищення креатиніну в сироватці крові, що потребує моніторингу функції нирок.
Фенофібрат, аторвастатин і лозартан є неліцензованими урикозуриками, які можна використовувати для лікування коморбідних станів подагри або у поєднанні з інгібіторами ксантиноксидази [104].
Уратоксидази
Расбуриказа – рекомбінантна уратоксидаза, фермент, що перетворює СК на нетоксичний алантоїн. Расбуриказа схвалена для запобігання та лікування синдрому лізису пухлини у пацієнтів, які отримують хіміотерапію із приводу лейкозів та лімфом. Про її неліцензійне застосування повідомлялося при тофусній подагрі [105].
Пеглотиказа – пегільована уриказа, яка каталізує окислення СК на алантоїн, схвалена у США та Європі для лікування тяжкої тофусної подагри, рефрактерної до оральної УЗТ. Пеглотиказу рекомендовано до застосування пацієнтам із кристал-верификованою тяжкою, хронічною тофусною подагрою і низькою якістю життя, у яких цільові сироваткові рівні СК не можуть бути досягнуті при використанні будь-яких інших препаратів у максимальній дозі (зокрема комбінацій). Препарат вводять внутрішньовенно по 8 мг кожні два тижні [105]. Водночас пеглотиказа має несприятливий профіль безпеки: приблизно у половини пацієнтів розвиваються антитіла. Це призводить до втрати відповіді до лікування і підвищеного ризику серйозних інфузійних реакцій, що потребує особливих умов використання – у стаціонарі з досвідченим персоналом. Рекомендується вимірювати урикемію протягом 24 год перед кожною запланованою реінфузією і припинити прийом препарату, якщо вона не зменшилася. Пеглотиказу не слід комбінувати з іншими представниками цієї групи [106]. Призначення пеглотикази дозволяє досягти цільового рівня СК у 42% пацієнтів, але широке застосування обмежене через часті алергічні реакції та високу вартість [107].
Висновки та перспективи
Зрозуміти патогенез подагри, а отже, і керувати нею, стало викликом майстерності лікарів за всю історії медицини. Успіхи в цій галузі, які набули форми постійного прогресу, нещодавно досягли гігантського прориву. Ми глибше розуміємо патогенез захворювання, можемо покладатися на більш складні діагностичні заходи, і, найголовніше, маємо у своєму розпорядженні ширший спектр терапевтичних стратегій для вирішення цієї проблеми.
Подагра вважалася заклятим ворогом довголіття. Цей похмурий світогляд ілюструється лордом Байроном (1788‑1824) у роздумах про старість: «Вони люб’язно залишають нас, хоч і не зовсім самих; але в добрій компанії – подагра або камінь». Але наразі ми маємо право на більш оптимістичний погляд завдяки сучасній науці. Наступні дослідження, ймовірно, сприятимуть розв’язанню таких питань:
- Інтенсивна робота в геноміці та протеоміці допоможе розібратися у схильності до захворювань та побічних ефектів від лікарських засобів. Це наближає потенційні терапевтичні прориви.
- Дослідження можливої ролі мікробіома в патогенезі подагри паралельно його метаболічним аналогам.
- Спроби стандартизувати міжнародні медичні підходи щодо подагри.
- Підвищений акцент на освіті пацієнта.
Cписок літератури, що включає 107 пунктів, знаходиться у редакції.
Тематичний номер «Кардіологія, Ревматологія, Кардіохірургія» №1 (62), березень 2019 р.