22 січня, 2017
Инновации в детской гастроэнтерологии и нутрициологии в практике семейного врача
20-21 октября в г. Харькове состоялась межрегиональная научно-практическая конференция с международным участием, посвященная памяти заслуженного деятеля науки и техники Украины, доктора медицинских наук, профессора Юрия Владимировича Белоусова. В докладах, прозвучавших на конференции, были подняты проблемы лечения функциональной патологии желудочно-кишечного тракта (ЖКТ), диагностики и коррекции гипоэлементозов и гиповитаминозов, модуляции нарушений кишечной микрофлоры.
 Тему оптимизации терапии гастродуоденитов путем коррекции нарушений микрофлоры в практике педиатра и детского гастроэнтеролога рассмотрела заведующая кафедрой педиатрической гастроэнтерологии и нутрициологии Харьковской медицинской академии последипломного образования (ХМАПО), доктор медицинских наук, профессор Ольга Юрьевна Белоусова.
Тему оптимизации терапии гастродуоденитов путем коррекции нарушений микрофлоры в практике педиатра и детского гастроэнтеролога рассмотрела заведующая кафедрой педиатрической гастроэнтерологии и нутрициологии Харьковской медицинской академии последипломного образования (ХМАПО), доктор медицинских наук, профессор Ольга Юрьевна Белоусова.
Микрофлора ребенка обладает огромным биологическим потенциалом, способным обеспечить полную защиту организма и его метаболическую поддержку. Сапрофитная микрофлора вместе со слоем слизи образует надэпителиальный слой, который обеспечивает защиту от физической и химической агрессии, патогенных микроорганизмов, токсинов и паразитов. Низкомолекулярные метаболиты сахаролитической микрофлоры (короткоцепочечные жирные кислоты) ингибируют рост условно-патогенной флоры. Вероятно, сапрофитные микроорганизмы способны перехватывать и выводить из организма патогенные вирусы. Сегодня доказано влияние метагенома (генов микробиоты) на экспрессию генов человека с формированием тех или иных позитивных влияний на состояние здоровья организма хозяина.
В последние годы появляется все больше доказательств того, что нарушение баланса кишечной микрофлоры повышает риск развития хронических воспалительных заболеваний кишечника – язвенного колита и болезни Крона. Доказано влияние нарушения кишечной микробиоты на риск развития атопии. Появляется все больше подтверждений тому, что микрофлора кишечника выполняет функции, далекие от простого поддержания кишечного гомеостаза.
Многочисленные исследования последних лет свидетельствуют о том, что микроэкологический дисбаланс в пищеварительной системе провоцируется рядом заболеваний пищеварительного тракта, которые сопровождаются хроническим воспалением. Так, частота выявления синдрома избыточного бактериального роста (СИБР) при различных заболеваниях пищеварительного тракта (хронический гастрит, язвенная болезнь, хронический холецистит, воспалительные заболевания кишечника, синдром раздраженной кишки) колеблется в пределах 70-97%. Также появляются все новые публикации, подтверждающие активацию условно-патогенной флоры в верхних отделах пищеварительного тракта при хронических заболеваниях гастродуоденальной зоны. Прогрессирующая атрофия слизистой оболочки желудка, связанная с изменением ее кислотопродуцирующей функции, способна изменять степень диверсификации желудочной микробиоты и ее количественный состав.
Клинические наблюдения показывают, что микробиоценоз человека является его интегральной частью, своеобразным экстракорпоральным органом, играющим важную роль в физиологии человека. Связь микробиоты с организмом хозяина настолько специфична, что любое изменение в этом балансе может привести к микроэкологическим нарушениям и, как следствие, к болезни.
Факторы, способствующие нарушению баланса микрофлоры у детей:
- любые погрешности в питании, голодание, введение прикорма, назначение парентерального питания, использование элементных диет;
- оперативные вмешательства, желудочно-кишечные кровотечения, сопровождающиеся даже незначительной кровопотерей;
- гормональные изменения, стресс;
- лекарственные средства.
Фармакологические препараты, используемые при лечении гастроэнтерологической патологии, могут оказать неблагоприятное воздействие на микроэкологию кишечника.
Известно более 700 лекарственных препаратов, способных провоцировать ятрогенную диарею (около 7% от общего числа побочных реакций лекарственных средств).
Одним из факторов, значительно повышающих риск развития ятрогенной диареи на фоне приема антибактериального препарата, является применение магнийсодержащих антацидов, антисекреторных препаратов и ингибиторов протонной помпы (ИПП). В рекомендациях IV Маастрихтского консенсуса (2010) подчеркивалось наличие риска развития диареи, ассоциированной с Clostridium difficile у лиц, длительно принимающих ИПП. Управление по контролю качества продуктов питания и лекарственных средств США (FDA) в феврале 2014 г. опубликовало предупреждение о возможной прямой связи приема ИПП и ятрогенной диареи.
Наиболее разрушающим воздействием на кишечный микробиом обладают антимикробные препараты. В рекомендациях V Маастрихтского консенсуса (2015) сказано, что антибиотикотерапия оказывает отрицательное влияние на здоровую кишечную флору и приводит к краткосрочным и долгосрочным клиническим последствиям. Антибиотики в практике детского гастроэнтеролога назначаются не так часто, как в практике педиатра или врача общей практики. Однако существуют нозологии, в лечении которых обойтись без антибактериальных средств не удается. Таким заболеванием, в частности, является Нp-ассоциированная язвенная болезнь (Hp – Helicobacter pylori), которая имеет достаточно высокую распространенность – 0,4-4,3% у детского населения Украины и до 16% – в структуре патологии органов пищеварения (Ю.В. Белоусов, 2012). Инфекционная природа язвенной болезни сегодня не вызывает сомнений и наряду с другими факторами (алиментарными, аллергическими, иммунологическими, наследственными) является основной причиной ее развития.
Для эрадикации Hp сегодня применяют семидневные трех- и четырехкомпонентные схемы лечения, которые обязательно включают один или два антибиотика. При этом частота развития антибиотикассоциированной диареи зависит от группы антибиотика и дозы. Так, при назначении амоксициллин/клавуланата диарея развивается в 10-25% случаев, цефиксима – 15-20% случаев. Именно амоксициллин лидирует по частоте развития ятрогенных диарей, в том числе и в детском возрасте.
Эрадикация Hp открывает единственно возможный путь для выздоровления, но полное уничтожение Hp становится все более трудной задачей для врача. За последние годы эффективность рекомендуемых Маастрихтским соглашением базовых схем лечения снизилась, это подтверждается как зарубежными данными, так и нашими собственными наблюдениями. Резистентность Hp к антибиотикам продолжает неуклонно расти – в конце 90-х годов 30% штаммов Hp были резистентны к метронидазолу и 4% к кларитромицину. Сегодня среди детей, инфицированных Hp, примерно половина является носителями резистентных к метронидазолу штаммов, и почти треть – резистентны к кларитромицину. Антибиотикорезистентность привела к тому, что эффективность эрадикации снизилась в развитых странах с 80-90 до 40-70%.
Согласно Маастрихтскому соглашению IV (2010), режим антихеликобактерной терапии должен соответствовать следующим критериям:
– простота применения;
– хорошая переносимость;
– эффективность эрадикации >80%.
В качестве меры повышения эффективности эрадикационной терапии может быть использована адъювантная терапия пре- и пробиотиками. Назначение пробиотических препаратов позволяет снизить частоту нежелательных побочных явлений, в том числе антибиотикассоциированной диареи, повысить эффективность эрадикации Hp и улучшить состояние слизистой оболочки ЖКТ. Так, в исследованиях последних лет доказано иммуномодулирующее действие некоторых пробиотиков (Lactobacillus reuteri, Lactobacillus rhamnosus GG). Нормофлора способна воздействовать на дифференцировку Т-хелперов и таким образом влиять на соотношение про- и противовоспалительных цитокинов. Таким образом, некоторые пробиотические штаммы способны повышать эффективность антихеликобактерной терапии за счет модуляции реакций местного иммунитета. Выбор способа иммуномодуляции в детском возрасте должен базироваться прежде всего на принципах безопасности, поэтому назначаться должны только те пробиотические штаммы, которые имеют доказанную эффективность и безопасность.
Штаммы, доказавшие свою эффективность и безопасность в плацебо-контролируемых исследованиях и одобренные Всемирной организацией здравоохранения (ВОЗ):
– Bifidobacterium:
– B. longum (штамм B. infantis; BB536),
– B. breve,
– B. lactis (штамм Bb12),
– B. bifidum;
– Lactobacillus:
– L. rhamnosus (GG),
– L. reuteri protectis,
– L. acidophilus (штамм L. Gasseri),
– L. bulgaricum,
– L. Casei (штамм L. Shirota).
– Streptococcus:
– S. termophylus.
Перечисленные штаммы не несут патогенный или инвазивный потенциал, не имеют нежелательных биохимических эффектов. Каждому из этих штаммов присвоен статус GRAS – «безусловно безопасный», они одобрены FDA для использования в детских молочных смесях с рождения.
Лактиале – синбиотик, имеющий паспорт безопасности. В состав Лактиале входит 7 штаммов пробиотических бактерий и питательная среда для их роста.
Синбиотик Лактиале содержит в своем составе:
– Bifidobacterium longum (штамм B. infantis);
– Bifidobacterium breve;
– Streptococcus termophylus;
– Lactobacillus rhamnosus;
– Lactobacillus acidophilus;
– Lactobacillus bulgaricum;
– Lactobacillus casei;
– фруктоолигосахариды.
Лабораторные штаммы бактерий, входящих в состав синбиотика Лактиале, производятся британской компанией Protexin Health Care. Высокое качество пробиотиков производства Protexin Health Care подтверждено международными сертификатами (GMP, RPSGB, FEMAS, ISO 9001). В производстве Лактиале используются инновационные технологии, позволяющие сохранить максимальное количество пробиотических бактерий живыми и доставить их сохранными непосредственно в кишечник.
Пробиотические штаммы в составе Лактиале оказывают ингибирующее действие на Clostridium difficile и положительно влияют на иммунную систему ребенка. Так, иммуномодулирующее действие Лактиале проявляется в стимуляции фагоцитарной активности нейтрофилов (L. acidophilus, L. rhamnosus, L. Casei, S. termophylus), усилении синтеза интерлейкина-10 и туморнекротического фактора (TNF), снижении синтеза иммуноглобулина (Ig) Е и повышении синтеза секреторного IgА, формировании иммунологической толерантности (B. longum).
Важным аспектом назначения пробиотиков является антибиотикорезистентность пробиотических штаммов. В 2013 г. Научный комитет Европейского агентства по безопасности продуктов питания (European Food Safety Authority, EFSA) опубликовал новые рекомендации, согласно которым для профилактики кишечных расстройств после и во время приема антибиотиков используются пробиотики. Следует применять только те штаммы пробиотиков, которые полирезистентны к антибиотикам, что позволяет им выжить при совместном приеме с антибактериальными средствами.
Штаммы бактерий, входящих в состав Лактиале, обладают высоким профилем антибиотикорезистентности. Антибиотикоустойчивость пробиотических компонентов достигается путем многократных пассажей бактерий на антибиотикосодержащих средах с растущим градиентом концентрации антибиотиков.
Учитывая доказанную взаимосвязь между гастроэнтерологическими заболеваниями и нарушениями микробиоты, которая обеспечивает сохранную защитную функцию слизистых оболочек в случае ее нормальной гастродуоденальной координации, пробиотики следует включить в новую редакцию национальных протоколов лечения гастродуоденальной патологии. Такая стратегия может привести к повышению эффективности лечения Hp-инфекции.
На базе нашей кафедры было выполнено собственное клиническое исследование, целью которого была оценка влияния синбиотика Лактиале на показатели эрадикации детей с Hp-ассоциированными гастродуоденальными заболеваниями. Лактиале назначали в качестве адъювантной терапии к стандартным эрадикационным схемам курсом 10 дней.
В группу I (n=20) вошли пациенты в возрасте <10 лет с клинической симптоматикой заболеваний гастродуоденальной зоны, которые имели положительный уреазный дыхательный тест на Hp (фиброэзофагогастродуоденоскопия – ФЭГДС – не обязательна). Эти дети получали 10-дневный курс двойной терапии препаратом висмута и Лактиале по 1 пакету 2 р/сут. Контроль эрадикации проводился через 4-6 недель при помощи дыхательного уреазного теста.
Группу II (n=20) составили пациенты >10 лет с воспалительными заболеваниями гастродуоденальной зоны (фиброгастродуоденоскопия – ФГДС – для верификации обязательна) и инфицированием Hp. В этой группе для лечения назначали стандартную схему эрадикационной терапии (тройную или квадро) и Лактиале по 1 пакету 1 р/сут курсом 10 дней.
Группа III (n=10) – группа сравнения, в которой проводили лечение по стандартным схемам без синбиотика Лактиале. Контроль эффективности проводили через 4-6 недель после 10-дневной схемы уреазным дыхательным тестом.
В результате проведенного лечения и сравнения результатов в трех группах оказалось, что у детей, получавших синбиотик Лактиале в качестве адъювантного лечения, снижалась частота побочных эффектов антихеликобактерной терапии. Кроме того, в группе детей, дополнительно получавших синбиотик Лактиале, эрадикация Hp достигалась у большего числа детей по сравнению с теми, кто получал стандартные триплексные или квадро-схемы.
Таким образом, назначение комбинированных синбиотиков для профилактики и коррекции дисбиоза у больных с гастродуоденальной патологией является перспективным, поскольку позволяет не только восстанавливать микробиоценоз кишечника, но и воздействовать на этиологический фактор заболевания. Это воздействие объясняется модулирующим действием пробиотических штаммов на факторы местной иммунной защиты. Кроме того, адъювантная пробиотическая терапия позволяет снизить частоту побочных эффектов от антихеликобактерной терапии, при этом повышая эффективность эрадикации.
Заведующий кафедрой педиатрии последипломного образования Национального медицинского университета им. А.А. Богомольца, доктор медицинских наук, профессор Юрий Владимирович Марушко в своем докладе осветил диагностический потенциал дыхательного теста с нагрузкой лактулозой у детей с патологией верхних отделов ЖКТ.
– В последние десятилетия отмечается рост распространенности гастроэнтерологической патологии у детей. Нарушения состава микрофлоры разных отделов пищеварительной системы возникают при большинстве заболеваний ЖКТ. При этом усугубляются клинические проявления основного заболевания, ухудшается качество жизни пациента, снижается эффективность терапии, проводимой по поводу основного заболевания (О.Г. Шадрин, 2015). Хронические заболевания гастродуоденальной зоны, ассоциированные с Hp, сами по себе могут приводить к нарушению микробиоценоза разных отделов пищеварительного тракта. Антибиотикотерапия, направленная на эрадикацию Hp-инфекции, только усугубляет нарушения со стороны микробного пейзажа. Поддержание определенного количественного и качественного состава микрофлоры разных отделов пищеварительного тракта, а также адекватная моторика кишечника – это необходимые условия для нормального функционирования организма. Поэтому коррекция нарушений микробиоценоза является одной из важнейших задач в практической гастроэнтерологии (Е.А. Маевская, 2013; О.Г. Шадрин, 2014; Smish, 2014).
Физиологические эффекты микробиоты сегодня достаточно хорошо изучены. Так, микробиота выполняет трофические и энергетические функции, регуляцию перистальтики кишечника, регуляцию дифференцировки и регенерации тканей (в первую очередь эпителиальных), поддержание ионного гомеостаза организма, регуляцию газового состава полостей, детоксикацию и выведение эндо- и экзотоксинов, разрушение мутагенов, активацию лекарственных средств, образование сигнальных молекул, в том числе нейротрансмиттеров. Известно, что микробиота принимает активное участие в регуляции местного иммунного ответа и образовании иммуноглобулинов. Сапрофиты кишечной микрофлоры обеспечивают цитопротекцию, угнетают рост патогенов, предупреждают адгезию патогенов к эпителию, поддерживают физико-химический гомеостаз приэпителиальной зоны, участвуют в метаболизме белков, рециркуляции желчных кислот, стероидов и других макромолекул. Важной функцией кишечной микробиоты является сохранение микробных плазмидных и хромосомных генов, а также синтез и поставка макроорганизму витаминов и незаменимых аминокислот (О.Ю. Белоусова, 2012; М.Д. Ардатская, 2011).
Использование непрямых методов – удобный клинический инструмент для исследования состояния кишечной микрофлоры. Дыхательные тесты, основанные на выявлении в выдыхаемом воздухе продуктов метаболизма бактерий, дают возможность изучить микрофлору всех отделов пищеварительного тракта. Поскольку дыхательные тесты неинвазивны, они могут широко применяться в педиатрической практике. Водородный дыхательный тест с нагрузкой пищевой лактулозой (ВДТНЛ) основан на определении концентрации водорода при выдохе до нагрузки (базальный уровень) и после лактулозной нагрузки каждые 15 мин в течение 3 ч.
Водородный дыхательный тест с нагрузкой пищевой лактулозой позволяет выявить:
– удлинение времени ороцекального транзита;
– наличие СИБР в тонком кишечнике;
– недостаточное заселение кишечника анаэробными бактериями (не Н2-продуцентами).
На клинической базе нашей кафедры было выполнено два исследования, в которых применяли ВДТНЛ для оценки состояния кишечной микрофлоры.
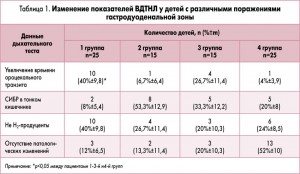
В первом исследовании приняли участие 80 детей в возрасте 6-17 лет. Целью работы была оценка состояния кишечника у детей с гастродуоденальной патологией при помощи ВДТНЛ. Всем пациентам проводили общеклинические исследования, ФЭГДС, ВДТНЛ и верификацию хеликобактерной инфекции.
В соответствии с результатами ФЭГДС все дети были распределены на такие группы:
I группа (n=25) – изменения слизистой оболочки желудка и/или двенадцатиперстной кишки (гастрит, дуоденит, язва двенадцатиперстной кишки) с нарушением моторики органов гастродуоденальной зоны (гастроэзофагеальный и дуоденогастральный рефлюкс, рефлюкс-эзофагит).
II группа (n=15) – нарушение моторики органов гастродуоденальной зоны при отсутствии воспалительных изменений со стороны слизистой оболочки желудка и двенадцатиперстной кишки.
III группа (n=15) – патологические изменения со стороны слизистой оболочки желудка и/или двенадцатиперстной кишки без моторных нарушений.
IV группа (n=25) – отсутствие патологических изменений на ФЭГДС.
Изменение показателей ВДТНЛ у детей с различными поражениями гастродуоденальной зоны представлены в таблице 1.
С целью коррекции выявленных нарушений был выбран синбиотик Лактиале, который содержит не только пробиотические микроорганизмы, но и фруктоолигосахариды в качестве пребиотика. Лактиале отвечает всем требованиям, предъявляемым к современным пробиотикам: соответствует здоровой микрофлоре человека, бактерии в составе синбиотика не являются патогенными, они имеют высокую жизнеспособность и биологическую активность, проявляют антагонизм по отношению к условно-патогенным микроорганизмам, стойкость к физико-химическим факторам (кислотности, действию желчных кислот), адгезивную способность к кишечному эпителию и колонизации, антибиотикоустойчивость.
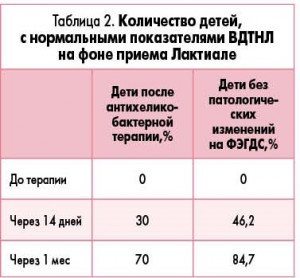
На фоне приема Лактиале у части пациентов отмечалась нормализация показателей ВДТНЛ уже через 14 дней (табл. 2).
Результаты этого исследования говорят о том, что ВДТНЛ позволяет оценить состояние кишечника, а именно заселение анаэробной флорой и изменение времени ороцекального транзита у детей с различной патологией пищеварительного тракта. На фоне приема синбиотика Лактиале на протяжении месяца по данным ВДТНЛ отмечалась нормализация показателей микрофлоры кишечника у 84,6% детей без патологических изменений слизистой оболочки гастродуоденальной зоны по данным ФЭГДС и у 70% детей с заболеваниями гастродуоденальной зоны. Синбиотик Лактиале способствовал нормализации кишечной микрофлоры, что позволяет использовать его в комплексном лечении гастродуоденитов.
Второе наше исследование было посвящено изучению эффективности синбиотика Лактиале в комплексной терапии хронических Hp-ассоциированных заболеваний гастродуоденальной зоны.
В это исследование было включено 66 детей в возрасте 11-16 лет с Hp-ассоциированной гастродуоденальной патологией. До начала лечения всем детям проводили ВДТНЛ, который повторяли на 14-й и 30-й день от начала лечения. Пациенты были разделены на две группы, сопоставимые по возрасту, полу, нозологии и результатам ВДТНЛ на начальном этапе.
Группу I составили 34 пациента, которые получали Лактиале с первого дня параллельно с тройной антихеликобактерной терапией.
Группу II составили 32 ребенка, которым синбиотик назначался после курса эрадикационной терапии на 8-й день от начала лечения.
Общий курс приема Лактиале в обеих группах составил 30 дней.
По результатам обследования:
– хронический поверхностный гастрит был диагностирован у 24 (36,4%) детей;
– хронический поверхностный гастродуоденит – у 31 (47%) пациента;
– хронический эрозивный гастродуоденит у 7 (10,6%) детей;
– изолированный эрозивный дуоденит у 4 (6,1%) пациентов.
У всех детей было подтверждено инфицирование Hp. По данным ВДТНЛ, у 24 пациентов было выявлено удлинение ороцекального транзита, у 37 – СИБР, 5 детей оказались не Н2-продуцентами.
Нормализация показателей ВДТНЛ у детей с СИБР была зарегистрирована на 14-й день от начала терапии у 31,6% пациентов группы I и у 27,8% – группы II. На 30-й день лечения этот показатель составил 68,4% – в группе I и 55,6% – в группе II. Нормализация ВДТНЛ у детей с увеличенным временем ороцекального транзита отмечалась на 14-й день терапии у 33,3% группы I и 25% – группы II. На 30-й день терапии этот показатель достиг 58% в группе I и 41,7% в группе II. Из 5 детей, которые в начале лечения выявились не Н2-продуцентами, 2 получали Лактиале параллельно с эрадикационной терапией и вошли в группу I, а 3, соответственно, попали в группу II. На 14-й день от начала терапии ни у одного из 5 не Н2-продуцентов не отмечалось динамики в отношении показателей ВДТНЛ. Но к 30-му дню лечения у 2 детей группы I отмечена нормализация ВДТНЛ, в группе II таких изменений выявлено не было.
Таким образом, включение синбиотика Лактиале в схему эрадикационной терапии позволяет улучшить функциональное состояние пищеварительного тракта, что проявляется нормализацией показателей ВДТНЛ у значительной доли пролеченных детей (68,4%). При более длительном приеме Лактиале (в наших исследованиях – 30 дней и более) частота нормализации результатов ВДТНЛ значительно возрастает, особенно у пациентов, которые начали прием Лактиале параллельно с эрадикационной терапией, а не после ее завершения.
 Доцент кафедры педиатрической гастроэнтерологии и нутрициологии ХМАПО, кандидат медицинских наук Елена Николаевна Бабаджанян сообщила о перспективах применения пробиотиков в комплексной терапии бактериальных кишечных инфекций у детей.
Доцент кафедры педиатрической гастроэнтерологии и нутрициологии ХМАПО, кандидат медицинских наук Елена Николаевна Бабаджанян сообщила о перспективах применения пробиотиков в комплексной терапии бактериальных кишечных инфекций у детей.
– Для развития острой кишечной инфекции необходимо два условия: инфицирование патогеном и преодоление патогенным микроорганизмом факторов местной защиты в слизистых оболочках пищеварительной системы. Такими факторами выступают адекватные величины рН, высокие концентрации ферментов, состоятельность фагоцитарной системы и специфических иммунных факторов (секреторный IgА), а также колонизационная резистентность нормальной микрофлоры.
В соответствии с этиологической классификацией острых кишечных инфекций и инвазий у детей выделяют:
а) кишечные инфекции установленной этиологии:
- бактериальные: дизентерия (шигеллез), сальмонеллезы, колиинфекции (эшерихиозы), иерсиниоз, брюшной тиф и паратифы, кампилобактериоз, холера, НАГ-инфекция, ботулизм и др.;
- вирусные: ротавирусная, саповирусная, астровирусная, аденовирусная;
б) кишечные инфекции неустановленной этиологии;
в) смешанные кишечные инфекции;
г) кишечные инвазии: амебиаз кишечника (амебная дизентерия), лямблиоз, криптоспоридоз, стронгилоидоз и другие гельминтозы.
Попадание эндотоксина грамотрицательных бактерий в организм человека вызывает однотипные патофизиологические реакции: лихорадку, рвоту, диарею, артериальную гипотензию, внутрисосудистое свертывание крови. В высоких дозах эндотоксин вызывает неспецифическую активацию клеток иммунной системы, усиление действия антигенов со слабой иммуногенностью, влияние на структуры и функции множества ферментных систем и медиаторов, индуцирование неспецифической устойчивости к некоторым вирусным и бактериальным инфекциям, регрессию и некроз некоторых опухолей.
Терапия острых кишечных инфекций включает антибиотики, специфические бактериофаги, энтеросорбенты, регидратацию, пробиотики. Согласно рекомендациям ВОЗ абсолютным показанием к назначению антибиотиков служат дизентерия, брюшной тиф, амебиаз, холера. Острые кишечные инфекции другой этиологии могут быть излечены без применения системных антибиотиков. В связи с этим значительный интерес представляет применение пробиотиков в качестве иммуномодуляторов при острых кишечных инфекциях. Кроме того, назначение системных антибиотиков наносит ощутимый удар по кишечной микрофлоре. К возможным осложнениям антибиотикотерапии относятся антибиотикассоциированная диарея, снижение иммунитета, развитие воспалительных заболеваний кишечника и иммунодефицитных состояний.
Кишечная микробиота человека содержит 1×1015 клеток, что в 10 раз превышает количество клеток человеческого тела. Это отдельный орган, весом 1-1,5 кг, состоящий из 8 бактериальных семейств и более чем 1100 различных видов бактерий. Суммарное число микробных генов составляет более 3 млн, что в сотни раз превышает количество генов человека. Этим объясняется многообразие тех физиологических эффектов, которые оказывает кишечная микрофлора на макроорганизм (создание кишечного барьера, метаболическая и иммунологическая активность, регуляция моторики и трофических процессов, модуляция риска некоторых заболеваний).
Высокоэффективным пробиотиком является Лактиале, который содержит 7 штаммов пробиотических микроорганизмов с доказанной эффективностью и безопасностью, а также фруктоолигосахариды. В производстве Лактиале используются инновационные технологии. Благодаря методу фильтрации жизнеспособность штаммов микроорганизмов сохраняется практически 100%, в отличие от центрифугирования, при котором живыми остаются только 40%. Метод микрокапсулирования способствует повышению уровня выживаемости микроорганизмов под действием агрессивных факторов макроорганизма, таких как желчные кислоты и высокая кислотность желудочного сока, обеспечивается непосредственная доставка микроорганизмов в кишечник. Синбиотик Лактиале имеет паспорт безопасности, не содержит лактозы и красителей, не требует хранения в холодильнике. Удобный режим применения Лактиале (1 р/сут) позволяет широко использовать его в комплексной терапии заболеваний ЖКТ.
Пробиотические штаммы в составе Лактиале обладают выраженным антагонизмом к возбудителям острых кишечных инфекций. Этот эффект достигается за счет синтеза бактерицидных веществ (молочная кислота, короткоцепочечные жирные кислоты, пероксид водорода, сероводород), конкуренции бактерий за питательные вещества и факторы роста, снижения внутриполостного рН (молочная кислота) и предупреждения адгезии и инвазии в слизистую оболочку патогенных микробов. Прямое антитоксическое действие Лактиале проявляется в нейтрализации цитотоксинов бактерий, энтеросорбции и детоксикации благодаря наличию фруктоолигосахаридов в составе синбиотика.
Известно, что микроорганизмы присоединяются к кишечному эпителию через гликоконъюгированные рецепторы, обеспечивая колонизационную резистентность и предупреждая адгезию и инвазию патогенов. Пробиотические микроорганизмы в составе Лактиале способствуют укреплению цитоскелета клеток кишечного эпителия и снижению его проницаемости за счет повышения фосфорилирования белка межклеточных соединений. Под действием Лактиале усиливается синтез муцина, эпителиального фактора роста, полиаминов (гормоноподобных веществ, которые усиливают процессы регенерации эпителия). При этом возрастает резистентность кишечного эпителия и усиливается его барьерная функция.
Штаммы бактерий, входящих в состав Лактиале, обладают высоким профилем антибиотикорезистентности, что позволяет применять синбиотик с первого дня антибиотикотерапии.
Эффективность Лактиале в комплексном лечении детей с острыми кишечными инфекциями была изучена в клинических исследованиях (С.В. Кузнецов, Т.С. Жаркова и соавт., 2014; С.В. Кузнецов, Т.О. Кирсанова, 2014). В двух независимых исследованиях приняли участие 268 детей в возрасте от 6 мес до 12 лет с подтвержденной острой кишечной инфекцией бактериальной природы. Применение Лактиале в комплексной терапии способствовало уменьшению интоксикационного синдрома и синдрома диареи, более быстрой нормализации реакции медиаторов воспаления и местных факторов защиты. Интересно, что даже через 4 недели от начала заболевания уровень провоспалительных цитокинов также зависел от назначенного лечения. В группе детей, получавших Лактиале, содержание интерлейкина-1β, -2, -4, -6, -8 и TNF находилось в пределах показателей здоровых детей группы контроля, в отличие от детей, не получавших синбиотик. Уровень секреторного IgА и активность лизоцима были ниже чем у здоровых детей. Но у пациентов, получавших Лактиале, он оставался в пределах физиологических значений.
Таким образом, использование пробиотиков в схемах лечения детей с кишечными инфекциями высокоэффективно. Применение синбиотика Лактиале приводит к более быстрой регрессии симптомов и нормализации показателей иммунного статуса. Лактиале может быть рекомендован в схемах комплексной терапии детей с бактериальными кишечными инфекциями для снижения риска побочных реакций от приема антибиотиков, а также в качестве иммуномодулирующего средства.
Подготовила Мария Маковецкая