14 червня, 2019
Сепсис: сучасні підходи до лікування в епоху антибіотикорезистентності
Впровадження антибіотиків у клінічну практику мало величезний вплив на долю людства й сприяло збільшенню очікуваної тривалості життя приблизно на десять років. Проте сьогодні ці наукові здобутки знаходяться під загрозою – передусім через появу й поширення резистентності до антибіотиків серед клінічно значущих патогенів. Одним із найважливіших підходів до вирішення цієї проблеми є зважене використання антибіотиків. Уперше в Україні в рамках І Міжнародного конгресу «Раціональне використання антибіотиків у сучасному світі» провідні науковці світу зібралися для того, щоб обговорити ці питання й обмінятися досвідом.
.jpg)
Думка вітчизняних фахівців щодо проблеми антибіотикорезистентності була представлена широко й змістовно. Так, із доповіддю «Сучасні принципи антибіотикотерапії сепсису» виступив президент Асоціації анестезіологів України, професор кафедри анестезіології та інтенсивної терапії Національного медичного університету ім. О.О. Богомольця, доктор медичних наук Сергій Олександрович Дубров.
Захворюваність на сепсис протягом останніх десятиліть постійно зростає. Сепсис розглядають як небезпечний для життя стан, спричинений інфекцією, який асоціюється з високим ризиком смерті. Термінологія дефініцій «сепсису» упродовж певного періоду часу зазнала ряду змін. Так, до 2016 р. поняття «сепсис» визначалося як синдром системної запальної відповіді (ССЗВ) за наявного або підтвердженого вогнища інфекції.
ССЗВ – це відповідь організму на подразник, який може бути як механічним (травма, опіки тощо), так й інфекційним (запалення) і характеризується двома або більше ознаками:
- температура тіла >38 °C або <36 °C;
- частота серцевих скорочень >90 уд./хв;
- частота дихальних рухів >20 на 1 хв або РаСО2 <32 мм рт. ст.;
- кількість лейкоцитів >12×109 або <4×109 або кількість незрілих форм перевищує 10%.
Виходячи з цих критеріїв у значної кількості пацієнтів відділень інтенсивної терапії (ВІТ) встановлювали діагноз сепсису. Так, за даними Sepsis Occurrence in Acutely Ill Patients (SOAP) Study (2006), у ВІТ ряду клінік Європи з 3147 хворих 37,4% мали сепсис. В Україні, згідно з даними звітів головних обласних позаштатних анестезіологів (2014), із 440 853 пацієнтів ВІТ лише 0,08% мали сепсис, що може бути зумовлено недостатньою діагностикою.
У 2016 році більшістю наукових товариств критерії визначення сепсису були переглянуті (Singer M. et al., The Third International Consensus Definition for Sepsis and Septic Shock, Sepsis‑3). Так, на сьогодні ССЗВ разом із наявним або підтвердженим вогнищем інфекції не вважається більше критеріями для встановлення діагнозу «сепсис». Ознаки ССЗВ не обов’язково вказують на зміни, небезпечні для життя. Сепсис визначається як загрозлива життю органна дисфункція внаслідок порушення відповіді хазяїна на інфекцію. Термін «тяжкий сепсис» в нових рекомендаціях виключено, оскільки поліорганна недостатність, на думку експертів, має розглядатися як складова сепсису, а не його ускладнення.
Органна дисфункція може бути визначена як гостра зміна в загальній кількості балів за шкалою Sequential Organ Failure Assessment (SOFA) ≥2 внаслідок інфекції. При цьому два і більше балів за шкалою SOFA відображають підвищення ризику летальності на 10% в загальній госпітальній популяції хворих із підозрою на інфекцію. Однак існують певні недоліки шкали SOFA для ранньої діагностики сепсису. Це пояснюється тим, що шкала недостатньо відома за межами ВІТ, а тому використовується виключно лікарями-анестезіологами. До того ж вона дозволяє оцінити тяжкість поліорганної недостатності, а не підозру на інфекцію. При цьому враховуються не клінічні дані, що доступні в будь-який момент, а в основному дані лабораторної діагностики, що потребує доступу до лабораторії. Так, необхідність визначення респіраторного індексу (відношення парціального тиску кисню в артеріальній крові до вмісту кисню у видихуваному повітрі) PaO2/ FiO2 потребує наявності газового аналізатора, яким забезпечені далеко не всі ВІТ в Україні. Тому експертами було запропоновано використання нової шкали Quick SOFA (qSOFA).
На відміну від шкали SOFA, qSOFA включає оцінку всього трьох параметрів: частоти дихання, рівня свідомості та рівня систолічного артеріального тиску (АТ).
Септичний шок – гіпотензія на фоні адекватної інфузійної терапії та призначення вазопресорів (доповідач зауважив, що показник середнього АТ має бути не менше 65 мм рт. ст.); рівень лактату ≥ 2 ммоль/л.
Далі професор С.О. Дубров представив результати загальновідомого міжнародного дослідження поширеності та наслідків інфекційних ускладнень у пацієнтів ВІТ (Vincent J.L. et al., 2009). Серед загальної кількості хворих, що складала 13 796 осіб, 9084 (71%) пацієнти отримували антибіотики. Інфекційні ускладнення було діагностовано у 7087 із 13 796 пацієнтів (51%). Інфекція дихальних шляхів відзначалась у 4503 (63,5%). Показник летальності у ВІТ серед пацієнтів із нозокоміальними інфекційними ускладненнями був майже в 2,5 разу вищий, ніж серед неінфікованих пацієнтів (25% проти 11%).
Раннє визначення патогенного збудника у хворого на сепсис є дуже важливим та відповідальним завданням лікаря з метою ефективного та своєчасного призначення адекватної антибактеріальної терапії.
На сьогодні виділено особливу групу збудників із високим рівнем резистентності до сучасних антибактеріальних препаратів – ESKAPE: Enterococcus faecium, Staphylococcus aureus, Klebsiella pneumoniae, Acinetobacter baumannii, Pseudomonas aeruginosa, Enterobacter spp.
Професор С.О. Дубров навів узагальнені дані стосовно виявлення патогенів групи ESKAPE в лікувальних закладах України станом на 2014 р. (%):
- Enterobacter spp. – 13,06;
- Pseudomonas aeruginosa – 20,20;
- Acinetobacter baumannii – 11,82;
- Escherichia coli – 12,53;
- Klebsiella pneumoniae – 9,79;
- Staphylococcus aureus – метицилінрезистентний золотистий стафілокок (Methicillin-resistant Staphylococcus aureus, MRSA) – 17,73;
- Staphylococcus aureus – метицилінчутливий золотистий стафілокок (Methicillin-susceptible Staphylococcus aureus, MSSA) – 7,06;
- Enterococcus faecium – 7,81.
Заходи інтенсивної терапії
А. Початкова інфузійна терапія
Інфузійну терапію слід розпочинати відразу з внутрішньовенного введення розчинів кристалоїдів (перевага віддається збалансованим розчинам) у дозі 30 мл/кг протягом перших 3 год, після чого слід провести переоцінку об’єму інфузійної терапії, ґрунтуючись на показниках моніторингу гемодинаміки.
У пацієнтів із СШ, які потребують вазопресорної підтримки, початковий цільовий рівень середнього AT становить 65 мм рт. ст.
Також рекомендоване використання розчину альбуміну з кристалоїдами для подальшого заміщення внутрішньосудинного об’єму у випадку, якщо пацієнти потребують значного об’єму кристалоїдів. Згідно з даними протоколів, застосування розчинів гідроксиетилкрохмалю для відновлення об’єму циркулюючої крові у хворих із сепсисом та септичним шоком є недоцільним.
Зростання рівня лактату є маркером гіпоперфузії тканин, а його зменшення або нормалізація визначає ефективність заходів інтенсивної терапії.
D. Антибактеріальна терапія
Відповідно до чинних гайдлайнів, хворим із сепсисом або септичним шоком після встановлення діагнозу показано якнайшвидше (протягом 1 год) довенне введення антибактеріальних препаратів (АБП). Стратегії дозування АБП ґрунтуються на особливостях фармакокінетики/фармакодинаміки та специфічних властивостях препаратів.
Призначення емпіричної комбінованої антибактеріальної терапії спрямоване на найбільш вірогідного збудника(ів) на початковому етапі лікування септичного шоку, що зумовлює застосування щонайменше двох препаратів різних класів. Також одним із принципів проведення антибактеріальної терапії є рання деескалація (згідно результатів антибіотикограми).
Стосовно особливостей застосування певних класів АБП професор С.О. Дубров зазначив наступне: β-лактамні антибіотики, у т. ч. карбапенеми, демонструють часозалежний бактерицидний ефект. Так, ефективність карбапенемів визначається часом (Т), протягом якого концентрація препарату у плазмі крові перевищує мінімальну інгібуючу концентрацію (МІК): Т>МІК. Максимальний бактерицидний ефект меропенему досягається при Т>МІК >35-40% інтервалу між інфузіями. Для підвищення ефективності антибактеріальної терапії можливе проведення постійної або пролонгованої інфузії.
Стосовно інших класів АБП, таких як фторхінолони, аміноглікозиди більш ефективним вважається однократне введення добової дози препарату. Тривалість антибактеріальної терапії, навіть для серйозних інфекцій, пов’язаних із сепсисом та септичним шоком, у більшості випадків не має перевищувати 7-10 діб. Більш тривалі курси показані хворим, у яких має місце повільна клінічна відповідь, вогнища інфекції, MRSA-бактеріємія, деякі грибкові або вірусні інфекції, імунодефіцит, у тому числі нейтропенія.
З метою деескалації антимікробної терапії у пацієнтів із сепсисом та септичним шоком рекомендовано проведення щоденної оцінки стану. Рівень прокальцитоніну може бути використаний із метою прийняття рішення щодо припинення антибактеріальної терапії у хворих із початковими проявами сепсису, які згодом мають обмежені клінічні прояви інфекційного процесу.
E. Контроль джерела інфекції
У пацієнтів із сепсисом або септичним шоком вкрай необхідним є якомога швидка ідентифікація специфічного анатомічного джерела інфекції або його виключення. Виявлення джерела інфекції зумовлює необхідність медичного втручання з метою його ліквідації. Рекомендовано швидке видалення систем для внутрішньосудинного доступу (після того, як буде встановлено інший судинний доступ), які є можливим джерелом сепсису або септичного шоку.
Антибактеріальні препарати, які призначаються при лікуванні нозокоміальних інфекцій, спричинених грампозитивними бактеріями:
- глікопептиди (ванкоміцин, тейкопланін);
- оксазолідинони (лінезолід);
- гліцилцикліни (тігациклін);
- даптоміцин;
- цефалоспорини 5-го покоління;
Антибактеріальні препарати, які призначаються при лікуванні нозокоміальних інфекцій, спричинених грамнегативними бактеріями:
Монотерапія
- Карбапенеми:
- ертапенем
- меропенем
- іміпенем
- доріпенем
- Захищені цефалоспорини:
- цефоперазон/сульбактам
- Захищені пеніциліни:
- піперацилін/тазобактам
Ертапенем неактивний по відношенню до неферментуючих грамнегативних збудників, таких як Pseudomonas aeruginosa та Acinetobacter baumannii. Натомість захищені цефалоспорини цефоперазон/сульбактам (Гепацеф-комбі) характеризуються високою активністю до Acinetobacter baumannii в основному за рахунок сульбактаму.
Комбінована терапія
Цефалоспорини 3-4-го покоління, у тому числі захищені цефалоспорини з карбапенемами, аміноглікозидами або коломіцином, захищені пеніциліни з фосфоміцином (у парентеральній формі), карбапенеми з карбапенемами у випадку панрезистентних збудників. Також можливе додавання фторхінолонів 2-4-го покоління, гліцилциклінів (тігациклін).
Критеріями відміни АБП є наступні показники:
- нормалізація температури (Тmax <37,5 °C);
- зниження рівня прокальцитоніну та С-реактивного протеїну;
- відсутність інтоксикації;
- стійка позитивна динаміка симптомів.
F. Інфузійна терапія
Введення рідини слід продовжувати до тих пір, поки гемодинамічні показники продовжують поліпшуватися. Для інфузійної терапії хворих із сепсисом або септичним шоком слід використовувати збалансовані розчини кристалоїдів або розчин NaСl 0,9%. Рекомендується використовувати альбумін як додатковий розчин до кристалоїдів для початкової ресусцитації та подальшого внутрішньосудинного заміщення об’єму у хворих із сепсисом і септичним шоком у випадку, коли пацієнт потребує значної кількості кристалоїдів.
Доповідач зазначив, що у пацієнтів із сепсисом або септичним шоком використання кристалоїдів має перевагу порівняно з желатином. Для внутрішньосудинного заміщення об’єму у цієї категорії хворих не рекомендується використовувати гідроксиетилкрохмали (НЕSs).
G. Вазоактивні препарати
У хворих із септичним шоком препаратом вибору першої лінії вазопресорів є норадреналін (norepinephrine). Для підтримання цільового показника середнього АТ та зниження дози норадреналіну можливо додавання вазопресину (до 0,03 ОД/ хв).
Дофамін як альтернативний норадреналіну вазопресорний препарат показаний лише у ретельно відібраних пацієнтів (із низьким ризиком розвитку тахіаритмії та абсолютною або відносною брадикардією).
Не рекомендовано:
- застосування низьких доз дофаміну для «захисту» нирок;
- призначення добутаміну у хворих з ознаками стійкої гіпоперфузії на фоні адекватної інфузійної терапії та використання вазопресорів.
Усім пацієнтам, які потребують введення вазопресорів, необхідно забезпечити артеріальний доступ (наявність артеріального катетера за можливості ресурсного забезпечення).
H. Кортикостероїди
Не рекомендовано внутрішньовенне введення гідрокортизону для лікування пацієнтів із септичним шоком, якщо стабілізація гемодинаміки досягається завдяки адекватній рідинній ресусцитації та терапії вазопресорами. У противному випадку пропонується використання гідрокортизону в дозі 200 мг/ добу.
I. Препарати крові
Трансфузія еритроцитів показана у випадку, коли концентрація гемоглобіну знижується до рівня <7,0 г/дл (у дорослих) за відсутності обтяжливих обставин, таких як ішемія міокарда, тяжка гіпоксемія або гостра крововтрата.
Не рекомендовано:
- використання еритропоетину для лікування анемії, пов’язаної із сепсисом;
- інфузія свіжозамороженої плазми (СЗП) для корекції порушень згортання за відсутності кровотечі або планованих інвазивних процедур.
Профілактична трансфузія тромбоцитів показана хворим у наступних випадках:
- рівень тромбоцитів <10×109/л при відсутності явної кровотечі;
- рівень тромбоцитів <20×109/л, якщо пацієнт має значний ризик кровотечі;
- рівень тромбоцитів ≥50×109/л при активній кровотечі, операції або інвазивних процедурах.
О. Контроль глікемії
У хворих ВІТ із сепсисом слід використовувати протоколи контролю рівня глюкози крові. Введення інсуліну слід починати при рівні глікемії >180 мг/ дл (>10 ммоль/л) після дворазового вимірювання. Контролювати глікемію необхідно кожні 1-2 год до тих пір, поки її рівень та швидкість інфузії інсуліну не стабілізуються, а потім через кожні 4 год у хворих, які отримують інфузію інсуліну.
Якщо у пацієнта встановлено артеріальний катетер, для визначення рівня глікемії використовують артеріальну, а не капілярну кров.
R. Профілактика тромбоемболічних ускладнень
Показано проведення фармакологічної профілактики венозної тромбоемболії (ВТЕ) нефракціонованим гепарином (НФГ) або низькомолекулярними гепаринами (НМГ) (Surviving Sepsis Campaign: International Guidelines for Management of Sepsis and Septic Shock, 2016). За відсутності протипоказань перевагу віддають НМГ. За можливості слід поєднувати фармакологічну й механічну профілактику ВТЕ. За наявності протипоказань до проведення фармакологічної профілактики ВТЕ слід використовувати механічні методи.
Додаткові специфічні фактори ризику ВТЕ у пацієнтів ВІТ:
- сепсис;
- застосування вазопресорів;
- респіраторна або серцева недостатність;
- фармакологічна седація;
- механічна вентиляція;
- центральний венозний катетер;
- термінальна стадія ниркової недостатності.
Сепсис може провокувати гіперкоагуляцію та сприяти розвитку катетер-асоційованого тромбозу.
Доповідач навів результати дослідження D. Kaplan та співавт., опублікованого у журналі CHEST (2015), в якому вивчали частоту ВТЕ у пацієнтів із сепсисом або септичним шоком. Серед усіх хворих (113) у 42 осіб (37,2%) встановлено діагноз ВТЕ. При цьому проксимальний тромбоз глибоких вен (ПТГВ) верхніх кінцівок діагностовано у 14,2%, ПТГВ нижніх кінцівок – у 11,5%, симптомний дистальний ТГВ – у 9,7%, безсимптомний дистальний ТГВ – у 4,4%, симптомну тромбоемболію легеневої артерії з ТГВ або без такої – у 3,5%.
S. Профілактика стресових виразок шлунково-кишкового тракту
У чинних настановах рекомендовано проведення профілактики стрес-індукованих виразок у пацієнтів із сепсисом та септичним шоком за умови наявності факторів ризику розвитку шлунково-кишкової кровотечі (ШКК). Із цією метою застосовують інгібітори протонної помпи (РРІs) або антагоністи Н2-гістамінових рецепторів (Н2RАs). У хворих без факторів ризику розвитку ШКК рутинна профілактика стресових виразок не рекомендована.
Т. Нутритивне забезпечення
У пацієнтів із сепсисом та септичним шоком слід віддавати перевагу ентеральному харчуванню, якщо це можливо. Не рекомендовано застосування раннього лише парентерального харчування; або парентеральне + ентеральне харчування (слід якнайшвидше розпочинати ентеральне харчування), навіть у критичних хворих, які можуть харчуватись ентерально.
У хворих із сепсисом та септичним шоком, які можуть харчуватись ентерально, слід розпочинати раннє ентеральне харчування, а не лише довенне введення глюкози, а також застосовувати раннє трофічне/низькокалорійне або раннє повне ентеральне харчування.
Не рекомендовано призначення омега‑3 жирних кислот, аргініну та глутаміну в якості імунної добавки критичним хворим із сепсисом та септичним шоком.
За наявності порушень засвоєння нутрієнтів слід використовувати прокінетики. Для проведення ентерального харчування (post-pyloric feeding tubes) у критичних хворих із сепсисом та септичним шоком, у хворих із порушенням моторики шлунка та засвоєння їжі, у пацієнтів з високим ризиком аспірації рекомендовано встановлювати інтестинальний зонд.
 З доповіддю «Антибіотикотерапія. Чого більше: помилок чи резистентності?» виступив директор Українського медичного центру інтенсивної терапії сепсису, заслужений лікар України, президент Товариства спеціалістів з антибіотикотерапії, кандидат медичних наук Леонід Аполлонович Харченко.
З доповіддю «Антибіотикотерапія. Чого більше: помилок чи резистентності?» виступив директор Українського медичного центру інтенсивної терапії сепсису, заслужений лікар України, президент Товариства спеціалістів з антибіотикотерапії, кандидат медичних наук Леонід Аполлонович Харченко.
У своєму виступі він наголосив, що неправильне призначення антибактеріальних препаратів (антибіотиків) може призвести до серйозних медичних наслідків й істотно вплинути не тільки на перебіг захворювання, а й на формування антибіотикорезистентності. Адже сепсис може бути клінічним проявом інфекцій, зараження якими можливе як за межами медичних установ, так і всередині них.
Сепсис, викликаний внутрішньолікарняною інфекцією
Інфікування, що відбулося в межах медичного закладу під час надання медичної допомоги, є одним із найбільш поширених різновидів несприятливих подій, що відбуваються в ході такої допомоги.
Сепсис – загрозлива для життя органна дисфункція, викликана порушенням регуляції реакції організму пацієнта на інфекцію. Якщо сепсис не розпізнати на ранній стадії й не забезпечити своєчасне лікування, можуть розвинутися септичний шок, поліорганна недостатність, що часто призводить до летального кінця. Сепсис може бути спричинений будь-яким типом інфекційного патогена. Отже, стійкість до протимікробних препаратів є ключовим чинником, що викликає відсутність клінічної відповіді на лікування, швидкий розвиток сепсису та септичного шоку. Серед пацієнтів із сепсисом, викликаним антибіотикорезистентними патогенами, спостерігається підвищений ризик лікарняної летальності.
Септичний шок – розвиток стійкої гіпотензії попри достатню інфузійну підтримку. Сепсис є невідкладним станом, однак ознаки й симптоми його в пацієнтів можуть бути різними в певні моменти часу. Це зумовлено тим, що такий клінічний стан може бути викликаний безліччю збудників, і характер протікання процесу може змінюватися на різних етапах. До тривожних ознак і симптомів відносяться підвищення або зниження температури тіла й озноб, зміна психічного стану, утруднене/прискорене дихання, прискорене серцебиття, ослаблення пульсу/низький кров’яний тиск, олігурія, синюшність або мармуровість шкіри, похолодання кінцівок і сильний біль або дискомфорт у тілі. Виникнення підозри на сепсис є першим кроком до його раннього виявлення та діагностики. Хірургічне дренування й антибактеріальна терапія найбільш ефективні при цьому стані.
Антибіотикотерапія
Внутрішньовенна антибіотикотерапія має розпочинатися протягом першої години з моменту розпізнавання тяжкого сепсису після забору мікробіологічного матеріалу. Починати слід із введення одного-двох препаратів, активних по відношенню до можливого причинного агента.
Призначаючи антибіотики пацієнтам із сепсисом, слід враховувати основні чотири групи патогенних мікроорганізмів:
- грампозитивні бактерії;
- грамнегативні бактерії;
- анаероби;
- метицилінрезистентні штами.
Парентеральне введення антибіотиків призначається в максимально короткі терміни після взяття зразків крові, біологічних рідин та пошкоджених тканин для дослідження (фарбування за Грамом, посів на живильне середовище). Рання емпірична терапія, розпочата негайно при виникненні підозри на сепсис, вкрай важлива й може бути вирішальною.
Вибір антибіотика вимагає обґрунтованого припущення виходячи з наступних критеріїв:
- можливого джерела зараження (наприклад, пневмонія, інфекція сечовивідних шляхів);
- клінічних умов;
- доведених або передбачуваних збудників, їх чутливості в умовах даного стаціонару;
- попередніх результатів бактеріологічного посіву.
Як правило, спершу використовується широкий спектр грампозитивних і грамнегативних антибактеріальних препаратів. Пацієнти з ослабленим імунітетом повинні також отримувати емпіричний протигрибковий препарат. Обов’язково необхідно провести переоцінку призначених АБП через 72 год з моменту введення (продовжити у тій же дозі/змінити дозу або призначити інший препарат).
Існує багато можливих вихідних схем лікування. За наявності слід використовувати інформацію стосовно особливостей мікрофлори в середовищі певного лікувального закладу, чутливості її до антибіотиків (за даними антибіотикограми). Загалом типовими антибіотиками для емпіричного лікування грампозитивних бактерій є ванкоміцин і лінезолід. Емпірична терапія, спрямована проти грамнегативних бактерій, має більше можливостей і включає в себе пеніциліни широкого спектра дії (наприклад, піперацилін/тазобактам), цефалоспорини 3-го або 4-го покоління, іміпенемом і аміноглікозиди. Початковий широкий спектр дії звужується залежно від виявленого збудника та його чутливості до антибіотиків.
Л.А. Харченко зазначив, що існує ряд захворювань, характер протікання яких схожий із сепсисом, до яких відносять наступні:
- системні захворювання;
- лімфопроліферативні хвороби;
- панікуліти;
- вісцеральний туберкульоз;
- пухлини;
- синдром імунодефіциту;
- хвороба Крона;
- сифіліс;
- аутоімунні гепатити та ін.
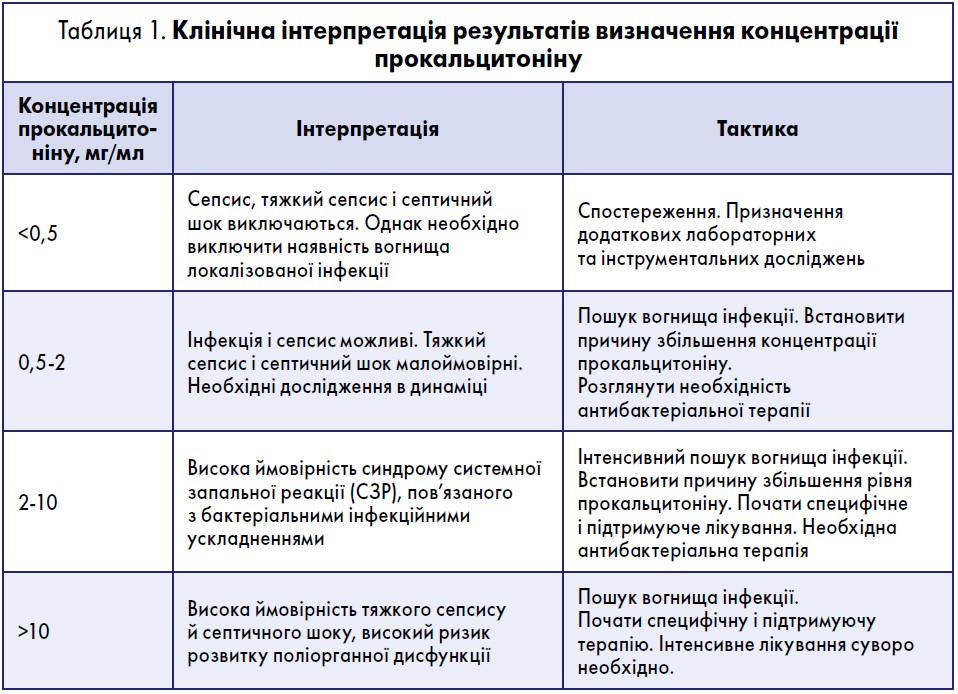
Саме тому важливим аспектом диференційної діагностики є визначення рівня прокальцитоніну в пацієнтів із підозрою на сепсис (табл. 1). Так, за даними S. Harbarth та співавт. (2001), при діагностичному рівні прокальцитоніну 1,1 нг/мл (Cut-off) у процесі диференціальної діагностики сепсису чутливість становила 97%, а специфічність – 78%. Важливим також є визначення рівня цього показника у динаміці.
Однак слід знати, що у хворих із патологією печінки, жовчовивідних шляхів не варто орієнтуватися на рівень прокальцитоніну, бо він не відображає дійсний ступінь вираженості запалення. Посилаючись на дані власних спостережень, доповідач зазначив, що іноді специфічність діагностичного рівня прокальцитоніну в процесі диференціальної діагностики сепсису становить навіть ≤69%.
У рамках мікробіологічного моніторингу українськими фахівцями було проведено дослідження (2009-2010), метою якого було вивчення особливостей клінічних штамів, виділених у хворих, що перебувають у відділеннях (переважно хірургічного профілю) стаціонару для вибору оптимальних схем емпіричної антимікробної терапії на підставі епідеміологічного моніторингу рівня антибіотикорезистентності мікроорганізмів, що циркулюють у стаціонарі.
Мікробіологічний моніторинг резистентності мікроорганізмів до антибіотиків корпорації «Артеріум» проводили у таких містах, як Київ, Донецьк, Луганськ, Харків, Чернігів, Одеса, Дніпропетровськ, Львів, Тернопіль, Сімферополь. Досліджувалась чутливість до наступних антибактеріальних препаратів: Аміцил (амікацин), Цефтум (цефтазидим), Гепацеф (цефоперазон), Гепацеф комбі (цефоперазон + сульбактам), Квадроцеф (цефепім), Цефтриаксон, Флоксіум (левофлоксацин), Ципрофлоксацин, Мепенам (меропенем), Амоксил-К (амоксицилін + клавуланова кислота).
Стосовно послідовності призначення антибіотиків у пацієнтів з тяжкою інфекцію слід керуватися принципом деексалаційної терапії. Наприклад, слід починати лікування з меропенему (Мепенаму) і лінезоліду. Через 72 год обов’язково потрібно проводити корекцію лікування.
Далі доповідач навів результати дослідження стосовно п’яти найбільш поширених збудників нозокоміальної інфекції у ВІТ країн Європи: S. aureus – 30% (MSSA – 40%, MPSA – 60%), P. aeruginosa – 29%, коагулазонегативний стафілокок – 19%, гриби – 17%, E. coli – 13%. На сьогодні MPSA-флора являє вкрай серйозну проблему лікування хворих у ВІТ. Найбільш часто у таких випадках призначаються ванкоміцин та тейкопланін. Але обидва вони нефротоксичні, тому кращою альтернативою буде призначення лінезоліду.
Орієнтовні схеми комплексної антибіотикотерапії в інтенсивній терапії:
- меропенем (Мепенам) – у дозі 1 г 3 р./добу (охоплює спектр грампозитивних, грамнегатиних патогенів та анаероби);
- тейкопланін (Глітейк) – у дозі 400 мг/добу (активний стосовно MRSA).
Якщо у хворого збільшені рівні сечовини і креатиніну, показаний лінезолід (Лінезолідін) у дозі 600 мг 2 р./добу (діє на MRSA). Лінезолід – синтетичний антибіотик, єдиний на сьогодні представник класу оксазолідинонів, який не чинить нефротоксичну дію. Застосовується для лікування тяжких інфекційних захворювань, викликаних грампозитивними бактеріями, стійкими до метіциліну.
Доповідач також звернув увагу колег на ще одне питання, яке досить часто постає перед практикуючим лікарем: який препарат обрати – брендовий чи генерик? Цю проблему слід розглядати виходячи з того, що витрати на охорону здоров’я практично в кожній країні обмежені, а одним із головних способів зниження вартості лікування є застосування генериків. Саме тому з цих позицій у всьому світі генеричним препаратам віддається перевага перед брендовими (Страчунський Л.С., 2007).
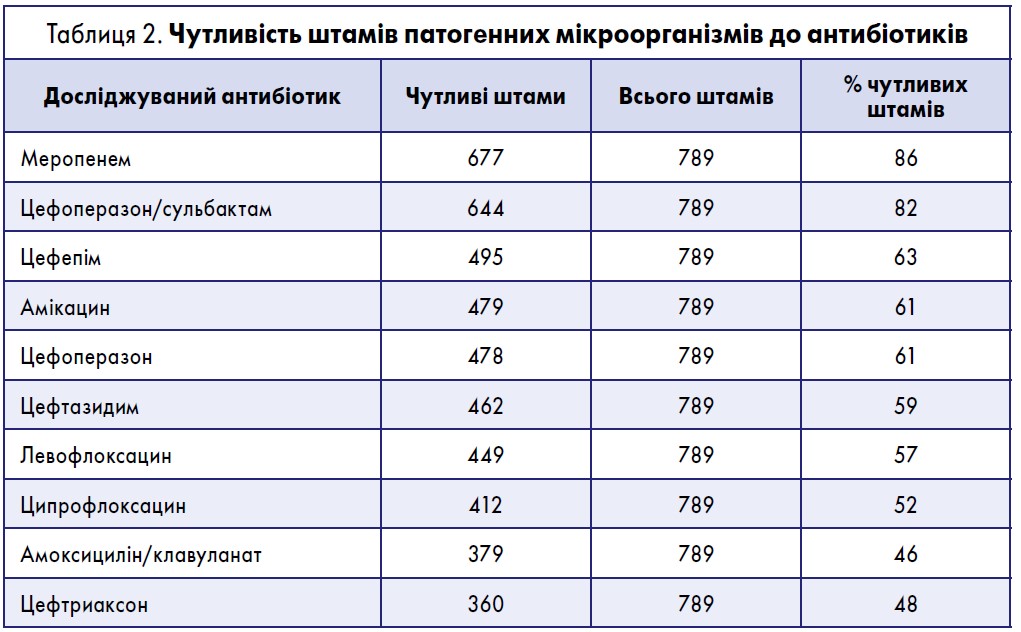
Далі Л.А. Харченко навів результати моніторингу антибіотикорезистентності (табл. 2), за результатами якого виділено всього 789 штамів патогенних мікроорганізмів.
Відповідно до результатів моніторингу антибіотикорезистентності до меропенему та цефоперазону/сульбактаму виявлена найбільш висока чутливість. Таким чином, ці препарати можна призначати емпірично для лікування хворих із тяжкою інфекцією. Натомість амоксицилін із клавулановою кислотою та цефтриаксон не рекомендовані в таких випадках.
Отже, дотримання простих принципів раціональної антибактеріальної терапії, а саме обґрунтоване призначення антибіотиків та своєчасна їх відміна, командна робота клініцистів, мікробіологів та клінічних фармацевтів, а також дотримання вимог інфекційного контролю в лікувальних закладах дозволять не лише стримати зростання резистентності госпітальних та позалікарняних штамів мікроорганізмів до антибактеріальних препаратів, а й поступово зменшити питому вагу полірезистентних штамів.
Підготувала Марія Ареф’єва
Тематичний номер «Хірургія, Ортопедія, Травматологія, Інтенсивна терапія» № 1 (35), лютий 2019 р.