4 жовтня, 2016
Функциональная диспепсия в свете Римских критериев IV
Данными многочисленных исследований установлено, что примерно 20% всей человеческой популяции имеют хронические симптомы, связанные с нарушением гастродуоденальной функции, причем со стороны желудочно-кишечного тракта (ЖКТ) каких-либо структурных изменений у большинства из этих людей нет. Согласно Римским критериям IV функциональные гастродуоденальные расстройства классифицируются по 4 категориям: функциональная диспепсия (ФД), расстройства отрыгивания, тошнотные и рвотные расстройства и руминационный синдром.
В свою очередь, ФД подразделяется на постпрандиальный дистресс-синдром (ПДС) и эпигастральный болевой синдром (ЭБС), расстройства отрыгивания – на чрезмерные супрагастральные и желудочные отрыжки, а рвотные и тошнотные расстройства – на синдром хронической тошноты и рвоты, циклический рвотный синдром и синдром чрезмерной каннабиоидной рвоты [3].
Функциональная диспепсия: определение
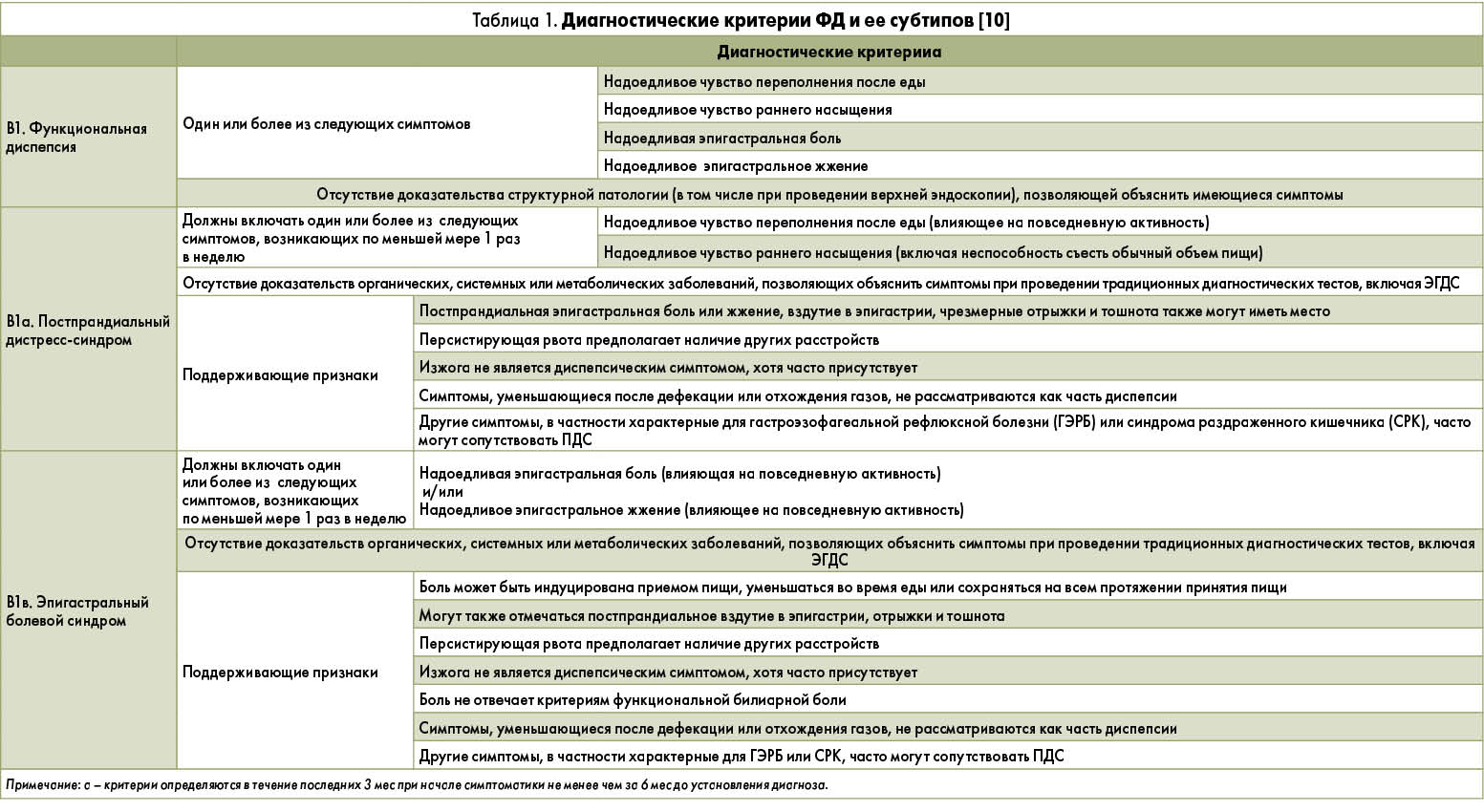
Согласно предыдущим Римским критериям ФД рассматривалась как заболевание, значительно влияющее на повседневную активность пациентов и характеризующееся одним или более из следующих симптомов: раннее насыщение, эпигастральная боль и/или эпигастральное жжение, которые нельзя объяснить при помощи рутинного клинического обследования [10]. Симптомное определение ФД оставалось слишком неопределенным и трудным для восприятия как пациентами, так и врачами или исследователями. Поэтому Римский комитет предложил детализировать определение ФД путем более подробной характеристики симптомов.
В Римских критериях IV рекомендуется рассматривать ФД как широкое понятие, охватывающее пациентов с ПДС, характеризующимся возникновением диспепсической симптоматики, индуцированной приемом пищи; пациентов с ЭБС, при котором эпигастральная боль или эпигастральное жжение могут возникать не только исключительно сразу после приема пищи, а и во время еды или же даже уменьшаться при приеме пищи; а также пациентов с перекрестом симптомов ПДС и ЭБС (оверлэп ЭБС и ПДС), при котором отмечаются как диспепсические симптомы, индуцированные приемом пищи, так и эпигастральная боль и/или жжение (табл. 1).
Неисследованная и исследованная диспепсия
С этиологической точки зрения, все пациенты с диспепсическими симптомами могут быть разделены на 2 основные группы:
- Пациенты с органическими, системными или метаболическими причинами диспепсической симптоматики, которые могут быть идентифицированы во время проведения традиционных диагностических процедур (пептические язвы, злокачественные опухоли, панкреатобилиарная патология, эндокринные расстройства, прием гастротоксичных медикаментов). При соответствующем лечении или вылечивании симптомы диспепсии уменьшаются или полностью исчезают. Такое состояние трактуется как вторичная диспепсия вследствие известных причин, включая инфекцию Helicobacter рylori [6,10].
- Пациенты, у которых имеющаяся симптоматики не может быть объяснена при помощи традиционных диагностических методов, рассматриваются как имеющие функциональную диспепсию, представляющую собой своеобразный терминологический «зонтик».
Эпидемиология
Проведенные широкомасштабные эпидемиологические исследования свидетельствуют о том, что ФД страдают от 10 до 30% всего населения земного шара [4]. Распространенность ФД в разных популяциях сильно варьирует, что связано с различной интерпретацией и выраженностью симптомов, различными диагностическими критериями, факторами окружающей среды, локальной распространенностью органических заболеваний, таких как пептические язвы или рак желудка. У пациентов с ФД сильно страдает качество жизни, что связано с эмоциональным дистрессом вследствие постоянных симптомов, расходами на приобретение лекарств и снижением трудоспособности. Во многих исследованиях идентифицировали различные факторы риска развития диспепсии (женский пол, возраст, низкий социально-экономический статус, инфицирование H. pylori, прием нестероидных противовоспалительных препаратов (НПВП), низкий образовательный уровень, стрессы и некоторые другие). Примечательно, что курение лишь частично ассоциировалось с диспепсией, в то время как прием алкоголя и кофе – нет [4, 10].
Отличие от предыдущих диагностических критериев
По сравнению с Римскими критериями III в последнюю версию внесены лишь минимальные изменения, касающиеся улучшения определения понятия ФД. Как уже было сказано, ФД по-прежнему остается терминологическим «зонтиком» для пациентов, отвечающих диагностическим критериям ПДС и/или ЭБС. Такое разделение первоначально базировалось на многофакторном анализе диспепсии в общей популяции и определении ФД, данном еще в Римских критериях II, – оно идентифицировало различные факторы возникновения симптомов, индуцированных приемом пищи, и эпигастральной боли, а позже было поддержано эпидемиологическими исследованиями с применением верхней эндоскопии [8,13]. Последующие исследования по изучению эффективности эрадикации H. pylori, антисекреторных средств и прокинетиков подтвердили существование ПДС и ЭБС как различных подтипов ФД.
Патофизиологические исследования, изучавшие влияние приема пищи на возникновение симптомов, показали, что не только постпрандиальное чувство переполненности и раннее насыщение, но также и эпигастральная боль / жжение и тошнота могут усиливаться после приема пищи [8,14]. Поэтому дефиниция ПДС была слегка модифицирована, с тем чтобы подчеркнуть, что чувство переполненности и раннее насыщение всегда возникают после еды, а другие симптомы, включающие эпигастральную боль / жжение, также могут восприниматься пациентом как индуцированные или усиливающиеся приемом пищи. Постпрандиальное вздутие в эпигастрии, отрыжки и тошнота могут отмечаться и при ПДС, и при ЭБС, выступая дополнительными признаками этих двух подтипов. В то же время персистирующая рвота для них не характерна и предполагает наличие других расстройств, нуждающихся в соответствующей диагностике [10].
Хотя симптомы, уменьшающиеся после дефекации или отхождения газов, обычно указывают на вовлеченность нижних отделов кишечника, они не рассматриваются как часть диспепсии и поэтому не включены в основные диагностические критерии ФД. То же касается и изжоги, исключенной из диспепсических симптомов и определения ФД, хотя нередко присутствующей при ГЭРБ. Типичная билиарная боль, которая характеризуется выраженной интенсивностью, эпизодичностью и непредсказуемостью, также рассматривается отдельно и может быть легко отделена от ЭБС на основании анамнеза и физикального обследования [10].
Другие небольшие изменения касаются более точного определения минимального предела частоты и выраженности каждого индивидуального симптома. В частности, для идентификации выраженность симптома должна быть достаточной, поэтому она лингвистически определена как «надоедливая», а клинически – как «достаточная для влияния на повседневную активность». Для исследовательских целей понятие «надоедливая» определена как ≥2 балла по 5-балльной шкале симптомов [10]. В предыдущих Римских критериях частота симптомов не детализировалась. В нынешней версии она определена как «минимально 3 раза в неделю» для ПДС и «минимально 1 раз в неделю» для ЭБС. Этот порог частоты симптомов основывается на данных, показавших, что не более 5% всей нормальной популяции отмечают более частое возникновение симптомов [3,4,8].
Патофизиология ФД
Патофизиология ФД сложная, мультифакториальная и до конца не изученная. Ключевыми факторами считают моторную и сенсорную гастродуоденальную дисфункцию, ухудшение целостности слизистой, низкоинтенсивную иммунную активацию и воспаление, а также дисрегуляцию оси «желудочно-кишечный тракт – центральная нервная система» [10].
Опорожнение желудка. Замедленное опорожнение желудка отмечается в среднем у 25-35% всех пациентов с ФД, в то время как быстрое опорожнение желудка не является характерным и наблюдается не более чем у 5% пациентов [11]. Корреляция между скоростью опорожнения желудка и возникновением симптоматики остается неопределенной. Выраженное замедление скорости опорожнения желудка, диагностируемое как гастропарез, чаще проявляется тошнотой и рвотой, а также потерей аппетита, хотя может быть и асимптоматичным.
Ухудшение желудочной аккомодации. Желудочная аккомодация контролируется ваго-вагальным рефлексом, возникающим вследствие приема пищи и опосредованным путем активации нервных окончаний в стенке желудка. Для больных ФД характерно ненормальное распределение принятой пищи с преимущественным накоплением химуса в антральном отделе и уменьшением заполнения проксимальных отделов желудка [13]. Редуцирование релаксации желудка в ответ на прием пищи отмечается примерно у 30-35% больных ФД, причем чаще возникает после перенесенных инфекционных гастроэнтеритов [15].
Желудочная и дуоденальная гиперсенситивность к растяжению, кислоте и другим интралюминальным стимулам. Гиперсенситивность желудка и 12-перстной кишки к механическим стимулам у больных ФД отмечается часто, хотя взаимоотношения между тощаковой гиперсенситивностью и появлением симптомов остаются неясными. Больные ФД также демонстрируют гиперсенситивность к химическим стимулам, таким как интралюминальная кислота или липиды [15]. Независимо от кислотозависимых эффектов ингибиторы протонной помпы (ИПП) могут уменьшать дуоденальную эозинофилию, а Н2-гистаминоблокаторы могут работать благодаря антигистаминным эффектам (уменьшение поступления тучных клеток и их дегрануляции у части больных ФД) [10].
Инфекция H. pylori. H. pylori рассматривается как возможный причинный фактор ФД только при успешной эрадикации инфекции, сопровождающейся разрешением всех симптомов [5]. Предполагается, что под влиянием успешной эрадикации могут нормализоваться желудочная секреция и гормональный статус, хотя нельзя исключить и такие механизмы, как предотвращение ранее недиагностированных пептических язв или модификация кишечной микробиоты.
Низкоинтенсивное дуоденальное воспаление, повышение проницаемости слизистой и пищевые антигены. Слизистый барьер гастродуоденальной зоны выступает как первая линия защиты против патогенов и раздражающих субстанций, поступающих в просвет желудка [15]. У пациентов с ФД нередко встречается дуоденальная эозинофилия, причем она явно связана с ощущением раннего насыщения [10]. В патогенезе воспаления дуоденальной слизистой и повышении ее проницаемости участвуют такие провоцирующие факторы, как инфекции, стрессы, кислота, курение и пищевая аллергия.
Воздействие факторов внешней среды. Острые инфекции могут вызывать верхние гастроинтестинальные симптомы у 10-20% инфицированных пациентов, хотя постинфекционная диспепсия протекает значительно короче и легче, чем постинфекционный СРК [13,15]. Развитие постинфекционной диспепсии обычно связано с особенностями инфекционных агентов и генетической предрасположенностью инфицированного пациента.
Психосоциальные факторы. Известна достаточно частая ассоциация между диспепсией и психическими расстройствами, особенно тревожностью, депрессией и невротизацией, что подтверждено данными метаанализа [13, 15]. Этому способствует психоэмоциональное перенапряжение и неспособность справляться с жизненными трудностями. Исследования с применением нейровизуализации показали, что когнитивные расстройства и эмоции могут влиять на восприятие симптомов пациентом.
Клиническое обследование и лечение
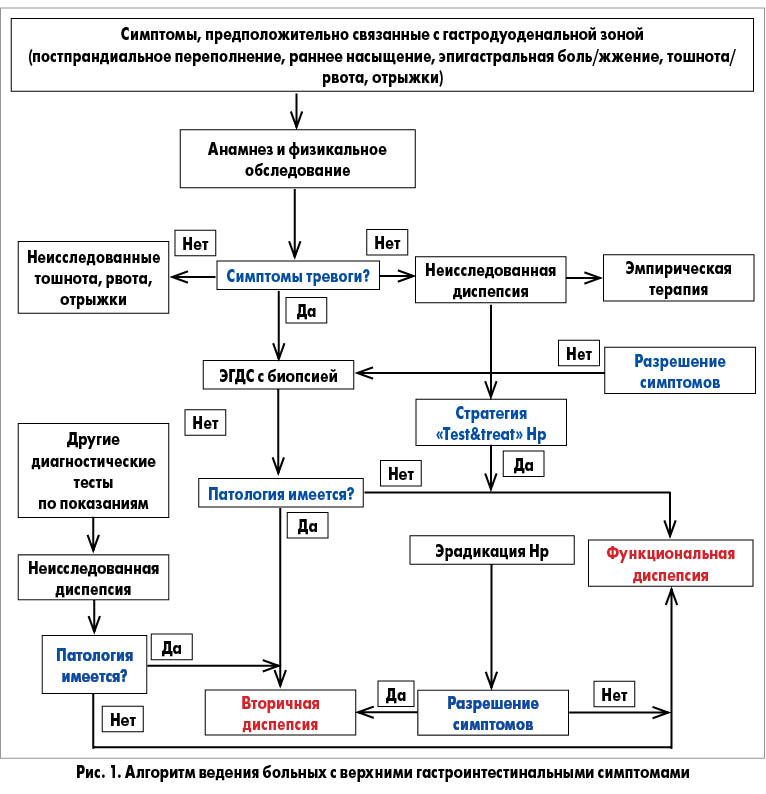
Стратегии ведения больных с неисследованной диспепсией основываются на тщательном сборе анамнеза, включая выявление «тревожных» симптомов и ятрогенных причин (например, прием НПВП), лечении сопутствующей и накладывающейся ГЭРБ, инфекции H. pylori (стратегия test and treat), особенно в регионах с ее высокой распространенностью, проведении верхней эндоскопии всем пациентам с «тревожными» симптомами (рис. 1) [7, 8].
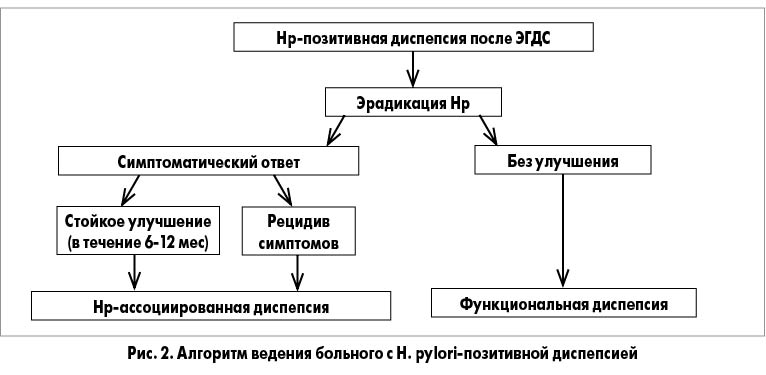
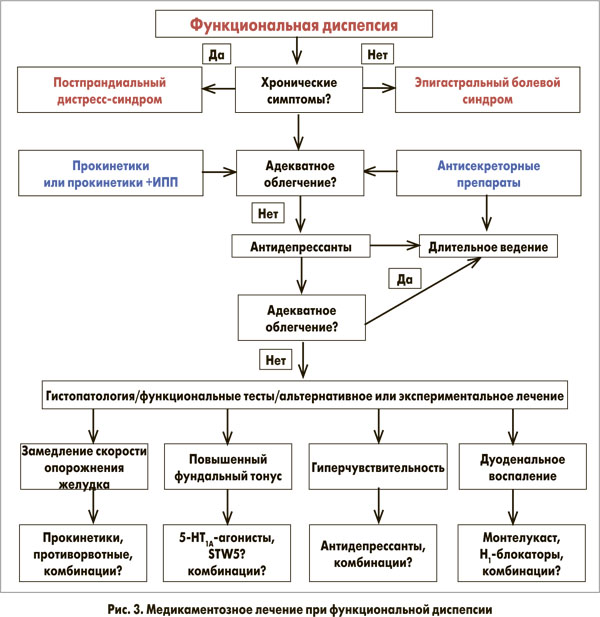
Все больные ФД нуждаются во врачебном объяснении симптомов, модификации стиля жизни и диетических рекомендациях (частое дробное питание небольшими порциями, отказ от жирной пищи и т. д.). Больным необходимо избегать приема НПВП, рекомендуется исключить кофе, алкоголь и курение. Имеются доказательства небольшого, но достоверно значимого преимущества эрадикации инфекции H. pylori (число больных, нуждающихся в лечении, равняется 14). Как и Киотский консенсус, Римские критерии IV рекомендуют отдельно рассматривать H. рylori-ассоциированную диспепсию и ФД. Если у H. рylori-инфицированного больного с диспепсией при отсутствии структурных изменений со стороны слизистой оболочки желудка после эрадикационной терапии отмечается стойкое улучшение симптоматики (в течение 6-12 мес), то таких пациентов следует относить к категории пациентов с H. рylori-ассоциированной диспепсией [12]. Проведенные исследования показали, что эрадикация H. pylori у диспепсических больных может быть наиболее эффективной стратегией в экономическом плане по сравнению с другими, более длительными, методами лечения. До настоящего времени неясно, зависит ли клиническая эффективность от субтипа ФД. Всех пациентов, не давших первичный ответ на эрадикационную терапию или имеющих рецидив симптоматики, рекомендуется рассматривать как больных с ФД, требующих другого лечения (рис. 2) [12]. Если ставится диагноз ФД, то больные сразу должны быть разделены на пациентов с ЭБС и пациентов с ПДС (рис. 3) [2].
Препараты первой линии и резервные методы лечения ФД представлены в таблице 2 [10]. ИПП и Н2-гистаминоблокаторы рассматриваются как эффективные средства для лечения ФД, в первую очередь ЭБС. Их эффективность превышает плацебо на 10-15%, что продемонстрировано несколькими рандомизированными клиническими исследованиями. Не исключено, что их эффективность может быть связана с недиагностированной ГЭРБ или перекрестом симптомов ФД и ГЭРБ. Как правило, ИПП при ПДС неэффективны [6, 7, 9, 16].
Прокинетики, такие как домперидон, в качестве препаратов первой линии лечения ФД рекомендуют применять при ПДС, причем желательно в тех случаях, когда замедление скорости опорожнения желудка подтверждено данными соответствующих исследований (сцинтиграфия или 13С-октаноевый дыхательный тест). Прокинетики – это препараты, которые на разных уровнях и с помощью различных механизмов меняют пропульсивную активность ЖКТ и ускоряют транзит пищевого болюса по нему. Наиболее широко применяются метоклопрамид и домперидон, реже – итоприд и мосаприд, значительно реже – эритромицин, прукалоприд, антагонисты 5-НТ3-рецепторов, антагонисты опиатных рецепторов и рецепторов холецистокинина [5, 8, 17].
Имеющиеся данные по безопасности домперидона указывают на низкий риск развития неблагоприятных сердечно-сосудистых реакций в сочетании с его хорошей клинической эффективностью. Согласно решению Европейского комитета по оценке фармакологического риска (PRAC) домперидон-содержащие препараты должны оставаться доступными и могут продолжать использоваться в Евросоюзе для воздействия на симптомы диспепсии, но рекомендуемая суточная доза не должна превышать 30 мг (3 раза по 10 мг или 30 мг однократно) для взрослых и подростков с массой тела ≥35 кг [1, 7, 17]. Именно такая дозировка содержится в составе комплексного препарата Омез ДСР (в сочетании с 20 мг омепразола), который оказывает хороший эффект у большинства больных ФД. Поскольку Омез ДСР представляет собой препарат пролонгированного действия, он применяется 1 раз в сутки, обычно утром, за 30 мин до завтрака. Длительность курсового лечения Омезом ДСР зависит от клинического ответа на препарат и обычно составляет 4 нед (при необходимости – до 8 нед).
Новым препаратом, обладающим прокинетическими свойствами и расслабляющим фундальный отдел желудка, является акотиамид. Он эффективен при ПДС, но не ЭБС (число больных, нуждающихся в лечении, равняется 6). Другие потенциальные фундальные релаксанты включают в себя буспирон (5-НТ1А агонист) и суматриптан (5-НТ1B/D агонист), а также такие фитопрепараты, как STW-5 и риккуншито [10, 13].
Психотропные препараты, в первую очередь антидепрессанты, часто применяются в качестве второй линии лечения ФД. Проведенные исследования продемонстрировали значительное улучшение симптоматики при приеме низких доз трициклических антидепрессантов по сравнению с плацебо у больных с ЭБС. Эффект при ФД показал также левосульпирид, обладающий седативными и прокинетическими свойствами [2].
Учитывая то, что у части больных ФД патогенетическое значение может играть дуоденальное воспаление аллергической природы, в качестве перспективных препаратов рассматриваются антиастматический препарат монтелукаст, а также Н1-гистаминоблокаторы [10].
Психотерапия при ФД рекомендуется как резервная «терапия спасения» и может успешно применяться у больных ФД, не дающих клинический ответ на фармакотерапию.
Список литературы находится в редакции.
Медична газета «Здоров’я України» № 17 (390), вересень 2016 p.