4 жовтня, 2016
Современные принципы ведения больных с гастроэзофагеальной рефлюксной болезнью: обзор актуальных рекомендаций
Гастроэзофагеальная рефлюксная болезнь (ГЭРБ) – наиболее распространенное хроническое гастроэнтерологическое заболевание, затрагивающее не менее 20-25% всей взрослой популяции и имеющее ярко выраженную тенденцию к дальнейшему увеличению роста заболеваемости (за последние 10 лет – в 3 раза, ежегодный прирост – около 5%) не только в развитых странах Европы и США, но и в странах Юго-Восточной Азии, в частности в Японии, Сингапуре и Китае. ГЭРБ характеризуется высоким уровнем рецидивирования, существенным негативным влиянием на качество жизни пациентов и во многих случаях требует применения кислотоснижающих препаратов в течение всей жизни. Пациенты с ГЭРБ являются основными потребителями ингибиторов протонной помпы (ИПП), которые в настоящее время применяют приблизительно 5% населения развитых стран.
К факторам, способствующим изменению эпидемиологии ГЭРБ, относят увеличение продолжительности жизни, пандемию ожирения, рост распространенности коморбидной патологии, обусловливающей ГЭРБ (сахарный диабет, неврологические расстройства и др.), бесконтрольный прием медикаментов, уменьшение распространенности инфекции Helicobacter (Н.) pylori. Одним из важнейших факторов, способствующих развитию ГЭРБ, в настоящее время признано ожирение. Так, при избыточной массе тела относительный риск развития ГЭРБ (особенно тяжелых рефлюкс-эзофагитов) повышается в 1,7 раза, а при ожирении – в 2 раза.
Проблема своевременной диагностики и лечения ГЭРБ по-прежнему остается актуальной, в связи с чем в последние годы регулярно разрабатываются и обновляются клинические рекомендации по этому вопросу.
Действующими руководствами по диагностике и ведению больных ГЭРБ служат клинические рекомендации Американской гастроэнтерологической ассоциации и Американского колледжа гастроэнтерологии, принятые, соответственно, в 2008 и 2012 г. Следует подчеркнуть, что оба руководства стали первыми клиническими рекомендациями по ведению больных ГЭРБ, основанными на данных доказательной медицины. При разработке их основных положений использовалась система GRADE, выделяющая различные уровни доказательств и силу рекомендаций. Высокий уровень доказательств означает, что дальнейшие исследования для изменения мнения относительно эффективности вмешательства не требуются. Средний (умеренный) уровень предполагает необходимость дополнительных исследований относительно установления эффективности, а низкий уровень означает, что ожидаются новые исследования, которые могут изменить мнение об эффективности данного вмешательства. Сильные (строгие) рекомендации подразумевают, что желаемые эффекты вмешательства явно перевешивают нежелательные, а условные рекомендации говорят о том, что однозначного мнения экспертов не существует. Ниже приводятся основные положения этих документов.
Диагностика ГЭРБ
Одним из основных ключевых положений в отношении диагностики ГЭРБ остается рекомендация о том, что предварительный диагноз ГЭРБ должен ставиться на основании типичных симптомов – изжоги и кислой регургитации. Во всех таких случаях рекомендуется проводить начальное эмпирическое лечение ИПП: так называемый ИПП-тест (строгие рекомендации, умеренный уровень доказательств). При наличии типичных симптомов ГЭРБ проводить верхнюю эндоскопию (эзофагогастродуоденоскопию – ЭГДС) нет необходимости. Она показана только при наличии тревожных симптомов, у пожилых пациентов, для скрининга пациентов с высоким риском осложнений, при загрудинной боли, предположительно связанной с рефлюксом (после исключения коронарной патологии), и у пациентов, не отвечающих на прием ИПП. При отсутствии пищевода Барретта и новых симптомов повторные эндоскопии проводить не следует. Рутинные биопсии из дистального пищевода для подтверждения диагноза ГЭРБ также не используются (строгие рекомендации, умеренный уровень доказательств). Для рутинной диагностики ГЭРБ категорически не рекомендуется проводить обычное рентгенологическое исследование с барием (строгие рекомендации, высокий уровень доказательств). Манометрия пищевода самостоятельной диагностической роли при ГЭРБ также не имеет и показана только при планировании хирургической фундопликации как составная часть предоперационного обследования (строгие рекомендации, низкий уровень доказательств).
Пищеводный рН-мониторинг (или лучше – импеданс-рН-мониторинг) проводится в ситуациях, когда диагноз ГЭРБ остается под вопросом, как часть дообследования пациентов, рефрактерных к ИПП, а также перед началом эндоскопического или хирургического лечения у пациентов с неэрозивной ГЭРБ (строгие рекомендации, низкий уровень доказательств). Кроме того, он рассматривается в основном как тест, позволяющий оценивать ассоциацию симптоматики с наличием рефлюкса (строгие рекомендации, низкий уровень доказательств). При эндоскопически подтвержденном наличии короткого или длинного сегмента пищевода Барретта амбулаторный рН-мониторинг рефлюкса для подтверждения ГЭРБ не требуется (строгие рекомендации, умеренный уровень доказательств). Скрининг на инфекцию H. рylori среди пациентов с ГЭРБ не рекомендуется, а эрадикация инфекции H. рylori как рутинный метод антирефлюксной терапии не показана (строгие рекомендации, низкий уровень доказательств).
Ведение пациентов с ГЭРБ
Модификация образа жизни и питания. Учитывая, что ожирение в настоящее время рассматривается как один из важнейших факторов риска, всем пациентам с ГЭРБ, имеющим избыточную массу тела / ожирение, или тем, кто недавно набрал лишние килограммы, рекомендуется похудение (условные рекомендации, умеренный уровень доказательств). Пациентам с ночными симптомами ГЭРБ следует приподнимать головной конец кровати и не есть за 2-3 часа до сна (условные рекомендации, низкий уровень доказательств). Рутинное прекращение курения и приема алкоголя, так же, как и исключение пищи, традиционно рассматриваемой в качестве триггеров рефлюкса (шоколад, кофеин, острые блюда, цитрусовые и др.), для улучшения симптоматики ГЭРБ не рекомендуется, поскольку убедительных доказательств эффективности в отношении улучшения качества жизни пока не получено (условные рекомендации, низкий уровень доказательств). Такой подход может быть показан только избранным пациентам, отмечающим явную связь изжоги с определенными продуктами. Тем не менее среди врачей стремление к модификации диеты у пациентов с ГЭРБ по-прежнему остается распространенным. Так, в одном из исследований 56% пациентов с ГЭРБ получили от врачей рекомендации по ограничению приема определенных продуктов, а 37% – по ограничению приема кофеина.
Начальное медикаментозное лечение. В качестве лечебного метода выбора для облегчения симптомов и заживления эрозивного эзофагита обычно рекомендуется 4-8-недельный курс применения ИПП. При этом отмечается, что существенных различий в конечной эффективности тех или иных ИПП при ГЭРБ нет (строгие рекомендации, высокий уровень доказательств). Тем не менее при необходимости длительного приема ИПП, часто возникающей при ГЭРБ, а также при приеме многих других препаратов для лечения сопутствующей патологии желательно принимать более безопасный ИПП, не оказывающий перекрестных межлекарственных взаимодействий. К таким препаратам относится пантопразол (Контролок), в отношении которого отмечены только единичные примеры лекарственного взаимодействия. В отличие от омепразола и других ИПП, пантопразол (Контролок) не вызывает взаимодействия при одновременном применении с фенитоином, варфарином, диазепамом, R-варфарином, бета-блокаторами, теофиллином, диклофенаком, фенацетином, ацетаминофеном, кларитромицином и другими препаратами, метаболизирующимися с участием CYP2C19 и CYP3A4. Поэтому при необходимости длительного сочетанного применения ИПП и этих медикаментов он рассматривается как препарат выбора. В случаях когда дополнительно рекомендуется эрадикация инфекции H. pylori, наилучшим базисным препаратом также является пантопразол (Контролок), который не вступает в конкурентные взаимоотношения с кларитромицином – основным антибиотиком в составе антихеликобактерной терапии, также метаболизирующимся цитохромной системой Р450. Такое сочетание снижает вероятность возникновения побочных эффектов и повышает эффективность лечения. Пантопразол также не показывает клинически значимых перекрестных реакций с нестероидными противовоспалительными препаратами (НПВП), в первую очередь с диклофенаком, который является одним из наиболее часто применяемых препаратов этой группы. Поэтому при высоком риске возникновения НПВП-гастропатий, когда требуется дополнительное превентивное назначение ИПП или при необходимости продолжения приема диклофенака даже в случае развития НПВП-гастропатии, дополнительным лечебным препаратом выбора также является пантопразол (Контролок).
Кроме того, пантопразол (Контролок) наиболее безопасный и наилучший ИПП по переносимости. При его приеме незначительные побочные эффекты фиксируются только у 1,1% больных. Программы контроля за результатами клинического применения показали, что среди получающих пантопразол 100 000 пациентов с кислотозависимыми расстройствами какие-либо неблагоприятные эффекты наблюдались только у 0,77%. Очень важно и то, что фармакокинетика пантопразола существенно не отличается у молодых и пожилых людей – основного контингента пациентов, которым назначаются многочисленные препараты по поводу сопутствующей патологии. Кроме того, даже легкая и среднетяжелая дисфункция печени не влияет на фармакокинетику пантопразола, что обеспечивает стабильность его фармакологического эффекта.
В отличие от других ИПП, которые обратимо связывают в протонной помпе (ПП) цистеин 813 или 321, пантопразол (Контролок) связывается сразу с двумя цистеинами ПП – 813 и 822. Именно цистеин 822 обеспечивает устойчивость связи и длительность ингибиции ПП и кислотной продукции. Поэтому если после прекращения приема других ИПП кислотность возвращается за счет прерывания химической связи с ПП, то в случае с пантопразолом – за счет синтеза новых ПП, который требует времени. Поэтому и период восстановления ингибированной секреции кислоты составляет для лансопразола около 15 ч, для омепразола и рабепразола – около 30 ч, в то время как для пантопразола – примерно 46 ч. То есть пантопразол (Контролок) обеспечивает наиболее продолжительный кислотоснижающий эффект и является одним из самых эффективных и безопасных ИПП.
Продолжительность первичного лечения в основном зависит от выраженности рефлюкс-эзофагита: в легких случаях оно может ограничиваться 4-недельным приемом ИПП, а при тяжелых рефлюкс-эзофагитах и их осложнениях – пролонгироваться до 12 недель.
Традиционные ИПП с замедленным высвобождением для максимального контроля за интрагастральным рН должны приниматься строго за 30-60 мин до еды (строгие рекомендации, умеренный уровень доказательств), в то время как новые ИПП с немедленным высвобождением можно более гибко дозировать в зависимости от времени приема пищи (условные рекомендации, умеренный уровень доказательств). Лечение ИПП должно начинаться с однократного приема препарата утром до завтрака (строгие рекомендации, умеренный уровень доказательств). Согласно последним данным, ИПП безопасны для беременных и могут применяться при наличии клинических показаний (условные рекомендации, умеренный уровень доказательств).
Пациентам с частичным ответом на однократный прием стандартных доз ИПП можно менять время их приема или назначать двойные дозы, особенно пациентам с ночными симптомами и расстройством сна (строгие рекомендации, низкий уровень доказательств). Кроме того, у пациентов с частичным ответом на ИПП дополнительный лечебный эффект может оказать назначение двукратного приема ИПП в день или переход на другой ИПП (условные рекомендации, низкий уровень доказательств). ИПП-неответчики должны быть дообследованы как пациенты с рефрактерной ГЭРБ (условные рекомендации, низкий уровень доказательств).
Тактика ведения при недостаточной эффективности ИПП. Хотя ИПП являются высокоэффективными агентами для лечения ГЭРБ, некоторые пациенты не дают адекватного терапевтического ответа на применение их стандартных доз. Так, примерно у 2/3 пациентов с рефлюксными симптомами после первой дозы ИПП адекватный контроль симптоматики не достигается, а приблизительно половину пациентов симптомы продолжают беспокоить после трех дней терапии стандартными дозами ИПП. Подсчитано, что в среднем 1 из 4 пациентов не удовлетворен результатами терапии ГЭРБ при помощи ИПП. Несмотря на то что большинство ИПП назначается 1 р/сут, значительная часть пациентов принимают эти препараты 2 р/день. Многие пациенты, получающие терапию ИПП, часто продолжают испытывать изжогу и самостоятельно дополняют прописанные им ИПП другими препаратами, чаще всего – антацидами. Несмотря на клиническую эффективность, доступные в наше время ИПП при однократном приеме не могут адекватно контролировать внутрижелудочную кислотность на протяжении ночи у значительной части как здоровых людей, так и пациентов с ГЭРБ, у которых степень облегчения симптомов остается субоптимальной. Поэтому важной проблемой у больных ГЭРБ продолжает оставаться ночной кислотный прорыв, который кроме того, что обусловливает развитие симптоматики, также вносит вклад в развитие эрозивного эзофагита.
Во многом недостаточный эффект классических ИПП связан с особенностями их действия и особенностями физиологии ПП париетальной клетки. Как известно, ИПП ингибируют секрецию соляной кислоты путем ковалентного связывания только с активными ПП. Для их активации необходим прием пищи, поэтому оптимальное ингибирование кислотной продукции требует приема ИПП натощак, примерно за 30 мин до еды. Однако при этом после приема стандартной дозы традиционных ИПП блокируется только 70-80% ПП, в то время как около 25% от их общего количества остаются неактивными. Поэтому 20-30% ПП после приема стандартных доз традиционных ИПП не блокируются, к тому же около 25% ПП ежедневно регенерируют, обеспечивая новую кислотную продукцию. Это может приводить к возобновлению секреции соляной кислоты в желудке неингибированными, восстановленными или новыми ПП, что, в свою очередь, является одной из основных причин отсутствия 24-часового контроля кислотности при однократном приеме стандартных доз традиционных ИПП.
В связи с этим в последние годы для повышения эффективности разработаны новые формы существующих ИПП и новые соединения. В частности, важной стратегией повышения эффективности ИПП стало создание новых форм с модифицированным (продленным) высвобождением ИПП, которые полезны для потенциального подавления секреции кислоты в ночное время ввиду их контролируемого и длительного высвобождения. Эта стратегия в настоящее время рекомендуется многими гастроэнтерологическими ассоциациями, которые в сотрудничестве с фармацевтическими компаниями разрабатывают новые формы ИПП с замедленным и контролируемым высвобождением.
Данная стратегия впервые была успешно реализована компанией Takeda при разработке правовращающего изомера лансопразола с модифицированным высвобождением – декслансопразола, который был одобрен Управлением по контролю качества пищевых продуктов и лекарственных препаратов США (FDA) еще 30 января 2009 г. и в настоящее время зарегистрирован во многих странах мира (в том числе и в Украине) под торговой маркой Дексилант. Сам по себе правовращающий изомер лансопразола имеет более медленный клиренс и, соответственно, более высокие концентрации в плазме крови, чем левовращающий изомер. Кроме того, на сегодняшний день Дексилант – первый и единственный ИПП с механизмом двухфазного высвобождения. Его особенностью является то, что каждая капсула препарата Дексилант содержит 2 типа гранул в кишечнорастворимых оболочках, растворяющихся при разном уровне pH. Такой механизм разработан специально для продления действия препарата (B.W. Behm, D.A. Peura, 2011). Гранулы 1-го типа составляют 25% дозы и растворяются в проксимальных отделах тонкой кишки при рН 5,5 в течение 1-2 ч после приема препарата, в то время как гранулы 2-го типа составляют 75% дозы, растворяются в дистальных отделах тонкой кишки при рН 6,75 и обеспечивают вторую фазу высвобождения через 4-5 ч после приема препарата (D.A. Peura et al., 2013).
Исследования по фармакокинетике препарата Дексилант продемонстрировали, что его временной профиль характеризуется двумя различными пиками плазменной концентрации, возникающими соответственно через 1-2 и 4-5 ч после приема, а при 24-часовом интрагастральном рН-мониторировании было зафиксировано более длительное подавление желудочной секреции, чем при применении других ИПП (N. Vakil et al., 2009).
В частности, сравнительные исследования на здоровых добровольцах показали, что длительность поддержаниятерапевтической концентрации декслансопразола на протяжении 24 ч превышала таковую для эзомепразола и напрямую коррелировала с процентным соотношением времени уровня интрагастрального pH >4, который в течение суток был выше, чем при применении эзомепразола (M. Kukulka et al., 2011). Средние значения pH желудочного содержимого у 48 здоровых добровольцев после ежедневного применения декслансопразола в разное время дня не показали каких-либо различий в зависимости от времени приема препарата (утром, днем или вечером) и приема пищи (натощак, за 5-30 мин до завтрака, после завтрака и т.д.) (R.D. Lee et al., 2009, 2010).
Анализ результатов контролируемых исследований показал, что декслансопразол в исследуемых дозировках имел преимущество над стандартными формами лансопразола (30 мг) при заживлении эрозивных эзофагитов любой степени тяжести (P. Sharma, 2009). Дополнительное исследование также продемонстрировало большую эффективность декслансопразола по сравнению с плацебо в поддержании заживления эзофагитов и разрешении изжоги (пациенты не испытывали изжоги на протяжении более чем 96% всего времени) в течение 6-месячного периода поддерживающей терапии (D.C. Metz, 2009). Дексилант в дозе 30 мг был высокоэффективным в лечении ночных изжог и расстройств сна, связанных с ГЭРБ (R. Fass, 2011). Таким образом, Дексилант представляет собой препарат, который содержит изомер ИПП декслансопразол в уникальной форме выпуска, обеспечивающей двухфазное высвобождение, и предназначен для длительного подавления выработки соляной кислоты в желудке. Благодаря системе двухфазного высвобождения этот препарат обеспечивает более длительное подавление секреции кислоты, чем лансопразол и эзомепразол. Дексилант выпускается в капсулах по 30 и 60 мг для перорального применения 1 р/сут вне зависимости от приема пищи. Основными показаниями для применения препарата Дексилант являются симптоматическая терапия неэрозивной ГЭРБ (30 мг 1 р/сут 4 недели), начальная терапия рефлюкс-эзофагитов любой степени тяжести (60 мг 1 р/сут 8 недель) и поддерживающая терапия рефлюкс-эзофагитов (30 мг 1 р/сут до 6 мес). Профиль безопасности и переносимости препарата Дексилант сопоставим с лансопразолом.
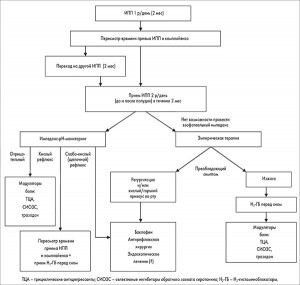
Тактика ведения больных с рефрактерной ГЭРБ. Пациентов, у которых ИПП в двойных дозах при соблюдении комплайенса не оказывают достаточного эффекта, следует рассматривать как больных, имеющих рефрактерную ГЭРБ. Первым шагом при ведении таких больных должна быть оптимизация ИПП-терапии (строгие рекомендации, низкий уровень доказательств), в частности назначение препаратов, способных контролировать интрагастральный рН в течение 24 ч (Дексилант). Всем больным с рефрактерной ГЭРБ обязательно проводится ЭГДС для исключения других причин изжоги и диспепсических симптомов (условные рекомендации, низкий уровень доказательств). Пациенты с рефрактерной ГЭРБ и негативными данными ЭГДС (при типичной симптоматике) либо дообследованные другими специалистами (при экстраэзофагеальных симптомах) должны пройти амбулаторный пищеводный рН-мониторинг (строгие рекомендации, низкий уровень доказательств). Рефлюкс-мониторинг вне приема ИПП может проводиться любым методом (рН- или импеданс-рН-мониторинг) (условные рекомендации, умеренный уровень доказательств). Тестирование на фоне приема ИПП для исключения некислотных рефлюксов проводится только путем импеданс-рН-мониторинга (строгие рекомендации, умеренный уровень доказательств). Алгоритм ведения больных с рефрактерной ГЭРБ представлен на рисунке.
Пациенты с негативными данными импеданс-рН-мониторинга редко имеют ГЭРБ, и ИПП-терапия у них должна быть прекращена (строгие рекомендации, низкий уровень доказательств). У рефрактерных пациентов с объективно подтвержденным рефлюксом в качестве причины симптомов должны рассматриваться другие дополнительные методы лечения, такие как хирургия или применение ингибиторов спонтанных релаксаций нижнего пищеводного сфинктера (условные рекомендации, низкий уровень доказательств).
Экстраэзофагеальные проявления ГЭРБ: астма, хронический кашель и ларингиты. Согласно существующим представлениям, ГЭРБ должна рассматриваться как потенциальный сопутствующий фактор риска у пациентов с астмой, хроническим кашлем и ларингитом. Пациенты с экстраэзофагеальными симптомами ГЭРБ, не отвечающие на ИПП-терапию, должны быть тщательно дообследованы соответствующими специалистами, такими как отоларинголог, пульмонолог, аллерголог (строгие рекомендации, низкий уровень доказательств). Все такие пациенты должны пройти тщательное обследование для выявления других (не связанных с ГЭРБ) причин (строгие рекомендации, средний уровень доказательств). В качестве метода постановки диагноза ГЭРБ-ассоциированных астмы, хронического кашля и ларингита ЭГДС не рекомендуется (строгие рекомендации, низкий уровень доказательств), а диагноз рефлюкс-ларингита не может быть поставлен исключительно на основании данных ларингоскопии (строгие рекомендации, средний уровень доказательств). У всех пациентов с экстраэзофагеальными симптомами, не имеющих типичных симптомов ГЭРБ, до назначения ИПП необходимо проводить пищеводный рН-мониторинг (условные рекомендации, низкий уровень доказательств).
Лечение ИПП рекомендовано при наличии экстраэзофагеальных симптомов у пациентов, имеющих также типичные симптомы ГЭРБ (строгие рекомендации, низкий уровень доказательств). Неответчики на прием ИПП должны пройти дальнейшее дообследование – такое же, как при рефрактерной ГЭРБ (условные рекомендации, низкий уровень доказательств). Пациентам с экстраэзофагеальными проявлениями ГЭРБ, не отвечающим на антисекреторную терапию ИПП, хирургическое лечение не назначают (строгие рекомендации, средний уровень доказательств).
Осложнения ГЭРБ. Пациентам с ГЭРБ и высоким риском, основанным на эпидемиологических данных, необходимо назначить эндоскопический скрининг на пищевод Барретта (условные рекомендации, умеренный уровень доказательств). У пациентов с пищеводом Барретта симптоматику лечат таким же образом, как и у пациентов без такового (строгие рекомендации, умеренный уровень доказательств). Пациенты с пищеводом Барретта должны проходить периодическое эндоскопическое обследование в соответствии с клиническими рекомендациями для таких пациентов (строгие рекомендации, умеренный уровень доказательств).
После дилатации пептических стриктур пищевода проводят продолжительную ИПП-терапию для уменьшения симптомов дисфагии и предотвращения повторных дилатаций (строгие рекомендации, умеренный уровень доказательств). При рефрактерных комбинированных стриктурах вследствие ГЭРБ могут применяться инъекции кортикостероидов непосредственно в область стриктур (условные рекомендации, низкий уровень доказательств).
Поддерживающее медикаментозное лечение. Поддерживающее лечение ИПП показано больным с ГЭРБ, у которых после отмены ИПП вновь появляются симптомы, а также пациентам с осложнениями, включая эрозивные эзофагиты и пищевод Барретта (строгие рекомендации, умеренный уровень доказательств). При необходимости длительного приема ИПП назначаются в наименьших эффективных дозах, включая терапию «по требованию» или интермиттирующую терапию (условные рекомендации, низкий уровень доказательств).
Н2-гистаминоблокаторы могут применяться как вариант поддерживающей терапии у пациентов с неэрозивной ГЭРБ, если они облегчают изжогу (условные рекомендации, умеренный уровень доказательств).
Н2-гистаминоблокаторы также можно назначать на ночь в дополнение к дневному приему двойных доз ИППотдельным пациентам с подтвержденным ночным кислотным прорывом, хотя это может сопровождаться развитием тахифилаксии после нескольких недель приема (условные рекомендации, низкий уровень доказательств). Лечение ГЭРБ некислотоснижающими препаратами, включая прокинетики и/или баклофен, у больных с ГЭРБ без дополнительного диагностического обследования проводиться не должно (условные рекомендации, умеренный уровень доказательств). Сукральфат у небеременных пациенток с ГЭРБ терапевтического значения не имеет (условные рекомендации, умеренный уровень доказательств).
Хирургическое лечение ГЭРБ. Хирургическое вмешательство рассматривается как одна из терапевтических стратегий для длительного лечения ГЭРБ, однако оно не рекомендовано пациентам, не отвечающим на ИПП (строгие рекомендации, высокий уровень доказательств). Хирургическое лечение у тщательно отобранных пациентов так же эффективно, как и медикаментозное, если оно проводится опытным хирургом (строгие рекомендации, высокий уровень доказательств). Всем пациентам с неэрозивной ГЭРБ, у которых планируется хирургическое лечение, перед операцией необходимо провести амбулаторный пищеводный рН-мониторинг, а также манометрию пищевода для исключения ахалазии или склеродермии (строгие рекомендации, умеренный уровень доказательств). Больным с ожирением и ГЭРБ, нуждающимся в операции, также рекомендуется бариатрическая операция (обычно – желудочное шунтирование) (условные рекомендации, средний уровень доказательств). Кроме традиционной фундопликации FDA утвердило два новых лапароскопических метода лечения ГЭРБ – установку магнитного кольца (система LINX) в области нижнего пищеводного сфинктера (НПС) при его несостоятельности и электрическую стимуляцию НПС с помощью специальной системы EndoStim. Проспективное мультицентровое исследование показало, что лапароскопическая установка магнитного устройства (LINX Reflux Management System, Torax Medical) в область НПС приводила к исчезновению эзофагеальных и экстраэзофагеальных симптомов ГЭРБ у 88% больных в течение первого года, 88 и 90% больных в течение второго и третьего года, а также к выраженному улучшению качества жизни и прекращению приема ИПП у 84% больных. Такой побочный эффект, как дисфагия, наблюдался лишь у 13% больных, а эндоскопическая дилатация потребовалась только 3,5% пациентов. Завершившиеся в США в декабре 2012 г. исследования системы электрической стимуляции НПС EndoStim показали, что ее установка позволила добиться значительного улучшения со стороны рефлюксной симптоматики у 77% больных, вплоть до отмены ИПП, которая сохранялась в течение 1 года и более. Применение эндоскопического лечения или трансоральной инцизионной фундопликации как альтернативы медикаментозному или традиционному хирургическому лечению в настоящее время не может быть рекомендовано (строгие рекомендации, умеренный уровень доказательств).
Таким образом, современная диагностика ГЭРБ в подавляющем большинстве случаев основывается на оценке клинических симптомов и ИПП-тесте, в то время как верхняя эндоскопия проводится только по соответствующим показаниям. Краеугольным камнем лечения ГЭРБ по-прежнему остается кислотоснижающая терапия по принципу «чем сильнее, тем лучше», а именно применение мощных антисекреторных препаратов, таких как ИПП. С целью оптимизации лечения ГЭРБ следует более широко применять ИПП, способные эффективно контролировать внутрижелудочный рН в течение 24 ч, такие как стереоизомеры ИПП с модифицированным высвобождением (Дексилант). Хирургическое, эндоскопическое и другое альтернативное лечение ГЭРБ следует рассматривать в качестве резервных методов терапии.
Литература
1. Allen L. et al. Aliment Pharmacol Ther 2010; 32: 787-94.
2. Alexandropoulou K., van Vlymen J., Reid F. et al. Temporal trends of Barrett’s oesophagus and gastro-oesophageal reflux and related oesophageal cancer over a 10-year period in England and Wales and associated proton pump inhibitor and H2RA prescriptions: a GPRD study. Eur J Gastroenterol Hepatol 2013 Jan; 25(1): 15-21.
3. Basu K.K. Concise guide to management of reflux disease in primary care. Prescriber 2012; 23(15-16): 19-28.
4. Behm B.W., Peura D.A. Expert Rev Gastroenterol Hepatol 2011; 5: 439-45.
5. Boeckxstaens G., El-Serag H., Smout A. et al. Symptomatic reflux disease: the present, the past and the future. Gut 2014; 63(7): 1185-93.
6. Bredenoord A.J., Pandolfino J.E., Smout A.J. Gastro-oesophageal reflux disease. Lancet 2013; 381: 1933-1942.
7. Dent J., El-Serag H.B., Wallander M.A. et al. Epidemiology of gastro-oesophageal reflux disease: a systematic review. Gut 2005; 54: 710-17.
8. DEXILANT (dexlansoprazole) Prescribing Information DEX006 R20, revised August 2013.
9. El-Serag H., Beecher A., Jones R. Systematic review: persistent reflux symptoms on proton pump inhibitor therapy in primary care and community studies. Aliment Pharmacol Ther 2010; 32(6): 720-737.
10. El-Serag H.B., Sweet S., Winchester C.C. et al. Update on the epidemiology of gastro-oesophageal reflux disease: a systematic review. Gut 2014; 63: 871-80.
11. Fass R. Erosive esophagitis and nonerosive reflux disease (NERD): comparison of epidemiologic, physiologic, and therapeutic characteristics. J Clin Gastroenterol 2007 Feb; 41(2): 131-7.
12. Kahrilas P.J., Shaheen N.J., Vaezi M.F. et al. American Gastroenterological Association medical position statement on the management of gastroesophageal reflux disease. Gastroenterology 2008; 135: 1383-1391.
13. Kahrilas P.J., Boeckxstaens G. Failure of reflux inhibitors in clinical trials: bad drugs or wrong patients? Gut 2012; 61(10): 1501-1509.
14. Katz P.O., Gerson L.B., Vela M.F. Guidelines for the Diagnosis and Management of Gastroesophageal Reflux Disease. The American Journal of Gastroenterology, Vol. 108, March 2013, р. 308-328.
15. Kukulka M. et al. Clin Exp Gastroenterol 2011; 4: 213-20.
16. Lee R.D. et al. Aliment Pharmacol Ther 2010; 31: 1001-11.
17. Peura D.A. et al. Aliment Pharmacol Ther 2013; 37: 810-8.
18. Tytgat G.N., Mccoll K., Tack J. et al. New algorithm for the treatment of gastro-оesophageal reflux disease // Aliment Pharmacol Ther 2008; Vol. 27: р. 249-256.
19. Vakil N. et al. Curr Med Res Opin 2009; 25: 627-38.
20. Wu J. et al. Am J Gastroenterol 2007; 102 (Suppl 2): S124.
UA/ (PPIF)/0916/0032
При содействии ООО «Такеда Украина»