23 липня, 2019
Менеджмент пациентов с остеоартритом коленных суставов: анализ и обсуждение основных положений рекомендаций ESCEO 2019 года
 Остеоартрит (ОА) – наиболее распространенная форма патологии суставов, которая сопровождается разрушением суставного хряща, воспалением синовиальной оболочки и ремоделированием субхондральной кости [1]. Это заболевание характеризуется болью и тугоподвижностью в суставах, приводящими к нарушению функции и ухудшению качества жизни больных. Заболеваемость ОА растет из-за старения населения и увеличения распространенности ожирения [2]. ОА коленного сустава – наиболее частая локализация ОА, он поражает более 250 млн человек во всем мире [2].
Остеоартрит (ОА) – наиболее распространенная форма патологии суставов, которая сопровождается разрушением суставного хряща, воспалением синовиальной оболочки и ремоделированием субхондральной кости [1]. Это заболевание характеризуется болью и тугоподвижностью в суставах, приводящими к нарушению функции и ухудшению качества жизни больных. Заболеваемость ОА растет из-за старения населения и увеличения распространенности ожирения [2]. ОА коленного сустава – наиболее частая локализация ОА, он поражает более 250 млн человек во всем мире [2].
ОА является основной причиной боли у пожилых людей. Так, согласно исследованию, проведенному E. Nuesch et al. (2011), хроническая боль в бедре, суставах нижних конечностей приводит к инвалидности и повышенному риску смертности от всех причин [3]. Коленный сустав считается самым крупным синовиальным суставом, который состоит из костных структур (дистальная часть бедра, проксимальная часть большеберцовой кости и коленная чашечка), хряща (мениск и гиалиновый хрящ), связок и синовиальной оболочки. Последняя отвечает за выработку синовиальной жидкости, обеспечивающей любрикацию и питательные вещества для аваскулярного хряща [4].
Раннее считалось, что ОА является исключительно дегенеративным заболеванием хряща, однако последние исследования доказали, что ОА – многофакторная болезнь, в патогенезе которой участвует множество причинных факторов, таких как травма, механическое воздействие, воспаление, биохимические реакции и метаболические нарушения [1]. Также установлено, что в патологический процесс вовлекается не только хрящевая ткань. Эти выводы были сделаны исходя из того, что, учитывая отсутствие кровоснабжения и иннервации, хрящ сам по себе не способен инициировать воспалительные реакции или боль, по крайней мере, на ранних стадиях заболевания.
Следовательно, источником боли являются главным образом изменения в нехрящевых составляющих сустава, таких как суставная капсула, синовиальная оболочка, субхондральная кость, связки и периартикулярные мышцы [4]. По мере развития болезни эти структуры с различной скоростью вовлекаются в патологический процесс, обусловливая патологическое ремоделирование кости, образование остеофитов, ослабление периартикулярных мышц, слабость связок и синовиальный выпот [6].
Роль воспаления не совсем ясна. В настоящее время ведутся споры по поводу того, что первично – воспалительная реакция, которая вызывает ОА, или ОА, инициирующий развитие воспаления [6]. В отличие от воспалительного артрита, воспаление при ОА хроническое и не столь выраженное, оно инициируется, в основном, врожденными иммунными механизмами. Синовит (инфильтрация воспалительными клетками синовиальной оболочки) – характерный признак ОА, который часто присутствует на ранних стадиях заболевания, но более распространен на поздних и связан с тяжестью патологического процесса [4].
При ОА в синовиальной жидкости было обнаружено несколько медиаторов воспаления, включая белки плазмы (С-реактивный белок, предложенный в качестве маркера для развития и прогрессирования ОА), простагландины, лейкотриены, цитокины, факторы роста, оксид азота и компоненты комплемента [7]. Локально все эти компоненты могут индуцировать матриксные металлопротеиназы и другие гидролитические ферменты (включая циклооксигеназу 2 и простагландин E), приводя к разрушению хряща [8]. Разрушение внеклеточного матрикса способствует высвобождению молекул, ассоциированных с повреждением молекулярных структур, которые распознаются врожденными иммунными клетками (макрофагами и тучными клетками) и активируют их. Эта длительная и нерегулируемая степень воспаления может привести к разрушению тканей. В исследованиях на животных было обнаружено, что макрофаги участвуют в развитии остеофитов, которые являются патологическим признаком ОА [8].
Терапия ОА
ОА – это прогрессирующее заболевание различной степени тяжести, с разными вариантами/фенотипами в течение всего патологического процесса, которое требует длительного лечения. Целями терапии ОА являются уменьшение симптомов и замедление прогрессирования болезни, что в свою очередь может снизить влияние ОА на качество жизни пациента с последующим сокращением потребностей в ресурсах здравоохранения.
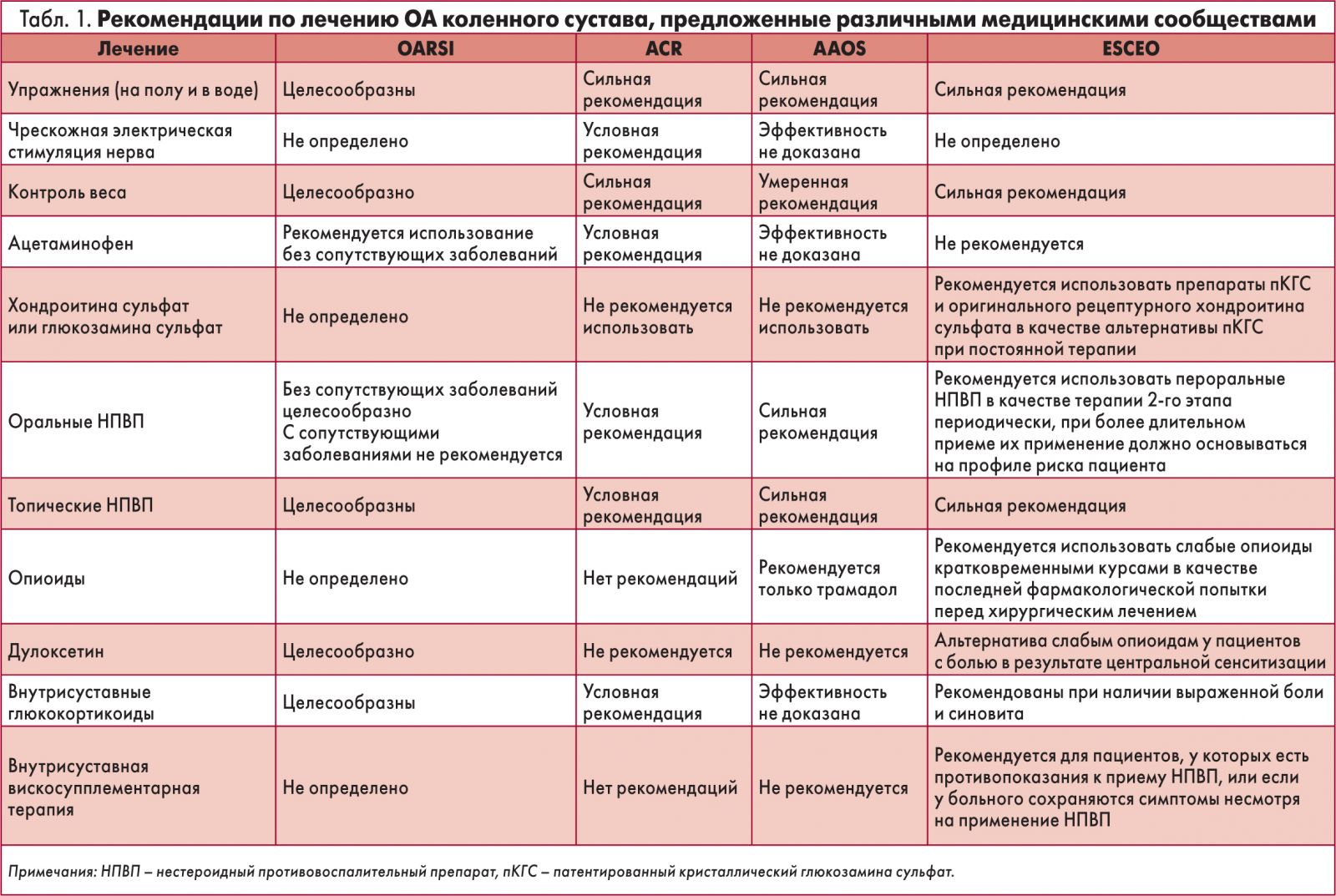
На сегодняшний день различные академические и профессиональные общества разработали руководящие принципы и рекомендации для стандартизации доступных вариантов лечения. Среди них – Международное общество по изучению остеоартрита (OARSI, 2014), Американский колледж ревматологии (ACR, 2012), Американская академия хирургов-ортопедов (AAOS, 2013) и Европейское общество по клиническим и экономическим аспектам остеопороза и остеоартрита (ESCEO, 2019) [9‑12]. В таблице 1 представлена сравнительная характеристика основных рекомендаций по лечению ОА.
Основная информация в данном обзоре посвящена новым рекомендациям ESCEO (2019) в отнош нии менеджмента ОА коленного сустава. Со времени обнародования предыдущих рекомендаций 2014 и 2016 гг. опубликовано немало новых данных, в частности, касающихся безопасности и эффективности многих лекарственных средств, обычно используемых для лечения ОА. Были выявлены несоответствия в представленных сведениях, а также необходимость разработки более точного руководства согласно современным клиническим испытаниям.
Таким образом, недавнее согласованное заявление ESCEO представляет конкретные, четкие, практически направленные и стандартизированные рекомендации по лечению ОА [12]. В этом обновлении рабочая группа ESCEO пересмотрела алгоритм терапии в свете последних доказательств эффективности и безопасности препаратов.
Были сформулированы новые клинические рекомендации, основанные на системе оценки, экспертизе, разработке и изучении степени их обоснованности (GRADE) и представлен обновленный пошаговый алгоритм для практического руководства клиницистам в оказании ориентированной на пациента помощи в практике лечения ОА коленного сустава. Комбинация методов терапии, включая нефармакологические и фармакологические вмешательства, остается ключевой для лечения ОА коленного сустава.
Нефармакологическое лечение
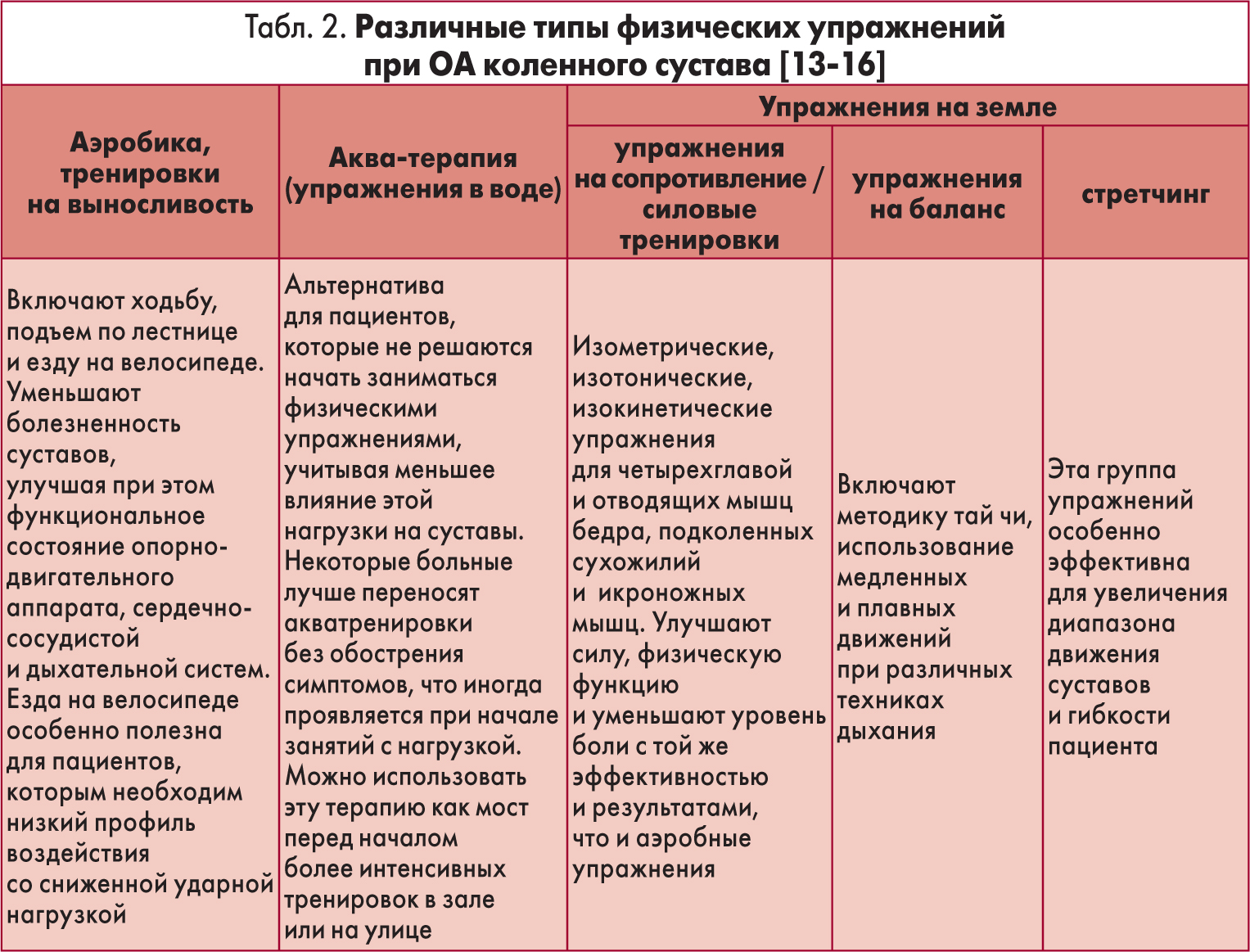
OARSI, ACR, AAOS и ESCEO единогласно утверждают, что первыми шагами в ведении лиц с ОА являются информированность и образование пациента в отношении заболевания, нормализация веса и регулярное выполнение программ физических упражнений (аэробные, силовые или с сопротивлением, на гибкость и растяжку, в воде), причем эти рекомендации должны быть имплементированы в лечебные программы в течение всего времени ведения больного ОА коленного сустава.
Рабочая группа ESCEO отмечает, что остаются некоторые дебаты относительно оптимальных модальностей подходов к программам физических упражнений, их реального воздействия на боль и функцию суставов и возможность выполнения (осуществимость) в долгосрочной перспективе [13].
Гиподинамия, иммобилизация и полная обездвиженность вредны для здоровья коленного сустава, отсутствие механической стимуляции вызывает более быструю дегенерацию хряща из-за его размягчения и истончения, снижения содержания гликозаминогликана, нарушения механики и гибкости суставов [13]. Легкая/умеренная физическая активность предоставляет множество преимуществ этой группе пациентов. Помимо механических и функциональных улучшений, она также способствуют снижению риска развития сахарного диабета, сердечно-сосудистых событий, падений, инвалидности, а также улучшению настроения и социальной самоэффективности [13].
Упражнения должны быть адаптированы к потребностям, толерантности и предпочтениям каждого пациента. Следует избегать ударной нагрузки, больших перерывов и обеспечить максимальную приверженность для увеличения успеха. Существуют различные виды упражнений, оказывающих благоприятное воздействие на лиц с ОА коленного сустава (табл. 2), комплексы которых пациент должен выполнять три раза в неделю, а для оценки ответа иметь не менее 12 тренировок [4]. Подчеркивается, что рекомендации по физической нагрузке при ОА коленного сустава также применимы к больным в возрасте 70‑80 лет, несмотря на то что доказательств их пользы недостаточно [14].
Нормализация массы тела играет важную роль в управлении симптомами при ОА. Было отмечено, что польза от упражнений увеличивается при снижении веса [14]. Ожирение имеет предрасполагающие механизмы в развитии ОА коленного сустава не только за счет механического, но и молекулярного воздействия. Сама жировая ткань является источником провоспалительных факторов. Цитокины, адипокины, интерлейкин (ИЛ) 6, фактор некроза опухоли α (ФНО-α) и С-реактивный белок повышены в плазме крови пациентов с ожирением и ассоциированы с изменением гомеостаза хряща [7].
Во время ходьбы коленный сустав выдерживает нагрузку в 3‑5 раз больше массы тела, следовательно, даже небольшие колебания в весе представляют собой высокую вариацию нагрузки на сустав [15]. S.P. Messier et al. (2005) отметили, что при уменьшении массы тела на 1 килограмм происходит улучшение в клиническом течении ОА коленного сустава на 10% (та же пропорция применяется в противоположном направлении при повышении веса) [16]. Исследователи обратили внимание, что развитие ОА усугубляется как за счет общей массы пациента, так и высокого процентного содержания жира в организме; уменьшение на 1% массы именно жировой ткани приводит к повышению функции сустава на 28% и улучшению на 9,4% по шкале индекса выраженности остеоартроза университетов Западного Онтарио и МакМастера (WOMAC) [17].
Что касается других нефармакологических вмешательств, пациенты могут получить пользу от тепловых модальностей. Однако данных, чтобы рекомендовать использование чрескожной электрической нервной стимуляции или терапевтического ультразвука, недостаточно [18].
В версии алгоритма ESCEO (2019) были кратко рассмотрены другие нефармакологические методы лечения ОА коленного сустава [12]. Более того, рабочая группа считает, что следует проводить оценку, чтобы уточнить, могут ли другие физические вмешательства быть полезными для дополнительного облегчения симптомов в сочетании с фармакологическими вмешательствами. Неполный список возможных нефармакологических вмешательств, подкрепленных различными степенями доказательности, приведен на рисунке.
На первом этапе лечения и после соблюдения основных принципов пациенты должны быть направлены к физиотерапевту или другому специалисту для оценки необходимости коррекции варусной либо вальгусной деформации [19]. Коррекция с помощью шарнирного коленного бандажа предпочтительнее клиновидных стелек [20].
Однако на практике нефармакологические методы лечения используются недостаточно. Поставщики медицинских услуг (ревматологи, хирурги-ортопеды, физиотерапевты и врачи общей практики) сообщают о трех основных барьерах, препятствующих немедикаментозной и нехирургической помощи пациентам с ОА коленного и тазобедренного суставов [21]:
- отсутствие опыта у медицинского работника (знания и навыки);
- отсутствие рекомендаций по лечению, основанных на фактических и доказательных данных (например, в отношении контроля веса, интенсивности и дозированности физических упражнений);
- отсутствие условий для оптимальной организации ухода за пациентами с ОА.
Для преодоления этих барьеров предлагается сфокусировать образование клиницистов и пациентов на инициировании и поддержке изменений образа жизни, продвижении вмешательств в соответствии с рекомендациями, основанными на фактических данных, и улучшении организации ухода. Для больного существуют барьеры, особенно в отношении физической активности и упражнений, поскольку они часто испытывают сильную боль, и предварительное облегчение является обязательным условием для выдерживания нагрузки. Барьеры можно преодолеть с помощью положительного опыта упражнений, изменения убеждений, знаний и отношения пациента к физической нагрузке, а также путем поддержки медицинских работников и социальных служб. Наконец, программа должна быть персонализирована и адаптирована к индивидуальным характеристикам больного и его окружения.
Фармакологическое лечение
Парацетамол (ацетаминофен) ранее широко применялся и по-прежнему рекомендован OARSI и ACR в качестве первого шага для анальгезии, несмотря на тот факт, что его влияние на симптомы ОА минимально [22]. ESCEO с сомнением рекомендовало использование данного препарата на регулярной основе в алгоритме 2014 г. [23].
Систематический обзор литературы обсервационных исследований показал, что парацетамол имеет минимальную эффективность при боли и не оказывает значительного влияния на скованность и функцию у пациентов с ОА коленного сустава [23]. Профиль безопасности препарата также вызывает значительные опасения в связи с увеличением числа желудочно-кишечных, сердечно-сосудистых, печеночных и почечных нежелательных явлений [24]. Кроме того, обнаружен более высокий уровень смертности среди больных, принимавших парацетамол по сравнению с теми, кто его не получал [25].
Основываясь на сомнительной эффективности и подтвержденных проблемах безопасности, рабочая группа ESCEO (2019) не рекомендует использовать парацетамол на постоянной основе для лечения ОА коленного сустава на первом этапе терапии [12]. Дана слабая рекомендация о том, что парацетамол (ацетаминофен) в дозах, не превышающих 3 г/сут, можно применять только в качестве краткосрочной спасательной анальгезии на фоне первого этапа постоянной терапии с симптоматическими препаратами медленного действия для ОА (SYSADOAs).
Симптом-модифицирующие препараты замедленного действия
В классе SYSADOA существует много различных агентов, включая глюкозамин, хондроитин, диацереин и неомыляемые соединения авокадо и сои (НСАС), влияние которых подтверждается различной степенью клинической эффективности. Глюкозамин, хондроитин и НСАС являются натуральными продуктами. Глюкозамина гидрохлорид (ГГ) представляет собой простую молекулу, полученную в процессе экстракции и используемую в качестве нутрицевтического или безрецептурного продукта. И наоборот, глюкозамина сульфат (ГС) – более сложная молекула, которая может быть получена только с помощью запатентованного полусинтетического пути и процесса стабилизации. Она обнаруживается только в рецептурном оригинальном лекарственном средстве – патентированном рецептурном кристаллическом ГС (пКГС) [26]. Хондроитин является высокомолекулярным длинноцепочечным полимером из повторяющихся звеньев, который воспроизводится в виде хондроитина‑4/-6 сульфата (ковалентная связь) различными процессами экстракции. Таким образом, доступны многочисленные составы этих агентов как в виде рецептурных продуктов, так и в качестве пищевых добавок. Однако, хотя все эти препараты могут претендовать на достижение терапевтического уровня глюкозамина или хондроитина в крови, клинические данные подтверждают эффективность только некоторых из них [5].
Показано, что только оригинальный пКГС обеспечивает стабильно высокую биодоступность глюкозамина и концентрацию в плазме крови у пациентов, что соответствует продемонстрированной клинической эффективности [27]. И наоборот, ГГ, а не продукты ГС (обычно состоящие из ГГ с добавлением сульфата натрия для получения вводящей в заблуждение «сульфатной» маркировки) неоднократно демонстрировали свою неэффективность при ОА [28].
Проведен ряд клинических исследований по оценке пКГС: его эффективность в уменьшении боли была выше, чем у парацетамола и аналогична нестероидным противовоспалительным препаратам (НПВП) [29]. пКГС также оказывает существенное влияние на функцию и имеет модифицирующие болезнь эффекты, снижая потребность в сопутствующих препаратах для лечения ОА и отсрочке для проведения операции по протезированию сустава [30]. Недавний сетевой метаанализ, включавший только долгосрочные (>1 года) исследования любого фармакологического вмешательства при ОА коленного сустава, показал, что только пКГС имел модифицирующий заболевание профиль, был эффективен при боли, обусловленной ОА коленного сустава, улучшал функцию и структуру сустава [31]. Другие же препараты глюкозамина не продемонстрировали положительного влияния в высокодоказательных исследованиях и метаанализах [32]. Кроме того, препараты глюкозамина, отпускаемые без рецепта, включая ГГ с/без добавления сульфата натрия, не были эффективны ни для одного из вышеперечисленных результатов.
Аналогично, только хондроитина сульфат (ХС) с соответствующей фармацевтической степенью чистоты и физико-химическими параметрами показал эффективность, подтвержденную в исследованиях [33]. Позитивное действие ХС при боли, как сообщается, варьирует. Недавний метаанализ показал, что ХС обеспечивает умеренную эффективность в уменьшении боли, с большим влиянием на функцию при ОА коленного сустава [34]. Недавнее исследование J.Y. Reginster et al. (2017) продемонстрировало, что ХС фармацевтического уровня не отличается от целекоксиба с точки зрения эффективности при симптоматическом ОА коленного сустава [33]. Также сообщалось, что он оказывает положительное действие на структуру сустава, согласно изменениям, визуализированным с помощью магнитно-резонансной томографии [31].
Полученные доказательные данные эффективности SYSADOA нашли отражение в относительно недавних исследованиях, поэтому в рекомендациях OARSI (2014), ACR (2012), AAOS (2013) SYSADOA не рекомендованы к использованию.
ESCEO (2019), среди всех доступных продуктов, содержащих глюкозамин и хондроитин, рекомендует использовать препараты рецептурного кристаллического ГС и оригинального рецептурного ХС в качестве альтернативы пКГС определенного фармацевтического качества, для которых доказательная база однозначна [12], в качестве фоновой постоянной терапии, начиная с первого этапа (сильная рекомендация) (рисунок).
ESCEO рекомендует проводить исследования генерических препаратов сложных молекул с определенной биологической активностью, так называемых биосимиляров, демонстрирующих сопоставимость с эталонным лекарственным средством, с использованием соответствующих физико-химических и биологических тестов in vitro, в неклинических и клинических испытаниях.
Глюкозамин и хондроитин часто встречаются в комбинации в качестве пищевых добавок, хотя такие продукты могут иметь различное фармацевтическое качество. Более того, в клинических исследованиях получены противоречивые результаты относительно того, есть ли какая-либо дополнительная выгода от такого сочетания. В недавнем рандомизированном контролируемом испытании (РКИ) приняли участие 164 пациента с рентгенографическим ОА коленного сустава 2-й или 3-й степени по классификации Келлгрена – Лоуренса и умеренной/тяжелой болью в колене, которые получали ХС (1200 мг) плюс ГС (1500 мг) один раз в день или плацебо в течение шести месяцев. Не удалось продемонстрировать превосходство комбинации глюкозамин/хондроитин над плацебо с точки зрения уменьшения боли в суставах и функциональных нарушений у больных симптоматическим ОА коленного сустава [35]. Эти результаты могут быть объяснены тем фактом, что ХС, как известно, влияет на абсорбцию глюкозамина, снижая его биодоступность на 50‑75% [36].
Согласно ESCEO, комбинация глюкозамина и хондроитина не может быть рекомендована для долговременного лечения ОА (слабая рекомендация).
НСАС представляют собой сложную смесь многих натуральных растительных экстрактов, полученных из авокадо и соевых масел. Идентификационные данные активного компонента(-ов) неизвестны, и анализ коммерчески доступных добавок демонстрирует различия в содержании стеролов [37]. В клинических испытаниях от трех до шести месяцев было показано некоторое улучшение боли, скованности и физической функции при использовании НСАС (300 мг/сут), что привело к снижению потребности в обезболивании [38]. Положительные результаты по влиянию НСАС на прогрессирование заболевания обнаружены в исследованиях продолжительностью 2‑3 года у пациентов с ОА тазобедренного или коленного сустава [39].
Диацереин является производным антрахинона и обладает противовоспалительной активностью [40]. В известном метаанализе он продемонстрировал небольшое положительное влияние на боль и задержку прогрессирования разрушения тазобедренного сустава при ОА [41]. Однако значительные долгосрочные эффекты при ОА коленного сустава еще не показаны. Безопасность диацереина была поставлена под сомнение после сообщений о тяжелой диарее и редких случаях потенциально серьезной гепатотоксичности [42]. В недавнем метаанализе безопасности диацереина показано, что частота побочных эффектов со стороны желудочно-кишечного тракта (ЖКТ), среди которых – диарея, боль в животе, мягкий стул, колит, более чем в два раза выше, чем при использовании плацебо, с/без сопутствующего лечения ОА [43].Согласно имеющимся данным, такая частота возникновения диареи после ежедневной терапии диацереином в дозе 100 мг варьирует от 2,3 до 45,9%.
Этот широкий диапазон результатов может быть частично объяснен изменчивостью продуктов, содержащих диацереин, на фармрынке. Тем не менее, в отчете Европейского агентства по лекарственным средствам (EMA) сделан вывод о том, что для диацереина характерен баланс пользы и риска при лечении ОА тазобедренного и коленного сустава у пациентов в возрасте до 65 лет [44]. Рекомендуется начинать терапию с половины суточной дозы диацерина (то есть 50 вместо 100 мг/сут) и прекратить прием в случае возникновения диареи.
Недавний отчет ESCEO, основанный на мнении экспертов, поддерживает диацереин как фоновое лечение ОА, которое может быть особенно полезно у пациентов с противопоказаниями к НПВП или парацетамолу [45].
Таким образом, диацереин демонстрирует баланс соотношения пользы/риска при лечении ОА коленного сустава и рекомендуется в качестве альтернативной терапии на первом этапе.
Топические НПВП могут быть добавлены в схему лечения на первом этапе, если у пациента сохраняется симптоматика после начала фармакологической терапии SYSADOAs, и ургентная анальгезия парацетамолом не обеспечивает достаточное облегчение симптомов согласно рекомендациям сообществ по изучению ОА. Краткосрочная эффективность местных НПВП при ОА коленного сустава была установлена в нескольких РКИ, метаанализах и исследованиях в реальной жизни [46, 47]. Недавний сетевой метаанализ показал, что топические НПВП превосходили плацебо для облегчения боли и улучшения функции при ОА, среди которых пластыри, содержащие диклофенак, были наиболее эффективными для уменьшения боли при ОА [48]. Данные, полученные в ходе исследований, показывают, что местные НПВП столь же действенны, как и пероральные НПВП. Они ассоциированы с более низким риском системных нежелательных явлений по сравнению с пероральными НПВП из-за меньшей системной абсорбции, но с повышенным риском локальных кожных реакций по сравнению с плацебо [49, 50]. Из соображений безопасности местные НПВП можно использовать вместо пероральных у лиц с ОА в возрасте >75 лет, у пациентов с сопутствующими заболеваниями или повышенным риском развития побочных эффектов со стороны ЖКТ, сердечно-сосудистой системы (ССС) или почек.
Рабочие группы ESCEO и AAOS настоятельно рекомендуют использовать топические НПВП в качестве дополнительной анальгезии на первичном этапе у пациентов с сохранением симптомов после базисной терапии и до применения оральных НПВП.
Второй этап: расширенная фармакотерапия
Оральные НПВП
Фармакологические методы терапии второго этапа назначаются пациентам при недостаточной эффективности лечебных мероприятий, а также у лиц с ОА и умеренной/сильной болью. Пероральные НПВП оказывают слабое или умеренное влияние на облегчение боли при ОА коленного сустава (200 мг/сут целекоксиба, 150 мг/сут диклофенака, 60 мг/сут эторикоксиба) [51]. Показано, что селективные ингибиторы циклооксигеназы‑2 (ЦОГ‑2), преимущественно селективные или неселективные (нс) НПВП одинаково эффективны в обезболивании при ОА [52].
Однако кокрановский обзор продемонстрировал, что целекоксиб превосходит плацебо и некоторые нсНПВП в снижении боли при ОА и улучшении функции с высоким уровнем доказательности [53]. Кроме того, в сетевом метаанализе долгосрочных испытаний фармакологических вмешательств при ОА коленного сустава показано, что НПВП не связаны с улучшением боли и изменениями функции или структуры сустава, за исключением целекоксиба [54].
Выбор НПВП врачами, как правило, определяется оценкой пользы и балансом риска с точки зрения вариабельности профиля безопасности побочных явлений со стороны ЖКТ и ССС между отдельными препаратами и пациентами. Недавние метаанализы безопасности НПВП позволяют предположить, что все нсНПВП и ингибиторы ЦОГ‑2 обладают высоким потенциалом токсичности для пищеварительной системы и ССС [55]. Метаанализ 280 исследований НПВП в сравнении с плацебо (124 513 участников, 68 342 человеко-лет) и 474 испытаний одного НПВП в сравнении с другим (229 296 участников, 165 456 человеко-лет) выявил, что все схемы приема НПВП, включая нсНПВП и ингибиторы ЦОГ‑2, увеличивают осложнения со стороны верхней части ЖКТ по сравнению с плацебо [56].
С точки зрения влияния на пищеварительную систему целекоксиб менее токсичен, что было показано в ретроспективном объединенном анализе 21 РКИ 9461 пациента в возрасте >65 лет с ОА, ревматоидным артритом или анкилозирующим спондилитом. Меньшее количество больных, получавших целекоксиб, имели нежелательные явления со стороны ЖКТ – боли в животе, запоры, диарею, диспепсию, метеоризм, тошноту (16,7%), в сравнении с напроксеном (29,4%), ибупрофеном (26,5%) или диклофенаком (21,0%) [57].
Ранее считалось, что селективность НПВП в отношении фермента ЦОГ‑2 регулирует профиль токсичности для ССС, однако недавние результаты показывают, что СС-риск может быть специфичным для определенных лекарственных средств. Так, рофекоксиб является единственным НПВП, четко ассоциированным с повышенным риском СС-событий [58].
Значительная вероятность развития геморрагического инсульта была также обнаружена у пациентов, принимавших диклофенак и мелоксикам [59]. В популяционном когортном исследовании оценивали абсолютный риск инфаркта миокарда, связанного с применением НПВП, который составил 0,5‑1% в год [60]. Хотя абсолютное увеличение риска инфаркта миокарда невелико, использование данных препаратов очень распространено среди пожилых лиц: более 29 млн взрослых (12,1%) постоянно принимают НПВП [61].
Оценка вероятности развития острого инфаркта миокарда для НПВП за любой промежуток времени показала повышение риска на 15% для целекоксиба (200 мг), 25% для напроксена (500 мг), 35% для диклофенака (100 мг), 40% для ибупрофена (1200 мг) и 55% для рофекоксиба (25 мг) [60]. Примечательно, что риск инфаркта миокарда, ассоциированный с приемом целекоксиба, зависел от постоянного использования препарата в течение более 30 дней, тогда как для ибупрофена, рофекоксиба, диклофенака и напроксена данный показатель проявлялся в течение семи дней после назначения [60].
Все НПВП также связаны с повышенным риском острого повреждения почек, который особенно высок в первые 30 дней после начала терапии [62]. Хотя у пациентов с нормальной функцией почек вероятность развития острого повреждения почек после приема НПВП мала, у лиц с гипертонией, сердечной недостаточностью или сахарным диабетом в анамнезе она намного выше [62].
ESCEO и ACR рекомендуют использовать НПВП в самой низкой эффективной дозе в течение кратчайшего периода времени, необходимого для контроля боли, то есть периодически или в более длительных циклах, но не в качестве постоянного применения из-за риска возникновения побочных эффектов со стороны ЖКТ и ССС [10, 12].
Рабочая группа ESCEO считает, что целекоксиб (200 мг/сут) может быть предпочтительным пероральным НПВП из-за баланса между хорошей кратковременной эффективностью при ОА в утвержденных дозах и его более низкой склонности к токсичности.
Рабочая группа ESCEO настоятельно рекомендует использовать пероральные НПВП (селективные или неселективные) в качестве терапии второго этапа периодически, для более длительных циклов назначение оральных НПВП должно основываться на профиле риска пациента, как описано на рисунке (сильная рекомендация).
Внутрисуставные вмешательства: гиалуроновая кислота и глюкокортикоиды
В случае противопоказаний к назначению НПВП или при сохраняющейся симптоматике у больных, несмотря на рациональное применение НПВП, следует рассмотреть внутрисуставное лечение ОА. Внутрисуставное использование гиалуроновой кислоты (ВСГК) может быть альтернативой НПВП при ОА коленного сустава с более благоприятным профилем безопасности, особенно для пожилых пациентов или лиц с высоким риском развития побочных эффектов на фоне терапии НПВП. Вискосупплементация с помощью ВСГК является действенным методом лечения ОА коленного сустава, оказывающим благоприятное влияние на боль, функцию и общую оценку состояния пациента [63].
Существуют убедительные доказательства эффективности ВСГК по данным РКИ, многочисленных метаанализов и опыту реальной клинической практики [64]. Более того, ВСГК демонстрировали более значимое положительное влияние среди всех вмешательств при боли, сопровождающей ОА, с превосходящей эффективностью по сравнению с пероральными НПВП [65]. Систематические обзоры метаанализов подтвердили, что ВСГК – целесообразный выбор в лечении ОА коленного сустава, использование которого приводит к уменьшению боли и улучшению функции коленного сустава, причем эффекты могут сохраняться до 26 недель [66]. Для ВСГК характерно отсроченное начало действия: эффективность в отношении боли проявляется к четвертой неделе, достигает максимума через восемь недель и сохраняется до шести месяцев [67].
Исследования показывают, что одна инъекция ВСГК не демонстрирует преимуществ по сравнению с плацебо. Несколько курсов превосходят одну инъекцию, 2‑4 инъекции наиболее эффективны в уменьшении выраженности боли через три и шесть месяцев [68]. Ретроспективный анализ базы данных показывает уменьшение количества или задержку потребности в операции по полной замене коленного сустава приблизительно на два года после однократной инъекции и до 3,5 лет при пяти курсах ВСГК [69]. Лечение ВСГК также снижает необходимость применения других обезболивающих препаратов, таких как НПВП, глюкокортикоиды и опиоиды у пациентов с ОА коленного сустава [70].
Как известно, выраженность клинического эффекта для разных продуктов ВСГК отличается. ВСГК с низкой молекулярной массой обладают меньшей эффективностью, чем с промежуточной и высокой [71].
Противоречивые отчеты о безопасности, связанные с ВСГК, включая повышенный риск псевдосептических реакций, обострений синовита, местных побочных реакций (боль, отек и артралгия), привели к появлению некоторых опасений ESCEO по поводу использования этого метода терапии [72]. Кроме того, из-за необходимости повторных инъекций, выполняемых практикующим врачом, и высокой стоимости, в алгоритме лечения ВСГК позиционируется после НПВП или при наличии противопоказаний к применению НПВП.
Более того, в руководствах OARSI, ACR и AAOS вискосупплементарная терапия не входит в перечень рекомендованных методов лечения.
ВСГК следует вводить при ОА коленного сустава только после разрешения острого воспалительного процесса. При наличии синовита у таких пациентов необходимо использовать глюкокортикоиды для лечения выпота коленного сустава. Внутрисуставное применение глюкокортикоидов связано с большей пользой, чем плацебо и ВСГК в краткосрочных наблюдениях (2‑4 недели). Также абсолютно ожидаемо, что их эффективность выше у пациентов с выраженным болевым синдромом [73]. Внутримышечные инъекции глюкокортикоидов показали клинически значимое уменьшение боли, связанной с ОА тазобедренного сустава, в течение 12 недель после инъекции [74]. Однако польза повторных курсов ВС глюкокортикоидов в уменьшении болевых симптомов достаточно ограниченна. Кроме того, в двух исследованиях длительностью два года не было обнаружено пользы внутрисуставного введения глюкокортикоидов для модификации структуры сустава в долгосрочной перспективе [75].
В настоящее время доступны следующие одобренные Управлением по контролю за качеством пищевых продуктов и лекарственных средств США (FDA) глюкокортикоиды с немедленным высвобождением для внутрисуставного применения: метилпреднизолона ацетат (MA), триамцинолона ацетат (TA), триамцинолона гексацетонид, бетаметазона ацетат, бетаметазона натрия фосфат (БНФ) и дексаметазон [76].
Были проведены исследования для определения оптимального глюкокортикоида с наилучшими фармакологическими и клиническими характеристиками для внутрисуставных введений. Дозировки, эквивалентные или превышающие 50 мг преднизона (эквивалентно 40 мг ТА и МА), ассоциировались с более длительным обезболивающим действием – 12‑24 недели; при использовании меньших доз сообщалось о более коротком эффекте, в течение 2‑4 недель [77, 78]. U. Yavuz et al. (2012) отметили, что МА достаточно эффективно уменьшает боль в первые шесть недель по сравнению с другими используемыми кортикостероидами (ТА, БНФ), но все они обеспечивают эквивалентную анальгезию с 6-й по 12-ю недели приема [79].
Рабочая группа ESCEO рекомендует внутрисуставное использование глюкокортикоидов у пациентов с противопоказаниями к приему НПВП, а также если у больного сохраняются симптомы несмотря на применение НПВП. Глюкокортикоиды внутрисуставно продемонстрировали более высокую эффективность, чем ВСГК в первые несколько недель лечения в одной и той же популяции пациентов. Уменьшение сильной боли может быть лучшим предиктором этой краткосрочной эффективности, чем долговременная редукция воспалительных признаков (слабая рекомендация).
Этап 3: последний шаг в фармакотерапии ОА
Последние фармакологические возможности для пациента с выраженной симптоматикой ОА коленного сустава представлены кратковременными применением слабых опиоидов, таких как трамадол, для которых имеются убедительные доказательства анальгетического эффекта при ОА коленного сустава [80]. Опиоиды значительно снижают интенсивность боли и несколько улучшают функцию, тогда как индекс потенциального вреда составил 5 по сравнению с плацебо [81].
Препараты трамадола с замедленным высвобождением (SR) могут быть более предпочтительными для снижения боли. Кроме того, для улучшения переносимости и минимизации последствий прекращения лечения рекомендуется медленное восходящее титрование трамадола SR от 50 до 100 мг [82]. Недавний метаанализ безопасности пероральных опиоидов, используемых при ОА, выявил повышенный риск развития побочных эффектов со стороны ЖКТ (сухость во рту, язвы в полости рта, тошнота, рвота, диспепсия, запор), ЦНС (головная боль, головокружение, усталость, сонливость) и дерматологические симптомы (сыпь или зуд) [83]. Примечательно, что лечение опиоидами не оказалось лучше применения неопиоидных препаратов для улучшения функции, связанной с болью [83].
Антидепрессант дулоксетин использовался при хронических болевых синдромах. Некоторые доказательства эффективности препарата были получены при ОА, особенно у пациентов с болью в результате центральной сенситизации, несмотря на то что он имеет высокий уровень побочных явлений (головокружение, риск падений) [84].
Таким образом, OARSI (2014) и ACR (2012) не рекомендуют прием опиоидов при ОА коленного сустава, а AAOS (2013) рекомендован только трамадол.
ESCEO (2019), основываясь на последних и убедительных доказательных данных, рекомендует использование слабых опиоидов кратковременными курсами на третьем этапе алгоритма терапии в качестве последней фармакологической попытки перед хирургическим лечением. Дулоксетин может быть альтернативой слабым опиоидам на шаге 3, особенно у пациентов с болью в результате центральной сенситизации (слабая рекомендация).
Этап 4: лечение в конечной стадии и хирургические вмешательства
При неэффективности предыдущих методов лечения у пациентов с сохраняющейся выраженной симптоматикой и прогрессированием ухудшения качества жизни следует использовать хирургические методы, которые включают полную или частичную замену сустава и остеотомию. За последние годы возросло число выполненных операций по замене суставов, что обусловлено старением населения, ростом потребности в процедуре и увеличением количества операций по замене суставов у более молодых пациентов [85]. Один из последних сетевых метаанализов акцентирует на том, что функциональные показатели улучшаются именно при тотальном эндопротезировании коленного сустава (ТЭПКС) в долгосрочной перспективе, тогда как однокомпонентная артропластика коленного сустава (ОАК) – замена только поврежденной части коленного сустава, и остеотомия более эффективны в краткосрочной перспективе [86].
Однокомпонентная замена коленного сустава имеет более высокую частоту повторных оперативных вмешательств, однако связана с меньшим числом осложнений по сравнению с ТЭПКС, включая смертность [87]. Высокая остеотомия большеберцовой кости (ВОБК) показана при однокомпонентном остеоартрите коленного сустава, ассоциированного со смещением, пожилым пациентам старше 60 лет с нормальным индексом массы тела. Обычно ВОБК является операцией выбора при варусных деформациях, артрите и поражении медиального отдела коленного сустава. Это молодой, активный пациент, у которого артропластика в будущем может быть неэффективна вследствие чрезмерного износа протеза. ВОБК фактически сохраняет коленный сустав, включая крестообразные связки, и позволяет больному рано возвратиться к активному образу жизни.
По сравнению с артропластикой этот метод лечения требует дополнительное время для восстановления, имеет большее количество осложнений, связанных с заживлением кости и возможными переломами, менее эффективен в облегчении боли. В конечном счете, он не заменяет хрящ, который уже утрачен, и не восстанавливает оставшийся [88]. ОАК, при которой заменяется только поврежденная часть коленного сустава, – альтернатива ВОБК и ТЭКС. Остеотомия может отсрочит необходимость в эндопротезировании на срок до 10 лет.
ТЭПКС – вариант хирургического лечения для пациентов, у которых консервативное лечение оказалось неэффективным, и с ОА более чем одной области. Это ценное вмешательство для пациентов, которые испытывают сильную ежедневную боль наряду с рентгенографическими признаками ОА коленного сустава 3‑4-й стадии.
Рабочая группа ESCEO настоятельно рекомендует проводить тотальное эндопротезирование коленного сустава у пациентов с ОА на конечной стадии, что является высокоселективной и экономически эффективной процедурой, хотя и не лишенной неблагоприятных результатов. Роль других хирургических процедур, особенно однокомпонентной замены коленного сустава, требует дальнейшего изучения (сильная рекомендация).
Для больных с выраженной симптоматикой, которым хирургическое вмешательство противопоказано, или же они не желают ему подвергаться, последним фармакологическим средством могут быть классические пероральные или трансдермальные опиоиды, которые продемонстрировали незначительное или умеренное положительное влияние на боль и функцию при ОА [89]. Их следует назначать в соответствии с рекомендациями по применению опиоидных анальгетиков для лечения нераковых болей [89].
Рабочая группа ESCEO дает слабую рекомендацию по применению классических оральных или трансдермальных опиоидов у пациентов с ОА на конечной стадии коленного сустава, которым операция противопоказана.
Обсуждение рекомендаций ESCEO (2019)
Пошаговый алгоритм рекомендаций ESCEO (2019) по лечению ОА коленного сустава представляет собой своевременное обновление, основанное на оценке текущей научной литературы (2014‑2018) относительно эффективности и безопасности всех методов терапии ОА. ESCEO считает, что сочетание методов лечения, включая нефармакологические и фармакологические вмешательства, является ключевым для менеджмента ОА коленного сустава, как указано в обновленном алгоритме.
Хотя эффективность нефармакологических методик считается низкой, а данные об экономической эффективности ограничены и неубедительны из-за проблем с качеством испытаний, все же они наиболее безопасны. Немедикаментозные вмешательства в настоящее время недостаточно используются в клинической практике. Необходимо преодолеть барьеры для более широкого признания эффективности нефармакологических модальностей, популяризировать мероприятия в соответствии с рекомендациями, основанными на фактических данных и улучшить организацию их проведения.
В качестве первого этапа фармакотерапии рабочая группа ESCEO выступает за использование фонового лечения хроническими оригинальными рецептурными SYSADOA, в частности пКГС и ХС. Недавние опасения по поводу профиля безопасности парацетамола подтвердились в последующих исследованиях и обосновали сомнения по поводу его рутинного и постоянного применения из-за растущих данных о токсичности касательно ЖКТ, ССС и почек. Таким образом, парацетамол может быть назначен только для кратковременного ургентного обезболивания. Топические НПВП целесообразно добавлять к фоновой терапии на первичном этапе в качестве периодической анальгезии или использовать вместо пероральных НПВП, особенно у пациентов с ОА в возрасте >75 лет, а также с сопутствующими заболеваниями или повышенным риском системных побочных явлений. Если лечение на первом этапе демонстрирует недостаточную эффективность SYSADOA, или пациентов продолжает беспокоить умеренная/сильная боль, необходимо назначить более агрессивные фармакологические методы лечения, таких как пероральные НПВП.
В предыдущем руководстве ESCEO выбор подходящего орального НПВП определялся оценкой баланса пользы и риска. Однако недавние метаанализы безопасности НПВП показали, что все нсНПВП и ингибиторы ЦОГ‑2 обладают сравнимым потенциалом токсичности для пищеварительной системы и ССС. Выбор перорального НПВП должен основываться на профиле риска пациента и учитывать вероятность развития побочных реакций со стороны ЖКТ или ССС, связанную с каждым НПВП. Целекоксиб (200 мг/сут) является предпочтительным НПВП из-за его лучшего общего профиля безопасности.
ВСГК может быть хорошей альтернативой НПВП при ОА коленного сустава, особенно для пожилых пациентов или лиц с повышенным риском развития НПВП, индуцированных нежелательных эффектов либо при неэффективности терапии НПВП, хотя имеющиеся данные не позволяют сделать однозначный вывод. Рабочая группа ESCEO рекомендует использовать инъекции ВСГК у больных с ОА коленного сустава. ВСГК следует вводить только после того, как острая воспалительная вспышка утихла. Кроме того, для таких пациентов рекомендовано внутрисуставное введение глюкокортикоидов с целью лечения синовита коленного сустава или купирования сильной боли.
Третий этап фармакологических вмешательств для пациентов с выраженной симптоматикой – непродолжительный прием слабых опиоидов, таких как трамадол, а также дулоксетина в качестве альтернативы последним, особенно у лиц с болью в результате центральной сенситизации. ТЭПКС целесообразно рекомендовать при полной неэффективности предыдущих методов лечения с сохраняющейся симптоматикой и снижением качества жизни больных.
Выводы
ОА коленного сустава – одно из наиболее изученных и распространенных заболеваний в популяции. Тем не менее, оно по-прежнему не имеет четкой патофизиологии и единственного наиболее эффективного вмешательства для лечения симптомов, воспаления и дегенерации хряща, связанных с патологией. Рекомендации различных обществ по терапии ОА отличаются. Наиболее широкий выбор препаратов предложен в последних рекомендациях ESCEO (2019), благодаря чему ревматологи и семейные врачи имеют возможность предложить пациентам с ОА коленного состава более широкий выбор фармакологических и нефармакологических вмешательств.
Дальнейшие исследования должны быть направлены на выявление фенотипов пациентов при ОА, особенно на ранних стадиях заболевания. Рабочая группа Общества гериатрической медицины Европейского Союза (ESCEO-EUGMS) недавно предложила возможные профили больных ОА, включая наличие четырех клинических фенотипов, таких как биомеханический, остеопоротический, метаболический и воспалительный [90]. Характеристика этих фенотипов поможет должным образом стратифицировать пациентов с ОА в клинических исследованиях, что позволит оптимизировать индивидуализированное лечение ОА.
Литература
- Головач И.Ю. Остеоартрит: фундаментальные и прикладные аспекты этиопатогенеза заболевания. Ничего не стоит на месте // Український ревматологічний журнал. – 2014. – Т. 2, № 56. – C. 4‑11.
- Vos T., Flaxman A.D., Naghavi M. et al. Years lived with disability (YLDs) for 1160 sequelae of 289 diseases and injuries 1990‑2010: a systematic analysis for the Global Burden of Disease Study 2010 // Lancet. – 2012. – Vol. 380, № 9859. – P. 2163‑2196.
- Nuesch E., Dieppe P., Reichenbach S., et al. All cause and disease specific mortality in patients with knee or hip osteoarthritis: population based cohort study // BMJ. – 2011. – Vol. 342. – P. 1165.
- Sharma V., Anuvat K., John L., Davis M. Scientific American Pain Management – Arthritis of the knee // Decker: Pain related disease states, 2017. – 276 p.
- Головач І.Ю. Хворобомодифікуюча терапія остеоартриту в чинних рекомендаціях: уроки минулого та можливості для майбутнього. Травма. – 2017. – Т. 18, № 3. С. 11‑21; doi: http://dx.doi.org/10.22141/1608‑1706.3.18.2017.105356.
- Головач И.Ю. Метаболический фенотип остеоартрита: двойная роль ожирения // Травма. – 2017. – Т. 18, № 5. – С. 87‑93.
- Richards M.M., Maxwell J.S., Weng L. et al. Intra-articular treatment of knee osteoarthritis: from anti-inflammatories to products of regenerative medicine // Phys Sportsmed. – 2016. – Vol. 44, № 2. – P. 101‑108.
- Sellam J., Berenbaum F. The role of synovitis in pathophysiology and clinical symptoms of osteoarthritis // Nat Rev Rheumatol. – Vol. 6, № 11. – P. 625‑635.
- McAlindon T.E., Bannuru R.R., Sullivan M.C. et al. OARSI guidelines for the non-surgical management of knee osteoarthritis // Osteoarthritis Cartilage. – 2014. – Vol. 22, № 3. – P. 363‑388.
- Hochberg M.C., Altman R.D., April K.T. et al. American College of Rheumatology 2012 recommendations for the use of nonpharmacologic and pharmacologic therapies in osteoarthritis of the hand, hip, and knee. American College of Rheumatology // Arthritis Care Res (Hoboken). – 2012. – Vol. 64, № 4. – P. 465‑474.
- Jevsevar D.S. Treatment of osteoarthritis of the knee: evidence-based guideline, 2nd edition // J Am Acad Orthop Surg. – 2013. – Vol. 21, № 9. – P. 571‑576.
- Honvo G., Bannuru R.R., Bruyere O. et al. The European Society for Clinical and Economic Aspects of Osteoporosis, Osteoarthritis and Musculoskeletal Diseases (ESCEO) recommendations for the reporting of harms in studies assessing drugs to be used in osteoarthritis: a consensus statement from a working group on the safety of anti-osteoarthritis medications // Drugs Aging. – 2019. – Vol. 36, № 1. – P. 145‑159.
- Alrushud A.S., Rushton A.B., Kanavaki A.M. et al. Effect of physical activity and dietary restriction interventions on weight loss and the musculoskeletal function of overweight and obese older adults with knee osteoarthritis: a systematic review and mixed method data synthesis // BMJ Open. – 2017. – Vol. 7, № 6. – P. 014537.
- Quintrec J-L.L., Verlhac B., Cadet C. et al. Physical exercise and weight loss for hip and knee osteoarthritis in very old patients: a systematic review of the literature // Open Rheumatol J. – 2014. – Vol. 8. – P. 89‑95.
- Tanaka R., Ozawa J., Kito N. et al. Efficacy of strengthening or aerobic exercise on pain relief in people with knee osteoarthritis: a systematic review and meta-analysis of randomized controlled trials // Clin Rehabil. – 2013. – Vol. 27, № 12. – P. 1059‑1071.
- Messier S.P., Gutekunst D.J., Davis C., Devita P. Weight loss reduces knee-joint loads in overweight and obese older adults with knee osteoarthritis // Arthritis Rheum. – 2005. – Vol. 52, № 7. – P. 2026‑2032.
- Bliddal H., Leeds A.R., Christensen R. Osteoarthritis, obesity and weight loss: evidence, hypotheses and horizons – a scoping review // Obes Rev. – 2014. – Vol. 15, № 7. – Р. 578‑586; doi: 10.1111/obr.12173.
- Dulay G.S., Cooper C., Dennison E.M. Knee pain, knee injury, knee osteoarthritis & work // Best Pract Res Clin Rheumatol. – 2015. – Vol. 29, № 3. – P. 454‑461.
- Penny P., Geere J., Smith T.O. A systematic review investigating the efficacy of laterally wedged insoles for medial knee osteoarthritis // Rheumatol Int. – 2013. – Vol. 33, № 10. – P. 2529‑2538.
- Woods B., Manca A., Weatherly H. et al. Cost-effectiveness of adjunct non-pharmacological interventions for osteoarthritis of the knee // PLoS One. – 2017. –Vol.12, № 3. – P. 0172749.
- Selten E.M., Vriezekolk J.E., Nijhof M.W. et al. Barriers impeding the use of non-pharmacological, nonsurgical care in hip and knee osteoarthritis: the views of general practitioners, physical therapists, and medical specialists // J Clin Rheumatol. – 2017. – Vol. 23, № 8. – P. 405‑410.
- Bannuru R.R., Schmid C.H., Kent D.M. et al. Comparative effectiveness of pharmacologic interventions for knee osteoarthritis: a systematic review and network meta-analysis // Ann Intern Med. – 2015. – Vol. 162, № 1. – P. 46‑54.
- Bruyere O., Cooper C., Pelletier J.P., et al. An algorithm recommendation for the management of knee osteoarthritis in Europe and internationally: a report from a task force of the European Society for Clinical and Economic Aspects of Osteoporosis and Osteoarthritis (ESCEO) // Semin Arthritis Rheum. – 2014. – Vol. 44, № 3. – P. 253‑263.
- Conaghan P.G., Arden N., Avouac B. et al. Safety of paracetamol in osteoarthritis: what does the literature say? // Drugs Aging. – 2019. – Vol. 36, № 1. – P. 7‑14.
- Roberts E., Delgado Nunes V., Buckner S. et al. Paracetamol: not as safe as we thought? A systematic literature review of observational studies // Ann Rheum Dis. – 2016. – Vol. 75, № 3. – P. 552‑559.
- De Wan M., Volpi G. inventors; Rottapharm, assignee. A method of preparing mixed glucosamine salts: US patent 5 847 107, 2019; https://patents.google.com/ patent/US5847107A/en. USA patent 5 847 107, 1998.
- Kucharz E.J., Kovalenko V., Szanto S. et al. A review of glucosamine for knee osteoarthritis: why patented crystalline glucosamine sulfate should be differentiated from other glucosamines to maximize clinical outcomes // Curr Med Res Opin. – 2016. – Vol. 32, № 6. – P. 997‑1004.
- Runhaar J., Rozendaal R.M., Middelkoop M.V. et al. Subgroup analyses of the effectiveness of oral glucosamine for knee and hip osteoarthritis: a systematic review and individual patient data metaanalysis from the OA trial bank // Ann Rheum Dis. – 2017. – Vol. 76, № 11. – P. 1862‑1869.
- Conaghan P.G., Arden N., Avouac B. et al. Safety of paracetamol in osteoarthritis: what does the literature say? // Drugs Aging. – 2019. – Vol. 36, № 1. – P. 7‑14.
- Rovati L.C., Girolami F., D’Amato M., Giacovelli G. Effects of glucosamine sulfate on the use of rescue non-steroidal anti-inflammatory drugs in knee osteoarthritis: results from the Pharmaco-Epidemiology of GonArthroSis (PEGASus) study // Semin Arthritis Rheum. – 2016. – Vol.45, № 3. – P. 34‑41.
- Gregori D., Giacovelli G., Minto C. et al. Association of pharmacological treatments with long-term pain control in patients with knee osteoarthritis: a systematic review and meta-analysis // JAMA. – 2018. – Vol. 320, № 24. – P. 2564‑2579.
- Runhaar J., Rozendaal R.M., Middelkoop M.V. et al. Subgroup analyses of the effectiveness of oral glucosamine for knee and hip osteoarthritis: a systematic review and individual patient data metaanalysis from the OA trial bank // Ann Rheum Dis. – 2017. – Vol. 76, № 11. – P. 1862‑1869.
- Reginster J.Y., Dudler J., Blicharski T., Pavelka K. Pharmaceutical-grade Chondroitin sulfate is as effective as celecoxib and superior to placebo in symptomatic knee osteoarthritis: the ChONdroitin versus CElecoxib versus Placebo Trial (CONCEPT) // Ann Rheum Dis. – 2017. – Vol. 76, № 9. – P. 1537‑1543.
- Pelletier J.P., Raynauld J.P., Beaulieu A.D. et al. Chondroitin sulfate efficacy versus celecoxib on knee osteoarthritis structural changes using magnetic resonance imaging: a 2-year multicentre exploratory study // Arthritis Res Ther. – 2016. – Vol.18, № 1. – P. 256.
- Roman-Blas J.A., Castaneda S., Sanchez-Pernaute O. et al. Group CGCTS. Combined treatment with chondroitin sulfate and glucosamine sulfate shows no superiority over placebo for reduction of joint pain and functional impairment in patients with knee osteoarthritis: a six-month multicenter, randomized, double-blind, placebo-controlled clinical trial // Arthritis Rheumatol. – 2017. – Vol. 69, № 1. – P. 77‑85.
- Jackson C.G., Plaas A.H., Sandy J.D. et al. The human pharmacokinetics of oral ingestion of glucosamine and chondroitin sulfate taken separately or in combination // Osteoarthritis Cartilage. – 2010. – Vol.18, № 3. – P. 297‑302.
- Christiansen B.A., Bhatti S., Goudarzi R., Emami S. Management of osteoarthritis with avocado/soybean unsaponifiables // Cartilage. – 2015. – Vol. 6, № 1. – P. 30‑44.
- Appelboom T., Schuermans J., Verbruggen G. et al. Symptoms modifying effect of avocado/soybean unsaponifiables (ASU) in knee osteoarthritis. A double blind, prospective, placebo-controlled study // Scand J Rheumatol. – 2001. – Vol. 30, № 4. – P. 242‑247.
- Maheu E., Cadet C., Marty M. et al. Randomised, controlled trial of avocado-soybean unsaponifiable (Piascledine) effect on structure modification in hip osteoarthritis: the ERADIAS study // Ann Rheum Dis. – 2014. – Vol.73, № 3. – P. 376‑384.
- Martel-Pelletier J., Pelletier J.P. Effects of diacerein at the molecular level in the osteoarthritis disease process // Ther Adv Musculoskelet Dis. – 2010. – Vol. 2, № 2. – P. 95‑104.
- Dougados M., Nguyen M., Berdah L. et al. Evaluation of the structure-modifying effects of diacerein in hip osteoarthritis: ECHODIAH, a three-year, placebo-controlled trial. Evaluation of the chondromodulating effect of diacerein in OA of the hip // Arthritis Rheum. – 2001. – Vol. 44, № 11. – P. 2539‑2547.
- EMA. European Medicines Agency. Assessment report for diacerein containing medicinal products. EMA/527347/2014; www.ema.europa.eu/docs/en GB/document library/Referrals document/Diacerein/European Commission final decision/WC500173145.pdf.
- Honvo G., Reginster J-Y., Rabenda V. et al. Safety of symptomatic slow-acting drugs for osteoarthritis: outcomes of a systematic review and meta-analysis // Drugs Aging. – 2019. – Vol. 36, № 1. – P. 65‑99.
- Pelletier J.P., Martel-Pelletier J. Diacerein-containing products: same risk of diarrhoea? // Aging Clin Exp Res. – 2018. – Vol. 30, № 4. – P. 411‑412.
- Pavelka K., Bruyere O., Cooper C. et al. Diacerein: benefits, risks and place in the management of osteoarthritis. An opinion-based report from the ESCEO // Drugs Aging. – 2016. – Vol. 33, № 2. – P. 75‑85.
- Sardana V., Burzynski J., Zalzal P. Safety and efficacy of topical ketoprofen in transfersome gel in knee osteoarthritis: a systematic review // Musculoskeletal Care. – 2017. – Vol. 15, № 2. – P. 114‑121.
- Wadsworth L.T., Kent J.D., Holt R.J. Efficacy and safety of diclofenac sodium 2% topical solution for osteoarthritis of the knee: a randomized, double-blind, vehiclecontrolled, 4 week study // Curr Med Res Opin. – 2016. – Vol. 32, № 2. – P. 241.
- Zeng C., Wei J., Persson M.S. et al. Relative efficacy and safety of topical non-steroidal anti-inflammatory drugs for osteoarthritis: a systematic review and network meta-analysis of randomised controlled trials and observational studies // Br J Sports Med. – 2018. – Vol. 52, № 10. – P. 642‑650.
- Chou R., McDonagh M.S., Nakamoto E., Griffin J. Analgesics for osteoarthritis: an update of the 2006 comparative effectiveness review, 2011. Rockville MD; www.ncbi.nlm.nih.gov/pubmedhealth/PMH0016485/pdf/TOC.pdf; 2018.
- Sardana V., Burzynski J., Zalzal P. Safety and efficacy of topical ketoprofen in transfersome gel in knee osteoarthritis: a systematic review // Musculoskeletal Care. – 2017. – Vol.15, № 2. – P. 114‑121.
- da Costa B.R., Reichenbach S., Keller N. et al. Effectiveness of non-steroidal anti-inflammatory drugs for the treatment of pain in knee and hip osteoarthritis: a network meta-analysis. – Lancet. – 2017. – Vol. 390, №10090. – P. 21-33.
- Jung S.Y., Jang E.J., Nam S.W. et al. Comparative effectiveness of oral pharmacologic interventions for knee osteoarthritis: a network meta-analysis // Mod Rheumatol. – 2018. – Vol. 28, № 6. – P. 1021-1028.
- Puljak L., Marin A., Vrdoljak D., et al. Celecoxib for osteoarthritis // Cochrane Database Syst Rev. – 2017. – Vol. 5. – P. 009865.
- Gregori D., Giacovelli G., Minto C., et al. Association of pharmacological treatments with long-term pain control in patients with knee osteoarthritis: a systematic review and meta-analysis // JAMA. – 2018. – Vol. 320, № 24. – P. 2564-2579.
- Cooper C., Chapurlat R., Al-Daghri N. et al. Safety of oral non-selective non-steroidal anti-inflammatory drugs in osteoarthritis: what does the literature say? // Drugs Aging. – 2019. – Vol. 36, № 1. – P. 15-24.
- Bhala N., Emberson J., Merhi A. et al Coxib and traditional NSAID Trialists’ (CNT) Collaboration. Vascular and upper gastrointestinal effects of non-steroidal anti-inflammatory drugs: meta-analyses of individual participant data from randomised trials // Lancet. – 2013. – Vol. 382, № 9894. – P. 769-779.
Полный список литературы, включающий 90 пунктов, находится в редакции.