5 вересня, 2019
Новые аспекты аналгезии и седации в отделении интенсивной терапии
В рамках 11-го Британо-Украинского симпозиума «Инновационные технологии и методики в анестезиологии и интенсивной терапии», который проходил с 17 по 20 апреля в Киеве, работала отдельная секция, посвященная новым аспектам анестезиологии и интенсивной терапии. Участниками секции были ведущие украинские клиницисты – анестезиологи и интенсивисты, представившие множество актуальных докладов.

Темой доклада профессора кафедры анестезиологии, интенсивной терапии и медицины неотложных состояний Винницкого национального медицинского университета им. Н.И. Пирогова, доктора медицинских наук Дмитрия Валерьевича Дмитриева была «Оптимизация седативной стратегии в отделении интенсивной терапии», в которой автор коснулся проблемы достижения адекватной анестезии у детей и взрослых. Суть ее состоит в том, что в отличие от взрослых, которые засыпают быстро, у детей могут наблюдаться пробуждения от наркозного сна.
Докладчик напомнил, что основными целями седации являются:
- уменьшение беспокойства;
- вызывание состояния амнезии;
- снижение двигательной активности во время выполнения инвазивных процедур и мониторирования;
- синхронизация с респиратором.
Каким же требованиям должно отвечать идеальное седативное средство? В числе основных требований были названы следующие:
- обладать пролонгированным действием;
- оказывать минимальную депрессию на сердечно-сосудистую систему;
- обладать минимальной токсичностью;
- обеспечивать возможность быстрого пробуждения;
- не вызывать синдрома отмены.
Согласно данным систематического ревю (Nienke J. Vet et al., 2013), опубликованным в издательстве Европейской ассоциации интенсивной терапии, наиболее часто при анестезии встречается избыточная седация (31,8%), которую следует предупреждать и избегать, поскольку она способствует следующим осложнениям:
- замедляет процесс выздоровления пациента;
- удлиняет продолжительность искусственной вентиляции легких;
- уменьшает вероятность удачной экстубации;
- усиливает толерантность к препаратам;
- вызывает синдром отмены.
Все эти факторы увеличивают объем работы для врача-анестезиолога. Однако и недостаточная седация имеет свои последствия:
- усиление дистресса;
- увеличение частоты осложнений (пневмоторакс, экстубация, удаление/смещение катетеров, трубок);
- удлинение сроков госпитализации в отделении интенсивной терапии (ОИТ);
- инфекционные осложнения.
Докладчик подчеркнул, что всегда необходимо искать «золотую середину» для обеспечения оптимальной седации пациента. Касательно используемых препаратов он отметил, что наиболее часто применяемым в мире средством первой линии седативной терапии является фентанил (66%). Обычно используемые комбинации – это опиоидные анальгетики и седативные средства группы бензадиазепинов. Однако бензадиазепины могут вызывать депрессию дыхания, вазоплегию и развитие синдрома отмены. И такая комбинация может привести к избыточной седации со всеми вышеперечисленными последствиями.
В качестве альтернативы Д.В. Дмитриев предложил пропофол, по которому имеется положительный опыт применения в рутинной практике, в том числе и у детей. Главным недостатком этого лекарственного средства является синдром инфузии пропофола. Это осложнение возникает при дозе препарата более 4 мг/ кг/ч и длительном применении – более 48 ч. Поэтому использование пропофола аргументировано в том случае, если известно, что седативная терапия будет длиться недолго. В литературе описаны случаи развития синдрома инфузии пропофола у детей при средней дозе препарата 2,9 мг/кг/ч и даже летальные исходы в педиатрии при разовом введении этого препарата ребенку.
Что касается центральных α2-адрено-антагонистов, то дексмедетомидин применяется в нашей стране у взрослых пациентов. Однако в западной литературе имеются исследования, доказывающие возможность использования дексмедетомидина у детей. Спикер отметил, что в его практике препарат применялся в педиатрии и, что важно, он не вызывал депрессию дыхания и синдром отмены. Детям, получавшим дексмедетомидин, требовалось значительно меньшее количество морфина, что является существенным преимуществом данного препарата. Он способствует адекватной седации даже при низком эффекте бензадиазепинов или опиоидов. Применение дексмедетомидина в дозе 0,1-0,25 мкг/кг/ч уменьшает потребность в перечисленных группах средств.
Препарат дексмедетомидин можно использовать как адъювант для аналгезии. При моноседации (0,25 мкг/кг/ч) его эффект сравним с действием мидазолама (0,22 мг/кг/ч). Все эти факты дают повод чаще применять дексмедетомидин в рутинной практике. Препарат является хорошей альтернативой традиционным анестетикам и анальгетикам. Кроме того, дексмедетомидин можно использовать при лечении абстинентного синдрома и делирия.
Докладчик отметил, что побочные действия препарата довольно редко выражены: гипотензия, брадикардия, гипертензия при быстром введении, эффект отражения при резком прекращении инфузии (беспокойство, анизокория, судороги).
Показания к применению дексмедетомидина:
- умеренная и легкая седация;
- лечение синдрома отмены.
По поводу противопоказаний у детей до 18 лет, докладчик еще раз акцентировал внимание на собственном опыте применения дексмедетомидина в педиатрии и наличии доказательной базы зарубежных специалистов. В 44 рандомизированных клинических исследованиях (РКИ) и 7 проспективных обсервационных испытаниях было отмечено, что использование дексмедетомидина у детей с различной патологией безопасно и удобно (Minerva Anestesiologica, 2014).
Что же необходимо сделать для предупреждения осложнений седации? В качестве основных мер автор доклада назвал следующее:
- проводить коррекцию протоколов (препаратов) для анестезии;
- применять алгоритм «седация – пробуждение»;
- использовать нефармакологические техники (уменьшение стресса, связанного со светом, звуками; формирование нормальных биоритмов), которые применимы в педиатрической практике;
- переходить на пероральные формы препаратов для анестезии.
Что касается предупреждения абстинентного синдрома, то докладчик обратил внимание коллег на такие моменты:
- необходимо проводить прерывистую седацию с пробуждением, которая улучшает исходы у взрослых, уменьшает продолжительность подключения к аппарату искусственной вентиляции легких и сокращает сроки госпитализации в ОИТ;
- у детей прерывание седации является возможным и безопасным методом, но его эффективность не доказана, и это ключевое отличие детской анестезии от взрослой.
Подводя итоги, спикер отметил необходимость формирования протоколов, проведения регулярной оценки уровня седации, внедрения современных методик анестезии и важность лечения основной патологии в ОИТ. В заключение он поделился новостью о скором появлении на фармацевтическом рынке отечественного дексмедетомидина гидрохлорида с гарантией международного качества. Это первый препарат в Украине, который был зарегистрирован по процедуре «Fast track». Производственная площадка по его изготовлению одобрена организацией FDA, и лекарственное средство уже поставляется на рынок США.
 Еще одним содержательным выступлением в секции анестезии и интенсивной терапии стал доклад заведующего кафедрой анестезиологии и интенсивной терапии ГУ «Днепропетровская медицинская академия МЗ Украины», доктора медицинских наук, профессора Юрия Юрьевича Кобеляцкого на тему «Новые аспекты послеоперационного обезболивания». В первую очередь спикер отметил, что на сегодняшний день проблемой обезболивания является нерациональное использование имеющихся фармацевтических ресурсов. Несмотря на наличие в арсенале врача множества инструментов и средств, результат аналгезии не всегда является удовлетворительным.
Еще одним содержательным выступлением в секции анестезии и интенсивной терапии стал доклад заведующего кафедрой анестезиологии и интенсивной терапии ГУ «Днепропетровская медицинская академия МЗ Украины», доктора медицинских наук, профессора Юрия Юрьевича Кобеляцкого на тему «Новые аспекты послеоперационного обезболивания». В первую очередь спикер отметил, что на сегодняшний день проблемой обезболивания является нерациональное использование имеющихся фармацевтических ресурсов. Несмотря на наличие в арсенале врача множества инструментов и средств, результат аналгезии не всегда является удовлетворительным.
Например, что плохого в опиоидах? Во-первых, применение этих препаратов несет риск неадекватного обезболивания в связи с возникновением опиоид-индуцированной гипералгезии. Такая реакция есть всегда, поскольку она является нормальной адаптивной реакцией на экзогенное введение опиатов. Во-вторых, даже кратковременное использование опиоидных средств влечет риск трансформации острой боли в хроническую. Эта хронизация боли может возникнуть у пациента даже через год после применения опиоидов. И в‑третьих – это, конечно, побочные эффекты упомянутых препаратов. Данный вопрос является ключевым, поскольку и для пациента, и для врача крайне нежелательны такие реакции, как тошнота и рвота, замедление моторики кишечника, гиперседация и т. п. При внутримышечном и подкожном введении опиоидов часто возникает избыточность их эффекта, а анальгетическое действие иногда недостаточное.
Классификация анальгетиков:
Антиноцицептивные препараты:
- гипералгетики (морфин, агонисты µ-рецепторов);
- антигипералгетики (парацетамол, нестероидные противовоспалительные препараты (НПВП), глюкокортикоиды, нефопам, трамадол).
Не антиноцицептивные, но антигипералгетики:
- кетамин, габапентин;
- местные анестетики;
- клонидин;
- аденозин, неостигмин.
Докладчик заметил, что препараты второй группы очень активно применяются во врачебной практике.
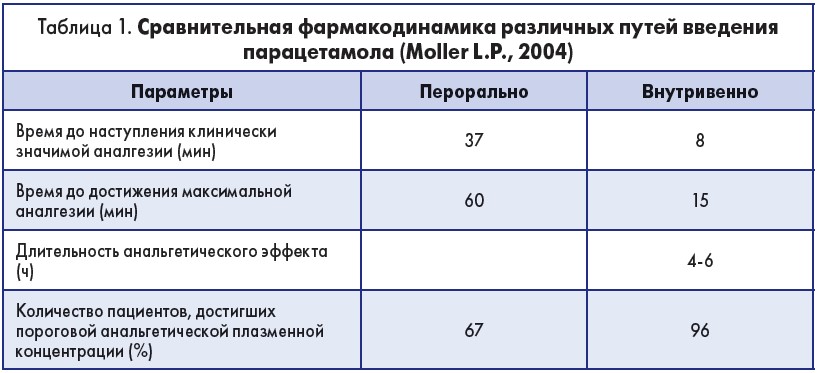
Он напомнил, что, согласно рекомендациям Американского общества анестезиологов (ASA), при любой возможности необходимо использовать многокомпонентный подход к лечению боли. Базовая аналгезия наилучшим образом достигается внутривенным введением парацетамола, поскольку пероральный прием не подходит для периоперационного обезболивания.
Согласно выводам Кокрановского обзора, парацетамол является эффективным анальгетиком для лечения острой боли с частотой побочных действий, сравнимой с плацебо (уровень доказательности 1). При комбинированном применении неселективных НПВП и парацетамола улучшается аналгезия в сравнении с изолированным назначением препаратов (уровень доказательности 1), особенно ибупрофена в комбинации с парацетамолом (уровень доказательности 1).
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) в ноябре 2010 года подтвердило безопасность внутривенного введения парацетамола в полимодальных протоколах для лечения лихорадки и сильной боли как в комбинации с опиатами, так и в качестве монотерапии для лечения слабой и средней боли.
Парацетамол имеет достаточный уровень безопасности даже при умеренной дисфункции печени. При нарушении гломерулярной функции безопасно назначать до 4 г парацетамола внутривенно. Использование парацетамола в периоперационном периоде позволяет снизить суммарное потребление фентанила без потери качества аналгезирующего действия (табл. 1).
Парацетамол – это препарат выбора в послеоперационном периоде для всех пациентов, которые не получают местные анестетики (Van Aken H., 1995).
Появление на рынке дексмедетомидина докладчик выделил как важнейшую инновацию. Этот препарат относится к новому поколению α2-адреномиметиков. Он применим как для седации, так и для периоперационной помощи.
Области клинического применения дексмедетомидина (Shagurta N., Epum O., 2014):
- премедикация;
- седация в ОИТ;
- процедурная седация;
- адъювант при локорегионарной анестезии;
- внутрисуставное использование;
- контролируемая гипотензия;
- снижение ответа на интубацию и экстубацию;
- сберегающий эффект для анестетиков;
- стабилизация сердечно-сосудистой системы (профилактика и лечение аритмий);
- кардиохирургия (снижение легочной гипертензии);
- нейрохирургия (профилактика повышения внутричерепного давления, нейропротекция).
Данные последнего метаанализа свидетельствуют об одинаковой эффективности дексмедетомидина с нагрузочной дозой и без нее.
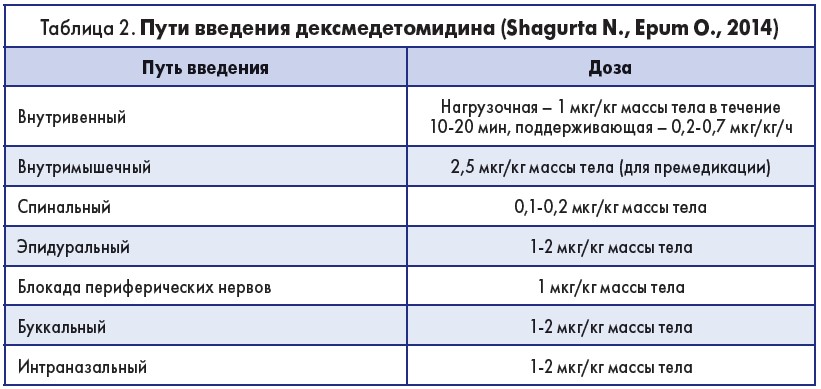
Касательно интраоперационного применения дексмедетомидина спикер отметил следующее. Введение препарата во время вмешательства снижает потребление опиоидов во время и после операции, уменьшает интенсивность послеоперационной боли, а также частоту тошноты и рвоты (Minerva Anestesiologica, 2015). Способы введения дексмедетомидина приведены в табл. 2.
Спикер поделился результатами исследований, проведенных на базе Днепропетровской городской больницы № 8. Врач со своей командой проводил оценку эффективности изолированного и комбинированного назначения внутривенного парацетамола (Инфулгана) и дексмедетомидина при риносептопластике. Учитывая, что ЛОР-операции являются тяжелыми ноцицептивными вмешательствами, они требуют наилучшего уровня защиты от операционного стресса. При условии введения дексмедетомидина обеспечивался должный контроль интенсивности боли, гликемии и частоты сердечных сокращений. При этом, по оценке со стороны хирурга, было отмечено уменьшение объема интраоперационной кровопотери.
Исходя из своей практики, докладчик отметил, что точек приложения для дексмедетомидина в предоперационной помощи больше, чем в интенсивной терапии – например, как монопрепарата для интубации в сознании.
.jpg) В секции, посвященной новым аспектам анестезии и интенсивной терапии, был представлен еще один доклад – «Место α‑2-агонистов в аналгезии и седации». С ним выступил заведующий научно-исследовательским отделением анестезиологии и интенсивной терапии ГУ «Национальный институт рака» (г. Киев), доктор медицинских наук Иван Иванович Лесной.
В секции, посвященной новым аспектам анестезии и интенсивной терапии, был представлен еще один доклад – «Место α‑2-агонистов в аналгезии и седации». С ним выступил заведующий научно-исследовательским отделением анестезиологии и интенсивной терапии ГУ «Национальный институт рака» (г. Киев), доктор медицинских наук Иван Иванович Лесной.
Что известно о группе α‑2-агонистов? Они обладают анальгетическим, седативным и симпатолитическим эффектами. Также α‑2-агонисты проявляют анальгетическое действие в отношении острой, нейропатической и раковой боли при спинальном и эпидуральном введении. При этом их анальгетический эффект при эпидуральном введении в 5 раз сильнее, чем при системном (Asano T., Dohl S. et al., Anesthesia & Analgesia, 2000). Исходя из этого α‑2 агонисты могут быть включены как компонент в мультимодальную аналгезию.
В Украине известны два препарата группы α‑2-агонистов, которые используются для анестезии: клофелин (клонидин) и дексмедетомидин, который появился на фармацевтическом рынке сравнительно недавно. Анальгетический эффект дексмедетомидина значительно превосходит таковой клонидина, поскольку имеет сродство с α‑2-адренорецепторами.
Какова роль α‑2-агонистов в периоперационном обезболивании? Докладчик отметил, что интраоперационная инфузия дексмедетомидина значительно снижает потребность в опиоидах по сравнению с плацебо (Gurbet et al., 2006, уровень доказательности 2). Комбинация дексмедетомидина с морфином приводила к лучшему обезболиванию, более низкой частоте возникновения тошноты и значительному опиоидсберегающему эффекту (Lin et al., 2009, уровень доказательности 2). Это немаловажно в современной стратегии опиоидсберегающих техник при проведении анестезии.
Препарат дексмедетомидин используется в практике врача-анестезиолога и в ОИТ. В British Journal of Anaesthesia (2017) был опубликован систематический обзор и метаанализ РКИ. Доказательная база содержала 32 РКИ с включением 2007 пациентов (Vorobeichik L., Brull R.). Дексмедетомидин применялся периневрально для улучшения качества блокады плечевого сплетения. Анализ выявил следующие преимущества использования дексмедетомидина:
- пролонгация сенсорного блока на 57% (р=0,0001);
- пролонгация моторного блока на 58% (р=0,0001);
- пролонгация и улучшение качества аналгезии на 63% (р=0,0001);
- ускорение начала сенсорного/моторного блока на 40 и 39% (р=0,0001);
- сокращение потребления морфина на 10,2 мг (р=0,0001);
- повышение удовлетворенности пациента качеством обезболивания.
Отмечено, что в дозе 50-60 мкг дексмедетомидин пролонгировал сенсорный блок без гемодинамических нарушений.
В другой работе по изучению применения дексмедетомидина как компонента мультимодальной аналгезии при межлестничном блоке (Abdallah F.W., 2016) содержится вывод, что продолжительность аналгезии при периневральном введении препарата была дольше, чем при внутривенном, и намного дольше, чем в контрольной группе.
При изучении действия дексмедетомидина при операциях по замене сердечных клапанов (Wang Zh., Chen Q., «Экспериментальная и терапевтическая медицина», 2017) были сделаны выводы о том, что дексмедетомидин сохраняет периоперационную стабильность гемодинамики у пациентов, перенесших замену клапанов сердца, уменьшает повреждение миокарда и головного мозга, способствует лучшему отдаленному прогнозу (р<0,001).
Автор доклада поделился результатами собственной исследовательской работы, проведенной на базе Национального института рака («Клиническая онкология», 2015), где дексмедетомидин использовался внутривенно при низкоопиоидной анестезии во время проведения колоректальных операций в онкохирургии.
Одна группа пациентов на фоне комбинации «ропивакаин + фентанил» получала дексмедетомидин в дозе 1 мкг/кг болюсно, в дальнейшем в ходе операции использовалась продленная инфузия препарата в дозе 0,6 мкг/кг/ч. Другая группа не получала дексмедетомидин. Результаты исследования выявили, что в группе, получавшей внутривенную продленную инфузию дексмедетомидина, наблюдалось уменьшение потребности в дозе фентанила в 5 раз.
Доклиническое исследование «Антиноцицептивная аналгезия и патогистологический эффект интратекального введения дексмедетомидина у крыс» (Elsevier, 2015) доказало, что препарат не обладает нейротоксическим действием. Таким образом, можно сделать вывод, что эпидуральное применение дексмедетомидина безопасно.
Дексмедетомидин применяется как для короткой, так и для длительной седации. Проведенные двойные слепые многоцентровые исследования DEX 1, MIDEX и PRODEX показали, что этот препарат является идеальным средством выбора для аналгоседации у терапевтических и хирургических пациентов.
Эффект дексмедетомидина проявляется дозозависимым снижением тонуса центральной нервной системы и двигательной активности. А анестетический и аналгезирующий эффекты препарата опосредованы преимущественно адренорецепторами подтипа α‑2А.
Дексмедетомидин показал преимущества по сравнению с другими препаратами для седации. Например, он сокращает продолжительность искусственной вентиляции легких по сравнению с мидазоламом или пропофолом. Также во время седации, обеспечиваемой дексмедетомидином, способность пациентов сообщать об ощущаемой ими боли превосходит таковую при использовании мидазолама или пропофола. Анестезия дексмедетомидином имеет схожий эффект с естественным NREM-сном. Кроме того, испытуемые в состоянии легкой или умеренной седации, вызванной этим лекарственным средством, реагируют на голосовую стимуляцию и способны общаться и взаимодействовать с персоналом ОИТ.
Подводя итоги, докладчик отметил, что дексмедетомидин – это компонент мультимодальной анестезии и аналгезии, обладающий опиоидсберегающим эффектом. Препарат безопасен и эффективен как адъювант при периферических блокадах и нейроаксиальной аналгезии. Дексмедетомидин – оптимальный препарат для аналгоседации.
Подготовила Елена Марченко
Тематичний номер «Хірургія, Ортопедія, Травматологія, Інтенсивна терапія» № 2 (36), травень 2019 р.