11 вересня, 2019
Инфаркт миокарда без обструктивного поражения коронарных артерий (MINOCA)
Современные исследователи рассматривают MINOCA (myocardial infarction with non-obstructive coronary arteries) как загадку, диагноз, объединяющий множество причин, приведших к необратимой ишемии миокарда с последующим некрозом [2, 10]. Опубликованный недавно обзор 28 тщательно подобранных исследований, включавших 176 052 случая острого инфаркта миокарда (ОИМ) с данными коронароангиографии (КАГ) острого периода, и проведенный авторами метаанализ [2] позволили заключить, что распространенность MINOCA в среднем составляет 6% (хотя в крупном исследовании B. Linhdall et al. 2017 г. указывается 9%), средний возраст пациентов – 55 лет, 40% из них – женщины. В сравнении с ОИМ на фоне обструктивной ишемической болезни сердца (ИБС) среди больных MINOCA больше женщин, реже констатируются атерогенные дислипидемии с одинаковой частотой иных факторов риска. Смертность на протяжении года при MINOCA составляет 4,7% (4-6,9%), что меньше, чем при классическом ОИМ (6,7%), однако это не позволяет считать прогноз благоприятным. Качественная оценка 46 публикаций, посвященных патофизиологическим механизмам возникновения MINOCA [2], показала, что наличие классического очага инфаркта в миокарде при исследовании с использованием ядерно-магнитного резонанса определяется только у 24% пациентов, миокардит – у 33%, а в 26% случаев заболевание протекает без существенных изменений в миокарде. У 27% больных был индуцирован спазм коронарных артерий (КА); достаточно часто выявляются различные факторы тромбофилии (14%).
Клинический случай № 1
На консультативном приеме – пациентка Л., 40 лет, после повторного Q-ИМ (31.10.2016; 17.02.2017), осложненного фибрилляцией желудочков, кардиогенным шоком, успешной реанимацией (31.10.2016), рецидивом ИМ (12.11.2016; 17.11.2016). Была проведена диагностическая КАГ (17.02.2017; 06.03.2017) для уточнения этиологии заболевания и определения дальнейшей диагностической и лечебной тактики.
На момент осмотра жалоб нет, но очень тревожна, испугана, депрессивна. Заболевание связывает со значительным ухудшением семейных отношений и своей эмоциональной сверхчувствительностью. Описывает классическую ангинозною картину всех приступов, послуживших причиной госпитализации и установки диагноза ОИМ, а также стабилизацию состояния на фоне лечения в стационаре, но возобновления приступов во время волнения, хотя и не таких интенсивных.
Из анамнеза жизни известно, что отец умер внезапно в 40 лет от ИМ, вызванного эмоциональным стрессом. Родная сестра больной, страдавшая артериальной гипертензией (АГ), также умерла внезапно от ИМ на фоне очередного ангинозного приступа. На протяжении многих лет страдает аспириновой астмой (диагноз установлен специалистом, присутствует аспириновая триада). По этой причине 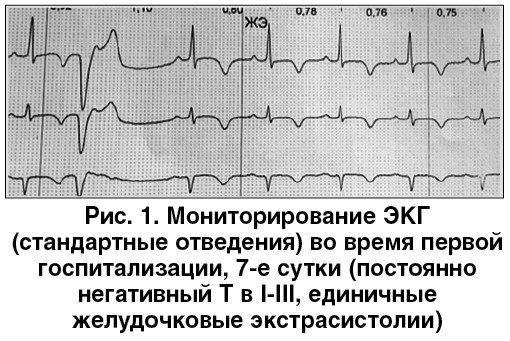 постоянно принимает сальметерол, увеличивая дозы во время приступов из-за появления одышки наряду с болью. В периоды лечения ОИМ в стационаре прием сальметерола не прекращался. На данный момент постоянно принимает небиволол, ивабрадин, эплеренон, лерканидипин, клопидогрель, аторвастатин.
постоянно принимает сальметерол, увеличивая дозы во время приступов из-за появления одышки наряду с болью. В периоды лечения ОИМ в стационаре прием сальметерола не прекращался. На данный момент постоянно принимает небиволол, ивабрадин, эплеренон, лерканидипин, клопидогрель, аторвастатин.
Физикальные данные без особенностей, артериальное давление (АД) – 110/79 мм рт. ст., частота сердечных сокращений (ЧСС) – 64 уд./мин. Выраженный красный дермографизм (20 с – 3 мин).
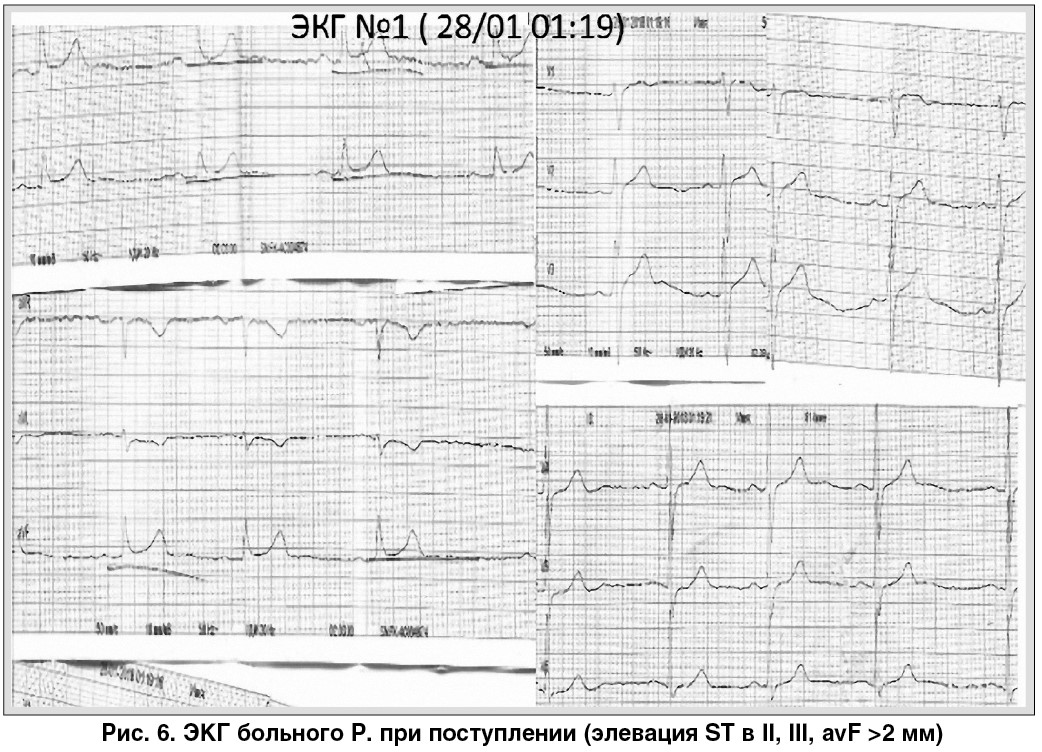
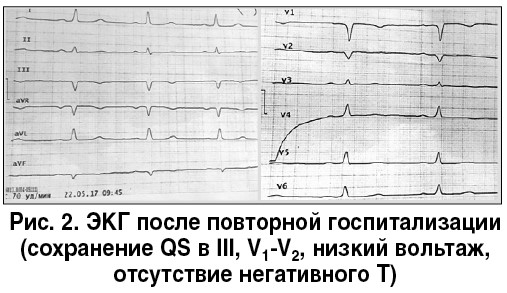
Электрокардиография (ЭКГ) согласно описанию в документах (рис. 1, 2). Очаговые изменения нижней стенки, ишемия передней стенки левого желудочка (ЛЖ).
 Эхокардиография (ЭхоКГ) в динамике. 02.02.2017: Фракция выброса (ФВ) ЛЖ – 79%; умеренная гипокинезия задненижних отделов ЛЖ, открытое овальное окно, дополнительная хорда ЛЖ, умеренная регургитация на митральном и трикуспидальном клапанах, систолическое давление в легочной артерии (ЛА) – 37 мм рт. ст.; 17.02.2017 – в реанимации: гипокинезия средневерхушечного отдела межжелудочковой перегородки (МЖП) и верхушки ЛЖ, организованный тромб верхушки ЛЖ; 09.03.2017: ФВ ЛЖ –
Эхокардиография (ЭхоКГ) в динамике. 02.02.2017: Фракция выброса (ФВ) ЛЖ – 79%; умеренная гипокинезия задненижних отделов ЛЖ, открытое овальное окно, дополнительная хорда ЛЖ, умеренная регургитация на митральном и трикуспидальном клапанах, систолическое давление в легочной артерии (ЛА) – 37 мм рт. ст.; 17.02.2017 – в реанимации: гипокинезия средневерхушечного отдела межжелудочковой перегородки (МЖП) и верхушки ЛЖ, организованный тромб верхушки ЛЖ; 09.03.2017: ФВ ЛЖ – 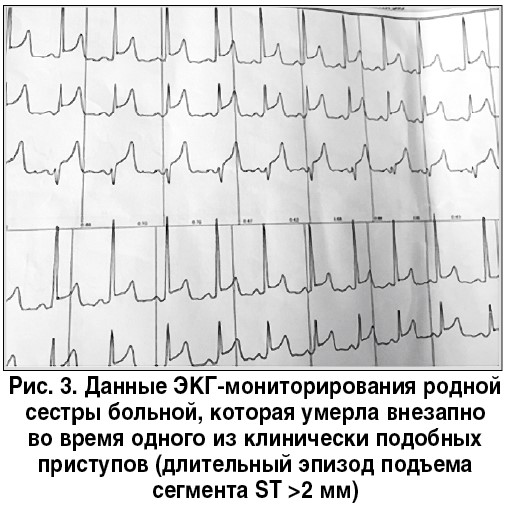 71%, движение МЖП обычное, нормальная геометрия ЛЖ, сократительная функция миокарда удовлетворительная, сегментарного снижения систолической функции при тканевой доплерографии не выявлено.
71%, движение МЖП обычное, нормальная геометрия ЛЖ, сократительная функция миокарда удовлетворительная, сегментарного снижения систолической функции при тканевой доплерографии не выявлено.
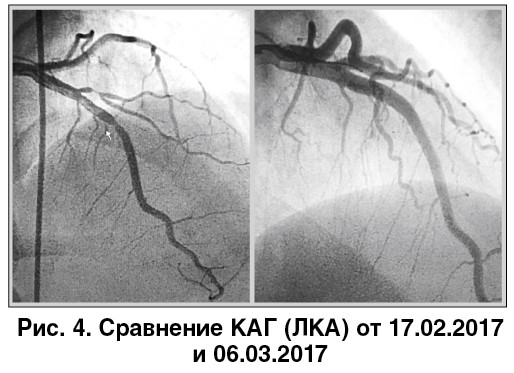
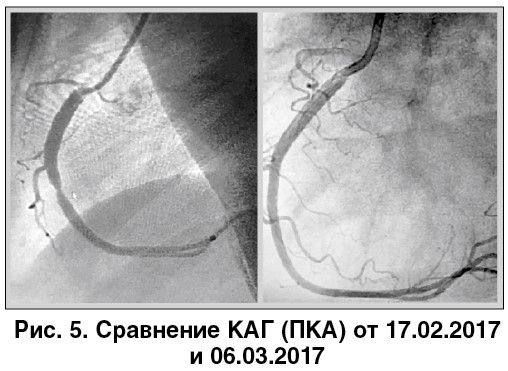
КАГ на фоне постоянной терапии сальметеролом (рис. 3, 4). 17.02.2017: стеноз диагональной ветви левой коронарной артерии (ЛКА) – 95%; средний отдел правой коронарной артерии (ПКА) – 75%; средний отдел передней нисходящей артерии – 75%; коллатералей нет. 06.03.2017: гемодинамических изменений нет. Сравнение обеих КАГ свидетельствует о значительном стойком спазме КА.
Биохимический анализ крови. Уровень общего холестерина в динамике не превышал 4,0 ммоль/л (2,7-4,0), при поступлении в стационар – дважды повышение уровня креатинфосфокиназы-МВ (КФК-МВ) до 35% от КФК, рутинная коагулограмма – без особенностей.
 Общий анализ крови. В динамике – незначительная гипохромная анемия.
Общий анализ крови. В динамике – незначительная гипохромная анемия.
Таким образом, мы могли констатировать наличие следующих диагностических критериев [1]:
- значительная эмоциональная лабильность, тревожность, типичные ангинозные приступы с негативным зубцом Т на ЭКГ в динамике;
- повышение КФК-МВ;
- преходящая апикальная и в средней порции МЖП гипокинезия ЛЖ, которая является основным диагностическим критерием кардиомиопатии Такоцубо согласно консенсусу 2018 г. (таблица);
- стойкий многососудистый вазоспазм.
На основании перечисленных критериев заподозрена кардиомиопатия Такоцубо на фоне аспириновой астмы с полным контролем приступов при постоянном приеме комбинированного препарата с включением пролонгированных β-агонистов.
Учитывая молодой возраст больной, семейный анамнез внезапных смертей от ОИМ, рекомендовано найти и оценить данные документов отца и сестры, а также провести скрининг тромбофилии для окончательного подтверждения диагноза кардиомиопатии Такоцубо. Рекомендовано избегать приема β-агонистов и перейти на контроль приступов астмы с помощью исключительно ингаляционных глюкокортикостероидов. Для снижения тревожности и устранения нарушений сна назначены фабомотизол и агомелатин.
 Повторная консультация. В документах сестры (пациентка Р., 38 лет) выявлены многочисленные эпизоды подъема сегмента ST при мониторинге ЭКГ (рис. 5), которые непосредственно предшествовали фатальному ангинозному приступу, а также описание ЭхоКГ (ФВ ЛЖ – 68%).
Повторная консультация. В документах сестры (пациентка Р., 38 лет) выявлены многочисленные эпизоды подъема сегмента ST при мониторинге ЭКГ (рис. 5), которые непосредственно предшествовали фатальному ангинозному приступу, а также описание ЭхоКГ (ФВ ЛЖ – 68%).
Результаты исследований генетических полиморфизмов, определяющих индивидуальную склонность к тромбофилии и тромбозам (30.05.2017). Не выявлено повышения уровней антифосфолипидных антител (IgG – 1,44; IgM – 4,87 Ед/л); определяется нормальный уровень волчаночного антикоагулянта в скрининговом и подтверждающем тестах; отсутствуют мутации в генах F2 протромбина, факторов V, VII, тромбоцитарного гликопротеина 1b; выявлены гетерозиготные мутации в генах фибриногена и серпина (РАІ‑1) и тромбоцитарного рецептора фибриногена (ITG3-β интегрин). Наличия этих гетерозиготных мутаций недостаточно для развития ОИМ с тяжелым течением, но их сочетание с кардиомиопатией Такоцубо является одним из возможных объяснений тяжести заболевания.
Комментарий
Среди мутаций, ассоциированных с кардиомиопатией Такоцубо [2], – активность фактора Лейдена (в популяции – 3-7%, при ОИМ – 7%, при MINOCA – 12%), дефицит протеинов С и S (0,1-1% – в популяции и 2,6% – при ОИМ и MINOCA).
В консенсусе 2018 г. по кардиомиопатии Такоцубо имеются указания на генетически связанные случаи кардиомиопатии по линии мать – дочь и родные сестры, что имеет место в нашем случае [1]. Как полагают, это связано с полиморфизмом адренергических генов, что, соответственно, нарушает функцию рецепторов и нисходящие пути сигналов активации, а также с тем, что изменение β2-рецепторов может вести к усиленному выделению тропонина.
Однако в контексте нашего клинического примера особый интерес представляют описания случаев развития кардиомиопатии Такоцубо, связанные с наличием легочной патологии (наиболее часто – хроническое обструктивное заболевание легких [ХОЗЛ], бронхиальная астма [БА]) и их лечением агонистами β2-адренорецепторов. Так, в недавнем обзоре этой проблемы подчеркивается, что установленным фактом является достаточно частое, но клинически недооцененное сочетание обострения ХОЗЛ, БА с развитием кардиомиопатии Такоцубо [3]. Последняя характеризуется клинической гетерогенностью, и в данном обзоре, а также в описаниях иных отдельных клинических случаев [4-7] подчеркиваются особенности клинических проявлений подгруппы кардиомиопатии, которая связана с наличием ХОЗЛ и БА, – «коварное» преобладание в клинической картине одышки и отсутствие боли в груди. Эти особенности приводят к тому, что одышка расценивается как следствие бронхоспазма, а это обусловливает прием высоких доз β-агонистов, усиливающих ишемию миокарда. Решение проблемы авторы видят в мониторинге ЭКГ в каждом случае длительного обострения ХОЗЛ и считают целесообразным выделение отдельной новой бронхогенной группы кардиомиопатии Такоцубо [3]. Экспериментальные данные свидетельствуют о парадоксальном негативном инотропном ответе на большие дозы адреналина, который реализуется через лиганд-опосредованный трансфер β2-адренергических рецепторов, со стимулирующего G-белка на субклеточные сигнальные пути, ингибирующие G-белок [8]. Важность этого факта для клинической практики уже подтверждена официально в очередном переиздании монографии о побочном действии лекарственных средств [14]. Следует отметить, что курильщики во всех случаях сочетания кардиомиопатии Такоцубо и ХОЗЛ практически не встречались, что исключает прямое воздействие никотина на патогенез. Не найдено и весомого подтверждения связи с использованием ипратропия бромида [9].
Таким образом, установление причины MINOCA является важным с точки зрения избегания длительной и неадекватной последующей терапии [11]. Исходя из рекомендаций Европейского общества кардиологов (ESC, 2017), MINOCA может быть и ОИМ 1-го типа, но значительно чаще констатируется ОИМ 2-го типа. Что касается определения последнего, то не утихают дискуссии относительно его лучшего клинического понимания и диагностического определения [12]. Так, McCarthy et al. (2018) анализируют результаты исследования (NCT03338504), включавшего только больных ОИМ 2-го типа, и определяют его как ишемический некроз миокарда в отсутствие тромбоза КА [12]. Авторы указывают, что в настоящее время этот тип ИМ является даже преобладающим (64%), ссылаясь на данные систематического определения уровней тропонина по неотложным показаниям в регистре UTROPIA, а также отмечают улучшение ситуации с официальной верификацией диагноза после его включения в октябре 2017 г. в Международную классификацию болезней с присвоением отдельного кода. Важность проблемы исследователи обоснованно усматривают в преобладании среди лиц с ОИМ 2-го типа пожилых пациентов с хронической ИБС и серьезными коморбидностями, а также акцентируют внимание на отсутствии рекомендаций по ведению данной субпопуляции больных с ОИМ, которые основывались бы на убедительных доказательных данных и необходимости рассмотрения иных, возможно, более адекватных методов лечения, чем классический подход к терапии и вторичной профилактике ОИМ 1-го типа.
Клинический случай № 2
Пациент Р., 18 лет, поступил 28.01.2018 в 2:50 во II инфарктное отделение Днепропетровского клинического объединения скорой медицинской помощи (ДКОСМП) с диагнозом «ОКС?». Жалобы на тяжесть, жжение за грудиной с иррадиацией в левую лопатку, купирующиеся нитратами в течение 5 мин, но возобновляющиеся.
Анамнез. Болевой приступ возник в 1:30 (за 80 мин до поступления) после «стрессовой» ситуации; был доставлен в Областную клиническую больницу им. И.И. Мечникова, проведена ЭКГ, тропониновый тест при поступлении в ДКОСМП отрицательный (<50 нг/мл). Состояние средней степени тяжести. Кожные покровы – обычной окраски. Дыхательная система – без особенностей, хрипов нет, частота дыхательных движений (ЧДД) – 18/мин. Сердечно-сосудистая система – без особенностей, АД – 120/80 мм рт. ст., ЧСС – 82/мин, тоны громкие. Система органов пищеварения – без особенностей. Мочевыделительная система – без особенностей.
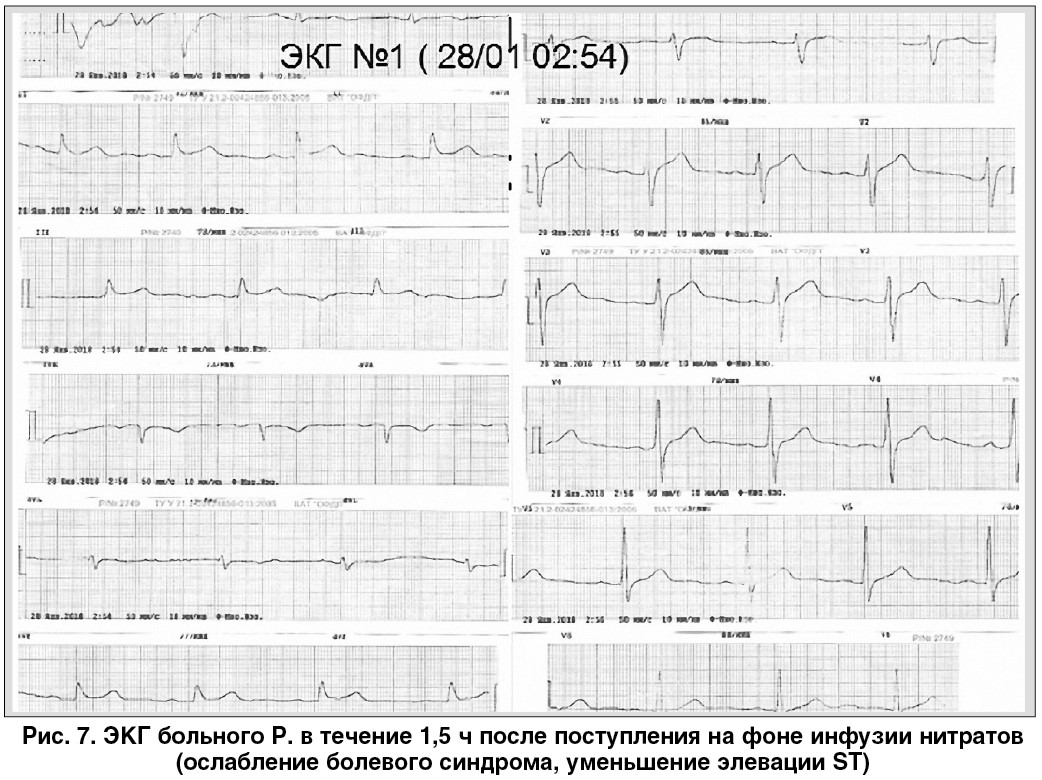
ЭКГ в динамике. При поступлении (рис. 6): ритм синусовый, элевация сегмента ST в II, III; avF >2 мм. 28.01.2018 в 02:54 (рис. 7): элевация сегмента ST в II, III; в avF – снизилась.
Общий анализ крови. Hb – 152 г/л, эритроциты – 4,7×1012/л, цветовой показатель (ЦП) – 0,97, Ht – 48%, тромбоциты – 352,5×109/л, лейкоциты – 12,7×109/л, СОЭ – 5 мм/ч; палочкоядерные – 10%, сегментоядерные – 63%, лимфоциты – 8%, моноциты – 19%.
Дополнительные данные при поступлении. Общий анализ мочи – без особенностей; тест на тропонин Т – отрицательный (<50 нг/мл); глюкоза – 4,0 мМ/л; креатинин – 98 мМ/л; скорость клубочковой фильтрации по CKD-EPI – 96,6 мл/мин/1,73 м2; общий холестерин – 3,2 ммоль/л; общий билирубин – 19,2 мМ/л; АСТ – 0,27 ммоль/л/ч; АЛТ – 0,22 ммоль/л/ч. Коагулограмма: протромбиновое время – 16 с, протромбиновый индекс – 112%, фибрин – 19 мг, фибриноген – 4,75 г/л.
Назначена стандартная терапия: ацетилсалициловая кислота (АСК) – 100 мг; клопидогрель – 75 мг; метопролол – 25 мг однократно, затем бисопролол – 5 мг/cут; нитраты, низкомолекулярный гепарин.
Течение заболевания. На протяжении суток беспокоят ангинозные боли, купирующиеся нитратами, и одышка, по поводу которой больной продолжает пользоваться собственным ингалятором сальбутамола. Сохраняется тахикардия: ЧСС – 80-88 уд./мин. АД – в пределах 120-140/80-90 мм рт. ст. При аускультации легких хрипов нет.
Дополнение к анамнезу. Страдает БА. Имела место «стрессовая» ситуация: курил марихуану в закрытой комнате вместе с еще пятью курильщиками. Стало трудно дышать, воспользовался своим ингалятором с короткодействующим β2-агонистом. Обычно приступы БА редкие, ранее препарат всегда помогал, однако в этот раз улучшения не наступило.
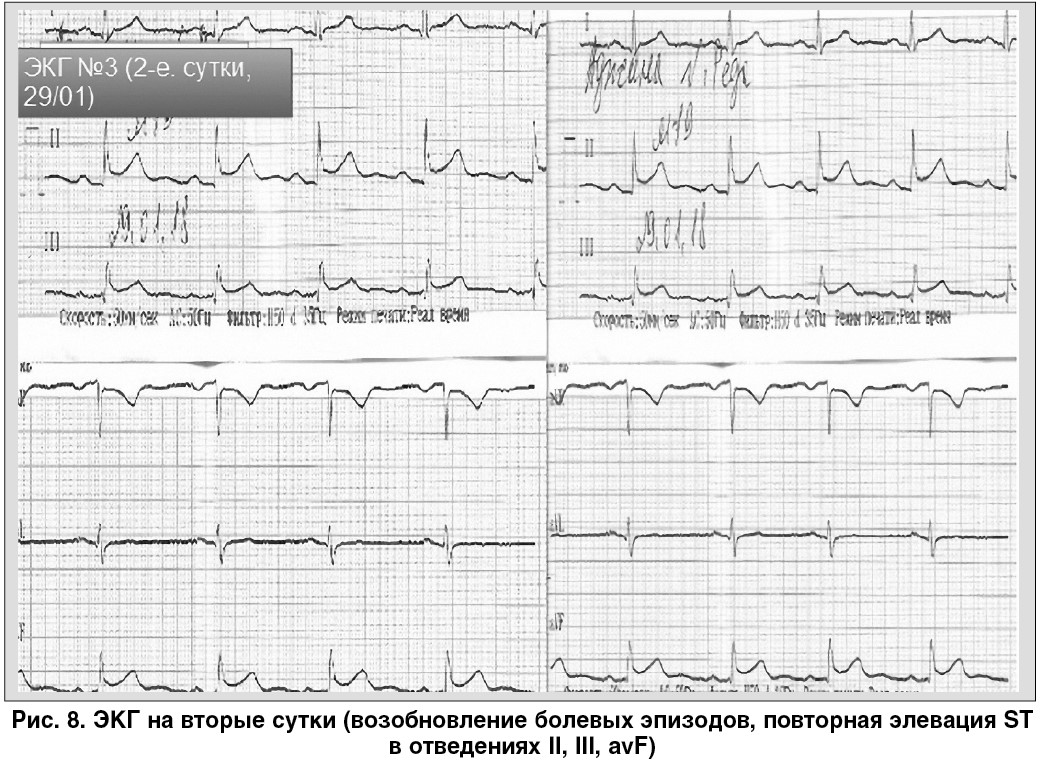
Учитывая сохраняющийся болевой синдром, данные анамнеза и повторный подъем сегмента ST в II, III, avF (рис. 8), принято решение о дополнительном обследовании.
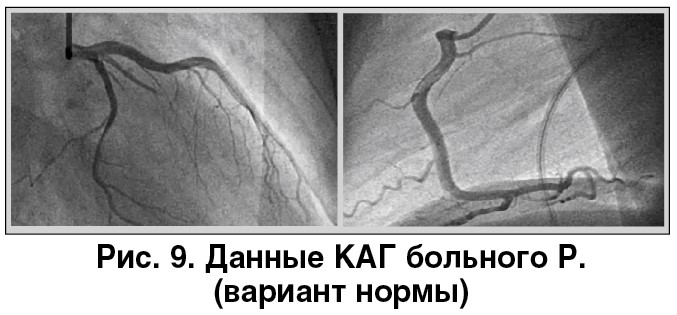 Результаты обследования 29.01.2018. Тропонин Т повторно – 1512 нг/мл. ЭхоКГ: дилатация правого предсердия, сократительная функция миокарда не нарушена, ФВ ЛЖ – 60%. Баллонирования верхушки ЛЖ, дискинезии отделов миокарда не выявлено. КАГ: преобладающий тип кровоснабжения – правый; гемодинамических изменений, спазма КА в течение процедуры не выявлено (рис. 9).
Результаты обследования 29.01.2018. Тропонин Т повторно – 1512 нг/мл. ЭхоКГ: дилатация правого предсердия, сократительная функция миокарда не нарушена, ФВ ЛЖ – 60%. Баллонирования верхушки ЛЖ, дискинезии отделов миокарда не выявлено. КАГ: преобладающий тип кровоснабжения – правый; гемодинамических изменений, спазма КА в течение процедуры не выявлено (рис. 9).
Диагноз. STEMI, MINOCA с вовлечением нижних отделов ЛЖ токсического генеза (курение марихуаны).
Последующая терапия. Провели беседу о смертельной опасности вредных привычек, отменили АСК, запретили β-агонисты длительного действия (применение только по требованию). Необходимо решить вопрос с пульмонологом о назначении монтелукаста для контроля астмы. Продолжает принимать клопидогрель, статин назначен только на острый период, β-блокаторы заменили на антагонист кальция дилтиазем; после снижения АД и появления слабости переведен на ивабрадин в дозе 5 мг два раза в сутки; в госпитальный период – максимальная доза триметазидина с модифицированным высвобождением (в соответствии с исследованием VASCO) с переходом при выписке на стандартные дозировки препарата не менее 6 мес.
Комментарий
Согласно критериям ESC (2017) [11], диагноз MINOCA ставится немедленно после получения данных КАГ при поступлении больного с признаками, характерными для ОИМ, а именно:
- соответствие общепринятым универсальным критериям ОИМ (симптомы ишемии более 20 мин, повышение с последующим снижением уровня тропонина, плюс-минус достоверные признаки ишемии миокарда на ЭКГ);
- отсутствие обструкции КА (без стенозов ≥50% в любой потенциально инфарктзависимой КА);
- отсутствие явных специфических причин возникновения острой ситуации.
При этом не исключается наличие атеросклероза, то есть ОИМ 1-го типа, поскольку тромбоз атеросклеротического происхождения может быть очень динамичен, а наличие эрозии атеросклеротической бляшки, вызвавшей тромбоз без наличия подлежащего стеноза, не фиксируется КАГ [11]. Таким образом, диагноз MINOCA является важным, но рабочим диагнозом, как и ОКС, и требует углубленного обследования и наблюдения за пациентом.
Оба представленных клинических случая больных c MINOCA, по нашему мнению, описывают ОИМ 2-го типа, но при наличии сходных черт заболевания имеют место разные основные патофизиологические механизмы их возникновения. Актуальным остается вопрос длительного ведения данных больных, которое, очевидно, не может строиться по классической схеме. В обоих случаях оправданным является дополнительное назначение препарата с доказанным прямым антиишемическим действием – триметазидина на срок не менее 6 мес (окончание основной реакции иммунной системы и активной репарации в ответ на произошедший некроз миокарда).
Назначение иных препаратов обусловливается нюансами спастической активности КА, наличием аритмий, особенно жизнеугрожающих. В связи с этим сохранены β-блокаторы в терапии первой больной, несмотря на аспириновую астму (бисопролол/небиволол ± ивабрадин в зависимости от аритмий/ЧСС). Во втором случае β-блокаторы немедленно заменены на антагонист кальция (дилтиазем), а затем на ивабрадин, учитывая наличие БА и высокую вероятность спазма, хотя и не индуцированного при КАГ. Кроме того, несмотря на высокий уровень катехоламинов в крови больных кардиомиопатией Такоцубо, β-блокаторы не показали позитивного влияния на прогноз [13]. В первом случае также рационально [13] назначение комбинированной антитромботической терапии (клопидогрель + ривароксабан) на срок не менее 6 мес в связи с непереносимостью АСК, наличием тромбофилии и тромба в ЛЖ. В обоих случаях следует обсудить с пульмонологами недопустимость базисной терапии и необходимость крайней осторожности при использовании ингаляторов с β2-агонистами, особенно длительного действия, в ургентных ситуациях.
Автор приносит благодарность врачам В.А. Борощуку, А.С. Скоромной, Л.А. Щукиной, Е.С. Щукиной за помощь в подготовке клинических данных.
Список литературы находится в редакции.
Спецвипуск «Клінічні випадки та сценарії у невідкладній кардіології», вересень 2019 р