12 вересня, 2019
Синдром «разбитого сердца» – клинический случай
Пациентка П., 70 лет, поступила в отдел реанимации и интенсивной терапии ННЦ «Институт кардиологии имени академика Н.Д. Стражеско» НАМН Украины г. Киева (далее – Институт кардиологии) с жалобами на давящие боли за грудиной, выраженную одышку, слабость. При поступлении артериальное давление (АД) – 135/80 мм рт. ст.; частота сердечных сокращений – 84 уд./мин; сатурация кислорода по данным пульсоксиметрии (без ингаляции кислорода) – 93%. Дополнительные тоны и шумы при аускультации сердца, а также хрипы в легких не выслушивались. В анамнезе – хроническая ишемическая болезнь сердца с сопутствующей артериальной гипертонией (выписка – 2013 г.), резекция желудка по поводу онкозаболевания (2012 г.), частичная резекция щитовидной железы (2006 г.) с последующим приемом гормонозаместительной терапии (последние два года уровень гормонов не контролировался).
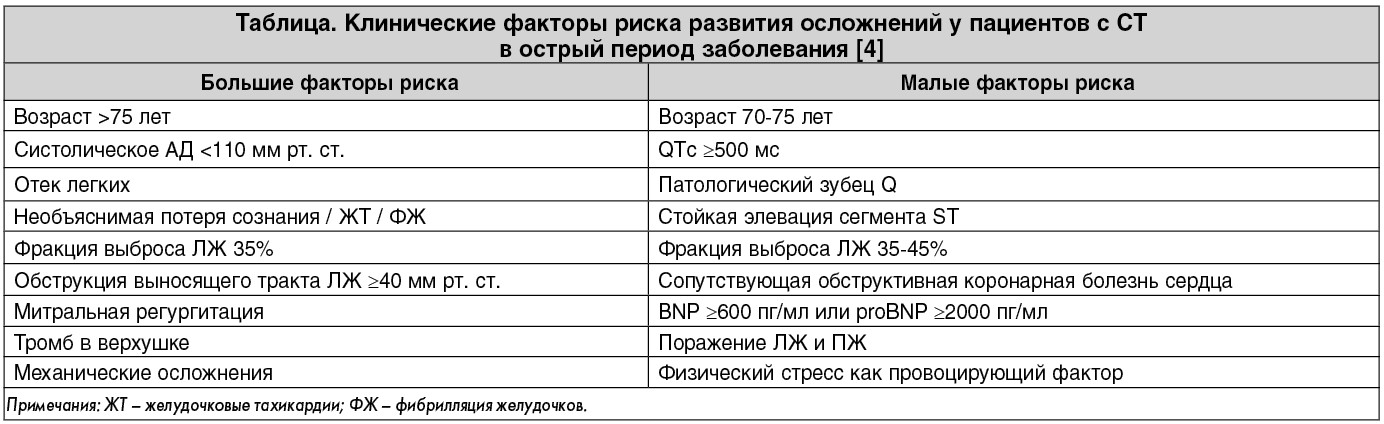
 Боли появились в течение последних 10-14 дней после стрессовой ситуации, носили прогрессирующий характер. За день до поступления отмечался интенсивный приступ боли в грудной клетке длительностью до 1 ч со снижением АД до 60/40 мм рт. ст. Была вызвана карета скорой медицинской помощи (КСП), боль купирована ненаркотическими анальгетиками. На электрокардиограмме (ЭКГ) отмечался подъeм сегмента ST до 0,5 мм в грудных отведениях, что особенно явно при оценке ЭКГ в сравнении с архивными (рис. 1). От госпитализации пациентка отказалась, однако в связи с рецидивированием болевого синдрома на следующее утро обратилась в поликлинику Института кардиологии. При поступлении на ЭКГ отмечались негативные зубцы Т в грудных отведениях (рис. 1). В результатах лабораторных анализов обращало на себя внимание незначительное, но диагностически значимое повышение МВ-фракции креатинфосфокиназы – КФК (26 Ед/л при норме <24 Ед/л) и тропонина Т (0,39 нг/мл при норме <0,1 нг/мл).
Боли появились в течение последних 10-14 дней после стрессовой ситуации, носили прогрессирующий характер. За день до поступления отмечался интенсивный приступ боли в грудной клетке длительностью до 1 ч со снижением АД до 60/40 мм рт. ст. Была вызвана карета скорой медицинской помощи (КСП), боль купирована ненаркотическими анальгетиками. На электрокардиограмме (ЭКГ) отмечался подъeм сегмента ST до 0,5 мм в грудных отведениях, что особенно явно при оценке ЭКГ в сравнении с архивными (рис. 1). От госпитализации пациентка отказалась, однако в связи с рецидивированием болевого синдрома на следующее утро обратилась в поликлинику Института кардиологии. При поступлении на ЭКГ отмечались негативные зубцы Т в грудных отведениях (рис. 1). В результатах лабораторных анализов обращало на себя внимание незначительное, но диагностически значимое повышение МВ-фракции креатинфосфокиназы – КФК (26 Ед/л при норме <24 Ед/л) и тропонина Т (0,39 нг/мл при норме <0,1 нг/мл).
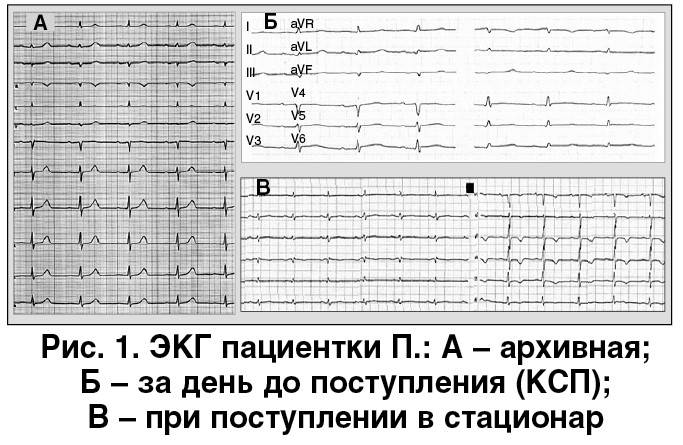
 Для оценки нарушений сегментарной сократимости была проведена эхокардиография (ЭхоКГ), по данным которой отмечалась баллоноподобная дилатация апикальных отделов левого желудочка (ЛЖ) – дискинезия. При этом выраженные нарушения сократительной способности ЛЖ не соответствовали минимальным изменениям на ЭКГ и незначительному повышению уровней кардиоспецифических ферментов. Обращала на себя внимание также существенная митральная регургитация 2-3+ и, как следствие описанных изменений, выраженная вторичная легочная гипертензия (градиент на трехстворчатом клапане – 55 мм рт. ст.). Данные ЭхоКГ представлены на рисунке 2.
Для оценки нарушений сегментарной сократимости была проведена эхокардиография (ЭхоКГ), по данным которой отмечалась баллоноподобная дилатация апикальных отделов левого желудочка (ЛЖ) – дискинезия. При этом выраженные нарушения сократительной способности ЛЖ не соответствовали минимальным изменениям на ЭКГ и незначительному повышению уровней кардиоспецифических ферментов. Обращала на себя внимание также существенная митральная регургитация 2-3+ и, как следствие описанных изменений, выраженная вторичная легочная гипертензия (градиент на трехстворчатом клапане – 55 мм рт. ст.). Данные ЭхоКГ представлены на рисунке 2.
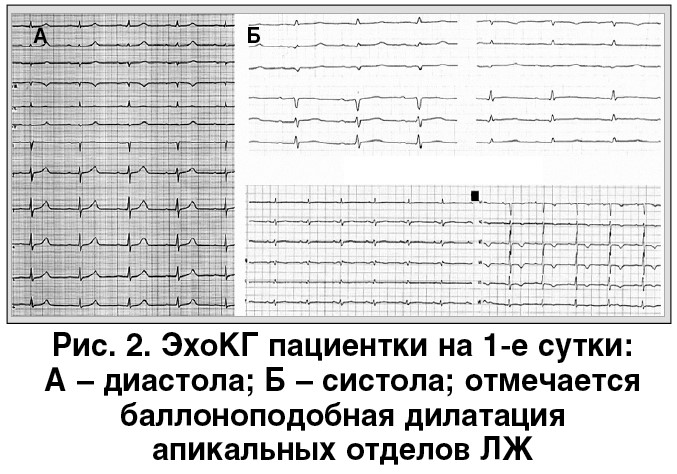
Пациентка П. была госпитализирована с рабочим диагнозом «острый коронарный синдром (ОКС) без стойкой элевации сегмента ST», и в 1-е сутки ее вели по соответствующему алгоритму (протокол Министерства здравоохранения Украины, 2016) [1]. Были назначены двойная антитромбоцитарная терапия, фондапаринукс, статины, а также антиангинальная и гипотензивная терапия (периндоприл, бисопролол, эплеренон, кверцетин, триметазидин в стандартных дозах). Пациентка соответствовала категории высокого риска развития осложнений (повышение уровня тропонина, динамические изменения ЭКГ, 143 балла по шкале GRACE), поэтому ангиография было проведена на следующее утро [1]. Коронаровентрикулография (КВГ) не выявила поражения коронарных артерий, но характерная конфигурация ЛЖ с акинезом и баллоноподобной дилатацией верхушечных сегментов натолкнула на мысль о синдроме такоцубо (СТ) (рис. 3).
СТ – это неотложное состояние, которое по клинической симптоматике имитирует ОКС и часто характеризуется развитием острой сердечной недостаточности (СН) в результате обратимых нарушений сократительной способности сердца. Термин «такоцубо» (от япон. такоцубо – ловушка для осьминога) впервые был введен японским ученым Н. Sаtо et al. в 1990 г.: при выполнении коронароангиографии ЛЖ пациентов по форме напоминал «керамический сосуд с круглым основанием и узким горлышком для ловли осьминогов в море» [2].
Причины СТ на сегодняшний день неизвестны. Среди возможных механизмов нарушения сократимости ЛЖ рассматривают множественный коронарный вазоспазм, микроциркуляторную дисфункцию, катехоламиновое оглушение миокарда. Существенную роль в патогенезе заболевания играют избыточное выделение и изменения чувствительности к катехоламинам [3]. Болеют преимущественно женщины в период постменопаузы (80-90%), средний возраст пациентов, по данным различных исследований, составляет 65-68 лет. Согласно клинической модификации Международной классификации болезней 10-го пересмотра (МКБ‑10-КM), для обозначения этого заболевания предлагается использовать следующие термины: «стрессовая кардиомиопатия», «кардиомиопатия такоцубо» или «синдром такоцубо» (код I51.81). Наиболее полно критерии для диагностики СТ отражены в позиционном документе Ассоциации сердечной недостаточности Европейского общества кардиологов (HFA ESC) [4].
Некоторые из рекомендованных критериев могут быть оценены только ретроспективно (обратимость ЭКГ-изменений и нарушений сократимости ЛЖ). Однако уже на данном этапе диагностического поиска характерные нарушения регионарной сократимости в совокупности с отсутствием значимых изменений в коронарных артериях и несоответствующим объему выявленных нарушений незначительным повышением уровня тропонина свидетельствовали в пользу СТ у нашей пациентки.
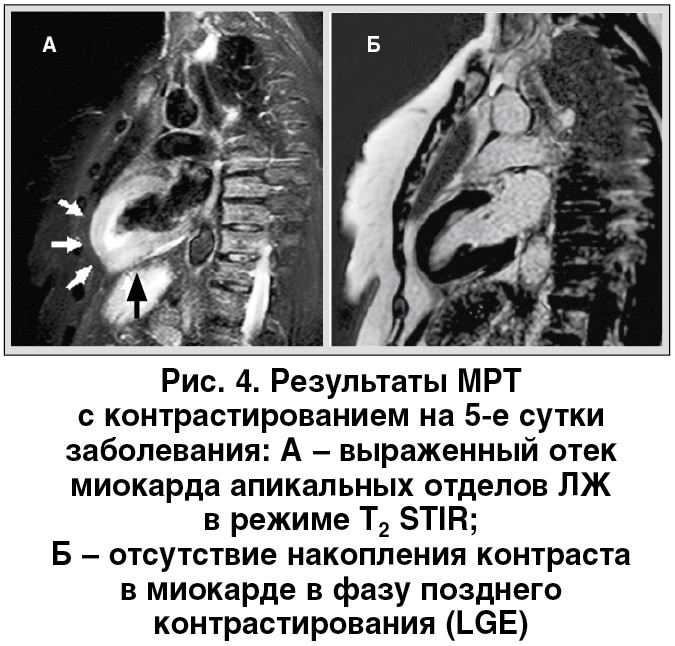 Большое значение для диагностики СТ и исключения острого инфаркта миокарда (ИМ) и острого миокардита имеет магнитно-резонансная томография (МРТ) сердца [5]. Отличительными признаками СТ при проведении МРТ являются регионарные нарушения сократимости, диффузный или трансмуральный отек миокарда (интенсивный сигнал) в Т2-взвешенном режиме, а также отсутствие или слабая задержка гадолиниевого контраста в фазу позднего контрастирования (LGE) [5]. Кардио-МРТ-исследование рекомендуют всем пациентам с подозрением на СТ в острый период (первые семь суток) заболевания. Результаты кардио-МРТ на 5-е сутки заболевания пациентки П. представлены на рисунке 4. По данным кардио-МРТ, у пациентки П. был подтвержден диагноз СТ, в частности апикальный вариант этого заболевания, который является наиболее распространенным и встречается у 75-80% больных.
Большое значение для диагностики СТ и исключения острого инфаркта миокарда (ИМ) и острого миокардита имеет магнитно-резонансная томография (МРТ) сердца [5]. Отличительными признаками СТ при проведении МРТ являются регионарные нарушения сократимости, диффузный или трансмуральный отек миокарда (интенсивный сигнал) в Т2-взвешенном режиме, а также отсутствие или слабая задержка гадолиниевого контраста в фазу позднего контрастирования (LGE) [5]. Кардио-МРТ-исследование рекомендуют всем пациентам с подозрением на СТ в острый период (первые семь суток) заболевания. Результаты кардио-МРТ на 5-е сутки заболевания пациентки П. представлены на рисунке 4. По данным кардио-МРТ, у пациентки П. был подтвержден диагноз СТ, в частности апикальный вариант этого заболевания, который является наиболее распространенным и встречается у 75-80% больных.
Клиническое течение госпитального периода СТ может сопровождаться развитием ряда осложнений. К наиболее частым относят возникновение острой СН, которая наблюдается у 12-45% пациентов. Кардиогенный шок встречается в 6-20% случаев. К частым осложнениям СТ относят также обструкцию выносящего тракта ЛЖ (10-25%), митральную регургитацию (14-25%), аритмические осложнения (фибрилляция предсердий – 5-15%, желудочковые аритмии – 4-9%, брадиаритмии, асистолия – 2-5%) и внутриполостное тромбообразование (2-8%). Описаны редкие случаи (<1%) внутренних и наружного разрывов сердца с гемотампонадой. Вовлечение правого желудочка (ПЖ), по данным кардио-МРТ, наблюдается практически у трети пациентов, однако клинические проявления поражения ПЖ отмечаются значительно реже. Госпитальная летальность при СТ в различных исследованиях колеблется от 1 до 4,5% [6]. Причинами летального исхода часто становятся острая СН, кардиогенный шок и желудочковые аритмии.
HFA ESC были разработаны критерии для оценки риска развития осложнений у пациентов с СТ [4]. Высокий риск осложнений определяется у больных с наличием хотя бы одного большого или двух малых факторов риска (таблица).
Наиболее тяжелой является категория пациентов с развитием явлений кардиогенного шока. У таких больных не рекомендовано использование симпатомиметиков для стабилизации гемодинамики, что может усугубить дисфункцию ЛЖ в условиях предсуществующей гиперсимпатикотонии. Для стабилизации состояния следует применять методы вспомогательного кровообращения и экстракорпоральной мембранной оксигенации, а при их отсутствии – низкодозовую инфузию левосимендана [7]. У пациентов со значимой обструкцией выносящего тракта ЛЖ рекомендовано использовать β-адреноблокаторы, предпочтительно начинать терапию с внутривенного введения препаратов короткого действия. В качестве альтернативы могут применяться агонисты α1-рецепторов некатехоламинового ряда (например, фенилэфрин) [4].
СТ ассоциируется с состоянием гиперкоагуляции, что обусловлено вазоконстрикцией, гиперактивацией тромбоцитов и активацией свертывающей системы крови на фоне гиперкатехоламинемии. Большинство лиц с СТ госпитализируются с рабочим диагнозом ОКС, поэтому на начальном этапе получают двойную антитромбоцитарную терапию и антикоагулянт. В то же время после подтверждения диагноза СТ большинство авторов рекомендуют отменять прием блокаторов P2Y12-рецепторов. Пациентам с внутриполостным тромбообразованием, фибрилляцией предсердий показано продолжать антикоагулянтную терапию. В некоторых случаях (выраженные сегментарные нарушения и синдром спонтанного контрастирования в ЛЖ) может использоваться профилактическое назначение антикоагулянтов [4]. Рекомендовано также применять β-адреноблокаторы и ингибиторы ангиотензинпревращающего фермента (иАПФ), особенно у больных с явлениями острой СН.
Диагностические критерии СТ (HFA ESC)
- Временные, обратимые нарушения регионарной сократимости ЛЖ или ПЖ, которым часто, но не всегда предшествует стрессовый триггер (эмоциональный или физический).
- Региональные нарушения обычноа выходят за бассейн кровоснабжения одной коронарной артерии и часто проявляются циркулярной дисфункцией вовлеченного сегмента ЛЖ.
- Отсутствие причинных изменений в коронарных артериях (в том числе острого повреждения бляшки, формирования внутрикоронарного тромба, диссекции коронарной артерии) или других патологических состояний, которые могли бы объяснить преходящую дисфункцию ЛЖ (например, ГКМП, вирусный миокардит и т.д.).
- Новые преходящие изменения на ЭКГ (элевация сегмента ST, депрессия ST, блокада ЛНПГ, инверсия зубца Т и/или удлинение интервала QTс)б.
- Существенное повышение уровня натрийуретических пептидов (BNP или proBNP).
- Относительно небольшое повышение уровня тропонинов, которое не соотносится с величиной поражения по данным визуализирующих методовв.
- Восстановление функции ЛЖ по данным методов визуализации в динамике наблюдения (3-6 мес)г.
Примечания: ГКМП – гипертрофическая кардиомиопатия; ЛНПГ – блокада левой ножки пучка Гиса. аОписаны случаи острой обратимой дисфункции миокарда в бассейне одной коронарной артерии. б Блокада ЛНПГ может сохраняться после СТ, хотя в таких случаях необходимо исключить другие кардиомиопатии. Инверсия зубца Т или удлинение интервала QT могут наблюдаться в течение недель/месяцев после восстановления функции ЛЖ. в Описаны тропонин-негативные случаи, хотя они встречаются редко. г Описаны минимальные повреждения (инфаркты) миокарда в зоне дисфункции ЛЖ.
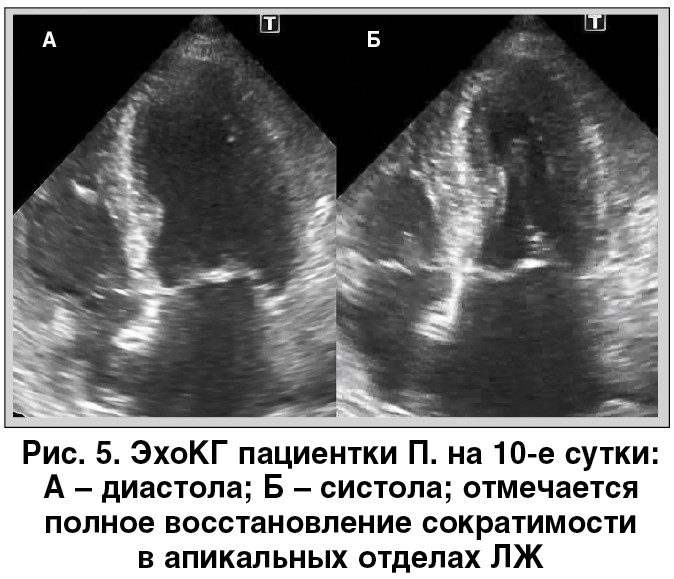 В нашем случае пациентка П. может быть отнесена к категории высокого риска развития осложнений (один большой фактор – митральная регургитация до 3+ и два малых фактора – возраст и удлинение QTc). После постановки диагноза СТ она продолжила принимать β-блокаторы, иАПФ, а также один антитромбоцитарный препарат (клопидогрель – с учетом гастроэнтерологического анамнеза). Антикоагулянтная терапия была отменена на 4-е сутки заболевания после постановки диагноза и расширения двигательного режима. На фоне терапии наблюдалось постепенное снижение уровней тропонина и КФК, а также улучшение регионарной сократимости ЛЖ по данным ЭхоКГ с полной нормализацией на 10-е сутки, что укрепило уверенность в диагнозе (рис. 5).
В нашем случае пациентка П. может быть отнесена к категории высокого риска развития осложнений (один большой фактор – митральная регургитация до 3+ и два малых фактора – возраст и удлинение QTc). После постановки диагноза СТ она продолжила принимать β-блокаторы, иАПФ, а также один антитромбоцитарный препарат (клопидогрель – с учетом гастроэнтерологического анамнеза). Антикоагулянтная терапия была отменена на 4-е сутки заболевания после постановки диагноза и расширения двигательного режима. На фоне терапии наблюдалось постепенное снижение уровней тропонина и КФК, а также улучшение регионарной сократимости ЛЖ по данным ЭхоКГ с полной нормализацией на 10-е сутки, что укрепило уверенность в диагнозе (рис. 5).
ЭКГ при выписке из стационара представлена на рисунке 6. Обращает внимание отсутствие четкой локализации изменений на ЭКГ (глубокие отрицательные зубцы Т определяются практически во всех отведениях) и характерное удлинение интервала QTc.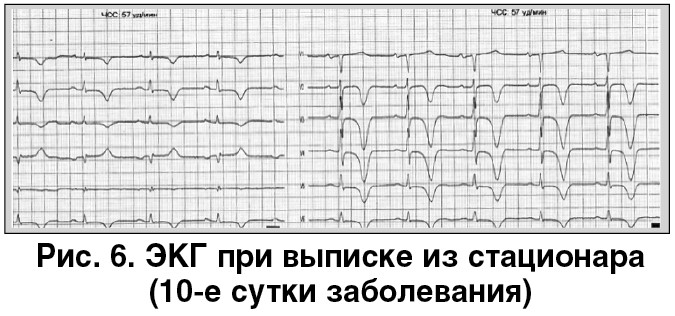
Пациентка П. была успешно выписана из стационара на 10-е сутки заболевания. На момент выписки состояние стабильное, клиническая симптоматика СН отсутствует.
После выписки из стационара все пациенты должны пройти повторное обследование у кардиолога через 3-6 мес с оценкой динамики изменений на ЭКГ, сократительной способности ЛЖ, а также кардио-МРТ, если данную процедуру не проводили в острый период заболевания. Исследования по длительному наблюдению за больными, перенесшими СТ, свидетельствуют, что эта категория имеет склонность к рецидивированию. Частота рецидива составляет 1-2% в год, а в течение пяти лет может достигать от 5 до 22% с развитием второго эпизода СТ от 3 мес до 10 лет после. Оценка прогноза должна быть индивидуальной в зависимости от характера провоцирующего фактора и сопутствующих заболеваний. По данным регистра SWEDE-HEART, смертность в течение трех лет у лиц с СТ была сходной с таковой у больных острым ИМ; позднее такие же результаты были показаны в регистре INTER-TAK [8]. Увеличение риска смерти отмечалось преимущественно в течение первых трех лет после установления диагноза и было связано с причинами, не обусловленными заболеваниями сердца, например со злокачественными новообразованиями.
Данные о влиянии различных групп препаратов на частоту рецидивирования СТ и вероятности смерти у этих пациентов также противоречивы. Однако определенные позитивные сведения получены для иАПФ / блокаторов рецепторов ангиотензина [9]. Использование β-блокаторов с этой целью выглядит патогенетически обоснованным, однако не нашло подтверждения на практике. Эти препараты остаются для пациентов с развитием аритмических осложнений. Большое значение в длительном ведении больных после СТ имеет устранение возможных триггеров данного заболевания (консультация психолога, коррекция дисфункции щитовидной железы, лечение причинных заболеваний).
Cписок литературы находится в редакции.
Спецвипуск «Клінічні випадки та сценарії у невідкладній кардіології», вересень 2019 р