10 травня, 2016
Современные взгляды на диагностику и лечение холестатических заболеваний печени
По материалам рекомендаций EASL, ACG
Продолжение. Начало в № 6.
ПСХ
ПСХ – это хроническое холестатическое заболевание печени, характеризующееся воспалительными и фиброзными изменениями, которые поражают внутри- и внепеченочные желчные протоки, приводят к их неравномерной облитерации, включая формирование мультифокальных стриктур; прогрессирующее течение заболевания осложняется развитием цирроза печени и печеночной недостаточности.
Диагностика
В соответствии с положениями руководства диагноз ПСХ устанавливается на основании увеличения сывороточных маркеров холестаза (ЩФ, γ-ГТП) и характерных изменений желчных протоков по данным МРХПГ или ЭРХПГ (мультифокальные стриктуры, сегментарная дилатация) при условии исключения заболеваний, течение которых сопровождается развитием вторичного склерозирующего холангита. Эксперты EASL подчеркивают, что у лиц с явными клиническими, биохимическими, гистологическими признаками ПСХ и нормальными результатами холангиограммы может быть установлен диагноз ПСХ малых желчных протоков.
Для ПСХ характерны следующие отличительные черты: подавляющее большинство (60-70%) больных являются представителями мужского пола, пик заболеваемости приходится на возраст 30-40 лет, 80% пациентов имеют тяжелую сопутствующую патологию – воспалительное заболевание кишечника (ВЗК), преимущественно неспецифический язвенный колит (НЯК). В отличие от ПБЦ течение ПСХ редко бывает бессимптомным: у 50% больных при первичном осмотре выявляют ряд патологических проявлений: зуд, боль в правом верхнем квадранте живота, усталость, снижение массы тела, эпизодическую лихорадку или озноб. При пальпации живота обращают внимание на гепато- и спленомегалию, тогда как другие проявления цирроза (портальная гипертензия, асцит, варикозное расширение вен пищевода и прямой кишки) у таких больных диагностируют достаточно редко. На поздних стадиях заболеваниях присоединяются проявления остеопении, мальабсорбции жира (стеаторея и дефицит жирорастворимых витаминов).
В биохимическом анализе крови также обнаруживаются патологические изменения: увеличение сывороточной концентрации ЩФ, аминотрансфераз, билирубина. В руководстве EASL подчеркивается, что на момент установления диагноза концентрация ЩФ может оставаться в пределах нормативных значений, однако при наличии клинических подозрений на ПСХ неизмененный уровень ЩФ не должен препятствовать проведению дальнейшей диагностики заболевания. Подобная ситуация складывается относительно гипербилирубинемии: на ранних стадиях заболевания у 70% больных уровень билирубина находится в рамках нормативных значений. У 60% пациентов с ПСХ отмечают увеличение сывороточной концентрации IgG, чаще всего в 1,5 раза выше верхней границы нормы.
В крови больных ПСХ циркулируют различные антитела: перинуклеарные антинейтрофильные цитоплазматические антитела (pANCA) обнаруживают у 26-94% пациентов, ANA и SMA выявляют в 8-77% и 0-83% случаев соответственно. Эксперты EASL подчеркивают, что обнаружение pANCA, ANA и SMA неспецифично для ПСХ, поэтому нет необходимости проводить регулярный скрининг аутоантител при этом заболевании.
Перечисляя преимущества и недостатки инструментальных методов исследования, эксперты EASL отмечают, что при проведении УЗИ вероятность выявления утолщенных стенок желчных протоков или их дилатации относительно невелика, но у 40% больных обнаруживают различные аномалии желчного пузыря: утолщение стенок, увеличение пузыря в размерах, конкременты. Золотым стандартом диагностики ПСХ, по мнению экспертов EASL, является ЭРХПГ. К характерным ранним признакам этого заболевания относятся неравномерная толщина стенок желчных протоков, множественные разделенные мультифокальные короткие и кольцеобразные стриктуры, которые чередуются с участками неизмененных или незначительно дилатированных протоков (симптом «четок», или «ожерелья»). При прогрессировании заболевания утрачивается локальность поражения и патологически измененные участки желчных протоков сливаются между собой. Несмотря на возможность получения точных диагностических данных при проведении ЭРХПГ, из-за высокой вероятности развития осложнений (панкреатита, сепсиса) эксперты рекомендуют прибегать к этому исследованию только при необходимости проведения терапевтических эндоскопических процедур или получения цитологических образцов, а в качестве ведущего метода первичной диагностики ПСХ называют МРХПГ. Последняя обладает одинаковой с ЭРХПГ точностью в диагностике ПСХ, хотя качество изображения желчных каналов при МРХПГ несколько ниже, чем при ЭРХПГ.
Гистологическое исследование биоптатов печени может подтвердить диагноз ПСХ, тем не менее биопсия печени не является обязательной при наличии типичных лабораторно-инструментальных данных, т. к. гистологические изменения при ПСХ неспецифичны, могут быть минимально выраженными и неравномерно располагаться в ткани печени, вследствие чего вероятность получения ложноотрицательного заключения чрезвычайно высока.
Рассматривая нюансы диагностики, регламентируемые руководством EASL (2009) (табл. 4), нельзя не упомянуть, что в 2015 г. Американская коллегия гастроэнтерологов (ACG) опубликовала практическое руководство «Первичный склерозирующий холангит», в котором представила последние данные по диагностике и лечению этой патологии. Эксперты ACG полностью поддерживают руководства EASL, рекомендуя при установлении диагноза отдавать предпочтение МРХПГ, а не ЭРХПГ. В вопросе проведения биопсии печени американские рекомендации также соответствуют европейским: выполнение этого исследования не считается целесообразным при получении положительных результатов диагностической холангиографии и допускается только у пациентов с подозрением на ПСХ малых желчных протоков или для исключения других заболеваний (АИГ). В отличие от экспертов EASL представители ACG рекомендуют однократное определение АМА и IgG4 для исключения ПБЦ и IgG4-ассоциированного холангита соответственно.
Сопутствующая патология
Известно, что 60-80% больных ПСХ имеют такую сопутствующую патологию, как ВЗК, причем в подавляющем большинстве случаев (80%) у этих пациентов диагностируют НЯК. ВЗК может развиваться как на ранних, так и на поздних стадиях ПСХ, но, как правило, манифестирует раньше ПСХ. Принимая во внимание подострый, а иногда и бессимптомный характер течения колита при ПСХ, эксперты EASL рекомендуют всем пациентам, у которых диагностирован ПСХ, в качестве рутинного обследования проводить тотальную колоноскопию с биопсией 1 раз в 1-2 года (III/С1). Больным ПСХ с подтвержденным диагнозом ВЗК необходимо выполнять это исследование ежегодно (III/С1).
Кроме ВЗК, течение ПСХ ассоциировано с высокой вероятностью возникновения злокачественных гепатобилиарных образований: по данным шведского когортного исследования, риск развития холангиокарциномы (ХК), гепатоцеллюлярной карциномы (ГЦК) и карциномы желчного пузыря у пациентов с ПСХ в 161 раз превышает таковой в среднестатистической популяции. Эксперты EASL отмечают, что вероятность возникновения карциномы желчного пузыря и ГЦК составляет 2%, а ХК – превышает 10%, при этом у 50% больных диагноз ХК устанавливают уже в течение первого года после подтверждения ПСХ. К сожалению, в настоящее время не существует биохимических маркеров или инструментальных методов, которые могли бы использоваться для ранней диагностики ХК. С учетом этого в рекомендациях EASL указывается, что при клинической необходимости для исключения ХК следует выполнять ЭРХПГ с проведением биопсии и/или получением цитологических образцов (III/С2). По мнению экспертов ACG, скрининг ХК заключается в осуществлении регулярных визуализирующих исследований в поперечной плоскости при помощи ультразвука или магнитно-резонансной томографии, а также в контроле уровня маркера СА 19-9 каждые 6-12 мес.
Еще одна рекомендация европейских экспертов предполагает ежегодное проведение абдоминального УЗИ для исключения аденокарциномы желчного пузыря (III/С2). Мнение экспертов ACG более радикально: профилактика этого злокачественного новообразования у больных ПСХ с полипами желчного пузыря >8 мм должна заключаться в проведении превентивной холецистэктомии.
Лечение
Одним из эффективных способов медикаментозного лечения больных ПСХ может быть назначение УДХК, однако результативность ее применения ученые оценивают по-разному. В одних исследованиях показано, что прием УДХК в дозе 10-15 мг/кг/сут приводит к биохимическому и гистологическому улучшению; в других испытаниях указывается, что терапия УДХК в дозе 13-15 мг/кг/сут способствует улучшению серологических показателей, но не влияет на выраженность клинических и гистологических проявлений. Есть данные, доказывающие уменьшение гистологической выраженности фиброза и улучшение холангиографических, биохимических показателей при приеме УДХК из расчета 20-25 мг/кг/сут. По результатам 2-летнего пилотного исследования низкие (10 мг/кг/сут) и стандартные
(20 мг/кг/сут) дозы УДХК способствовали улучшению, а высокие (30 мг/кг/сут) дозы приводили к значительному увеличению прогнозированного уровня выживаемости у больных ПСХ. Однако недавно было досрочно завершено исследование, в котором анализировалась эффективность высоких доз УДХК
(28-30 мг/кг/сут) у больных ПСХ. Так, у пациентов группы УДХК был зафиксирован высокий риск возникновения потребности в проведении трансплантации печени и развития кровотечений из варикозно расширенных вен.
Согласно существующим данным, назначение УДХК позволяет предотвратить развитие неоплазий у больных ПСХ с сопутствующим ВЗК. По результатам одного рандомизированного когортного исследования, в котором приняли участие больные ПСХ и НЯК с общей длительностью заболевания 355 пациенто-лет, прием УДХК способствовал значительному снижению относительного риска развития колоректальной дисплазии или карциномы толстого кишечника (0,26; 95% ДИ 0,06-0,92; р=0,003) по сравнению с больными, не получавшими УДХК.
Назначение кортикостероидов (преднизолона, будесонида) и других иммуносупрессантов (азатиоприна, циклоспорина, метотрексата, микофенолата), а также моноклональных антител, противофибротических препаратов (колхицина, D-пеницилламина), пентоксифиллина не оказывает выраженного положительного влияния на течение ПСХ, а также не предупреждает появление осложнений заболевания.
В руководстве EASL рассматривается также эффективность эндоскопического лечения билиарных стриктур. Указывается, что эндоскопическое вмешательство улучшает биохимические показатели, уменьшает зуд, снижает риск рецидивирующего холангита, поэтому проведение повторных эндоскопических дилатаций доминантных билиарных стриктур (стеноз общего желчного протока <1,5 мм, диаметр правого и левого печеночного протока <1 мм) рекомендуется только симптоматическим пациентам. Эксперты констатируют, что в настоящее время наиболее распространенным методом улучшения дренажа желчных протоков является введение пластикового стента с/без предварительной дилатации. Однако этот метод лечения имеет определенные недостатки: при необходимости замены или извлечения стента существует большая вероятность развития непроходимости стента и/или возникновения холангита. Учитывая все перечисленные преимущества и недостатки различных методов лечения, эксперты EASL сформулировали основные рекомендации (табл. 5).

В отличие от экспертов EASL представители ACG (2015) более категоричны в отношении медикаментозной терапии: они считают, что УДХК в дозе >28 мг/кг/сут не следует применять для лечения ПСХ, но допускают возможность использования более низких доз препарата. Относительно эндоскопического лечения эксперты ACG единодушно поддерживают европейских коллег, но дополнительно рекомендуют больным ПСХ со стриктурами, визуализирующимися при помощи инструментальных методов исследования, проводить ЭРХПГ с цитологическим исследованием, биопсией и флуоресцентной гибридизацией in situ для исключения ХК.
Перекрестный синдром ПСХ/АИГ
Симптомы перекрестного синдрома ПСХ/АИГ включают клинические, биологические и гистологические характеристики АИГ, а также холангиографические проявления, типичные для ПСХ (III/С2). Этот overlap-синдром диагностируют преимущественно у детей, подростков и лиц молодого возраста. В лечении перекрестного синдрома ПСХ/АИГ широко используется комбинация УДХК и иммуносупрессантов. Результаты проспективного анализа данных 41 пациента с ПСХ/АИГ показали, что комбинированная терапия УДХК (15-20 мг/кг/сут), преднизолоном (0,5 мг/сут с постепенным увеличением дозы до 10-15 мг/сут) и 50-75 мг азатиоприна позволяет достичь хорошего биохимического ответа. Основываясь на имеющихся данных доказательной медицины, эксперты EASL рекомендуют проводить медикаментозное лечение перекрестного синдрома ПСХ/АИГ посредством назначения УДХК и иммуносупрессантов (III/С2). Трансплантация печени признана терапией выбора на поздних стадиях заболевания (III/А1).
IgG4-зависимый склерозирующий холангит
IgG4-ассоциированный холангит (IgG4-АХ) – это относительно недавно описанное заболевание неуточненной этиологии, представляющее собой особую форму холангита, характеризующуюся преимущественным поражением внепеченочных желчных протоков и повышенным сывороточным уровнем IgG4, а также инфильтрацией IgG4-позитивными плазматическими клетками стенок желчных протоков в сочетании с фибротическими изменениями в них, часто сопровождающуюся аутоиммунным панкреатитом (АИП) и хорошо отвечающую на противовоспалительную терапию кортикостероидами.
Термин IgG4-АХ был введен экспертами EASL в 2009 г., однако уже в 2011 г. на первом международном симпозиуме по IgG4-ассоциированным заболеваниям это понятие было заменено на «IgG4-зависимый склерозирующий холангит» – IgG4-СХ (Stone J.H. et al., 2012). В настоящее время IgG4-СХ является одним из многочисленных проявлений IgG4-ассоциированной болезни (IgG4-АБ) – заболевания с пока неизвестной этиологией и полиорганным поражением, характеризующегося выраженной инфильтрацией IgG4-позитивными клетками и прогрессирующим фиброзом (Буеверов А.О., 2014).
С момента выделения IgG4-АБ в самостоятельную нозологическую форму не прошло и десятилетия, тем не менее уже описаны IgG4-ассоциированные поражения поджелудочной железы, желчевыводящих путей и желчного пузыря, печени, пищевода, желудка, кишечника, забрюшинного пространства, слезных и слюнных желез, щитовидной железы, легких, мочеточников и почек, предстательной железы, молочных желез, центральной нервной системы, артерий и вен миокарда, лимфатических узлов, кожи и костей. Среди этого множества патологических проявлений наиболее частыми клиническими признаками IgG4-АБ являются поражение поджелудочной железы и билиарного тракта.
Диагностика
В настоящее время типичный портрет больного IgG4-СХ описывается следующим образом: 50-60-летний мужчина, предъявляющий жалобы на малоинтенсивную или умеренную абдоминальную боль и снижение массы тела (Li J. et al., 2012). При объективном осмотре обращает на себя внимание желтушность кожи и субиктеричность склер, при пальпации выявляется чувствительность в эпигастральной области. В биохимическом анализе крови отмечается увеличение активности печеночных ферментов (АЛТ, АСТ), ЩФ и билирубина, амилазы. Нередко у таких больных обнаруживают повышение уровня сывороточного карбогидратного антигена (СА19-9), на основании чего можно заподозрить наличие холангиокарциномы. Все инструментальные методы исследования (УЗИ, КТ, МРТ) позволяют выявить билиарные стриктуры, подтверждая, таким образом, предположительный диагноз. Пациенту проводится панкреатодуоденальная резекция, однако при гистологическом исследовании операционного материала опухолевые клетки не обнаруживаются, хотя при макроскопическом осмотре патологические изменения желчных протоков очень похожи на опухолевое перерождение. Только на этом этапе возникает предположение о возможном IgG4-СХ, подтверждаемое иммуногистохимическим (выявление скопления IgG4-позитивных клеточных инфильтратов в стенке протока) и серологическим (обнаружение высоких концентраций IgG4 в сыворотке крови) методами. При дальнейшем углубленном исследовании может быть диагностировано IgG4-поражение других органов, которое оставалось «в тени» клинической картины холангита.
Особенно важным считается проведение дифференциальной диагностики между IgG4-СХ и ПСХ, главным образом ввиду различий в прогнозе заболеваний и ответе на терапию кортикостероидами. В отличие от ПСХ, при котором первые признаки холестаза отмечаются у молодых мужчин в возрасте 30-40 лет, дебют IgG4-СХ приходится на 50-60 лет. В подавляющем большинстве случаев IgG4-СХ манифестирует механической желтухой, тогда как при ПСХ она обычно развивается на поздней стадии заболевания. IgG4-СХ наиболее часто сочетается с АИП, а ПСХ – с воспалительным заболеванием кишечника (неспецифическим язвенным колитом). Типичными признаками IgG4-СХ являются повышение сывороточного уровня IgG4, инфильтрация IgG4-позитивными плазматическими клетками и хороший ответ на терапию кортикостероидами, что абсолютно не свойственно ПСХ.
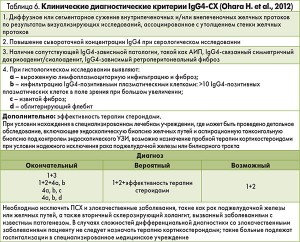
В 2012 г. рабочая группа Комитета по исследованию IgG4-АБ и Комитета по исследованию трудно диагностируемых заболеваний печени и билиарного тракта представила новые диагностические критерии IgG4-СХ (Ohara H. et al., 2012). Они основаны на комплексе клинических, лабораторных и морфологических данных и предполагают три уровня диагностики IgG4-СХ: окончательный, вероятный и возможный (табл. 6).
Лечение
По мнению экспертов EASL, терапией первой линии IgG4-СХ являются кортикостероиды, т. к. назначение этих препаратов приводит к разрешению желтухи, улучшению биохимических показателей и обратному развитию стриктур. Полная ремиссия заболевания на фоне терапии кортикостероидами может развиваться уже к 3-му месяцу лечния. Одним из условий успешного применения иммуносупрессивных препаратов является максимально надежная верификация диагноза, направленная в первую очередь на исключение патологии, при которой данное лечение противопоказано (Буеверов А.О., 2014). Следует отметить, что в руководстве EASL не описывается оптимальная схема назначения кортикостероидов, возможно, в данной ситуации следует прислушаться к мнению ведущих российских специалистов. А.О. Буеверов и соавт. (2014) рекомендуют первоначально использовать высокие дозы преднизолона (40 мг/сут на протяжении 4 нед с последующим снижением на 5 мг в неделю), а затем перейти на прием поддерживающих доз препарата (5 мг/сут на протяжении 6 мес).
Эксперты EASL подчеркивают, что у пациентов с проксимальными и внутрипеченочными стенозами, а также у больных с предполагаемым высоким риском рецидива в качестве возможного варианта лечения может быть назначение азатиоприна в дозе
2 мг/кг/сут на протяжении 3-6 мес.
Генетически обусловленные холестатические заболевания печени. Муковисцидоз ассоциированное поражение печени
Поражение печени при муковисцидозе, определяемое как гепатомегалия с персистирующим повышением ≥2 печеночных ферментов и патологическими изменениями ультразвуковой картины (стеатоз, фокальный или мультилобулярный цирроз), диагностируется у 27% больных с фиброзно-кистозной дегенерацией.
Диагностика
В руководстве EASL подчеркивается, что в настоящее время диагностические критерии муковисцидоз-ассоциированного поражения печени (МАПП) четко не определены. Гепатомегалия, выявляемая у каждого третьего пациента с муковисцидозом, может быть вызвана МАПП или рассматриваться как проявление легочного сердца. С целью своевременного обнаружения сопутствующего поражения печени при муковисцидозе эксперты EASL рекомендуют проводить скрининг печеночных ферментов (ЩФ, АЛТ, АСТ, билирубин) 1 раз в год. В случае 1,5-кратного превышения верхней границы нормы хотя бы одного из этих показателей следует тщательно контролировать все перечисленные биохимические параметры на протяжении 3-6 мес. В данной ситуации эксперты считают целесообразным проведение более углубленного обследования (определения протромбинового времени, уровня альбумина) и исключения другой возможной причины ухудшения функционального состояния печени (медикаменты, токсины, инфекции, патология желчного пузыря, АИГ, ПСХ).
Лечение
Рассматривая нюансы терапии, эксперты EASL подчеркивают, что в настоящее время не существует лекарственных средств, способных улучшить долгосрочный прогноз при МАПП (III/С2). Единственным препаратом, улучшающим функциональную активность печени у больных муковисцидозом, является УДХК. УДХК в дозе 20-30 мг/кг/сут стимулирует билиарную секрецию, способствует положительной динамике уровней печеночных ферментов и гистологических показателей, а также нормализации пищевого статуса. На терминальных стадиях МАПП трансплантация печени является методом выбора.
Продолжение следует.
В настоящее время на отечественном фармакологическом рынке широко представлены генерические препараты УДХК, каждый из этих гепатопротекторов имеет свою «изюминку», но у Урсохола, выпускаемого ЧАО «Фармацевтическая фирма «Дарница», их несколько.
Урсохол воплощает все лучшие свойства УДХК – обладает цито- и гепатопротекторным, антифибротическим и антихолестатическим, гипохолестеринемическим и иммуномодулирующим, антиапоптотическим и антиоксидантным эффектами. Благодаря этим особенностям применение Урсохола при холестатических заболеваниях печени сопровождается нормализацией физических свойств желчи, улучшением гепатобилиарной секреции с одновременным восстановлением текучести мембран и цитоскелета гепатоцитов. В зависимости от этиологии заболевания терапия Урсохолом может не только улучшить самочувствие больного, нормализовать клинико-лабораторные показатели, но и способствовать исчезновению морфологических признаков холестаза.
Еще одной особенностью Урсохола, выгодно отличающей его от других генериков УДХК, является оптимальное соотношение цены и качества. Урсохол, выпускаемый одним из лидеров украинской фармацевтической промышленности, производится на современном оборудовании с использованием инновационных технологий в контролированных условиях и полностью соответствует требованиям GMP. Пациенты с холестатическими заболеваниями печени, нуждающиеся в длительном приеме УДХК, особенно оценят Урсохол – ведь в упаковке содержится достаточное количество капсул, обеспечивающее непрерывный прием препарата на протяжении месяца и позволяющее больным тратить минимальное количество времени для посещения аптеки. Капсулы Урсохола имеют нейтральный вкус, небольшой размер и не вызывают особых затруднений при приеме. Оптимальная цена при высоком качестве и эффективности делает Урсохол доступным для многих пациентов с различными холестатическими заболеваниями печени. Сочетание всех вышеперечисленных положительных свойств в одном препарате позволяет повысить приверженность больных к лечению и, следовательно, увеличить эффективность медикаментозной терапии.