24 вересня, 2019
Острый коронарный синдром со стойкой элевацией сегмента ST
Пример коррекции антиагрегантной терапии после тромбоза стента
Пациент, 74 года, доставлен в отделение реанимации и интенсивной терапии ННЦ «Институт кардиологии имени академика Н.Д. Стражеско» НАМН Украины г. Киева (далее – Институт кардиологии) каретой скорой медицинской помощи с интенсивной болью за грудиной, которая продолжается в состоянии покоя в течение нескольких часов. Длительность максимального болевого приступа – в пределах 50 мин. У больного длительный анамнез артериальной гипертензии, для лечения которой он принимал лизиноприл. Также у пациента имеется сахарный диабет (СД) в состоянии субкомпенсации. На момент осмотра присутствует болевой синдром после применения наркотических анальгетиков.
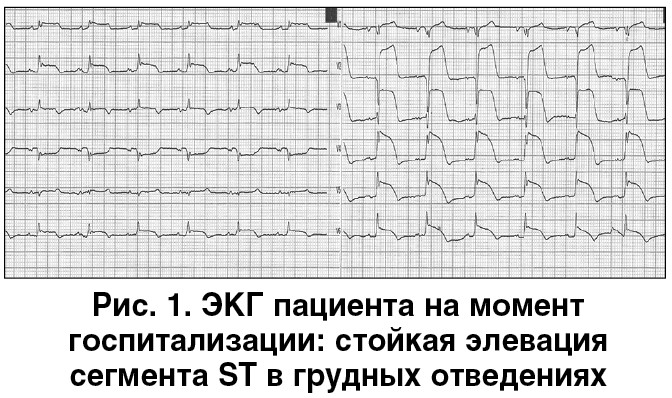 По результатам электрокардиографии (ЭКГ) диагностирован острый инфаркт миокарда (ОИМ) со стойкой элевацией сегмента ST (рис. 1).
По результатам электрокардиографии (ЭКГ) диагностирован острый инфаркт миокарда (ОИМ) со стойкой элевацией сегмента ST (рис. 1).
Результаты лабораторных анализов пациента представлены в таблице. В полученных данных обращают на себя внимание повышенный уровень общей креатинфосфокиназы (КФК), пограничные значения МВ-фракции КФК и тропонина, лейкоцитоз, гипергликемия, а также сниженная скорость клубочковой фильтрации (СКФ).
Реваскуляризация миокарда и тромбоз стента
 В рекомендациях Европейского общества кардиологов (ESC) по лечению ОИМ у пациентов, поступивших с элевацией сегмента ST, четко очерчены категории больных, которым показана реперфузионная терапия [1]. Ее назначают всем пациентам с симптомами, которые продолжаются <12 ч и сопровождаются подъемом сегмента ST или картиной блокады левой ножки пучка Гиса (класс рекомендации I, уровень доказательности А). Реперфузионная терапия (желательно первичное чрескожное коронарное вмешательство [ЧКВ]) показана при наличии доказательств продолжающейся ишемии, даже если симптомы длятся >12 ч и/или если боли и изменения на ЭКГ носили прерывистый характер (класс рекомендации I, уровень доказательности А).
В рекомендациях Европейского общества кардиологов (ESC) по лечению ОИМ у пациентов, поступивших с элевацией сегмента ST, четко очерчены категории больных, которым показана реперфузионная терапия [1]. Ее назначают всем пациентам с симптомами, которые продолжаются <12 ч и сопровождаются подъемом сегмента ST или картиной блокады левой ножки пучка Гиса (класс рекомендации I, уровень доказательности А). Реперфузионная терапия (желательно первичное чрескожное коронарное вмешательство [ЧКВ]) показана при наличии доказательств продолжающейся ишемии, даже если симптомы длятся >12 ч и/или если боли и изменения на ЭКГ носили прерывистый характер (класс рекомендации I, уровень доказательности А).
У больных со стабильным состоянием, доставленных в стационар через 12-24 ч после возникновения симптомов, реперфузионная терапия с использованием ЧКВ также может быть целесообразной (класс рекомендации IIb, уровень доказательности В).
Поскольку известно, что длительность загрудинной боли составляет <12 ч, пациент соответствует критериям для выполнения первичного ЧКВ. Перед ЧКВ назначена антитромбоцитарная терапия в нагрузочных дозах: ацетилсалициловая кислота (АСК) в дозе 300 мг, клопидогрель по 600 мг. Антикоагулянтное лечение было начато на догоспитальном этапе: больному ввели нефракционированный гепарин внутривенно. В качестве гиполипидемической терапии назначен розувастатин в дозе 40 мг. Кроме того, применяли метаболическое лечение: кверцетин в дозе 1,0 г внутривенно. Гипергликемию корригировали введением инсулина.
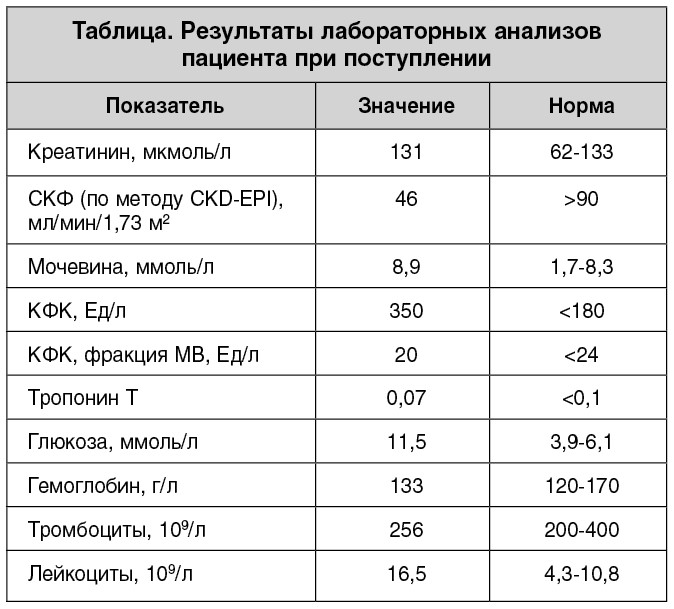
 В отделении интервенционной кардиологии Института кардиологии (руководитель – член-корреспондент НАМН Украины, д. мед. н. Ю.Н. Соколов) пациенту были выполнены коронаровентрикулография (КВГ) и стентирование инфарктобусловившей коронарной артерии. При проведении ургентной КВГ выявлена проксимальная окклюзия передней межжелудочковой ветви левой коронарной артерии (рис. 2).
В отделении интервенционной кардиологии Института кардиологии (руководитель – член-корреспондент НАМН Украины, д. мед. н. Ю.Н. Соколов) пациенту были выполнены коронаровентрикулография (КВГ) и стентирование инфарктобусловившей коронарной артерии. При проведении ургентной КВГ выявлена проксимальная окклюзия передней межжелудочковой ветви левой коронарной артерии (рис. 2).
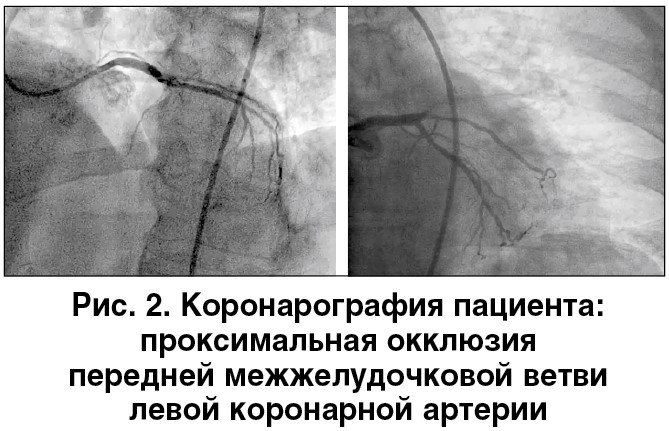
После предварительной предилатации установлен один BMS (простой металлический стент). Кровоток после имплантации стента: магистральный TIMI 2, тканевой BG 2 (рис. 3).
После ЧКВ продолжена двойная антиагрегантная (АСК + клопидогрель), а также антикоагулянтная терапия: назначен фондапаринукс по 2,5 мг подкожно.
В качестве гипотензивного и антиангинального лечения назначены перорально рамиприл в дозе 5 мг 2 р/сут, карведилол по 6,5 мг 2 р/сут; продолжены внутривенные инфузии кверцетина по 0,5 г 2 р/сут.
Через 4 ч после ЧКВ возник рецидив болевого синдрома (рис. 4). При проведении повторной КВГ выявлен тромбоз стента (рис. 5). Выполнены ургентная тромбосакция и стентопластика (рис. 6). В связи с ретромбозом возникает сомнение в эффективности назначенной антитромботической терапии. Возможные варианты ее коррекции: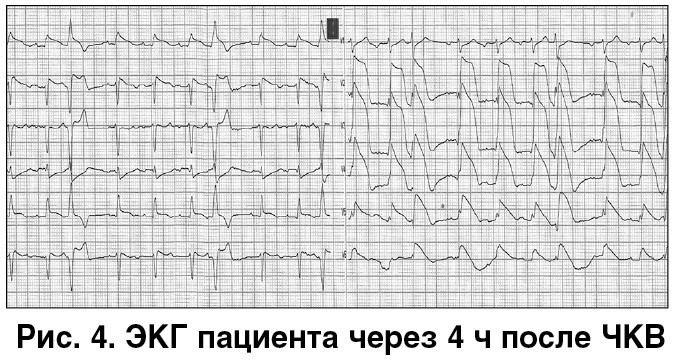
- увеличение дозы клопидогреля;
- увеличение дозы АСК;
- дополнительное назначение орального антикоагулянта (ривароксабана);
- замена клопидогреля на тикагрелор.
На первый взгляд решение не очевидно, однако накопленная доказательная база позволяет выбрать оптимальный вариант для снижения вероятности развития тромботических событий и сведения к минимуму риска возникновения кровотечений у конкретного пациента.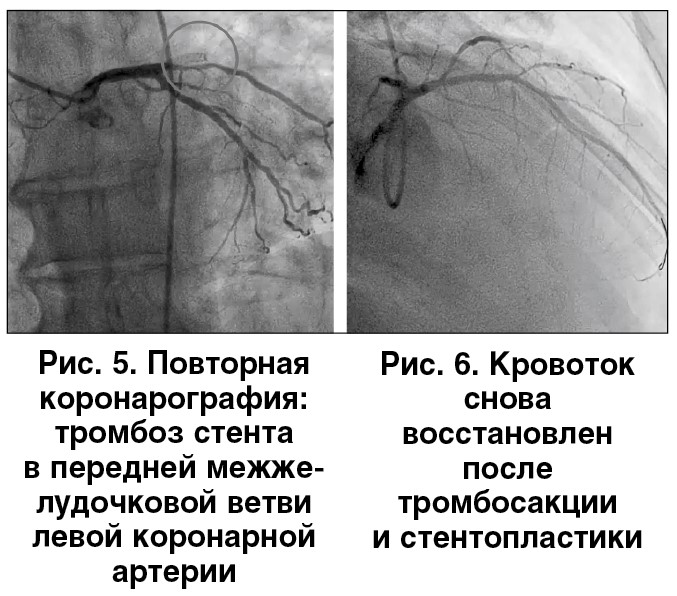
Риск возникновения кровотечений
Клопидогрель в сочетании с АСК является стандартом профилактики повторных сердечно-сосудистых событий у пациентов с острым коронарным синдромом (ОКС). Двойная антитромбоцитарная терапия (ДАТ) показана независимо от того, получают пациенты только консервативное лечение или подвергаются ЧКВ с постановкой как непокрытых, так и в особенности стентов с лекарственным покрытием. В последние годы получили распространение более мощные, но из-за этого и требующие тщательного изучения геморрагических рисков ингибиторы P2Y12-рецепторов тромбоцитов – прасугрель и тикагрелор. Применение любой схемы связано с риском развития основного побочного эффекта всех антиагрегантов – кровоточивости вследствие постоянного угнетения тромбоцитарного звена гемостаза.
В рутинной клинической практике серьезные кровотечения из органов желудочно-кишечного тракта, уретры и других локализаций являются относительно частыми некардиальными осложнениями антитромботической терапии при ОКС. По данным регистра GRACE, их частота в субпопуляции пациентов с ОИМ с элевацией сегмента ST составила 4,8%. Предикторами кровотечений были пожилой возраст, женский пол, почечная недостаточность, кровотечения в анамнезе [2].
Учитывая преклонный возраст нашего пациента и сниженную СКФ, соответствующую умеренному снижению функции почек, риск кровотечений достаточно высок, поэтому увеличение доз антиагрегантов не является подходящей опцией для профилактики повторных тромбозов.
В исследовании CURRENT у пациентов с ОКС (из них 29,2% – с ОИМ с элевацией сегмента ST), которых в первые сутки готовили к инвазивному лечению, изучались два режима дозирования антиагрегантов [3]:
- двойная доза клопидогреля (600 мг в первый день, затем по 150 мг в течение семи дней, далее по 75 мг/сут) против обычного дозирования (нагрузочная доза – 300 мг, затем по 75 мг/сут);
- высокая доза АСК (300-325 мг/сут) против низкой (75-100 мг/сут).
Исследование показало отсутствие достоверных различий исходов по первичной конечной точке (сердечно-сосудистая смерть, ИМ или мозговой инсульт в течение 30 дней) в общей популяции исследования в зависимости от дозирования клопидогреля. В подгруппе больных, у которых было выполнено ЧКВ (n=17 232), применение двойной дозы клопидогреля в первые 7 дней обеспечивало более эффективную профилактику тромбоза стентов: 1,6 против 2,3%; относительный риск (ОР) 0,68; 95% доверительный интервал (ДИ) 0,55-0,85; р=0,001. Однако улучшение этого вторичного исхода достигалось ценой существенного роста частоты больших кровотечений: 2,5% в группе высокой дозы клопидогреля против 2,0% при стандартном дозировании (ОР 1,24; 95% ДИ 1,05-1,46; р=0,01).
Что касается сравнения доз АСК, то частота ни первичной конечной точки тромботических событий, ни кровотечений не реагировала на повышение дозы этого препарата.
Назначение орального антикоагулянта?
Альтернативной стратегией является дополнительное назначение орального антикоагулянта, то есть переход к тройной антитромботической терапии. Поскольку тромбин – мощный стимулятор агрегации тромбоцитов, ингибирование образования тромбина посредством блокады фактора свертывания Xa может снижать риск тромбоза стента. Наиболее изученным оральным ингибитором Xa на сегодняшний день является ривароксабан.
В плацебо-контролируемом исследовании ATLAS-ACS2 TIMI 51 рандомизировали 15 526 пациентов с ОКС для приема 2 р/сут 2,5 или 5 мг ривароксабана дополнительно к ДАТ [4]. Срок наблюдения составил в среднем 13 мес, максимальный – до 31 мес. В группе 2,5 мг ривароксабана у стентированных пациентов частота тромбоза стентов была достоверно меньшей по сравнению с группой плацебо: 1,5 против 1,9% (абсолютное снижение риска 0,4%; р=0,023), тогда как в группе ривароксабана 5 мг отмечена статистически недостоверная тенденция к снижению частоты тромбоза стентов (1,5 против 1,9% в группе плацебо; ОР 0,70; p=0,089).
Однако в нашем случае ривароксабан не был назначен, во‑первых, потому, что пациент еще получал парентеральную антикоагулянтную терапию после повторного ЧКВ. Во-вторых, добавление ривароксабана к ДАТ, согласно данным исследования ATLAS-ACS2, влияло на риск тромбоза стента в меньшей степени, чем замена клопидогреля на тикагрелор в исследовании PLATO.
Переход с клопидогреля на тикагрелор?
Тикагрелор – обратимый прямой антагонист аденозиндифосфатных рецепторов P2Y12, который обеспечивает более быстрое, мощное и стабильное ингибирование агрегации тромбоцитов по сравнению с клопидогрелем [5].
В рандомизированном двойном слепом исследовании PLATO по эффективности профилактики тромботических событий тикагрелор превзошел клопидогрель без увеличения риска геморрагических осложнений ДАТ [6]. У стентированных пациентов частота тромбоза стентов была ниже в группе тикагрелора: 1,3 против 1,9% при приеме клопидогреля. Абсолютное снижение риска составило 0,6%; относительное – 33%.
Дополнительным аргументом в пользу выбора тикагрелора стали данные о том, что по мере снижения функции почек его преимущество перед клопидогрелем увеличивается.
Немаловажной причиной смены антитромбоцитарного препарата могут быть отличия в эффективности тикагрелора и клопидогреля у больных СД из-за особенностей метаболизации [8]. Специальное исследование показало, что у пациентов с ишемической болезнью сердца (ИБС) и СД по сравнению с таковыми с ИБС без СД снижен эффект ингибирования рецепторов P2Y12 из-за нарушений фармакокинетики клопидогреля. Это приводит к недостаточной эффективности ДАТ и повышает риск развития повторных тромботических событий [9].
По данным рандомизированного перекрестного исследования, у пациентов с СД вариативность антиагрегантного действия тикагрелора оказалась намного меньшей, чем у клопидогреля. То есть тикагрелор обеспечивает более выраженный, стабильный и предсказуемый антитромботический эффект независимо от метаболического профиля пациента.
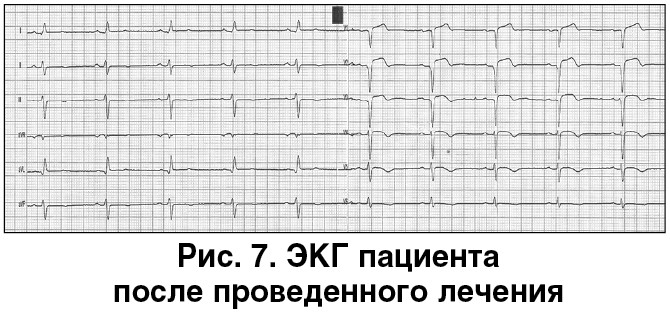 На основании вышеизложенных данных проведена коррекция терапии [10]. Клопидогрель заменили на тикагрелор в дозе 90 мг 2 р/сут без изменения дозы АСК и антикоагулянта. Продолжены лечение β-блокатором (карведилол), ингибитором ангиотензинпревращающего фермента (рамиприл), а также высокодозовая гиполипидемическая (розувастатин по 40 мг) и метаболическая терапия. Дополнительно в качестве прогноз-улучшающей терапии после ОИМ назначен блокатор рецепторов альдостерона эплеренон в стандартной дозе 25 мг 2 р/сут. В результате проведенного лечения достигнута стабилизация состояния пациента (рис. 7).
На основании вышеизложенных данных проведена коррекция терапии [10]. Клопидогрель заменили на тикагрелор в дозе 90 мг 2 р/сут без изменения дозы АСК и антикоагулянта. Продолжены лечение β-блокатором (карведилол), ингибитором ангиотензинпревращающего фермента (рамиприл), а также высокодозовая гиполипидемическая (розувастатин по 40 мг) и метаболическая терапия. Дополнительно в качестве прогноз-улучшающей терапии после ОИМ назначен блокатор рецепторов альдостерона эплеренон в стандартной дозе 25 мг 2 р/сут. В результате проведенного лечения достигнута стабилизация состояния пациента (рис. 7).
Литература
- The Task Force on the management of ST-segment elevation acute myocardial infarction of the European Society of Cardiology (ESC). ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation // European Heart Journal. – 2012. – 33. – Р. 2569-2619.
- Moscucci M., Fox K.A., Cannon C.P. et al. Predictors of major bleeding in acute coronary syndromes: the Global Registry of Acute Coronary Events (GRACE) // Eur Heart J. – 2003. – 24 (20). – Р. 1815-1823.
- The CURRENT-OASIS7 Investigators. Dose Comparisons of Clopidogrel and Aspirin in Acute Coronary Syndromes // N Engl J Med. – 2010. – 363. – Р. 930-942.
- Gibson C.M., Chakrabarti A.K., Mega J. et al. Reduction of Stent Thrombosis in Patients With Acute Coronary Syndromes Treated With Rivaroxaban in ATLAS-ACS2 TIMI 51 // Journal of the American College of Cardiology. – 2013. – 62 (4). – Р. 286-290.
- Storey R.F., Husted S., Harrington R.A. et al. Inhibition of platelet aggregation by AZD6140, a reversible oral P2Y12 receptor antagonist, compared with clopidogrel in patients with acute coronary syndromes // J Am Coll Cardiol. – 2007. – 50. – Р. 1852-1856.
- Cannon C.P., Harrington R.A., James S., Ardissino D., Becker R.C., Emanuelsson H., Husted S., Katus H., Keltai M., Khurmi N.S., Kontny F., Lewis B.S., Steg P.G., Storey R.F., Wojdyla D., Wallentin L. PLATelet inhibition and patient Outcomes Investigators. Comparison of ticagrelor with clopidogrel in patients with a planned invasive strategy for acute coronary syndromes (PLATO): a randomised double-blind study // Lancet. – 2010. – 375 (9711). – Р. 283-293.
- Wallentin L., Becker R.C., Budaj A. et al. Ticagrelor versus Clopidogrel in Patients with Acute Coronary Syndromes // N Engl J Med. – 2009. – 361. – Р. 1045-1057.
- James S., Budaj A., Aylward P. et al. Ticagrelor versus clopidogrel in acute coronary syndromes in relation to renal function: results from the Platelet Inhibition and Patient Outcomes (PLATO) trial // Circulation. – 2010. – 122 (11). – Р. 1056-1067.
- Angiolillo D.J., Jakubowski J.A., Ferreiro J.L. et al. Impaired responsiveness to the platelet P2Y12 receptor antagonist clopidogrel in patients with type 2 diabetes and coronary artery disease // J Am Coll Cardiol. – 2014. – 64 (10). – Р. 1005-1014.
- Zafar M.U., Mehremic S., Koloffon C.L. et al. Variability of antiplatelet effect with ticagrelor versus clopidogrel in diabetic patients // Journal of the American College of Cardiology. – 2016. – 67 (13_S): 455.
Спецвипуск «Клінічні випадки та сценарії у невідкладній кардіології», вересень 2019 р


