25 вересня, 2019
L-орнітину-L-аспартат як гепатопротектор при неалкогольній жировій хворобі печінки
Неалкогольна жирова хвороба печінки (НАЖХП) у всьому світі визначається як основне хронічне захворювання печінки, пов’язане з ожирінням і метаболічним синдромом. НАЖХП включає простий стеатоз печінки, неалкогольний стеатогепатит (НАСГ), а також фіброз печінки з подальшим розвитком цирозу, що у багатьох випадках призводить до виникнення гепатоцелюлярної карциноми [1]. Оскільки печінка відіграє ключову роль у виведенні аміаку, то закономірно, що у пацієнтів із НАСГ має місце гіперамоніємія [2]. Накопичення аміаку у печінці підтверджено як у хворих людей, так і на моделях тварин із жировими захворюваннями органа [3].
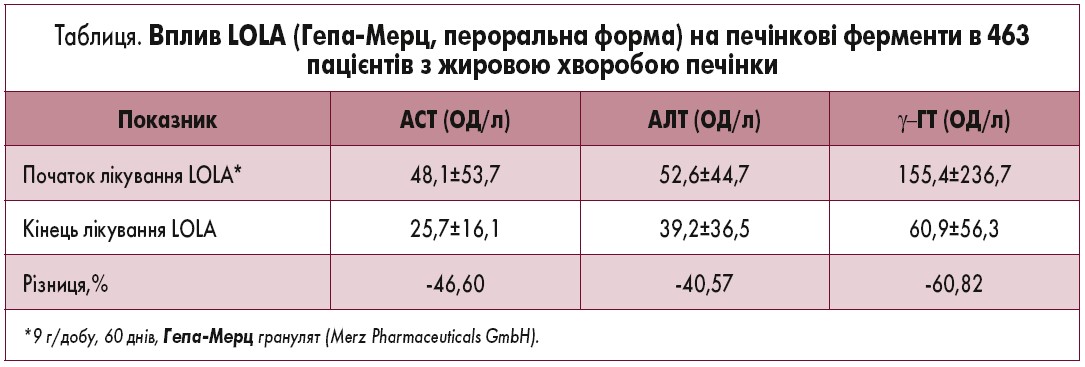
L-орнітину-L-аспартат (LOLA) – це поєднання ендогенних амінокислот, які продемонстрували здатність до підвищеного виведення аміаку резидуальними гепатоцитами та скелетними м’язами у пацієнтів з цирозом [4]. За результатами нещодавно проведених досліджень висловлено припущення, що LOLA, окрім виведення аміаку, чинить прямий захисний вплив на печінку. Так, 463 пацієнти з жировою хворобою печінки, у 29% з яких етіологія захворювання була не алкогольною, перорально застосовували різні дози LOLA протягом 30-90 днів [5]. Підвищений рівень печінкових ферментів у крові (аспартатамінотрансферази – АСТ, аланінамінотрансферази – AЛT та гамма-глутамілтранспептидази – γ-ГT) значно знижувався (до 70%) на тлі лікування LOLA (табл.), що свідчить про поліпшення функції печінки; також відзначена залежність ефекту від дози. Позитивні результати лікування були більш вираженими у пацієнтів з жировою хворобою печінки, ніж у хворих на цироз. Підгруповий аналіз показав, що лише при повному утриманні від вживання пацієнтами алкоголю було досягнуто оптимального рівня печінкових ферментів.
Роль LOLA у лікуванні НАЖХП/НАСГ
Таким чином, LOLA проявляє гепатопротекторні властивості у пацієнтів з жировою хворобою печінки різної етіології. Щоб вивчити це питання безпосередньо у зв’язку з НАЖХП/НАСГ, виконано багатоцентрове відкрите мультидозове рандомізоване контрольоване дослідження ефективності LOLA, який приймали перорально протягом 12 тижнів. У нього було включено 72 пацієнти віком від 18 до 65 років, у яких діагностовано НАСГ відповідно до Рекомендацій щодо лікування неалкогольного стеатогепатиту (2010): співвідношення розмірів печінки та селезінки <1 за даними комп’ютерної томографії (КТ); рівень AЛT в 1,3 разу вищий за верхню межу норми. Після 12 тижнів лікування LOLA спостерігалось істотне дозозалежне зниження рівня АЛТ разом зі значним зниженням концентрації тригліцеридів; значно покращилося співвідношення розмірів печінки та селезінки [6].
В іншому дослідженні у 78 пацієнтів з НАСГ і порушеннями мікроциркуляції у печінці проводили полігепатографію – модифіковану методику неінвазивної оцінки стану внутрішньопечінкового кровотоку. Зміни після лікування LOLA включали підвищену стійкість і відхилення форми хвилі та її амплітуди (синусоїдальний рівень). Спостерігалось покращення мікроциркуляції у печінці у всіх пацієнтів навіть за наявності фіброзу 0-1 стадії [7].
Гепатопротекторні механізми LOLA при НАЖХП/НАСГ
Патогенез НАЖХП повністю не з’ясований, однак гіпотеза подвійного удару привернула значну увагу. Вона передбачає, що початковий удар – змінений обмін ліпідів – призводить до накопичення жиру. Другий удар включає низку факторів, зокрема оксидативний стрес і запалення.
Основний механізм дії LOLA, який лежить в основі виведення аміаку при хронічному захворюванні печінки, включає 2 різні процеси: синтез сечовини (L-орнітину, що є метаболічною проміжною речовиною у циклі сечовини) перипортальними гепатоцитами та синтез глутаміну ферментом глутамінсинтетазою (ГС) у перивенозних гепатоцитах і скелетних м’язах. Встановлено, що виведення аміаку за допомогою ГС зменшене на 50% у зразках біопсії печінки у пацієнтів з гістологічно підтвердженим стеатозом і підвищеними рівнями трансаміназ та білірубіну у сироватці крові [8]. Ці відкриття узгоджуються зі значною втратою високоафінного шляху з видалення аміаку за участю ГС по периферії гепатоцитів.
Дослідження останніх років дали змогу виділити низку механізмів впливу LOLA на саркопенію, а також проміжний обмін у печінці, оксидативний стрес і перекисне окислення ліпідів, які можуть відігравати певну роль у гепатопротекторних властивостях LOLA при наявності НАЖХП/НАСГ.
Саркопенія
Цей стан визначається як прогресуюча втрата маси скелетних м’язів, їх сили та функціональності. Саркопенія є фактором ризику розвитку НАЖХП. Механізми, що пов’язують саркопенію з розвитком НАЖХП, включають дію прозапальних факторів, які потенційно можуть уражати печінку [9]. Повідомлялося, що лікування LOLA пацієнтів із цирозом [10, 11] або експериментальних тварин із хронічною печінковою недостатністю [12] сприяє відновленню протеостазу м’язів і значному покращенню їх роботи. Ймовірно, гепатопротекторні властивості LOLA у пацієнтів з НАЖХП (принаймні у частини з них) реалізуються через механізми, що передбачають вдосконалення функцій скелетних м’язів. Подальші дослідження у цьому напрямі тривають.
Глутамін
Лікування хронічного захворювання печінки в експерименті з використанням LOLA сприяло підвищенню вмісту глутаміну у плазмі крові у 3 рази. Це є результатом двоступеневої реакції, що включає трансамінування L-орнітину до глутамату, який є обов’язковим субстратом для ГС [13]. Внутрішньовенні інфузії LOLA також забезпечували значне підвищення рівня глутамату в плазмі крові та відновлення запасів глутаміну в осіб із хронічними захворюваннями печінки [14]. Відновлення синтезу глутаміну в печінці є важливим аспектом гепатопротекторних властивостей LOLA при НАЖХП/НАСГ, визначеним на підставі спостережень, у яких після прийому глутаміну у пацієнтів відзначaлося покращення функції печінки після ураження, викликаного низкою чинників, включаючи ішемію/реперфузію і хронічне вживання алкоголю [15, 16]. Результати нещодавно проведених двох експериментальних досліджень продемонстрували значний гепатопротекторний вплив глутаміну при НАЖХП/НАСГ [17, 18]. У першому дослідженні, де НАЖХП була зумовлена дієтою з високим вмістом жиру, пероральне застосування глутаміну сприяло зниженню експресії печінкових маркерів окисного стресу та гальмування NFkB p65 разом із позитивною динамікою гепатостеатозу.
У другому дослідженні гепатопротекторні ефекти перорального введення глутаміну при НАСГ, спричиненому дієтою західного типу, були пов’язані із профілактикою перекисного окислення ліпідів у печінці. Більше того, застосування препаратів, які містили глутамін, було асоційоване зі значно меншою прозапальною активністю (рис. 1).
Глутатіон
Ще один важливий продукт глутамату, що походить від LOLA – глутатіон – є потужним антиоксидантом, який володіє необхідними властивостями для контролю оксидативних ушкоджень. Лікування LOLA забезпечувало можливість відновлення втрати глутатіону в сироватці крові тварин з печінковою недостатністю, спричиненою токсичним ураженням [19]. Отже, обидва зазначені дослідження пропонують чітке пояснення гепатопротекторної дії LOLA, а саме – антиоксидантні властивості двох продуктів обміну (глутаміну й антиоксиданту глутатіону).
Застосування антиоксидантів у пацієнтів з НАЖХП/НАСГ вже пропонувалось, але результати такого лікування були суперечливі. У початкових випробуваннях використання вітаміну Е у пацієнтів з НАЖХП сприяло зниженню рівнів трансаміназ, однак значного гістологічного покращення не спостерігалось. Результати початкових клінічних випробувань пробуколу (антиоксиданту, що знижує рівень ліпідів у крові) сьогодні незадовільні [20]. Необхідне проведення подальших досліджень.
Оксид азоту
Припускають, що зміни синусоїдальної перфузії при стеатозі призводять до здавлення синусоїдальних просторів та, як наслідок, – до порушень мікроциркуляції у печінці [21]. Відповідно збільшення синтезу вазоактивного модулятора оксиду азоту чи його вивільнення може бути новою ефективною стратегією запобігання НАЖХП та її лікування [22]. Результати двох досліджень підтвердили таку можливість. У першому дослідженні введення гепатоселективного донатора оксиду азоту [O(2)-вініл‑1(піролідин‑1-іл)діазен‑1-іум‑1,2-діолат], V_PYRRO/NO, показало наявні захисні властивості проти стеатозу, викликаного дієтою з високим умістом жиру. Такі донатори оксиду азоту, які не мають системних гіпотензивних ефектів, можуть бути перспективним методом лікування при НАЖХП [22].
У другому дослідженні щодо вивчення оксиду азоту виявлено, що введення L-аргініну, субстрату для оксиднітритсинтази, асоційоване з покращенням перфузії у мікросудинній системі «жирової печінки» [23]. Ці висновки про корисний вплив L-аргініну є особливо цікавими з огляду на результати експериментальних досліджень хронічної хвороби печінки, які продемонстрували, що лікування LOLA забезпечувало значне збільшення (в 2,5 разу) вмісту L-аргініну у плазмі крові [13]. Збільшення рівня циркулюючого L-аргініну було виявлено у пацієнтів із цирозом, які пройшли лікування LOLA [14]. Ці дані свідчать, що механізм, завдяки якому LOLA покращує мікроциркуляцію у печінці при НАЖХП/НАСГ (забезпечуючи підвищені концентрації LOLA-похідного L-аргініну), базується на активації синтезу оксиду азоту (рис. 2).
Висновки
Результати клінічних досліджень підтверджують, що LOLA проявляє гепатопротекторні властивості у пацієнтів з НАЖХП/НАСГ. Про це свідчить здатність LOLA зменшувати підвищений рівень печінкових ферментів, у тому числі AЛТ, а також рівень тригліцеридів у сироватці крові. Крім того, застосування LOLA зумовлює значне поліпшення співвідношення печінки та селезінки на КТ. До механізмів, які відповідають за позитивні ефекти LOLA, належить пришвидшене перетворення складових ферментів LOLA в глутамін, L-аргінін та глутамат. І глутамін, і глутамат мають гепатопротекторні властивості при оксидативному стресі та перекисному окисленні ліпідів за наявності експериментальних НАЖХП/НАСГ. Відомо, що L-аргінін здатний зменшити порушення мікроциркуляції, пов’язані зі вказаними патологіями через посилений синтез оксиду азоту.
Запропоновано застосування нового морфологічного методу виявлення підвищеної концентрації аміаку в печінці, який показав хорошу кореляцію з тяжкістю хронічного захворювання печінки і міг би бути корисним для прогнозу результатів у пацієнтів з жировими захворюваннями печінки [3]. З’ясування сигнальних шляхів, пов’язаних із аміаком і його проміжними продуктами, має потенціал не тільки для виявлення патофізіологічних механізмів при цих патологіях, а й для розроблення нових терапевтичних стратегій та визначення біомаркерів для стратифікації ризику стосовно НАЖХП/НАСГ. Подальші дослідження необхідні для підтвердження відповідності цих механізмів при розгляді патогенезу НАЖХП/НАСГ у популяції пацієнтів та для оцінки ефективності LOLA у правильно структурованому контрольованому клінічному дослідженні.
Список літератури знаходиться в редакції.
Dig Dis, 2019; 37: 63-68.
Переклала з англ. Ольга Мигалатюк
Тематичний номер «Гастроентерологія. Гепатологія. Колопроктологія» № 3 (53), 2019 р.