3 лютого, 2021
Сучасні погляди на стеатоз печінки: ігнорувати чи лікувати?
 Печінка належить до найважливіших органів людини, про що відомо ще з прадавніх часів. У Стародавньому Єгипті для зберігання печінки під час виготовлення мумії використовували спеціальну ємність – канопу, котру, на відміну від інших подібних пристосувань, прикрашала голова бога Амсета – сина бога Гора (рис. 1). Особливу увагу в сучасній медицині привертає стеатоз печінки (СП) – акумуляція ліпідів у гепатоцита [1], що триває безсимптомно роками, але невідомо, коли та чому може спричиняти гепатит, цироз і гепатоцелюлярну карциному. Англомовна база наукової літератури PubMed містить посилання на >4 тис. монографій, 213 тис. статей, а також ≈600 робіт про генетичні основи СП; кількість таких публікацій постійно зростає. Тільки впродовж останнього року оприлюднено >24 тис. статей про СП, проте зацікавлення науковців цією проблемою не зменшується. Підставою для цього є те, що печінка часто зумовлює ефективність лікування всіх інших хвороб людини, адже метаболізм переважної більшості препаратів здійснюється саме в ній.
Печінка належить до найважливіших органів людини, про що відомо ще з прадавніх часів. У Стародавньому Єгипті для зберігання печінки під час виготовлення мумії використовували спеціальну ємність – канопу, котру, на відміну від інших подібних пристосувань, прикрашала голова бога Амсета – сина бога Гора (рис. 1). Особливу увагу в сучасній медицині привертає стеатоз печінки (СП) – акумуляція ліпідів у гепатоцита [1], що триває безсимптомно роками, але невідомо, коли та чому може спричиняти гепатит, цироз і гепатоцелюлярну карциному. Англомовна база наукової літератури PubMed містить посилання на >4 тис. монографій, 213 тис. статей, а також ≈600 робіт про генетичні основи СП; кількість таких публікацій постійно зростає. Тільки впродовж останнього року оприлюднено >24 тис. статей про СП, проте зацікавлення науковців цією проблемою не зменшується. Підставою для цього є те, що печінка часто зумовлює ефективність лікування всіх інших хвороб людини, адже метаболізм переважної більшості препаратів здійснюється саме в ній.
СП є початковою формою жирової хвороби печінки, що розподіляється на неалкогольну (НАЖХП) й алкогольну (МКХ‑10: К70.0 – алкогольна жирова інфільтрація печінки; К76.0 – жирова печінка, некласифікована в інших рубриках). Однак слід пам’ятати, що в клініці такий розподіл є досить умовним, адже інформацію про вживання алкогольних напоїв ми отримуємо зі слів пацієнтів, які можуть бути недостатньо відвертими та щирими щодо цього питання з різних міркувань. Окрім того, навіть серед ¼ пацієнтів, які зловживають алкоголем, не встановлено ураження печінки (хоча, можливо, це зумовлено недостатньою настороженістю лікарів і скринінговим обстеженням із певними обмеженнями). Отже, розподіл жирової хвороби печінки на неалкогольну й алкогольну в реальній практиці є певною мірою досить умовним, про що слід пам’ятати практичному лікарю.
Поширеність
Поширеність СП залишається остаточно невизначеною, оскільки лише в прицільних дослідженнях недоказової медицини проводилося її вивчення. Зокрема, серед 224 осіб без значимих хронічних хвороб віком ≈40 років, які загинули внаслідок неопікової травми, в 48,2% було діагностовано СП, а у 2,7% – стеатогепатит [2]. Вважається, що НАЖХП уражає ⅓-¼ населення розвинених країн [3-5]. У сучасних умовах в епоху пандемії коронавірусної інфекції зростає актуальність вивчення СП, адже вищою є частота СП у пацієнтів із COVID‑19, аніж у загальній популяції (50% [6], 53% [5, 7], 60% [8]), а також вищою є частота тяжкого перебігу COVID‑19 за НАЖХП у 4 рази, тоді як за супутнього ізольованого цукрового діабету (ЦД) 2 типу – лише в 3 рази [5, 9].
Етіологія
Етіологія СП є багатофакторною та включає етнічні, генетичні, метаболічні фактори, вплив довкілля (характер харчування, харчові добавки й замінники, малорухомий спосіб життя тощо) та стан мікробіоти кишок [1]. Дискусійною ми вважаємо наявність первинного СП, зумовленого множинними екзогенними й ендогенними причинами. До ендогенних факторів СП належать переважно метаболічні порушення (метаболічний синдром, дефіцит α1-антитрипсину, ідіопатичний гемохроматоз, хвороба Вільсона-Коновалова, ліподистрофія). Проте з урахуванням первинності зазначених метаболічних процесів такий СП за суттю та генезом також є вторинним. Особливо ця теза стосується СП як наслідку метаболічного синдрому, ожиріння / надлишкової маси тіла та ЦД 2 типу, поширеність яких є пандемічною.
У цьому аспекті варто знову згадати про доведений міжпандемічний глобальний зв’язок COVID‑19 з ожирінням і ЦД. На тлі пандемії коронавірусу 2019-2020 рр. особливої уваги набуває вірусне походження метаболічного ураження печінки. Так, у вересні 2020 р. опубліковано роботу сінгапурських дослідників H.X.J. Lin і V.M. Aravamudan «Метаболічно-асоційована хвороба печінки та COVID‑19: подвійний удар?» (Singapore Medical, 2020), де для НАЖХП застосовується новий термін – «метаболічно-асоційована хвороба печінки» [5]. У 96,8% випадків зміни печінки в разі COVID‑19 проявляються підвищенням трансаміназ [6] та їх відношення (індексу де Рітіса). Метааналіз 24 досліджень за участю 12 882 пацієнтів довів, що підвищення аспартатамінотрансферази (АСТ) спостерігалося в 41%, аланінамінотрансферази (АЛТ) – у 29,1%, а ушкодження печінки на тлі COVID‑19 зі збільшенням трансаміназ статистично значимо асоціювалося з несприятливим наслідком COVID‑19 [8]. Схожі результати описані в метааналізі 31 дослідження за участю 4862 пацієнтів [10] з акцентом на АЛТ, а також у бельгійському метааналізі 11 випробувань із залученням 793 учасників [11], в якому, крім підвищення трансаміназ, відзначено збільшення рівня білірубіну (5,5%), зміну альбуміну сироватки (78,9%), зростання тромбоцитів (20,0%). Отже, якщо говорити про тип ураження печінки при коронавірусній інфекції, то його, найімовірніше, можна визначити як вірус-індукований гепатит, але при цьому значення СП потребує подальшого вивчення.
Екзогенні фактори первинного СП, до котрих належать швидке схуднення та тривале парентеральне харчування, нечасто трапляються в клінічній практиці, проте їх патогенетичну основу також становлять метаболічні порушення. Отже, СП за своїм генезом завжди є вторинним станом, що зумовлює клінічно значимі зміни у стратегії й тактиці лікування.
Патогенез
Механізми розвитку наразі досліджуються. Насамперед вивчаються генетичні основи СП. Зокрема, описано, що генетично детерміновані вищі рівні печінкового Х-рецептора та фарнезоїд-Х-рецептора в периферичних мононуклеарах і знижена кількість дуоденального протеїну Німана-Піка спричиняють СП, а мутації генів обох транспортерів холестерину (NPC1L1 й ABCG8) достеменно пов’язані з холестазом і холелітіазом [12]. Особливого значення науковці надають ядерним рецепторам PPAR, які впливають на запалення, вуглеводний і ліпідний метаболізм [1].
На друге місце серед причин можна поставити зміни жирового й вуглеводного метаболізму та процесів окислення. Під впливом змін регуляції інсуліном і глюкозою в гепатоцитах відбувається підвищення синтезу жирних кислот, що зумовлює підвищення кількості тригліцеридів (ТГ) у цитоплазмі гепатоцитів і зниження вивільнення з них ліпопротеїнів дуже низької щільності з подальшим порушенням β-окислення жирних кислот й активацією їх перекисного окислення [4]. Якщо за НАЖХП метаболічні порушення спричиняють зміни окисних процесів, то за алкогольного ураження печінки особливо сильно індукуються окисні процеси під впливом етанолу, що зумовлює подальші метаболічні зміни, тобто фактично це є перестановкою доданків. Надалі патогенез неалкогольного й алкогольного жирового ураження печінки відбувається однаково: процеси дисметаболізму та надокислення зумовлюють мітохондріальну дисфункцію гепатоцитів та їхню загибель, активацію клітин Купфера, гіперпродукцію цитокінів, колагену, лептину, резистину, адипонектину, ядерного фактора транскрипції та фактора некрозу пухлини в макрофагах печінки [4]. Це ще раз вказує на відносність розподілу жирової хвороби печінки на неалкогольну й алкогольну в клініці. Отже, первинні метаболічні зміни в тканині печінки й окисний стрес є пусковими ланками та підтримувальними факторами запалення в печінці, наслідком чого стає загибель клітин й утворення сполучної тканини, що клінічно проявляється як гепатит (стеатогепатит), цироз печінки, а також гепатоцелюлярна карцинома.
Механізми ураження печінки при інфекції COVID‑19 також залишаються гіпотетичними. Насамперед ідеться про безпосереднє ушкодження вірусом, який інфікує клітини через рецептори ангіотензинперетворювального ферменту‑2 (АПФ-2). Ці рецептори найширше представлені на ендотеліоцитах і м’язових клітинах артерій, у легенях, нирках, стравоході, тонкій кишці й серці, тоді як на клітинах печінки експресія таких рецепторів є відносно низькою. Проте коронавірус переважно надходить до ретикулоендотеліальної системи печінки через тонку кишку [13, 14], що дало змогу дослідникам називати це кишково-печінковою віссю [14]. Після його проникнення відбувається активація клітин Купфера, котрі починають продукувати потужні цитокіни (інтерлейкін‑6), що запускають каскадне запалення в печінці та жировій тканині [5]. Інша гіпотеза вказує на зумовлений коронавірусом дисбаланс у макрофагах зі зсувом від прозапальних макрофагів М1 у бік імуносупресивних М2 [15], що спричиняє зменшення продукції універсального регулятора адипонектину [5], який зазвичай продукується жировою клітковиною. Водночас до механізмів ураження печінки на тлі COVID‑19 належать гепатотоксичність застосованих препаратів для лікування, їхні масивні дози, а також гіпоперфузія й ішемія печінки внаслідок легеневої (пневмонічної) гіпоксії [5].
Дискусійним питанням, яке потребує уваги морфологів, є визначення зворотності змін у печінці, що зумовлюватиме практичні зусилля лікарів. Чи всі морфологічні прояви СП можуть зникати без наслідків? На нашу думку, сумнівним є те, що жирові депозити й особливо жирова дистрофія можуть зникнути безслідно, а клітина стане абсолютно структурно та функціонально нормальною. Слід зазначити, що більшість пускових ланок цього процесу не може бути припиненою одномоментно, а корекція метаболічних порушень навіть в успішних випадках потребує тривалого часу та наполегливих зусиль.
Діагностика
Діагностику СП часто взагалі не проводять, адже клінічно він проявляється лише тоді, коли ліпідами інфільтровано понад ⅔ гепатоцитів [3], а сам патологічний стан переважно є знахідкою звичайного сонографічного обстеження печінки. Сьогодні стандартом діагностики СП вважають ультразвукове дослідження (УЗД) печінки у В-режимі (специфічність – 84%; чутливість – 94%). Цей неінвазивний, доступний і повторювальний дешевий метод рекомендовано сьогодні європейськими асоціаціями з вивчення печінки, діабету й ожиріння. Ехогенність печінки порівнюється з ехогенністю нирки, та здійснюється оцінка внутрішньопечінкових судин, паренхіми, діафрагми [3].
Основні сонографічні ознаки НАЖХП:
- неоднорідність паренхіми (насамперед за рахунок дистального загасання ультразвуку на тлі підвищення її акустичної щільності та збільшення розмірів печінки);
- рівні та недеформовані контури печінки;
- розширення селезінкової (82,3%) та ворітної (94,1%) вен, погана візуалізація центральних судин унаслідок їх компресії перевантаженою жиром паренхімою;
- збільшена площа селезінки (91,2%);
- зменшення показників васкуляризації об’ємної гістограми та підвищення щільності за спеціальною шкалою [3].
Проте слід пам’ятати, що чутливість і специфічність В-режиму УЗД печінки для діагностики першого початкового ступеня СП є невисокими (60-65%), тоді як для діагностики помірного СП (2 ступінь) чутливість методу УЗД уже збігається з чутливістю магнітно-резонансної томографії [3]. Факторами, котрі знижують сонографічну візуалізацію СП, є повітря в кишках, ожиріння, фіброз печінки.
Наразі проводяться спроби стандартизувати УЗД-методики діагностики СП, для чого запропоновано певні розрахунки (Hamaguchi scorе, US-FLI score, hepatorenal index, BSC, CAР, UGAP). За індексом Хамагучі (Hamaguchi М. et al., 2007), із сумарним значенням його від 0 до 3, оцінюються 4 показники: гепаторенальний ехоконтраст, яскравість печінки, глибоке згасання сигналу, нечіткість судин. За ультразвуковим індексом фіброзу печінки (US-FLI score, значення від 2 до 8) враховуються гепаторенальний ехоконтраст, згасання сигналу, погана судинна та діафрагмальна візуалізація, наявність жирових ділянок. Гепаторенальний індекс СП (значення >1,34), запропонований М. Webb і співавт. у 2009 р. як співвідношення ехогенності печінки та кори нирок, має 95% чутливість і 82% специфічність.
Сучасними цифровими системами (наприклад, FibroScan system, Echosens, Франція; Aplio i800 US system Canon Medical Systems, Tochigi, Японія; EUB‑8500 US system, Hitachi Ltd., Японія; General Electric Healthcare Wauwatosa, WI, США) проводиться автоматичний аналіз радіочастот сигналів проведень, що дає змогу вирахувати коефіцієнт розсіювання та контрольований параметр затухання (від 100 до 400 дБ/м), а АТІ-техніки (attenuation imaging) визначають параметр кількісного затухання ехо-сигналу (ultrasound-guided attenuation parameter, UGAP). Окрім того, жорсткість печінки як критерій фіброзу визначається за ультразвуковою чи магнітно-резонансною еластографією печінки [16], стан печінкових судин – за доплерографією печінки [17], а антитоксична функція печінки – за метацетиновим дихальним тестом.
Найдостовірніше діагноз СП дає змогу підтвердити гістологічне дослідження біоптату печінки, в т. ч. під контролем ультразвуку: за його допомогою можна розрізнити 3 ступені активності та 4 стадії СП. Утім, стандартні показання до проведення біопсії печінки не включають стеатозу, а отримані результати значною мірою залежать від навичок і технічних можливостей [18, 19]. Кількісна гістологічна характеристика стадій стеатозу базується на пропорції гепатоцитів із візуалізованими краплинами жиру (СП немає – 0%, 1 стадія – <5%; 2 стадія – 5-33%; 3 стадія – 34-66%; 4 стадія – >66%) із визначенням ознак запалення та балонних змін [20].
Не менш важливе значення для діагностики СП мають лабораторні показники (параметри функції печінки, вуглеводного та ліпідного метаболізму, запалення, ендогенної інтоксикації) (табл. 1). Саме нормальні значення трансаміназ і гострофазових показників запалення дають змогу віддиференціювати СП від стеатогепатиту [21]. Крім того, лабораторне обстеження дає змогу встановити метаболічний фон, зміни котрого і є пусковою ланкою розвитку чи прогресування СП. Згідно з результатами досліджень нашої кафедри, за лабораторними параметрами можна визначити етіологічний варіант СП: метаболічний, алкогольний або вірус-індукований. Зокрема, маркерами метаболічного варіанту СП є підвищені величини ТГ крові, нормальний або незначно підвищений уміст загального холестерину, зміни вуглеводного обміну й інсулінорезистентність (за НОМА-індексом); на алкогольний генез СП вказують підвищення загального холестерину, ліпопротеїнів низької щільності та ТГ; водночас вірус-індукований СП незалежно від генотипу вірусу характеризується низькими величинами загального холестерину, ліпопротеїнів низької щільності та ТГ [22].
Лікування
Досить дискусійним залишається питання лікування СП, оскільки в пацієнтів із СП не виявляється ні «печінкових» скарг, ні об’єктивних «печінкових» змін; найголовніше, що немає лабораторно доведених порушень функцій печінки. Перед лікарем постають такі запитання: чи ігнорувати випадково виявлені сонографічні зміни; чи потребують такі пацієнти медикаментозного втручання, враховуючи чутливість печінки до ксенобіотиків і переважної кількості лікарських засобів? Однозначної відповіді на ці запитання наразі не маємо [4, 23]. На нашу думку, ігнорувати СП не можна ні пацієнту, ні лікарю; однозначно, що необхідно діяти, оскільки жирові депозити в гепатоцитах ініціюють і підтримують асептичне запалення, а також зумовлюють фіброзування тканини з розвитком гепатитів, цирозів або гепатоцелюлярної карциноми. Проте не слід розпочинати з медикаментозної терапії, адже вона має бути ініційована лише після здійснення перших двох тактичних напрямів.
Стратегію щодо СП на сьогодні можна визначити так: навіть найменші зміни у структурі чи функції печінки потребують корекційних заходів. У плані СП – це єдиний час для вчасного проведення повноцінної профілактики уражень печінки, котрі ми докладно описали в роботі «Профілактика уражень печінки в практиці сімейного лікаря» [24]. Пацієнти з ознаками СП належать до осіб із високим ризиком ураження печінки, тому це не можна ігнорувати; щодо них потрібно планувати та здійснювати індивідуальні профілактичні заходи.
Оцінка індивідуального сукупного ризику уражень печінки має проводитися за 3 основними обов’язковими напрямами:
- визначення ймовірності інфікування вірусами гепатитів;
- встановлення фактів уживання алкоголю (навіть не зловживання ним!);
- загального медикаментозного навантаження на пацієнта – які ліки (як часто, з якого приводу, в яких дозах), додатково для жінок – контрацептиви, додатково для спортсменів – андрогени, анаболічні гормони (табл. 2).

Особливу увагу слід приділяти пацієнтам високого кардіоваскулярного ризику, котрі дуже часто мають метаболічний синдром, пожиттєво приймають низку препаратів, мають старший вік і низку супутніх хвороб, тому в них варто прицільно перевіряти рекомендовані та застосовані дози всіх медикаментів.
Тактику дій лікаря за умови виявленого в пацієнта СП можна розподілити на 3 однаково важливі моменти:
- активна модифікація стилю життя пацієнта;
- інтенсивна корекція причинного стану, що зумовив такі зміни печінки: зменшення надмірної маси тіла / ожиріння, усунення порушень ліпідного та/або вуглеводного обміну, адекватне лікування ЦД у співпраці з ендокринологом; діагностика та лікування хронічних хвороб системи травлення у співпраці з гастроентерологом, ліквідація чи хоча би зменшення проявів метаболічного синдрому й інших метаболічних порушень;
- медикаментозна терапія (рис. 2).
Активна модифікація способу життя пацієнта
Обов’язковим базисом корекції стану печінки має бути активна модифікація стилю життя – повна відмова від алкоголю, повноцінне різноманітне харчування зі зменшеною калорійністю, низьким умістом жирів і вуглеводів, збагачене поліненасиченими жирними кислотами та вітамінами; зменшення маси тіла й регулярні фізичні вправи. Описано, що зі зменшенням калорійності харчування спостерігається зменшення рівня ліпідів у печінці за магнітною резонансною спектроскопією, але без зменшення вмісту ТГ, ліпопротеїнів високої щільності й АЛТ [25]. Дієта, збагачена поліненасиченими жирними кислотами – лігандами рецептора PPAR, в експерименті підвищувала чутливість до інсуліну, зменшувала акумуляцію жирів у печінці [26], проте клінічно ці дані підтверджені лише в невеликих дослідженнях. Розглядається користь припинення куріння, пряма дія котрого на печінку не встановлена, хоча значення цього заходу для первинного запобігання метаболічному синдрому та зменшення кардіоваскулярного ризику не підлягає сумніву.
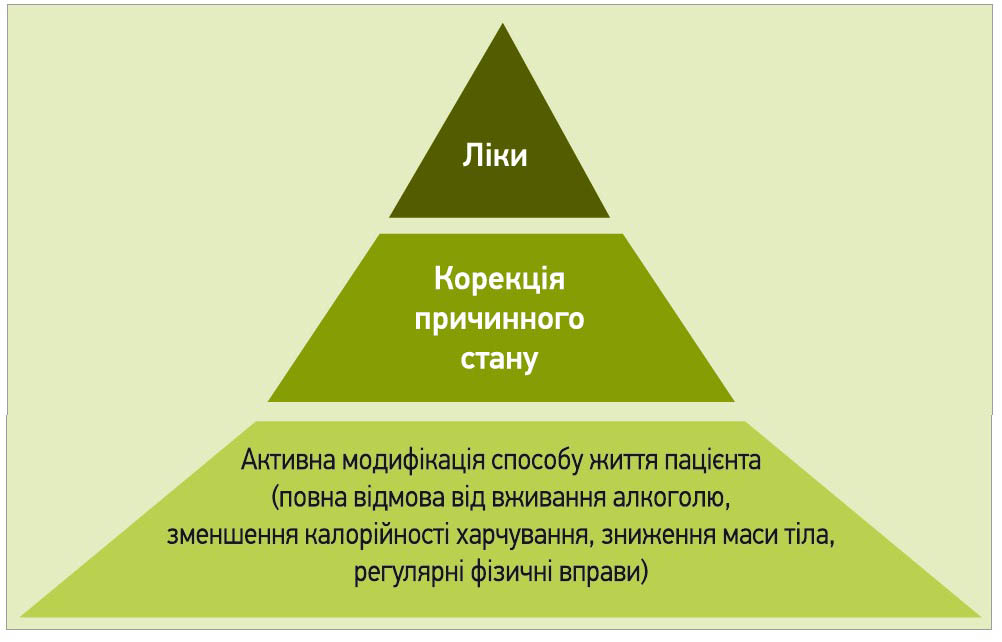 Рис. 2. Тактика дій лікаря за виявленого СП
Рис. 2. Тактика дій лікаря за виявленого СП
Проте власна практика доводить, що шлях активної модифікації способу життя не приваблює ні лікарів, ні пацієнтів, адже потребує ретельної тривалої роботи й об’єднаних зусиль. Єдиним винятком можна вважати алкоголізм і зловживання алкоголем, шкоду котрих розуміють усі, проте за незначного вираження клінічних симптомів алкоголізму та відсутності явних клінічних і лабораторних ознак ураження печінки повної абстиненції досягти досить складно. Крім того, навіть у ґрунтовних наукових та освітніх роботах, присвячених НАЖХП, такий основний напрям терапії залишається поза увагою.
Інтенсивна корекція причинного стану
Корекція причинного стану, що зумовив СП, дає реальний, а не уявний результат, хоча зазвичай повністю її практично не можна здійснити. Крім того, це потребує наполегливої тривалої співпраці команди лікарів і пацієнта та значно залежить від характеру причини. Так, разом із кардіологом слід активно виявляти та лікувати хвороби системи кровообігу (з контролем рекомендованих і реально застосованих доз препаратів); з ендокринологом – ЦД, метаболічний синдром, інші порушення вуглеводного обміну та гіпотиреоз; із гастроентерологом – панкреатит (стеатоз підшлункової залози), біліарний сладж і холецистит, холелітіаз, кишковий дисбіоз, хронічний ентерит; із психіатром – депресивні розлади, що часто спричиняють збільшення маси тіла, алкоголізм; із хірургом – холелітіаз, морбідне ожиріння тощо, причому всі гепатотоксичні препарати мають бути вилучені з лікування, дози застосованих засобів ретельно вивірені, а кількість медикаментів, які пацієнт приймає постійно чи тривало, має бути зменшена до мінімуму.
Медикаментозна терапія
Медикаментозне лікування СП дотепер залишається не менш дискусійним питанням, оскільки методів прицільного впливу на жирові депозити в гепатоцитах і процеси жирової дистрофії печінки ми не маємо, а кількість медикаментів, які негативно впливають на печінку, є досить значною. Крім того, на практиці часто не враховується конкуренція препаратів за ферменти метаболізму в гепатоцитах.
Для медикаментозного лікування СП нині запропоновано агоністи PPAR (фібрати); препарати, що зменшують інсулінорезистентність і підвищують чутливість до інсуліну (метформін, тіазолідиндіони, блокатори рецепторів ангіотензину ІІ); урсодезоксихолева кислота (УДХК), гепатопротектори, антиоксиданти (рис. 3). Власна практика доводить, що лікарі мало звертають уваги на необхідність корекції дисліпідемії й інсулінорезистентності, що поряд із покращенням обміну жовчних кислот може вважатися патогенетичною терапією. За потреби розглядається також доцільність застосування засобів для зменшення маси тіла, антидепресантів, гормонозамісної та ферментозамісної терапії, пробіотиків тощо.
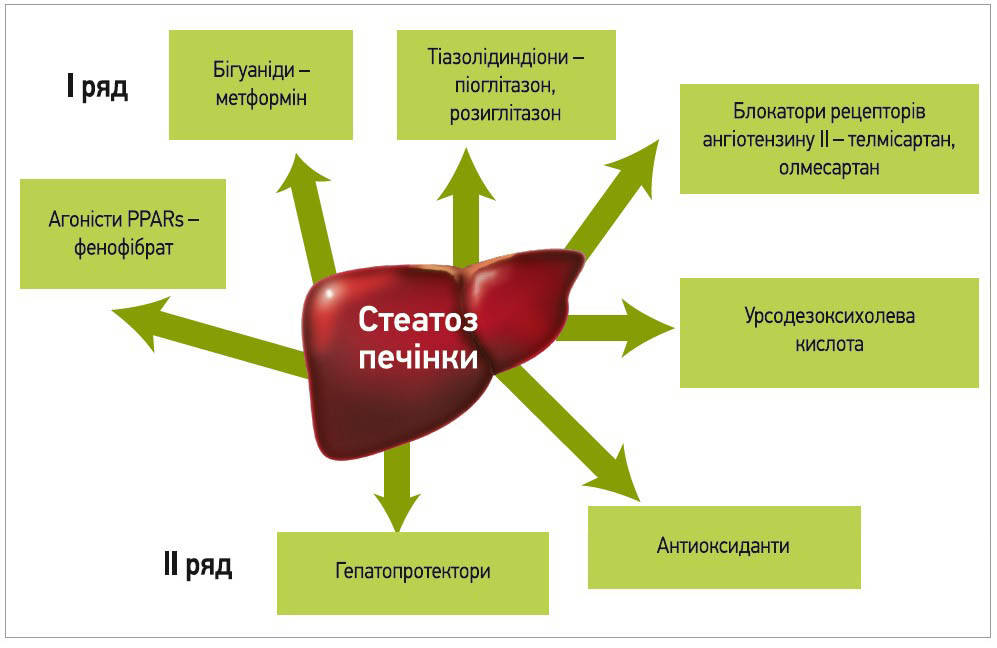 Рис. 3. Медикаментозні засоби, котрі застосовуються для лікування СП
Рис. 3. Медикаментозні засоби, котрі застосовуються для лікування СП
Особливе значення для науковців має активація ядерних рецепторів PPAR, що впливає на запалення, вуглеводний і ліпідний метаболізм [1], оскільки перша генерація агоністів PPAR (фенофібрати) наразі надала нові перспективи лікування СП. Описано, що фібрати зменшують експресію та секрецію фактора некрозу пухлини й інтерлейкіну‑6 через сигнальний шлях NF-κB, що зменшує запалення в паренхімі печінки [27]. Фібрати належать до PPAR-α-лігандної терапії; особливо показані за холестазу [28].
Для корекції інсулінорезистентності запропоновано метформін, тіазолідиндіони та блокатори рецепторів ангіотензину ІІ. Слід нагадати, що в такому разі йдеться не про лікування супутнього ЦД, а про патогенетичне лікування СП. Метформін – бігуанід із класу гіпоглікемічних засобів, препарат першої лінії лікування ЦД 2 типу, що діє через зменшення викиду глюкози печінкою, збільшення утилізації глюкози в периферичних тканинах, яка регулюється інсуліном, зменшує концентрацію вільних жирних кислот у сироватці. Важливими властивостями препарату є те, що він зумовлює зменшення маси тіла (на відміну від інших гіпоглікемічних засобів) і не так часто спричиняє гіпоглікемію. Експериментальні дослідження довели, що метформін зменшує гепатомегалію, прояви СП і нормалізує печінкові проби [5]. У відкритому рандомізованому дослідженні 110 пацієнтів із НАЖХП без ЦД метформін зумовлював більше зменшення АЛТ, покращення гістології печінки та збільшення чутливості до інсуліну, ніж за умови лікування вітаміном Е та зменшення маси тіла [29].
Тіазолідиндіони (піоглітазон, розиглітазон) підвищують чутливість до інсуліну в еуглікемічних і діабетичних пацієнтів шляхом активації рецептора PPAR-γ. В експериментах продемонстровано, що захисний ефект піоглітазону за НАЖХП залежить від регуляції адипонектину й істотного зниження білка SREBP‑1c (sterol regulatory element-binding protein 1c), який контролює експресію майже всіх генів, відповідальних за синтез жирних кислот і ТГ [30]. Адипонектин нині вважається первинним медіатором ефекту тіазолідиндіонів на гомеостаз глюкози, чутливість до інсуліну та ліпідний метаболізм; він підвищує рівень окислення жирних кислот у м’язах, зменшує вміст ліпідів у гепатоцитах, має антифібротичні та протизапальні властивості [31]. В експериментах на тваринах піоглітазон і розиглітазон запобігали активації зірчастих клітин печінки, що зменшувало фіброз; навіть тижневе застосування піоглітазону сприяло значному зменшенню вмісту ТГ у печінці та рівня фактора некрозу пухлини, а після 4 тиж застосування препарату було зафіксовано зменшення ступеня фіброзу печінки зі зниженням умістів проколагену, α-актину та фактора росту пухлини-β [32]. Схожі ефекти отримано в клінічних дослідженнях [33].
Суттєву роль у розвитку інсулінорезистентності має ренін-ангіотензин-альдостеронова система, що впливає на внутрішньоклітинну інсулінову регуляцію через активацію PPAR-γ, нормалізує продукцію адипонектину та запобігає активації зірчастих клітин печінки, що в комплексі зменшує запалення та фіброгенез у паренхімі печінки [34]. Зважаючи на потенційну гепатотоксичність інгібіторів АПФ, препаратами вибору є блокатори рецепторів ангіотензину II. На думку науковців, телмісартан та олмесартан покращують інсуліночутливість, тому можуть бути використані як гепатопротектори [34]. Експериментальні дослідження продемонстрували, що застосування телмісартану впродовж 3 міс зменшувало експресію PAI‑1 (plasminogen activator inhibitor‑1), що може запобігти жировій хворобі печінки [35], а використання лоcартану у хворих на артеріальну гіпертензію з НАЖХП зумовлювало зменшення рівня маркерів фіброзу в сироватці та покращення мікроскопії печінки після однорічного застосування [36].
Досить перспективним є застосування УДХК – гідрофільної жовчної кислоти, що сповільнює апоптоз, зменшує токсичність жовчних кислот, зменшує окисний стрес, має холеретичний, гіполіпідемічний, імуномодeлювальний, протипухлинний, протизапальний, цитопротекторний ефекти [37]. За НАЖХП її ефективність була доведена лише в невеликих дослідженнях, але клінічні симптоми вказують на покращення стану пацієнтів. За іншими даними, не виявлено структурних змін печінки в 166 біоптатах печінки після дворічного застосування УДХК [38]. Для підвищення ефективності УДХК запропоновано комбінувати її з антиоксидантом – вітаміном Е [39].
Користь щодо ліквідації СП, яка викликає найбільші дискусії, на наш погляд, мають гепатопротектори, котрі найчастіше призначаються таким пацієнтам. Незважаючи на те що вони нормалізують функціональну активність печінки, мають антиоксидантну, антигіпоксичну та протифібротичну дії, стабілізують мембрани клітин, позитивно впливають на енергозабезпечення гепатоцитів, підвищують резистентність печінки до ушкодження [40], конкретні показання до їх застосування остаточно не встановлено, а наявність на фармацевтичному ринку гепатопротекторів різного складу лише ускладнює раціональний вибір, хоча основну увагу привертають есенціальні фосфоліпіди, котрі відновлюють структуру ушкоджених мембран гепатоцитів, а також їхню фізіологічну активність, але (як і силімарин) протипоказані за внутрішньопечінкового холестазу [40].
Серед антиоксидантів у лікуванні НЖХП чільне місце посідає вітамін Е, що стабілізує біологічні мембрани шляхом захисту ненасичених жирних кислот від ліпідної пероксидації та дії радикалів. Описано, що застосування вітаміну Е впродовж 1 року (300 мг/добу) пригнічувало експресію гена TGF-β1 і регулювало цитокінову стимуляцію зірчастих клітин, що було показано на біоптатах печінки [41]. За іншими даними, застосування вітаміну Е в утричі вищій дозі (1000 мг/добу) впродовж півроку не супроводжувалося зменшенням ступеня СП, хоча було виявлено покращення [42]. Отже, вітаміну Е недостатньо для пригнічення прогресії СП без інших заходів.
Останнім напрямом медикаментозного впливу при СП є корекція інших метаболічних, причинних або супутніх станів – ліпідного дисметаболізму в пацієнтів високого кардіоваскулярного ризику, ожиріння, кишкового дисбіозу, депресії, котрі обираються за додатковими показаннями зі врахуванням доцільності, гепатотоксичності та шляхів елімінації. У такій роботі неможливо всі їх розглянути, тому зупинимося лише на певних важливих положеннях.
Зокрема, в пацієнтів високого кардіоваскулярного ризику гіполіпідемічна терапія статинами й езетимібом, на нашу думку, має розглядатися лише після недостатньої ефективності фібратів щодо зниження ліпідів. Хоча за умови застосування статинів не виявлено покращення мікроскопічного стану печінки [31], описано запобігання розвитку фіброзу печінки під їх впливом [43], але таке положення потребує подальших досліджень. Додаткова проблема – потенційна гепатотоксичність статинів, яку деякі фірми наразі пропонують ігнорувати, хоча існує достатньо доказів, що стандартне застосування статинів є безпечним для пацієнтів із базовими хворобами печінки навіть із підвищенням амінотрансфераз з акцентом на використання гідрофільних засобів (правастатин) [44]. У метааналізі доцента нашого університету Л. М. Стрільчук доведена ефективність комбінованого застосування езетимібу (інгібітора абсорбції холестерину) й акарбози (інгібітора α-глюкозидази) впродовж 6 міс на збільшення експресії мікросомального ТГ-транспортного протеїну та РРАR-α в печінці, а отже, покращення ліпідного обміну [45].
За збільшення індексу маси тіла >30 розглядається доцільність призначення медикаментів для зменшення маси тіла, для чого рекомендовано анорексичні засоби центральної дії (сибутрамін), які є специфічними інгібіторами захоплення норепінефрину, серотоніну та дофаміну в нервових закінченнях, що зумовлює підвищення відчуття насиченості [46]. Застосовувати ці препарати слід обережно, оскільки вони спричиняють транзиторне підвищення печінкових ферментів. Перевагу варто віддавати засобам із периферичною дією (орлістат), які пригнічують шлунково-кишкові ліпази [47].
Що стосується застосування антидепресантів, то слід пам’ятати, що більшість із них мають гепатотоксичну дію та спричиняють внутрішньопечінковий холестаз, тому мають призначатися за конкретними показаннями.
Висновки
- СП – пускова ланка ланцюгового ушкодження печінки, часто є коморбідним обтяжувальним тлом інших хвороб, впливає на ефективність будь-якого лікування, добре та легко діагностується; має завжди бути у фокусі уваги клініцистів.
- Основа лікування – модифікація стилю життя (зменшення маси тіла, харчування зі зменшенням калорій і збагаченням поліненасиченими жирними кислотами, регулярна фізична активність, повна відмова від алкоголю), а також корекція причинного стану.
- До препаратів патогенетичної терапії СП належать активатори ядерних рецепторів PPAR (фібрати), засоби, що зменшують інсулінорезистентність і підвищують чутливість до інсуліну (метформін, тіазолідиндіони, блокатори рецепторів до ангіотензину II), УДХК, антиоксиданти; гепатопротектори мають другорядне значення.
- Уся медикаментозна терапія має бути ретельно виваженою з визначенням показань до призначення, доз і тривалості лікування.
Список літератури знаходиться в редакції.
Медична газета «Здоров’я України 21 сторіччя» № 1 (494), 2021 р.



