21 грудня, 2019
Менеджмент менопаузальных симптомов после перенесенного рака: научно обоснованный подход к оказанию первичной помощи
Нарушение функции яичников часто наблюдается у женщин после лечения рака. Симптомы менопаузы возникают в более раннем возрасте у больных раком и могут быть более серьезными, чем при естественной менопаузе. Системная менопаузальная гормональная терапия (МГТ) является наиболее эффективным методом лечения этих симптомов, однако подходит не всем пациенткам, перенесшим рак. В таких случаях рекомендуются альтернативные эффективные негормональные методы лечения.
Менопауза – физиологический этап в жизни женщины, который наступает в среднем в возрасте 51 года. Проявления гормональных изменений в этот период, включают вазомоторные симптомы (приливы и ночную потливость), симптомы вульвовагинальной атрофии (сухость, зуд и дискомфорт во влагалище) и диспареунию. Кроме того, во время менопаузального перехода также повышается частота расстройств сна; это нарушение может быть вторичным по отношению к вазомоторным симптомам. К симптомам, связанным с возрастом, также относятся когнитивное снижение, перепады настроения и проблемы со стороны костно-мышечной системы.
Согласно статистическим данным, 1,5% женского населения Австралии больны раком. У женщин в возрасте до 25 лет лейкемия, лимфома и меланома являются наиболее часто диагностируемыми видами рака. В то же время в возрасте 25‑49 лет наиболее распространенными являются рак молочной железы (РМЖ), меланома и рак щитовидной железы. Лечение этих состояний, как и наличие самого рака, часто приводит к раннему развитию менопаузы или появлению менопаузальных симптомов. В метаанализе A. Overbeek et al. (2017) 45 исследований с участием перенесших рак пациентов (диагностированный с детства до 40 лет) обнаружено, что средний возраст наступления менопаузы у этой категории больных составляет 44 года. Это может привести к возникновению у пациентки дистресса. Кроме того, у многих выживших после РМЖ симптомы менопаузы являются одними из наиболее стойких и неприятных последствий лечения и могут быть более тяжелыми, чем у здоровых женщин.
Диагностика менопаузы после рака иногда вызывает затруднения, поскольку возможно возобновление овуляции после 2 или более лет индуцированной химиотерапией аменореи. Сведения относительно обращения за медицинской помощью, назначения лечения симптомов менопаузы и удовлетворенности таковым у перенесших рак пациенток ограничены, однако известно, что треть больных раком женщин не удовлетворены качеством обсуждения с врачом до начала лечения рака проблем репродуктивного здоровья, в т. ч. появления симптомов менопаузы.
Настоящий обзор литературы проведен с целью предоставления информации о патогенезе и принципах лечения менопаузальных симптомов у женщин, перенесших злокачественное заболевание.
Патогенез менопаузальных симптомов, связанных с онкопатологией
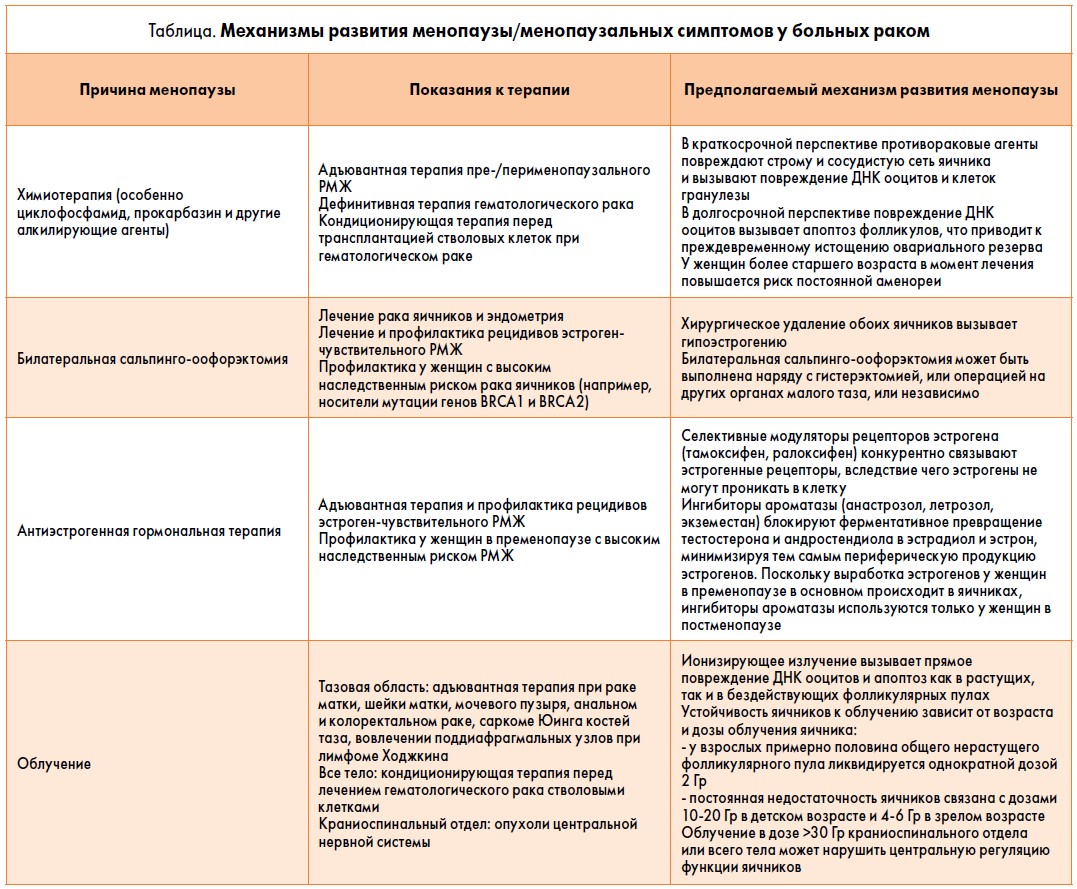
Механизм индукции менопаузы или менопаузальных симптомов варьируется в зависимости от типа рака и способа лечения. Они могут быть результатом хирургического вмешательства, химио- или лучевой терапии рака или быть связаны с эффектами применения антиэстрогенных препаратов (таблица). Кроме того, лицам, у которых диагностируется РМЖ, рекомендуется прекратить лечение с помощью МГТ, что обычно приводит к рецидивированию симптомов менопаузы.
Хирургическая менопауза
Билатеральная оофорэктомия у женщин в пременопаузе в сочетании с сальпингоэктомией может использоваться для лечения рака эндометрия и яичников или рекомендоваться в качестве метода профилактики женщинам с высоким наследственным риском развития рака яичников или молочной железы. В результате удаления яичников возникает хирургическая менопауза. Хирургическая менопауза, по-видимому, вызывает более частые и тяжелые вазомоторные симптомы и нарушения сексуальной функции, чем естественная менопауза.
Индуцированная облучением менопауза
Ткань яичников очень чувствительна к ионизирующей радиации. В лечении рака органов брюшной полости и таза часто используется лучевая терапия или брахитерапия, при этом яичники обычно подвергаются воздействию облучения. Облучение тазовой области при раке шейки матки или ободочной и прямой кишки обычно приводит к недостаточности яичников. У пациенток в пременопаузе, у которых проводится лучевая терапия в области таза по поводу рака, не связанного с яичником, перед местным облучением можно хирургически переместить один или оба яичника из поля воздействия. Согласно результатам метаанализа (Mossa B. et al., 2015), этот метод способствует сохранению функции яичников примерно у 70% пациенток, однако не выяснено, улучшает ли транспозиция яичников исходы беременности.
Кроме влияния на яичники, облучение таза вызывает стойкую атрофию эндометрия и миометрия, а также фиброз миометрия. Радиационное повреждение слизистой влагалища может привести к формированию спаек, изъязвлению, атрофии слизистой и фиброзу, вызывая укорочение и сужение (стеноз) влагалища у 1,25‑88% пациенток в зависимости от дозы и участка облучения и сопутствующей терапии (Morris L. et al., 2017).
Индуцированная химиотерапией менопауза
Адъювантная химиотерапия, применяемая для лечения распространенных раковых заболеваний у женщин, может быть гонадотоксичной. В исследовании A. Overbeek et al. (2017) с участием больных раком детей и молодых женщин схемы химиотерапии, наиболее связанные с развитием ранней нехирургической менопаузы, включали алкилирующие препараты; возможно, их эффект на функцию яичников зависел от дозы циклофосфамида. Степень тяжести вазомоторных симптомов, по-видимому, не отличается у онкологических пациентов, прошедших химиотерапию, хотя имеются данные (Davis S. R. et al., 2014; Marino J. L. et al., 2016), что диспареуния более выражена после этого метода лечения.
Индуцированные эндокринной терапией симптомы менопаузы
Использование эндокринной терапии для снижения уровня эстрадиола рекомендуется в качестве адъювантной терапии для женщин с эстроген-рецептор-положительным РМЖ и в качестве профилактики для лиц с высоким наследственным риском этой патологии.
Лечение РМЖ у пациенток в постменопаузе обычно включает эндокринную терапию продолжительностью до 10 лет. У женщин в пременопаузе подавление функции яичников с помощью агонистов гонадотропин-рилизинг-гормона в дополнение к эндокринной терапии способствует повышению частоты приливов.
Эндокринная терапия (тамоксифен или ингибиторы ароматазы) вызывает вазомоторные симптомы приблизительно у 80% женщин, причем они более выражены среди пациенток, получающих тамоксифен. Кроме того, применение как тамоксифена, так и ингибиторов ароматазы связано с сексуальной дисфункцией (сухость влагалища, диспареуния, потеря сексуального интереса), которая может сохраняться в течение многих лет после приема препаратов. Отмечено, что данные нарушения более выражены при применении ингибиторов ароматазы. До 50% женщин оказываются не в состоянии завершить 5-летний курс эндокринной терапии. Смена препаратов для преодоления побочных эффектов является распространенным явлением и может быть эффективной у 58‑77% пациенток. В ходе анализа в подгруппах в рамках рандомизированного контролируемого исследования эффективности летрозола и экземестана (Kadakia K. C. et al., 2017) обнаружено, что у женщин (n=83), которые прекратили прием назначенного им лекарственного средства из-за непереносимости, переход на другой препарат улучшил исходы (включая частоту вазомоторных симптомов) без значительного изменения уровня эстрадиола.
Трансплантация гемопоэтических стволовых клеток
Первичная недостаточность яичников возникает после высокодозовой химио- и лучевой терапии, необходимой для трансплантации стволовых клеток. При многих гематологических злокачественных заболеваниях кондиционирующая (подготовительная) терапия перед трансплантацией стволовых клеток включает общее облучение организма; однако трудно дифференцировать влияние на функцию яичников общего облучения от гонадотоксического воздействия сопутствующей химиотерапии. Более того, примерно у половины пациенток, перенесших трансплантацию гемопоэтических стволовых клеток, может развиться болезнь отторжения (graft-versus-host disease) с проявлениями в генитальной области. Признаки этого заболевания со стороны женских половых органов включают эритему и эрозии вульвы, рубцы в вульвовагинальной зоне, а сухость, зуд, боль во влагалище и диспареуния аналогичны симптомам менопаузальной генитальной атрофии. Это заболевание также может привести к стенозу влагалища, диагностика которого затруднена без биопсии.
Терапевтические опции
Менопаузальная гормональная терапия
Лечение связанной с раком менопаузы зависит от типа злокачественного заболевания и генеза симптомов. МГТ – предпочтительный метод терапии для пациенток, приближающихся к возрасту естественной менопаузы, при условии что наличие рака не является противопоказанием к ее назначению. МГТ включает препараты эстрогенов с/без прогестагена. Она может применяться системно, как пероральная или трансдермальная терапия, или местно для лечения симптомов вагинального дискомфорта. Системная МГТ является наиболее эффективным средством лечения вазомоторных симптомов и способствует улучшению сна у женщин, испытывающих эти симптомы ночью. Для пациенток с интактной маткой в схемы лечения включают прогестоген с целью предотвращения гиперплазии эндометрия или рака эндометрия. Тиболон, селективный модулятор рецепторов эстрогена с антиэстрогенной активностью, также может использоваться для лечения вазомоторных симптомов, но, по-видимому, является менее эффективным, чем эстрогенные препараты.
Основной проблемный вопрос, требующий рассмотрения при назначении МГТ перенесшим рак пациенткам: может ли она вызывать прогрессирование или рецидив заболевания? Данные доказательной базы варьируются в зависимости от типа рака. При принятии решения следует учитывать чувствительность конкретного типа заболевания к эстрогенам и наличие клинических доказательств о стимулирующем влиянии терапии эстрогенами на рост/рецидив опухоли.
МГТ после РМЖ. Несмотря на незначительное количество доказательств относительно безопасности системной МГТ после РМЖ, международный консенсус не рекомендует ее использование у пациенток, перенесших РМЖ любого типа. Кроме того, учитывая наличие данных (Kenemans P. et al., 2009) о повышении риска рецидива РМЖ на фоне применения тиболона, этот препарат не следует назначать данной категории больных.
МГТ после гематологического рака. Имеются ограниченные данные, свидетельствующие о безопасности использования МГТ после гематологических онкологических заболеваний (лейкоз, лимфома, множественная миелома). МГТ рекомендуется до достижения возраста естественной менопаузы всем лицам с преждевременной недостаточностью яичников (более 90% женщин в пременопаузе, перенесших трансплантацию гемопоэтических стволовых клеток). Трансдермальный путь введения МГТ может быть предпочтительнее, поскольку пациентки с гематологическим раком в анамнезе подвержены повышенному риску тромбоэмболических осложнений в связи с их заболеванием.
МГТ после колоректального рака. Считалось, что МГТ безопасна для симптомных пациенток, перенесших колоректальный рак, однако имеющиеся данные о ее безопасности ограничены и неоднозначны. Согласно результатам наблюдательных исследований (Kuhle C. L. et al., 2016; Marjoribanks J. et al., 2017), МГТ после колоректального рака связана с более низкой смертностью. Доказательства также экстраполируются из результатов рандомизированных контролируемых исследований, проведенных в рамках исследования Women’s Health Initiative. Первоначальный анализ данных показал, что комбинированная МГТ снижала частоту возникновения колоректального рака. Однако недавно проведенный J. E. Manson et al. (2017) анализ обобщенных данных за 18-летний период наблюдения свидетельствует, что в объединенной когорте смертность от колоректального рака существенно не отличалась ни в одном из исследований. Вместе с тем после стратификации данных по возрасту в исследовании с применением только эстрогенов наблюдался повышенный уровень смертности от колоректального рака у женщин в возрасте 70‑79 лет.
МГТ после рака легких. МГТ, по-видимому, не влияет на заболеваемость раком легких, но рецепторы эстрогена экспрессируются в нормальной и малигнизированной легочной ткани. По результатам post hoc анализа результатов исследования Women’s Health Initiative, комбинированная МГТ была связана с повышенным риском смертности от рака легких независимо от статуса курения, и поэтому рекомендуется информировать женщин с высоким риском развития рака легких об этом факте. В настоящее время не существует конкретных рекомендаций по применению МГТ после рака легких.
МГТ после гинекологического рака. У женщин с неэстрогензависимыми гинекологическими злокачественными новообразованиями, включая рак вульвы и влагалища, плоскоклеточный рак шейки матки и большинство видов рака матки, MГT может использоваться в краткосрочной перспективе для лечения вазомоторных симптомов и вагинальной атрофии.
Хотя большинство видов рака эндометрия считаются эстрогензависимыми, существует ограниченное количество доказательств того, что эстрогены можно безопасно использовать у женщин на ранней стадии низкодифференцированного рака эндометрия; в то же время нет данных об использовании эстрогенов после распространенного рака эндометрия. Более того, согласно руководству Североамериканского общества по проблемам менопаузы (2017), перенесенный эстрогензависимый рак эндометрия является противопоказанием к применению МГТ. В немногочисленных наблюдательных исследованиях не было продемонстрировано неблагоприятных результатов МГТ у лиц, перенесших эпителиальную карциному яичника. Однако, учитывая экспрессию эстрогенных рецепторов в низкодифференцированной серозной карциноме, эту терапию нельзя рекомендовать при серозном раке. Не имеется данных относительно безопасности МГТ при других потенциально эстрогензависимых опухолях (саркома матки, цервикальная аденокарцинома, опухоли клеток гранулезы яичников и пр.), следовательно, нужно избегать назначения этого метода при таких новообразованиях.
МГТ после меланомы. Злокачественная меланома долгое время считалась эстрогензависимой патологией. Имеющиеся данные в отношении влияния МГТ на прогрессирование и прогноз заболевания неоднозначны. Необходимы дополнительные доказательства касательно безопасности МГТ у пациенток, перенесших меланому.
Терапия биоидентичными гормонами
Эффективность биоидентичных гормонов в облегчении приливов умеренной и тяжелой степени превосходит плацебо. Однако не установлена их эффективность по сравнению с обычной МГТ, а также безопасность при долгосрочном применении у больных раком.
Эстрогены для интравагинального применения
Доказано, что местное применение эстрогенов эффективно в лечении вульвовагинальной атрофии. Согласно результатам систематического обзора (Lethaby A. et al., 2016), не найдено различий в частоте побочных эффектов между интравагинальным применением эстрогенов и плацебо. В исследовании M. E. Melisko et al. (2017) эффективности вагинального кольца у пациенток постменопаузального возраста с ранней стадией РМЖ, принимавших ингибиторы ароматазы, обнаружено, что эстрогены способствовали устранению атрофии влагалища и улучшению качества сексуальной жизни без повышения уровня системного эстрадиола. Однако безопасность интравагинального использования эстрогенов у пациенток с РМЖ остается спорным вопросом, и следует придерживаться индивидуального подхода в каждом случае. Рекомендуется установить тесную связь с хирургом и онкологом, наблюдающими пациентку.
Негормональная терапия
Вазомоторные симптомы менопаузы. В лечении вазомоторных симптомов эффективны селективные ингибиторы обратного захвата серотонина и норадреналина, клонидин и габапентин. Циталопрам (10‑20 мг/сут) был специально исследован (Barton D. L. et al., 2010) у пациенток с РМЖ, и было доказано, что его применение способствует снижению частоты приливов (максимальный период наблюдения составил 7 нед). Данные об использовании сертралина у лиц с РМЖ ограниченны, и поэтому не следует рекомендовать этот препарат. Необходимо избегать назначения флуоксетина и пароксетина у больных, использующих тамоксифен, так как они могут ухудшить превращение последнего в его активный метаболит. Венлафаксин (таблетки пролонгированного действия, 75 мг/сут) снижает частоту приливов у женщин с РМЖ на 10‑40%, улучшение состояния происходит быстрее, чем при применении клонидина, и пациентки предпочитают его габапентину.
Когнитивно-поведенческая терапия (в группе или индивидуально) улучшает переносимость, но не снижает частоту вазомоторных симптомов у пациенток с РМЖ. Использование клинического гипноза представляется многообещающим, исходя из результатов исследования G. Elkins et al. (2008) с участием 51 пациентки, перенесших РМЖ. В нем было показано ослабление вазомоторных симптомов, улучшение настроения и сна после гипнотического воздействия. Прием фитоэстрогенов может уменьшить выраженность вазомоторных симптомов и сухости влагалища, но имеющиеся доказательства такого эффекта относятся к категории низкого или среднего качества. Эти данные не подтверждают эффективность иглоукалывания, техник релаксации, йоги или других упражнений в контроле вазомоторных симптомов. Блокада звездчатого ганглия (инъекция местного анестетика в симпатические нервные волокна для прерывания терморегуляции) является инвазивной, дорогостоящей процедурой; кроме того, недостаточно доказательств ее эффективности в лечении вазомоторных симптомов.
Симптомы вагинальной атрофии. Для лечения сухости влагалища рекомендуется использование увлажняющих средств и лубрикантов. Североамериканское общество по проблемам менопаузы рекомендует использовать вагинальные увлажняющие средства для облегчения симптомов сухости влагалища, в то же время не имеется достаточных доказательств в пользу их эффективности. В качестве основы при изготовлении лубрикантов применяется вода, минеральные и растительные масла, а также полимеризованные силоксаны (лубриканты на основе силикона). Средства на основе масел не могут использоваться наряду с латексными презервативами. Гликоли (например, глицерин и пропиленгликоль) могут добавляться в лубриканты на водной основе для повышения стойкости, однако при их применении повышается риск повреждения эпителия. В рандомизированном контролируемом исследовании (Hickey M. et al., 2015) увлажняющих средств на водной и силиконовой основе с участием пациенток с РМЖ показано, что лубрикант на силиконовой основе более эффективен в уменьшении боли во время полового акта.
Нарушения сна, связанные с менопаузой. В исследованиях эффективности негормональной терапии симптомов менопаузы у больных раком изучению нарушений сна уделено недостаточно внимания. У перенесших РМЖ женщин с вазомоторными симптомами добавление к лечению золпидема (10 мг на ночь) улучшало сон и качество жизни (Joffe H. et al., 2010). Также улучшению сна у этой категории больных может способствовать когнитивно-поведенческая терапия.
Плотность костной ткани
В период менопаузального перехода снижается минеральная плотность костей, вследствие чего повышается риск переломов. Еще более высокому риску переломов подвержены больные раком из-за развития ранней менопаузы, применения ингибиторов ароматазы, лучевой терапии и кортикостероидов.
Доказано, что системная МГТ снижает риск остеопорозных переломов в общей популяции женщин в постменопаузе. Этот метод рекомендуется для сохранения плотности костной ткани у всех женщин, переживающих менопаузу в возрасте до 40 лет (включая менопаузу, связанную с раком), до возраста естественной менопаузы при отсутствии противопоказаний. Кроме того, Европейское общество клинической онкологии рекомендует проводить оценку факторов риска и измерение плотности костей методом двухэнергетической рентгеновской абсорбциометрии исходно и с интервалами 1‑2 года всем пациентам, получающим эндокринную терапию и подвергшимся овариэктомии. Рекомендуются также регулярные физические упражнения, потребление кальция 1000 мг/сут и добавки витамина D в дозе 1000‑2000 МЕ/сут. Женщинам, у которых показатель минеральной плотности кости в позвоночнике или бедре T<-2 балла, следует начать антирезорбтивную терапию бисфосфонатами или деносумабом. В исследовании R. Coleman et al. (2015) показано, что бисфосфонаты повышают показатели выживаемости и снижают частоту рецидивов и метастазирования у лиц в постменопаузе, страдающих РМЖ.
Выводы
Нарушение функции яичников и симптомы менопаузы часто возникают у пациенток после лечения рака. Менопауза может начинаться у больных раком в более раннем возрасте, и симптомы могут быть более выраженными, чем при естественной менопаузе.
Системная МГТ является наиболее эффективным методом лечения симптомов менопаузы, но она не показана всем пациенткам, перенесшим рак; в таких случаях доступны альтернативные эффективные негормональные методы лечения.
Врачи первичного звена медицинской помощи должны быть осведомлены о природе симптомов менопаузы после рака и обсуждать их со всеми пациентками, прошедшими лечение по поводу рака, рассматривая целесообразность терапии или направления к специалисту.
Подготовила Виктория Лисица
По материалам: J. L. Marino, H. C. McNamara, M. Hickey
Managing menopausal symptoms after cancer:an evidence-based approach for primary care.Med J Aust 2018; 208 (3): 127‑132 .