30 грудня, 2019
Поєднана блокада ренін-ангіотензин-альдостеронової системи: за і проти
Активація ренін-ангіотензин-альдостеронової системи (РААС) відіграє важливу роль у виникненні та прогресуванні артеріальної гіпертензії (АГ), ушкодженні органів-мішеней і формуванні резистентності до терапії. Доведена її роль у патогенезі атеросклерозу, серцевої недостатності (СН), хронічної хвороби нирок (ХХН) і цукрового діабету (ЦД) [1-4].
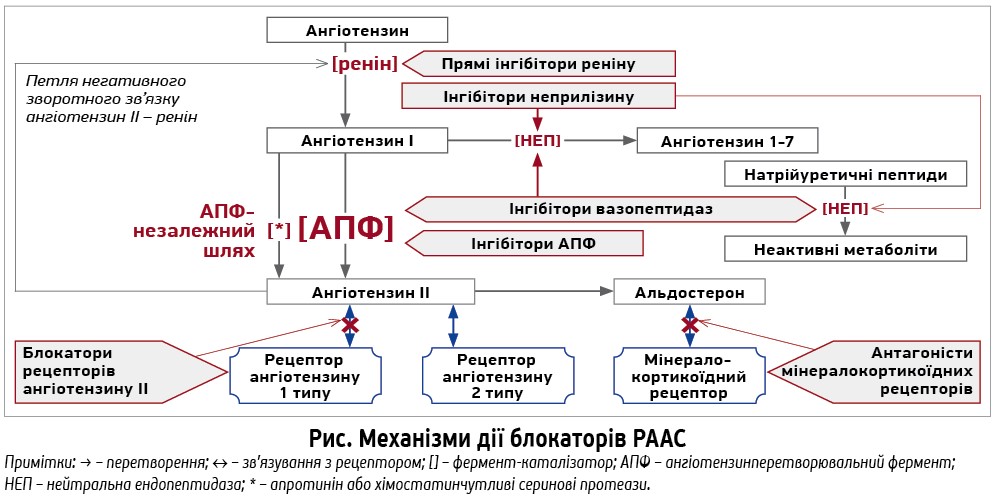
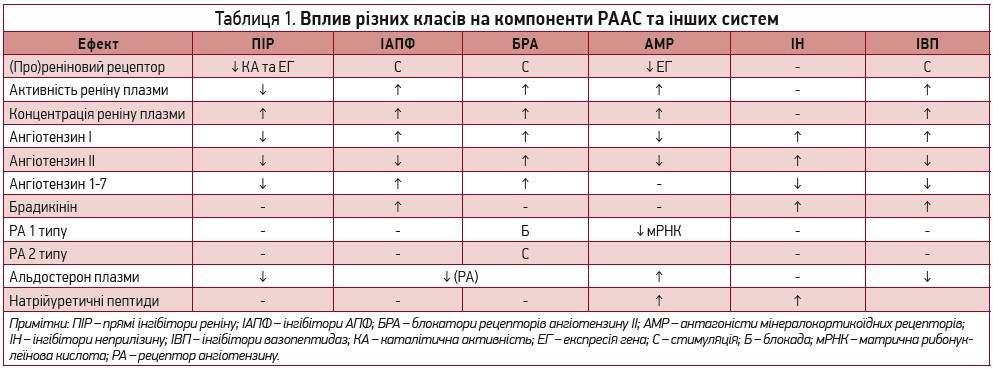
На сьогодні є декілька класів препаратів, які пригнічують різні ланки цієї системи (рис.). Їхній вплив на компоненти РААС підсумовано в таблиці 1.
Порівняльна характеристика блокаторів РААС
Прямі інгібітори реніну (ПІР) пригнічують розщеплення ангіотензиногену, спричиняють повну блокаду РААС із дуже низькими циркулюючими рівнями ангіотензину І, ІІ та їхніх похідних. У клінічній практиці застосовують аліскірен – потужний конкурентний високоселективний ПІР. Його непептидна структура та низька ліпофільність підвищують стійкість до деградації і біодоступність після орального застосування, тривалий період напіврозпаду забезпечує адекватний контроль артеріального тиску (АТ) упродовж доби.
Аліскірен не впливає на цитохром Р450, виводиться в незміненому вигляді гепатобіліарною системою, діє на нейрогуморальні медіатори, зменшує запалення, ремоделювання серця і судин [5, 6].
Інгібітори ангіотензинперетворювального ферменту (ІАПФ) пригнічують утворення ангітензину ІІ. Клас включає 17 препаратів, серед яких практичне застосування мають беназеприл, еналаприл, зофеноприл, каптоприл, лізиноприл, моексиприл, периндоприл, раміприл, спіраприл, трандолаприл, хінаприл і фозиноприл. Під дією ІАПФ відбуваються вазодилатація без впливу на частоту серцевих скорочень і пригнічення ангіотензин ІІ‑залежного утворення медіаторів фіброзу, вільних радикалів і цитокінів унаслідок прямого ефекту та накопичення пептидів – судинорозширювальних (брадикінін, ангіотензин 1-7), антипроліферативних (N‑ацетил-серил-аспартам-лізил-пролін) і натрійуретичних [7, 8]. Однак ІАПФ не повністю блокують синтез ангіотензину ІІ, особливо в тканинах, оскільки не впливають на АПФ‑незалежні механізми.
Блокатори рецепторів ангіотензину ІІ (БРА) валсартан, епросартан, ірбесартан, кандесартан, лосартан, олмесартан, телмісартан є антагоністами рецепторів ангіотензину 1 типу (РА1). Вони забезпечують блокаду ефектів ангіотензину ІІ, у тому числі синтезованого АПФ‑незалежними шляхами. Відтак, посилюється активність інших РА, зокрема 2 типу, що підвищує утворення брадикініну, окису азоту та циклічного гуанозинмонофосфату (цГМФ), зумовлюючи вазодилатацію та натрійурез. Під дією БРА блокується зворотний зв’язок пригнічення вивільнення реніну. Це активує каскад РААС і продукцію ангіотензину ІІ, який взаємодіє з РА2, оскільки РА1 заблоковані [9]. Встановлено зменшення активності симпатичної нервової системи (СНС) та утворення ендотеліну‑1, покращення функції ендотелію та ренопротекторний ефект БРА, не пов’язаний зі зниженням АТ [10, 11].
Блокада РААС під впливом ІАПФ/БРА має багато корисних впливів, як-от ефективна антигіпертензивна дія, захист органів-мішеней, покращення якості життя, зменшення ризику ускладнень та смерті [8, 12-15]. Впливи на зниження АТ та протеїнурії в цих двох класів зіставні [13, 16], проте при тривалій терапії ІАПФ/БРА можлива реактивація РААС, про що йтиметься далі.
Антагоністи мінералокортикоїдних рецепторів (АМР) пригнічують ефекти альдостерону (АС) шляхом конкурентного зв’язування з мінералокортикоїдними рецепторами (МР). У клінічній практиці застосовують спіронолактон і його активний метаболіт канренон (І покоління) та еплеренон (ІІ покоління). Спіронолактон застосовують у терапії хронічної СН, есенціальної та мінералокортикоїдної АГ, а також портальної гіпертензії з асцитом. Водночас низька специфічність до МР спричиняє проестрогенні ефекти (гінекомастію, дисменорею), яких позбавлений еплеренон [17, 18]. На сьогодні доведено ефективність та безпеку препаратів цього класу при лікуванні АГ та СН [19-21].
Інгібітори неприлізину (ІН) пригнічують неприлізин або нейтральну ендопептидазу (НЕП), яка відповідає за деградацію натрійуретичних пептидів – потужних ендогенних вазодилататорів, що існують у передсердній, мозковій і судинній ізоформах [22]. Подібно до брадикініну вони стимулюють NO‑цГМФ каскад у міоцитах судинної стінки, посилюють натрійурез, пригнічують активність СНС, зумовлюють вазодилатацію та розвантаження шлуночків, зменшують гіпертрофію і проліферацію [23, 24]. До цієї групи належать кандоксатрил і сакубітрил. Фармакологічне пригнічення НЕП підвищує концентрацію передсердного і мозкового натрійуретичних пептидів у плазмі крові. При цьому НЕП метаболізує також ангіотензин І та ендотелін‑1, що може нівелювати потенційну користь від підвищення рівня натрійуретичних пептидів [25]. Зокрема, описано парадоксальне підвищення АТ після введення кандоксатрилу [26].
Відтак, з’явився новий клас препаратів – інгібітори вазопептидаз (ІВП), представники якого пригнічують як неприлізин, так й АПФ та ендотелінперетворювальний фермент. До цього класу відносять омапатрилат, сампатрилат, фазидотрилат. Фармакологічними ефектами ІВП є вазодилатація, посилення діурезу та натрійурезу, зменшення периферичного судинного опору [27, 28]. Найбільш вивченим ІВП є омапатрилат, який продемонстрував ефективність у хворих на АГ і СН [29]. Серед учасників дослідження OCTAVE досягнення контролю АТ у групі омапатрилату було на 9% вищим, ніж у групі еналаприлу (р<0,001), але паралельно підвищувався ризик ангіоневротичного набряку (2,17 vs 0,68%), що пояснюється накопиченням брадикініну внаслідок пригнічення АПФ, НЕП та амінопептидази [30].
Феномен реактивації ангіотензину ІІ та вислизання АС
Як відомо, ангіотензин ІІ пригнічує активність реніну за механізмом негативного зворотного зв’язку. За умов терапії ІАПФ/БРА цей механізм послаблюється, внаслідок чого активність і концентрація реніну в плазмі підвищуються.
Реактивація ангіотензину ІІ зумовлена насамперед неспроможністю ІАПФ забезпечити достатнє пригнічення АПФ за умов накопичення реніну й ангіотензину І. Крім того, 30-40% ангіотензину ІІ утворюється ренін-залежними, але АПФ‑незалежними шляхами під впливом серинових протеаз, чутливих до апротиніну (калікреїн, трипсин, тонін і катепсин G) чи хімостатину (хімаза, хімостатинчутливий ангіотензин ІІ‑утворювальний фермент і фермент еластази‑2) [31].
Реактивований ангіотензин II стимулює секрецію АС, що спричиняє повторне підвищення його концентрації в крові – так званий феномен вислизання [32]. Так, в учасників дослідження RESOLVD через 17 тиж комбінованої терапії (КТ) еналаприлом/кандесартаном рівні АС істотно знизилися, а через 43 тиж повернулися до початкових значень, незважаючи на застосування максимальних доз обох препаратів [33]. За 6-24 міс терапії ІАПФ/БРА вторинне підвищення АС виникає в 10-53% пацієнтів [34-36].
Реактивація ангіотензину II не єдиний механізм вислизання, оскільки описані випадки підвищення АС за умов нормальних рівнів ангіотензину ІІ [37]. Іншим потужним стимулятором виділення АС є калій, а ІАПФ/БРА, як відомо, зумовлюють гіперкаліємію. Рівень калію також підвищується під впливом адренокортикотропного гормону, вазопресину й адипокінів [38, 39].
Своєю чергою, АС стимулює тканинні АПФ, унаслідок чого ангіотензин ІІ, незважаючи на терапію ІАПФ/БРА, продовжує утворюватися, замикаючи коло реактивації-вислизання [40]. Іншими несприятливими ефектами АС є активація МР, дисфункція ендотелію, запалення та фіброз в неепітеліальних тканинах. У нирках пошкоджуються клубочки, з’являється чи посилюється протеїнурія, прогресує втрата функціонуючих нефронів і гломерулосклероз. У серці збільшується синтез колагену, виникають ремоделювання, гіпертрофія та підвищення жорсткості міокарда. Зрештою це призводить до виникнення СН, підвищує ризик шлуночкових аритмій та раптової смерті. [41-43]. Ризик смерті збільшується навіть за умов тривалого застосування ІАПФ/БРА, натомість додавання АМР суттєво знижує смертність [19, 20].
Вислизання АС переважає у хворих на СН і ХХН, хоча цей феномен описаний і при АГ та після гострого інфаркту міокарда (ІМ) [44, 45]. Підвищення АС не завжди супроводжується погіршенням контролю АТ [34, 44]. Хворі на ХХН з гіперальдостеронемією схильні до значної протеїнурії попри рівень АТ <130/85 мм рт. ст. [36, 46]. Відтак, підвищення рівня АС крові може бути маркером вислизання під час блокади РААС, хоча застосування цього показника в клінічній практиці обмежене малодоступністю і високою вартістю.
Доказовість щодо переваг і недоліків поєднаної блокади РААС
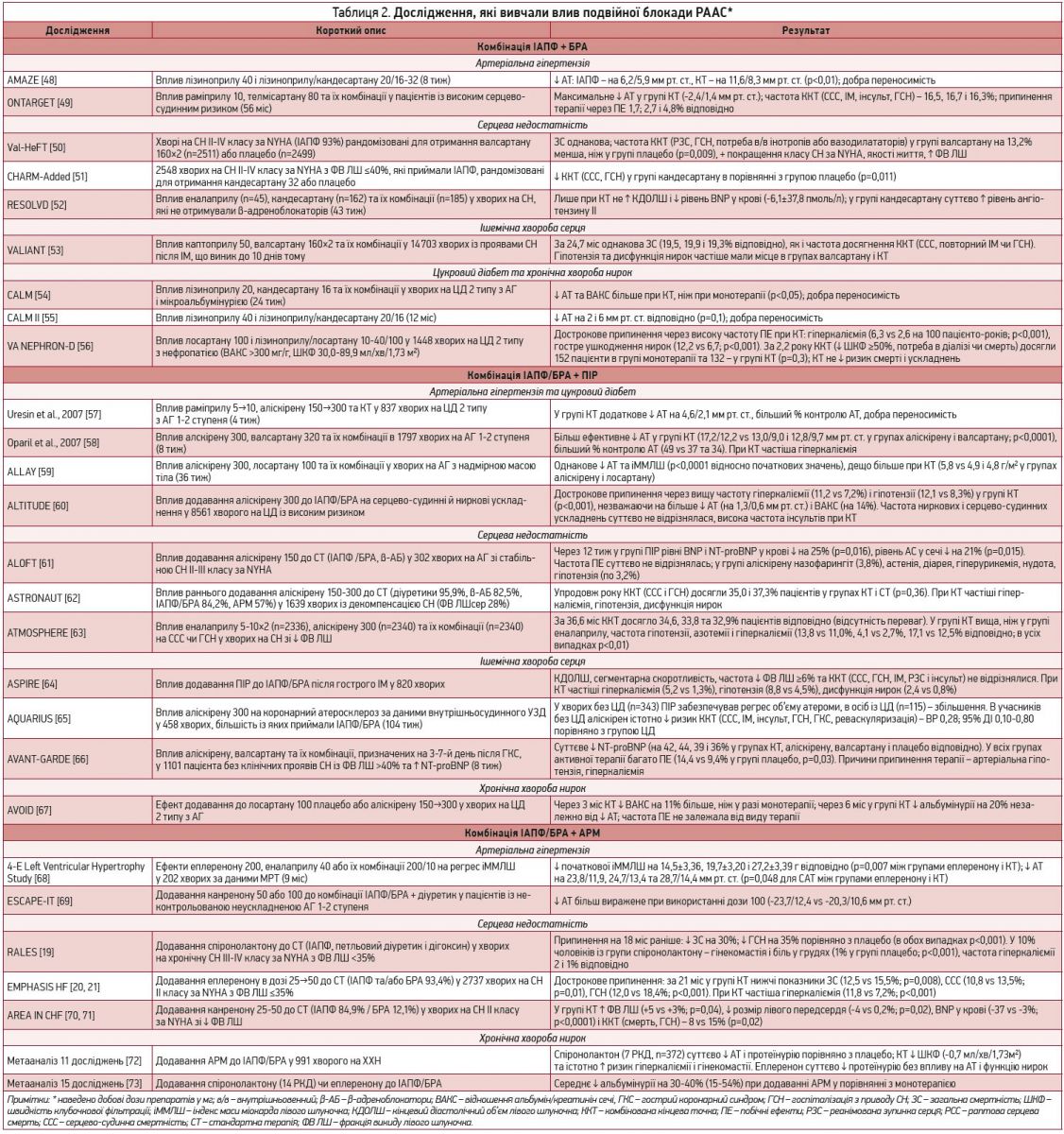
Після відкриття феноменів реактивації ангіотензину та вислизання АС виникла ідея поєднати ≥2 блокатори РААС із різними механізмами дії [47]. Результати рандомізованих контрольованих досліджень (РКД) і метааналізів, у яких вивчалися ефекти поєднання різних класів блокаторів РААС, підсумовано в таблиці 2.
Комбінація ІАПФ + БРА ефективніше знижує АТ і має інші сприятливі плейотропні ефекти в порівнянні з монотерапією, за результатами невеликих клінічних випробувань [74, 75], РКД і метааналізу [76]. Утім, комбінована терапія (КТ) суттєво збільшує частоту і тяжкість таких проявів побічної дії, як гіперкаліємія, артеріальна гіпотензія, непритомність, порушення функції нирок, кашель і діарея [77]. Немає також даних щодо сприятливого впливу поєднання ІАПФ із БРА на жорсткі серцево-судинні чи ниркові кінцеві точки в пацієнтів із неускладненою АГ [78].
У хворих на СН подвійна блокада ефективно пригнічує нейрогуморальну активацію та попереджає дилатацію лівого шлуночка [52]. Метааналіз, який включав 38 080 хворих на хронічну СН, виявив, що КТ знижує ризик госпіталізації з приводу СН (відношення шансів 0,77; 95% ДІ 0,69-0,87; p<0,001 у порівнянні з монотерапією), але не впливає на загальну смертність (0,97; 0,87-1,08; p=0,6) [79]. Призначення КТ хворим після гострого ІМ не покращувало прогноз, але збільшувало ризик небажаних ефектів.
Метааналіз досліджень, які повідомляли про побічну дію (n=17 337; середній період спостереження – 25 міс), продемонстрував значне збільшення випадків припинення лікування в пацієнтів із хронічною СН і гострим ІМ із симптомами дисфункції лівого шлуночка під впливом КТ, здебільшого внаслідок погіршення функції нирок, гіперкаліємії і симптоматичної артеріальної гіпотензії [80].
Багато досліджень вказують на значний антипротеїнуричний вплив цієї комбінації [81, 82], проте результати щодо зменшення ниркових ускладнень досить суперечливі [49, 83, 84]. До того ж КТ суттєво збільшує частоту проявів побічної дії, особливо у хворих на діабет і пацієнтів із ХХН 3-5 стадії. Імовірність виникнення цих проявів вища за умов паралельного прийому АМР, калійзберігаючих діуретиків, β-адреноблокаторів і нестероїдних протизапальних препаратів [56, 85].
Комбінація ІАПФ/БРА + ПІР менш вивчена, але більш ефективно знижує АТ і протеїнурію, ніж монотерпія, сприяє зменшенню рівнів натрійуретичних пептидів у хворих на СН. При цьому в жодному з проведених досліджень не доведено її здатності знижувати смертність і частоту серцево-судинних ускладнень. Натомість частота проявів побічної дії вища за умов КТ [60, 62-64, 66].
Що стосується комбінації ІАПФ/БРА + АРМ, то додавання до ІАПФ/БРА спіронолактону в добових дозах 12,5-100 мг забезпечує адитивний антигіпертензивний ефект із середнім зниженням АТ на 22/10 мм рт. ст. і регрес гіпертрофії лівого шлуночка. Поряд із цим збільшується частота гіперкаліємії та гінекомастії [86]. Додавання еплеренону має наслідком більш виражений регрес гіпертрофії лівого шлуночка та зменшення протеїнурії, ніж монотерапія [68, 87, 88]. Особливі переваги ця комбінація демонструє у хворих на СН, оскільки знижує смертність і частоту госпіталізації.
З приводу комбінації БРА + ІН варто зауважити, що у зв’язку з низькою ефективністю ІН у монотерапії та побічними ефектами ІВП виникла ідея поєднання корисних ефектів від блокади РААС та підвищення натрійуретичних пептидів шляхом додавання ІН до БРА. Так з’явилася комбінація сакубітрил/валсартан, яку вже декілька років успішно застосовують у Європі (Ентресто, «Новартіс», Швейцарія; Юперіо, «Новартіс фарма», Італія); з 2019 року препарат зареєстрований і в Україні.
Результати РКД PARADIGM-HF доводять, що сакубітрил/валсартан має переваги над еналаприлом у хворих на СН. За 2,3 року спостереження за пацієнтами із СН ІI-IV класу за NYHA з ФВ ЛШ ≤40% та рівнями BNP ≥150 пг/мл чи NT‑proBNP ≥600 пг/мл виявлено зниження загальної смертності на 16%, серцево-судинної – на 20%, зменшення частоти госпіталізації з приводу СН на 21% (в усіх випадках р<0,001) у порівнянні з еналаприлом [89]. Тому у випадках, коли попри оптимальну терапію симптоми СН утримуються, рекомендовано замінити ІАПФ на сакубітрил/валсартан [90].
Вторинний аналіз результатів цього дослідження продемонстрував, що пацієнти, які приймали сакубітрил/валсартан у дозі 97/103 мг двічі на добу впродовж 44 міс, мали менше зниження ШКФ у порівнянні з учасниками, які приймали еналаприл по 10 мг двічі на добу (-1,3 vs -1,8 мл/хв/1,73 м2 за рік; p<0,0001). Користь була вищою у хворих на ЦД 2 типу в порівнянні з пацієнтами без діабету, але ефект не був пов’язаний із впливом на HbA1c чи перебіг СН [91].
Отже, на сьогодні здатність знижувати ризик смерті та ускладнень доведена лише для комбінацій ІАПФ/БРА + АРМ та БРА + ІН (сакубітрил/валсартан), насамперед у пацієнтів із СН. Користь від поєднання інших блокаторів РААС сумнівна, адже, незважаючи на певні позитивні впливи, цей терапевтичний підхід не покращує прогноз. Натомість поєднана блокада у 2-4 рази збільшує ризик таких небажаних ефектів, як артеріальна гіпотензія, азотемія, гіперкаліємія. Відтак, якщо зазначена терапія є абсолютно необхідною, вона має застосовуватися під наглядом спеціаліста за умови частого і ретельного контролю АТ, функції нирок та електролітів крові.
Список літератури знаходиться в редакції.
Медична газета «Здоров’я України 21 сторіччя» № 23 (468), грудень 2019 р.