3 січня, 2020
Вплив метформіну на мікробіоту кишечнику та імунну систему як поле майбутніх досліджень
Історія розвитку метформіну, що вивела його на позиції найбільш застосовуваного засобу для лікування цукрового діабету (ЦД) 2 типу, не була типовим продуманим шляхом розробки ліків. Навпаки, значну роль відіграли інтуїтивне застосування та вивчення робіт середньовічних лікарів-травників. Неочікувані молекулярні механізми дії метформіну були з’ясовані пізніше і дотепер залишаються остаточно не вивченими.
Середньовічне лікування поліурії передбачало застосування екстракту козлятника лікарського (Galega officinalis) [1]. Коли в середині ХХ ст. розпочали пошук ліків від діабету, було з’ясовано, що активними інгредієнтами цієї рослини виступають гуанідин і галегін. Експерименти показали, що ці речовини здатні зменшувати гіперглікемію, глюкозурію та поліурію, однак клінічне застосування галегіну обмежене його токсичністю. Ці знахідки індукували пошук потенційного глюкозознижувального агента серед бігуанідів – похідних гуанідину. Найкращі показники продемонстрував метформін – диметилбігуанід, який було вперше впроваджено у європейську клінічну практику в 1950-х рр., а в північноамериканську – лише в 1990-х. Попри створення в подальшому кількох різних класів медикаментів для лікування ЦД 2 типу метформін залишається наріжним каменем терапії цієї хвороби у зв’язку з ефективністю та безпекою. Цей препарат представлений багатьма генериками і є одним із найдешевших протидіабетичних засобів.
Молекулярні мішені
Механізми дії метформіну широко вивчалися [2-5]. Хоча цьому препарату властиві кілька молекулярних мішеней [6, 7], більшість досліджень фокусувалися на респіраторному комплексі I ланцюга переносу електронів [8, 9]. Точний механізм взаємодії між крихітною молекулою бігуаніда та велетенським багатобілковим комплексом не встановлений. Багато більш ранніх лабораторних досліджень були дещо неточними, оскільки головним механізмом називали загальне зниження споживання кисню клітинами. Нещодавнє дослідження виявило активність бігуанідів, у тому числі метформіну, в ізольованих мітохондріях [11] та ізольованому комплексі I [9]. Окисне фосфорилювання гальмують більшість бігуанідів, але існують певні особливості різних речовин стоcoвно внутрішньоклітинної та мітохондріальної концентрації, а також накопичення в місці дії, що може визначати активність препарату [9].
Більш давні літературні джерела [2, 4, 5] приписували клітинні ефекти пригнічення комплексу I переважно дефіциту АТФ унаслідок зниження інтенсивності окисного фосфорилювання. Цей дефіцит безпосередньо призводить до змін у перебігу АТФ‑залежних біохімічних реакцій, а також опосередковано – до активації АМФ‑активованої протеїнкінази (ААПК), яка перепрограмовує енергетичний обмін у клітинах у бік зменшення споживання енергії та збільшення виробітки АТФ. Активація ААПК має низку наслідків, зокрема гальмування синтезу жирних кислот та інгібування сигнального шляху механістичної мішені рапаміцину (mTOR) [12], що, своєю чергою, веде до зниження споживання енергії. Однак нещодавно було з’ясовано, що пригнічення комплексу I має додаткові наслідки, пов’язані з накопиченням НАДФ [13].
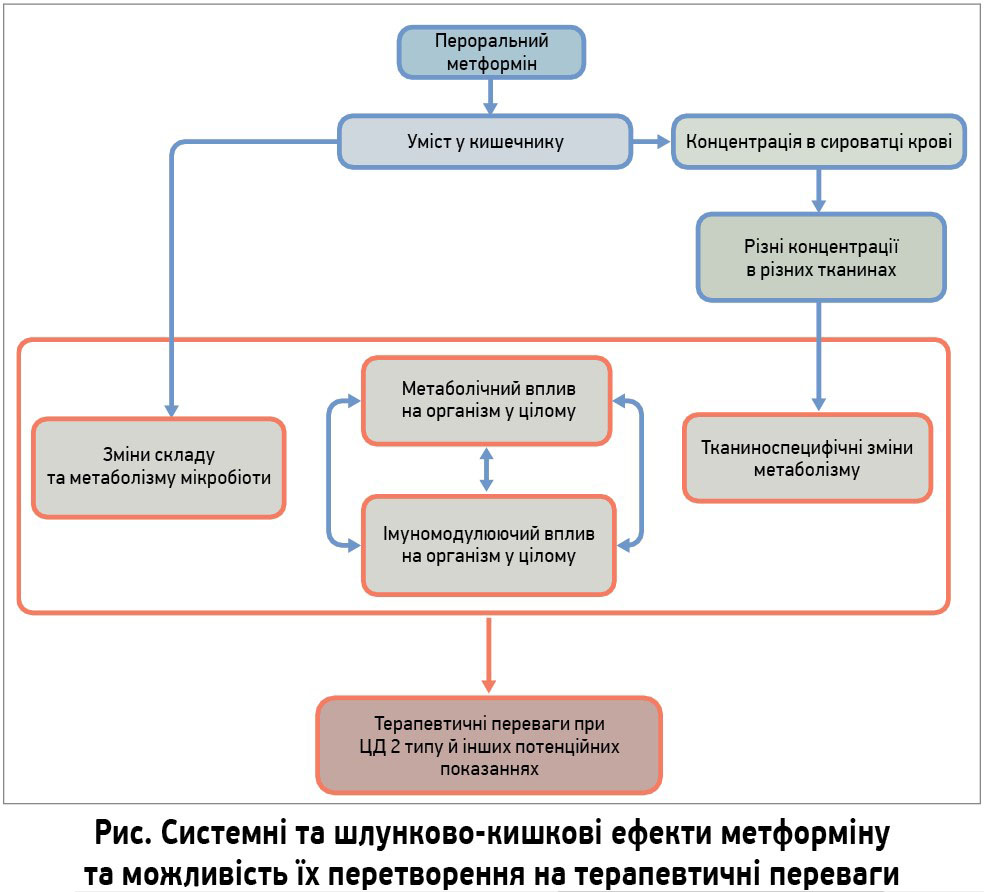
На рівні організму дія метформіну залежить від ступеня накопичення цієї речовини. Гетерогенність накопичення метформіну в різних органах після перорального прийому є наслідком низки фармакокінетичних чинників, а також відмінностей в експресії транспортерів препарату на поверхні різних клітин [14]. Класичним місцем дії метформіну є печінка, яка після перорального прийому препарату підлягає впливу більшої його концентрації, ніж інші органи, оскільки вміст метформіну в портальній системі перевищує аналогічний показник у системному кровообігу. Енергодефіцит унаслідок гальмування окисного фосфорилювання під дією метформіну зумовлює пригнічення глюконеогенезу в гепатоцитах, спричиняючи зниження викиду глюкози печінкою. Це сприяє зниженню гіперглікемії та, вторинно, гіперінсулінемії. Крім того, існують докази, що метформін знижує окисне фосфорилювання в м’язовій тканині [15], що, ймовірно, має наслідком компенсаторне зростання захоплення глюкози та гліколізу, забезпечуючи корекцію гіперглікемії. Нещодавно також з’явилася зацікавленість впливом метформіну на мікробіоту кишечнику й імунну систему.
Метформін та мікробіота кишечнику
Переконливі докази [19, 20] свідчать, що метформін індукує значимі зміни в мікробіоті кишечнику людини (наприклад, зменшення кількості представників певних підвидів Intestinibacter) та відповідному метаболомі (як-от підвищення продукції масляної кислоти). Ці спостереження було зроблено в ході спроб підтвердити та розширити попередні дані стосовно зв’язку складу мікробіоти, ожиріння та ЦД [21-23]. Було виявлено, що на результати деяких попередніх досліджень (наприклад, [24]) могла впливати дія метформіну на мікробіоту кишечнику.
Механізм цієї дії лишається невизначеним. Було показано, що бігуаніди гальмують комплекс І бактерій аналогічним чином до гальмування комплексу І ссавців [9]. Утім, це не є однозначним свідченням того, що вплив метформіну на мікробіоту кишечнику є наслідком інгібування комплексу І та, відповідно, гальмування ланцюга переносу електронів бактеріальних клітин. У бактерій Caenorhabditis elegans метформін здатен подовжувати тривалість життя шляхом впливу на метаболізм фолатів, хоча специфічна молекулярна мішень цього впливу наразі не визначена [25]. Відомо, що бігуанідам властива антибактеріальна активність [26], але точні її механізми також не відомі.
Слід зауважити, що концентрація метформіну в просвіті кишечнику може більш ніж у 100 разів перевищувати аналогічний показник у сироватці крові. Це може свідчити про те, що для реалізації впливу на мікробіоту потрібна висока концентрація, досягнути якої в системному кровообігу неможливо [28]. Вміст метформіну в кишечнику залежить від інтенсивності системного всмоктування та часу кишкового транзиту. Біодоступність препарату становить 30-60%, і близько половини спожитої дози визначається в фекаліях, хоча обидва ці показники характеризуються значною індивідуальною варіабельністю. Таким чином, ступінь впливу на кишкову флору визначається чинниками з боку організму-хазяїна.
Враховуючи докази, що індивідуальні особливості складу мікробіоти кишечнику можуть бути пов’язані з ризиком ожиріння та ЦД [18], цікавим є визначення ступеня впливу кишкових ефектів препарату (які включають зміни мікробіоти, але не обмежуються ними) на терапевтичні переваги. Докази того, що препарати метформіну з низьким рівнем всмоктування також мають глюкозознижувальний ефект [16, 29] свідчать про те, що хоча б частково терапевтичні впливи цього препарату є наслідком дії в шлунково-кишковому тракті.
Як препарат, який діє лише в межах кишечнику, може впливати на системний обмін вуглеводів? З порушенням толерантності до глюкози пов’язані специфічні профілі мікробіоти [30]. Зміни останньої можуть впливати на метаболом кишечнику, в тому числі на виробітку масляної й оцтової кислот [24, 31]. Своєю чергою, ці метаболіти впливають на інсулінорезистентність організму-хазяїна та, відповідно, на контроль глікемії. Мікробіота кишечнику також модифікує обмін глюкагоноподібного пептиду-1. Наприклад, зменшення вмісту лактобацил асоціюється з резистентністю до останнього внаслідок змін подукції оксиду азоту кишковими нейронами [32].
Слід, однак, зауважити, що метформін здатен впливати й на системний обмін вуглеводів через шлунково-кишкові механізми, не пов’язані з мікробіотою. Такими механізмами є зміни фізіології жовчних кислот і гормонів кишечнику [27], а також гальмування глюконеогенезу в печінці під дією дуоденальної ААПК [33].
Метформін та імунна система
Клінічний досвід не надав доказів значимого впливу метформіну на функцію імунної системи, оскільки ні імунодефіцит, ні аутоімунні реакції не є його побічними ефектами. Хоча в клінічних дослідженнях дії метформіну на імунітет також не виявлено, лабораторні дослідження продемонстрували низку імуномодулюючих ефектів
Було показано, що ААПК впливає на ефекторні відповіді Т‑лімфоцитів [34]. Таким чином, наведені раніше докази того, що метформін гальмує окисне фосфорилювання, спричиняючи активацію ААПК, можуть пояснювати вплив цього препарату на імунні функції. Хоча здатність метформіну впливати на імунну систему шляхом зміни енергообміну клітин, які її утворюють, встановлена, залишається невідомим, на які субпопуляції імунних клітин найбільш виражено діє препарат і яким буде його ефект у різних клінічних ситуаціях. Нещодавні онкоімунологічні дослідження свідчать про активацію імунних функцій під дією метформіну [36-38], натомість випробування в інших галузях (при туберкульозі, розсіяному склерозі) демонструють протизапальний вплив [40-45].
Експеримент, у якому порівнювали ефективність метформіну як протипухлинного препарату в інтактних мишей і мишей з імунодефіцитом [36], продемонстрував його потужну протипухлинну активність у тварин із робочою імунною системою за рахунок збільшення кількості CD8-лімфоцитів, що інфільтрують пухлину. Ця активність була опосередкована впливом на ААПК. У лабораторному дослідженні також були отримані докази підсилення протипухлинного імунітету під дією іншого бігуаніда фенформіну [37], проте в цьому випадку бігуанід покращував функціонування імунної системи шляхом пригнічення гранулоцитарних супресорних клітин мієлоїдного походження. У лабораторній моделі вплив метформіну на імунну пам’ять асоціювався з покращенням ефективності протипухлинної вакцини зі значним зростанням виживаності організму-хазяїна [35]. Перспективами подальших досліджень є встановлення клінічної цінності отриманих даних, з’ясування механізму дії метформіну та виявлення дозозалежності зв’язку.
Хоча наведені вище результати досліджень дозволяють припустити, що імуномодулююча дія бігуанідів може бути підґрунтям протипухлинної активності, є важливі застереження. По-перше, деякі моделі [4, 46] продемонстрували гальмування пухлинного росту під дією бігуанідів у мишей з імунодефіцитом, що може свідчити про включення в роботу механізмів, відмінних від імуномодуляції. По-друге, має бути доведена значимість проведених доклінічних досліджень для клінічної медицини, оскільки, незважаючи на багатообіцяючі доклінічні дані [47], перше рандомізоване плацебо-контрольоване дослідження застосування метформіну в лікуванні раку підшлункової залози не змогло довести переваг цього препарату над плацебо [48].
Окремі дослідження свідчать про те, що в певних умовах метформін може виступати протизапальним чи імуносупресивним агентом. Так, в експерименті було отримано потужні докази на користь того, що метформін може пригнічувати запалення, яке асоціюється зі старінням [40] і раковими пухлинами [41]. В обох випадках було зафіксовано зменшення активації ядерного фактора κB (nuclear factor κB, NF‑κB) із відповідним зниженням секреції прозапальних цитокінів. Однак точний молекулярний механізм дії метформіну, що веде до інгібування NF‑κB, ще потребує визначення. В експериментальному дослідженні також продемонстровано гальмування метформіном вродженої імунної відповіді на грибкову інфекцію ААПК‑залежним шляхом [42], але клінічна цінність цього спостереження не відома.
У пілотному клінічному дослідженні за участю пацієнтів із розсіяним склерозом було показано, що метформін зменшує запалення в центральній нервовій системі та покращує прогноз хвороби [43], проте ці дані потребують підтвердження. Показано, що метформін здатен впливати на метаболізм CD4-лімфоцитів і зменшувати вираженість аутоімунних реакцій, покращуючи перебіг системного червоного вовчака в експериментальній моделі [44]. Метформін також зменшує запалення, асоційоване з туберкульозом легень [49], але для встановлення клінічної важливості цих даних необхідні подальші дослідження.
Як поєднати вражаючі та різноманітні впливи метформіну на імунну систему, виявлені в експерименті, і клінічний досвід, який не продемонстрував явних імуномодулюючих ефектів препарату? Більшість клінічних досліджень функцій імунної системи в осіб, які вживають метформін, наприклад [50], застосовували відносно прості кінцеві точки на кшталт рівня С‑реактивного протеїну. Хоча було виявлено зниження цього неспецифічного запального маркера під впливом метформіну, клінічна цінність цієї знахідки невідома. Імовірно, дія метформіну на імунну систему залежить від вихідного стану останньої. Наприклад, якщо певні аутоімунні хвороби асоціюються з експресією транспортерів метформіну на поверхні імуноефекторних клітин, наслідки його прийому можуть відрізнятися від таких у пацієнтів із ЦД 2 типу, які лікуються цим препаратом. Таким чином, наразі невідомо, чи можуть бути важливими в клінічних умовах дані, отримані експериментальним шляхом.
Висновки
Метформін забезпечує низку клінічних переваг десяткам мільйонів людей із ЦД 2 типу. Лабораторні дослідження, розпочаті через кілька декад після схвалення цього препарату для лікування діабету, продовжують з’ясовувати механізми його дії. Як показано на рисунку, метформін чинить вагомий вплив на шлунково-кишковий тракт, оскільки концентрація препарату в просвіті кишечнику значно перевищує концентрацію в крові. Ці шлунково-кишкові ефекти мають як місцеві, так і системні наслідки, в тому числі вплив метформіну, що всмоктався, на класичні (печінка) та нещодавно виявлені (імунна система, новоутворення) мішені. Дія метформіну на мікробіоту й імунну систему дозволяє потенційно застосовувати препарат не лише в лікуванні діабету, а й в онкології та геронтології [51-53]. Завданням майбутніх досліджень є визначення клітинної фармакокінетики метформіну та встановлення клінічної цінності наявних лабораторних досліджень [14].
Pollak M. The effects of metformin on gut microbiota and the immune system as research frontiers.Diabetologia, 2017; 60: 1662-1667.
Переклала з англ. Лариса Стрільчук
Медична газета «Здоров’я України 21 сторіччя» № 24 (469), грудень 2019 р.